Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación y tinción por inmunofluorescencia de haces y células de fibra única de la corteza y el núcleo del cristalino del ojo
En este artículo
Resumen
Este protocolo describe métodos para preparar células periféricas, maduras y nucleares de fibras del cristalino ocular para la tinción de inmunofluorescencia con el fin de estudiar las complejas interdigitaciones de célula a célula y la arquitectura de la membrana.
Resumen
El cristalino es un órgano transparente y elipsoide situado en la cámara anterior del ojo que cambia de forma para enfocar finamente la luz en la retina y formar una imagen clara. La mayor parte de este tejido está formado por células fibrosas especializadas y diferenciadas que tienen una sección transversal hexagonal y se extienden desde los polos anterior hasta el posterior del cristalino. Estas células largas y delgadas son muy opuestas a las células vecinas y tienen interdigitaciones complejas a lo largo de la célula. Las estructuras entrelazadas especializadas son necesarias para las propiedades biomecánicas normales de la lente y se han descrito ampliamente utilizando técnicas de microscopía electrónica. Este protocolo demuestra el primer método para preservar e inmunoteñir células de fibra de lente de ratón individuales y haces de células de fibra de lente de ratón para permitir la localización detallada de proteínas dentro de estas células de forma compleja. Los datos representativos muestran la tinción de las células de fibras periféricas, diferenciadoras, maduras y nucleares en todas las regiones del cristalino. Este método puede utilizarse potencialmente en células de fibra aisladas de lentes de otras especies.
Introducción
El cristalino es un tejido transparente y ovoide en la cámara anterior del ojo que está formado por dos tipos de células, epiteliales y fibrosas 1 (Figura 1). Existe una monocapa de células epiteliales que cubre el hemisferio anterior del cristalino. Las células fibrosas se diferencian de las células epiteliales y constituyen la mayor parte del cristalino. Las células fibrosas altamente especializadas experimentan una programación de elongación, diferenciación y maduración, marcada por cambios distintivos en la morfología de la membrana celular desde la periferia del cristalino hasta el centro del cristalino 2,3,4,5,6,7,8,9,10,11,12 , también conocido como núcleo del cristalino. La función del cristalino para enfocar con precisión la luz que proviene de varias distancias sobre la retina depende de sus propiedades biomecánicas, incluida la rigidez y la elasticidad 13,14,15,16,17,18,19. Las complejas interdigitaciones de las fibras del cristalino han sido objeto de la hipótesis 20,21 y recientemente se ha demostrado que son importantes para la rigidez del cristalino 22,23.
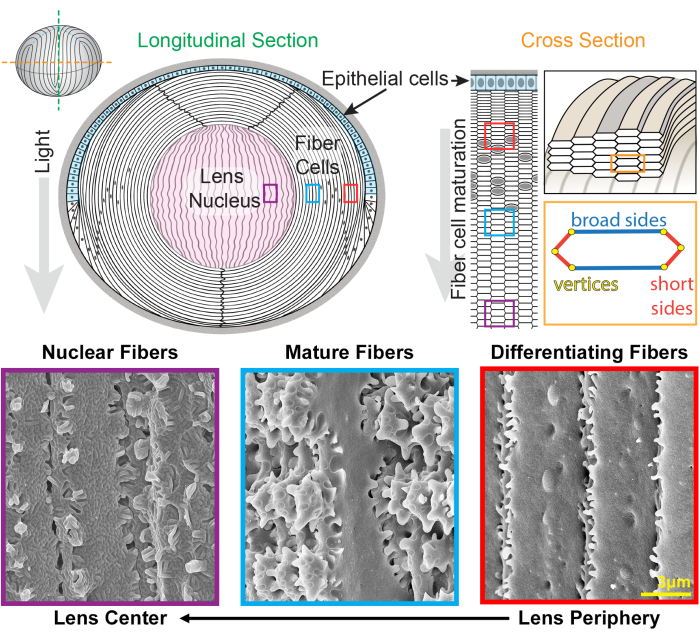
Figura 1: Diagramas de anatomía del cristalino e imágenes representativas de microscopía electrónica de barrido (SEM) de fibras del cristalino. La caricatura muestra una vista longitudinal (anterior a posterior, de arriba a abajo) de la monocapa anterior de células epiteliales (sombreada en azul claro) y una masa masiva de células de fibra del cristalino (blanca). El centro del cristalino (sombreado en rosa) se conoce como núcleo y está formado por células de fibra altamente compactadas. A la derecha, una caricatura de sección transversal revela la forma de celda hexagonal alargada de las fibras de la lente que están empaquetadas en un patrón de panal. Las células de fibra tienen dos lados anchos y cuatro lados cortos. Las imágenes SEM representativas a lo largo de la parte inferior muestran las complejas interdigitaciones de membrana entre las células de fibra de la lente a diferentes profundidades de la lente. Desde la derecha, las fibras recién formadas de la lente en la periferia de la lente tienen pequeñas protuberancias a lo largo de los lados cortos y bolas y zócalos a lo largo del lado ancho (cajas rojas). Durante la maduración, las fibras del cristalino desarrollan grandes dominios de paleta que están decorados por pequeñas protuberancias a lo largo de los lados cortos (cajas azules). Las células fibrosas maduras poseen grandes dominios de paleta ilustrados por pequeñas protuberancias. Estos dominios entrelazados son importantes para las propiedades biomecánicas del cristalino. Las células fibrosas en el núcleo del cristalino tienen menos protuberancias pequeñas a lo largo de sus lados cortos y tienen interdigitaciones machihembradas complejas (cajas moradas). Los lados anchos de la célula muestran una morfología de membrana globular. La caricatura fue modificada a partir de22,32 y no dibujada a escala. Barra de escala = 3 μm. Haga clic aquí para ver una versión más grande de esta figura.
El cristalino crece mediante la adición de capas de nuevas células de fibra superpuestas sobre las generaciones anteriores de fibras24,25. Las células de fibra tienen una forma de sección transversal hexagonal alargada con dos lados anchos y cuatro lados cortos. Estas células se extienden desde el polo anterior hasta el posterior del cristalino y, dependiendo de la especie, las fibras del cristalino pueden tener varios milímetros de longitud. Para apoyar la estructura de estas células alargadas y delgadas, las interdigitaciones especializadas a lo largo de los lados anchos y cortos crean estructuras entrelazadas para mantener la forma de la lente y las propiedades biomecánicas. Los cambios en la forma de la membrana celular durante la diferenciación y maduración de las células de fibra han sido ampliamente documentados por estudios de microscopía electrónica (EM) 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Las células de fibra recién formadas tienen bolas y alvéolos a lo largo de sus lados anchos con protuberancias muy pequeñas a lo largo de sus lados cortos, mientras que las fibras maduras tienen protuberancias entrelazadas y paletas a lo largo de sus lados cortos. Las fibras nucleares muestran interdigitaciones machihembradas y morfología de membrana globular. Poco se sabe sobre las proteínas que se requieren para estas complejas membranas entrelazadas. Estudios previos sobre la localización de proteínas en células de fibra se han basado en secciones de tejido del cristalino, que no permiten una visualización clara de la compleja arquitectura celular.
Este trabajo ha creado y perfeccionado un método novedoso para fijar células individuales y haces de fibras del cristalino para preservar la morfología compleja y permitir la inmunotinción de proteínas en la membrana celular y dentro del citoplasma. Este método preserva fielmente la arquitectura de la membrana celular, comparable a los datos de los estudios de EM, y permite la tinción con anticuerpos primarios para proteínas específicas. Hemos inmunoteñido previamente fibras corticales del cristalino en proceso de diferenciación y maduración22,23. En este protocolo, también hay un nuevo método para teñir células de fibra del núcleo del cristalino. Este protocolo abre la puerta a la comprensión de los mecanismos de formación y cambios en las interdigitaciones de la membrana durante la maduración de las células de fibra y la compactación del núcleo del cristalino.
Protocolo
Los ratones han sido atendidos en base a un protocolo animal aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Indiana en Bloomington. Los ratones utilizados para generar datos representativos fueron animales control (tipo salvaje) en el fondo C57BL6/J, hembras y de 8 a 12 semanas de edad. Se pueden utilizar ratones machos y hembras para este experimento, ya que es muy poco probable que el sexo de los ratones afecte al resultado del experimento.
1. Disección y desencapsulación del cristalino
- Aplicar la eutanasia a los ratones siguiendo la "Guía para el Cuidado y Uso de Animales de Laboratorio" de los Institutos Nacionales de Salud, así como los protocolos de uso animal aprobados por la institución.
NOTA: Para el presente estudio, los ratones fueron sacrificados por sobredosis de CO2 seguida de dislocación cervical de acuerdo con un protocolo animal aprobado (Universidad de Indiana). - Enuclear los ojos de los ratones usando pinzas curvas presionando el tejido alrededor de los ojos con un lado de las pinzas para desplazar el ojo fuera de la órbita. A continuación, cierre las pinzas debajo del ojo y levántelas para extraer el ojo de la cavidad. Transfiera los ojos a solución salina tamponada con fosfato (PBS) fresca 1x en una bandeja de disección.
- Corta el nervio óptico con unas tijeras ultrafinas lo más cerca posible del globo ocular. Inserte con cuidado unas pinzas rectas de punta fina en el globo ocular a través de la salida del nervio óptico en la parte posterior del ojo.
- Inserte con cuidado las tijeras en el mismo lugar que las pinzas en el paso 1.3 y comience a hacer una incisión desde la parte posterior hacia la unión córnea-escleral.
NOTA: Las lentes de los roedores ocupan ~ 30% de sus ojos. Se producirán daños accidentales si las pinzas o tijeras se insertan demasiado profundamente en el ojo. - Continúe cortando a lo largo de la unión corneal-escleral hasta que se haya separado al menos la mitad de la unión.
- Use pinzas para empujar suavemente la córnea para que el cristalino pueda salir a través de la incisión realizada con los pasos 1.4 y 1.5.
- Retire con cuidado cualquier trozo grande de tejido de la lente con unas pinzas rectas de punta fina. Inspeccione la lente para encontrar la región ecuatorial.
- Perfore superficialmente la lente con pinzas rectas de punta fina y luego retire la cápsula de la lente. La masa de células de fibra del cristalino permanecerá intacta y la monocapa epitelial del cristalino permanecerá unida a la cápsula del cristalino. Deseche la cápsula de la lente.
2. Tinción de células de fibra única de lentes
- Transfiera la masa celular de la fibra del cristalino a una placa de pocillos con 500 μL de solución de paraformaldehído (PFA) al 1% recién hecha e incube las muestras a 4 °C durante la noche con una nutación suave (Figura 2A).
NOTA: Los volúmenes de las soluciones dadas están optimizados para placas de 48 pocillos. Si se utilizan placas o tubos de pocillos de otro tamaño, ajuste los volúmenes de las soluciones en consecuencia. Las soluciones de fijación, bloqueo y lavado (1x PTX, 0.1% Triton X-100 en 1x PBS) se hicieron con 10x PBS y agua bidestilada (ddH2O) hasta una concentración final de 1x PBS. - Transfiera las celdas de fibra de la lente a una antena de 60 mm con PFA al 1%. Utilice un bisturí afilado para partir la bola de células de fibra por la mitad a lo largo de su eje antero-posterior (Figura 2B). Corta las mitades por la mitad nuevamente a lo largo del mismo eje para producir cuartos.
NOTA: El eje antero-posterior se reconoce fácilmente por la dirección de las células de fibra en la masa de tejido. - Utilice pinzas rectas para extraer la región del núcleo de los cuartos de células de la fibra del cristalino (Figura 2C).
NOTA: La región del núcleo del cristalino es rígida en los lentes de roedores, y el centro del cristalino se separará fácilmente de las fibras corticales más blandas. - Fijar los cuartos de la región de la corteza del cristalino en 200 μL de PFA al 1% durante 15 min a temperatura ambiente (RT) con una suave agitación (300 rpm en un agitador de platos).
- Lavar los cuartos de tejido dos veces en 750 μL de 1x PBS durante 5 minutos cada uno con una suave agitación a la derecha.
- Bloquear las muestras con 200 μL de solución de bloqueo (suero al 5%, Triton X-100 al 0,3%, 1x PBS) durante 1 h a RT con agitación suave.
NOTA: Para los datos representativos de este protocolo, las muestras no se tiñeron con anticuerpos primarios o secundarios. Después de la etapa de bloqueo, las muestras se incubaron con aglutinina de germen de trigo (WGA; 1:100) y faloidina (1:100) (ver Tabla de Materiales) durante 3 h a RT con agitación suave y protección contra la luz. La tinción primaria de anticuerpos ha sido demostrada en publicaciones previas22,23. - Incubar con 100 μL de solución primaria de anticuerpos durante la noche a 4 °C agitando suavemente.
NOTA: Los anticuerpos se diluyen en una solución bloqueante. En comparación con los portaobjetos con secciones de tejido, hay más células en este tipo de preparación. Las concentraciones primarias de anticuerpos deben aumentarse para proporcionar anticuerpos amplios para teñir más células. Se recomienda duplicar la concentración de anticuerpos de lo que se usa en las secciones de tejido. Lo mismo ocurre con los anticuerpos secundarios. - Lave los cuartos de pañuelo tres veces con 1x PTX (0.1% Triton X-100, 1x PBS) durante 5 minutos cada uno a RT con agitación suave.
- Incubar las células de fibra con 100 μL de solución secundaria de anticuerpo/colorante durante 3 h a RT con una suave agitación. Proteja las muestras de la luz durante este y los siguientes pasos.
NOTA: Se pueden agregar WGA, faloidina y otros colorantes fluorescentes a la solución de anticuerpos secundarios para el marcaje simultáneo de la membrana celular, el citoesqueleto u otros orgánulos al mismo tiempo que se marca el anticuerpo primario. - Lave las celdas de fibra cuatro veces con 1x PTX durante 5 minutos cada una a RT agitando suavemente.
- Agregue una gota o 50 μL de medio de montaje en un portaobjetos de microscopio cargado más antes de transferir los cuartos de tejido al portaobjetos.
- Use pinzas para separar suavemente las células de fibra entre sí y tratar de limitar la superposición de los haces celulares.
- Aplique suavemente un cubreobjetos #1.5 en la parte superior de la muestra en el medio de montaje. El medio de montaje debe extenderse hasta el borde del cubreobjetos; Si esto no ocurre, agregue algunos medios de montaje adicionales al borde del cubreobjetos. Aspire cualquier exceso de medios de montaje alrededor del borde del cubreobjetos y use esmalte de uñas para sellar los bordes del cubreobjetos en el portaobjetos.
NOTA: Para estos experimentos se puede utilizar cualquier tipo de medio de montaje formulado para microscopía confocal.
3. Tinción de células de fibra única del núcleo del cristalino
- Complete la disección descrita en la sección 1.
- Eliminar mecánicamente las fibras corticales de la bola de las células de la fibra del cristalino, dejando el núcleo del cristalino, transfiriendo suavemente la masa celular de la fibra a las yemas de los dedos húmedas y enguantadas y rodando suavemente la masa de tejido.
NOTA: En lentes de ratón, hacer rodar la bola de células de fibra del cristalino entre las yemas de los dedos enguantados es un método eficaz para la eliminación de las células de fibra cortical del núcleo del cristalino duro28,30. Para las lentes en las que este método mecánico no es eficaz, se puede utilizar una disección cuidadosa o un método de vórtice29 para eliminar las células de las fibras corticales. - Transfiera el núcleo del cristalino a una solución de PFA al 1% recién hecha en una placa de pocillos e incube durante la noche a 4 °C agitando suavemente.
- Transfiera la muestra a una placa de 60 mm con PFA al 1% y use un bisturí afilado para dividir el núcleo de la lente a lo largo del eje anteroposterior. Vuelva a dividir por la mitad las muestras de tejido para producir cuartos de núcleo.
- Siga el proceso descrito en los pasos 2.4-2.13 para la inmunotinción y el montaje de la muestra.
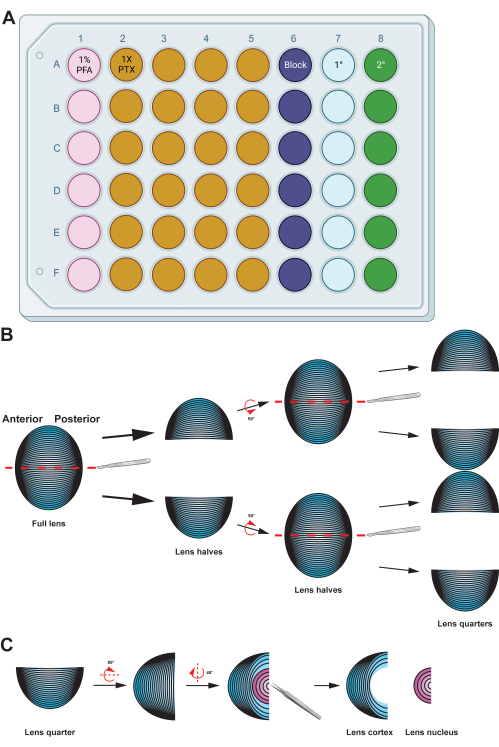
Figura 2: Resumen gráfico que detalla la preparación e inmunotinción de las células de fibra del cristalino . (A) Esta placa de 48 pocillos ha sido codificada por colores por columna para demostrar una configuración de placa de muestra para los métodos descritos, lo que permite una fácil transferencia de muestras entre los diversos pasos de inmunotinción mediante un manejo suave con fórceps. Si bien los datos representativos de este protocolo no se incuban con un anticuerpo primario, el diagrama incluye una columna para la incubación de anticuerpos primarios, y los pocillos para el lavado se pueden reutilizar después de eliminar los tampones de lavado usados por aspiración. (B) Después de la fijación de la masa celular de la fibra del cristalino, el tejido se divide a lo largo del eje antero-posterior (líneas discontinuas rojas) para preservar la estructura original de las células. Una vez que la masa de tejido se ha reducido a la mitad, las muestras se rotan y las mitades se dividen en cuartos a lo largo del eje antero-posterior (líneas discontinuas rojas). (C) La extirpación de la región del núcleo del cristalino (en rosa) se realiza fácilmente con pinzas para extraer el tejido central denso de las células de fibra cortical (en azul). Los diagramas de dibujos animados se crearon parcialmente con BioRender.com y no se dibujaron a escala. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Las células de las fibras del cristalino se preparan a partir de la corteza del cristalino (fibras diferenciadoras y fibras maduras) y el núcleo, y las células se tiñen con faloidina para la F-actina y WGA para la membrana celular. Se observa y se obtiene una imagen de una mezcla de haces de células o fibras de una sola lente (Figura 3). De la corteza del cristalino se encuentran dos tipos de células (Figura 3A). Las células de fibra diferenciadoras en la...
Discusión
Este protocolo ha demostrado los métodos de fijación, preservación e inmunotinción que preservan fielmente la morfología de la membrana 3D de haces o células de fibra de lente singular de varias profundidades en el cristalino. Las fibras del cristalino teñidas se comparan con las preparaciones SEM que se han utilizado durante mucho tiempo para estudiar la morfología de las células de las fibras del cristalino. Los resultados muestran estructuras de membrana comparables entre ambas preparaciones. La EM sigue sien...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por la subvención R01 EY032056 (a CC) del Instituto Nacional del Ojo. Los autores agradecen a la Dra. Theresa Fassel y Kimberly Vanderpool del Centro de Microscopía Central de Investigación Scripps por su ayuda con las imágenes de microscopio electrónico.
Materiales
| Name | Company | Catalog Number | Comments |
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Referencias
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Developmental Biology. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe's Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe's Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados