Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Methods Article
Präparation und Immunfluoreszenzfärbung von Bündeln und Einzelfaserzellen aus der Hirnrinde und dem Zellkern der Augenlinse
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt Methoden zur Vorbereitung von peripheren, reifen und nukleären Augenlinsenfaserzellen für die Immunfluoreszenzfärbung, um komplexe Zell-zu-Zell-Vermischungen und die Membranarchitektur zu untersuchen.
Zusammenfassung
Die Linse ist ein transparentes und ellipsoides Organ in der vorderen Augenkammer, das seine Form ändert, um Licht fein auf die Netzhaut zu fokussieren und ein klares Bild zu erzeugen. Der Großteil dieses Gewebes besteht aus spezialisierten, differenzierten Faserzellen, die einen hexagonalen Querschnitt aufweisen und sich vom vorderen bis zum hinteren Pol der Linse erstrecken. Diese langen und dünnen Zellen stehen in engem Gegensatz zu benachbarten Zellen und haben komplexe Verflechtungen entlang der Länge der Zelle. Die spezialisierten ineinandergreifenden Strukturen sind für normale biomechanische Eigenschaften der Linse erforderlich und wurden mit elektronenmikroskopischen Techniken ausführlich beschrieben. Dieses Protokoll demonstriert die erste Methode zur Konservierung und Immunfärbung von Einzelzellen sowie Bündeln von Mauslinsenfaserzellen, um die detaillierte Lokalisierung von Proteinen in diesen komplex geformten Zellen zu ermöglichen. Die repräsentativen Daten zeigen eine Färbung der peripheren, differenzierenden, reifen und nukleären Faserzellen in allen Regionen der Linse. Diese Methode kann möglicherweise auf Faserzellen angewendet werden, die aus Linsen anderer Spezies isoliert wurden.
Einleitung
Die Linse ist ein klares und eiförmiges Gewebe in der vorderen Augenkammer, das aus zwei Zelltypen besteht, Epithel- und Faserzellen 1 (Abbildung 1). Es gibt eine Monoschicht von Epithelzellen, die die vordere Hemisphäre der Linse bedeckt. Faserzellen werden von Epithelzellen unterschieden und machen den Großteil der Linse aus. Die hochspezialisierten Faserzellen durchlaufen eine Elongations-, Differenzierungs- und Reifungsprogrammierung, die durch deutliche Veränderungen der Zellmembranmorphologie von der Linsenperipherie bis zum Linsenzentrum gekennzeichnetist 2,3,4,5,6,7,8,9,10,11,12 , auch bekannt als Linsenkern. Die Funktion der Linse, Licht aus verschiedenen Entfernungen auf die Netzhaut zu fokussieren, hängt von ihren biomechanischen Eigenschaften ab, einschließlich Steifigkeit und Elastizität 13,14,15,16,17,18,19. Die komplexen Verzahnungen von Linsenfasern wurden hypothetisch aufgestellt20,21 und haben kürzlich gezeigt, dass sie für die Linsensteifigkeitwichtig sind 22,23.
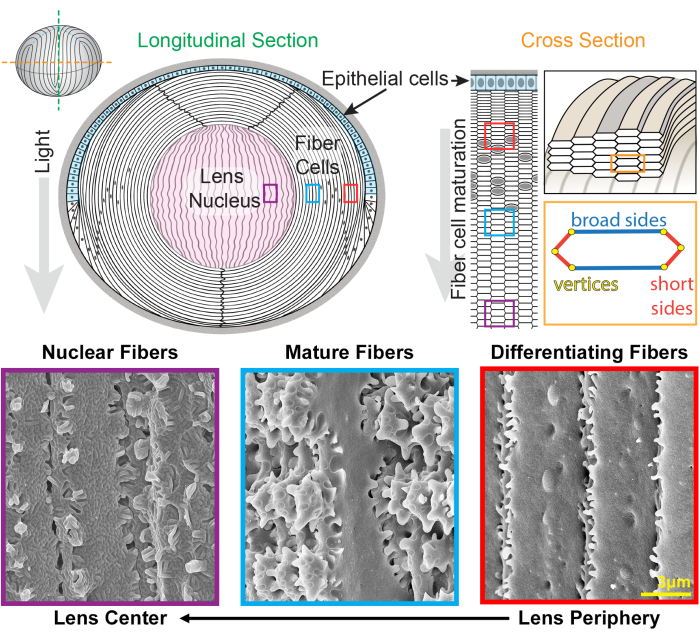
Abbildung 1: Linsenanatomiediagramme und repräsentative Rasterelektronenmikroskopie-Aufnahmen (REM) von Linsenfasern. Die Karikatur zeigt eine Längsansicht (von oben nach hinten von oben nach unten) der vorderen Monoschicht von Epithelzellen (hellblau schattiert) und einer Masse von Linsenfaserzellen (weiß). Das Zentrum der Linse (rosa schattiert) wird als Zellkern bezeichnet und besteht aus hochverdichteten Faserzellen. Auf der rechten Seite zeigt ein Querschnitts-Cartoon die längliche sechseckige Zellform von Linsenfasern, die in ein Wabenmuster gepackt sind. Faserzellen haben zwei breite Seiten und vier kurze Seiten. Repräsentative REM-Bilder entlang der Unterseite zeigen die komplexen Membranverflechtungen zwischen Linsenfaserzellen in verschiedenen Tiefen der Linse. Von rechts haben neu gebildete Linsenfasern an der Linsenperipherie kleine Ausstülpungen an den kurzen Seiten und Kugeln an der Breitseite (rote Kästchen). Während der Reifung entwickeln Linsenfasern große Paddeldomänen, die durch kleine Ausstülpungen entlang der kurzen Seiten (blaue Kästchen) verziert sind. Reife Faserzellen besitzen große Paddeldomänen, die durch kleine Ausstülpungen gekennzeichnet sind. Diese ineinandergreifenden Domänen sind wichtig für die biomechanischen Eigenschaften von Linsen. Faserzellen im Linsenkern haben weniger kleine Ausstülpungen entlang ihrer kurzen Seiten und haben komplexe Nut-Feder-Verflechtungen (violette Kästchen). Die Breitseiten der Zelle weisen eine globuläre Membranmorphologie auf. Die Karikatur wurde von22,32 modifiziert und nicht maßstabsgetreu gezeichnet. Maßstabsleiste = 3 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Linse wächst durch Hinzufügen von Schalen aus neuen Faserzellen, die über frühere Generationen von Fasern24,25 gelegt werden. Faserzellen haben eine längliche, sechseckige Querschnittsform mit zwei breiten Seiten und vier kurzen Seiten. Diese Zellen erstrecken sich vom vorderen zum hinteren Pol der Linse, und je nach Art können die Linsenfasern mehrere Millimeter lang sein. Um die Struktur dieser länglichen und dünnen Zellen zu unterstützen, schaffen spezielle Verflechtungen entlang der breiten und kurzen Seiten ineinandergreifende Strukturen, um die Linsenform und die biomechanischen Eigenschaften zu erhalten. Veränderungen der Zellmembranform während der Differenzierung und Reifung von Faserzellen wurden durch elektronenmikroskopische (EM) Studien umfassend dokumentiert 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Neu gebildete Faserzellen haben Kugeln und Pfannen entlang ihrer breiten Seiten mit sehr kleinen Vorsprüngen entlang ihrer kurzen Seiten, während reife Fasern ineinandergreifende Vorsprünge und Paddel entlang ihrer kurzen Seiten haben. Kernfasern weisen Nut-Feder-Verflechtungen und eine globuläre Membranmorphologie auf. Über die Proteine, die für diese komplexen ineinandergreifenden Membranen benötigt werden, ist wenig bekannt. Bisherige Studien zur Proteinlokalisierung in Faserzellen stützten sich auf Linsengewebeschnitte, die keine eindeutige Visualisierung der komplexen Zellarchitektur ermöglichen.
In dieser Arbeit wurde eine neuartige Methode entwickelt und perfektioniert, um einzelne und Bündel von Linsenfaserzellen zu fixieren, um die komplexe Morphologie zu erhalten und die Immunfärbung von Proteinen an der Zellmembran und im Zytoplasma zu ermöglichen. Diese Methode bewahrt die Zellmembranarchitektur, vergleichbar mit Daten aus EM-Studien, und ermöglicht die Färbung mit primären Antikörpern für spezifische Proteine. Wir haben zuvor immungefärbte kortikale Linsenfasern in Differenzierung und Reifung22,23. In diesem Protokoll gibt es auch eine neue Methode zur Färbung von Faserzellen aus dem Linsenkern. Dieses Protokoll öffnet die Tür zum Verständnis der Mechanismen für die Bildung und Veränderung der Membraninterdigitation während der Reifung von Faserzellen und der Verdichtung des Linsenkerns.
Protokoll
Die Mäuse wurden auf der Grundlage eines Tierprotokolls versorgt, das vom Institutional Animal Care and Use Committee an der Indiana University Bloomington genehmigt wurde. Die Mäuse, die zur Generierung repräsentativer Daten verwendet wurden, waren Kontrolltiere (Wildtyp) mit dem C57BL6/J-Hintergrund, weiblich und 8-12 Wochen alt. Für dieses Experiment können sowohl männliche als auch weibliche Mäuse verwendet werden, da es sehr unwahrscheinlich ist, dass das Geschlecht der Mäuse das Ergebnis des Experiments beeinflusst.
1. Dissektion und Entkapselung der Linse
- Euthanasie von Mäusen gemäß dem "Leitfaden für die Pflege und Verwendung von Labortieren" der National Institutes of Health sowie den von der Einrichtung genehmigten Tierverwendungsprotokollen.
HINWEIS: Für die vorliegende Studie wurden Mäuse durch eine CO2 -Überdosierung mit anschließender Gebärmutterhalsverrenkung in Übereinstimmung mit einem zugelassenen Tierprotokoll (Indiana University) euthanasiert. - Enukleieren Sie die Augen der Mäuse mit einer gebogenen Pinzette, indem Sie das Gewebe um die Augen herum mit einer Seite der Zange eindrücken, um das Auge aus der Augenhöhle zu verschieben. Schließen Sie dann die Pinzette unter dem Auge und heben Sie sie an, um das Auge aus der Augenhöhle zu entfernen. Übertragen Sie die Augen auf frische 1x phosphatgepufferte Kochsalzlösung (PBS) in einer Dissektionsschiene.
- Schneiden Sie den Sehnerv mit einer ultrafeinen Schere so nah wie möglich am Augapfel ab. Führen Sie vorsichtig eine feine, gerade Pinzette durch den Ausgang des Sehnervs an der Rückseite des Auges in den Augapfel ein.
- Führen Sie die Schere vorsichtig an der gleichen Stelle wie die Pinzette in Schritt 1.3 ein und beginnen Sie mit dem Schneiden eines Schnitts von der Seitenzahnseite in Richtung der Hornhaut-Sklera-Verbindung.
HINWEIS: Nagetierlinsen nehmen ~30% ihrer Augen ein. Versehentliche Schäden entstehen, wenn die Pinzette oder Schere zu tief in das Auge eingeführt wird. - Fahren Sie mit dem Schnitt entlang des Hornhaut-Sklera-Übergangs fort, bis mindestens die Hälfte des Übergangs getrennt ist.
- Drücken Sie mit einer Pinzette vorsichtig auf die Hornhaut, damit die Linse durch den mit den Schritten 1.4 und 1.5 vorgenommenen Einschnitt austreten kann.
- Entfernen Sie vorsichtig große Gewebestücke mit einer feinen Pinzette von der Linse. Untersuchen Sie das Objektiv, um die Äquatorregion zu finden.
- Stechen Sie die Linse mit einer geraden Pinzette mit feiner Spitze flach ein und entfernen Sie dann die Linsenkapsel. Die Masse der Linsenfaserzellen bleibt intakt und die Monoschicht des Linsenepithels bleibt an der Linsenkapsel haften. Entsorgen Sie die Linsenkapsel.
2. Linsen-Einzelfaser-Zellfärbung
- Die Zellmasse der Linsenfasern wird in eine Well-Platte mit 500 μl frisch hergestellter 1%iger Paraformaldehyd-Lösung (PFA; in 1x PBS) überführt und die Proben über Nacht bei 4 °C mit sanfter Nutenation inkubiert (Abbildung 2A).
HINWEIS: Die Volumina für die angegebenen Lösungen sind für 48-Well-Platten optimiert. Wenn Well-Platten oder Röhrchen anderer Größe verwendet werden, passen Sie das Volumen der Lösungen entsprechend an. Fixierungs-, Blockierungs- und Waschlösungen (1x PTX, 0,1% Triton X-100 in 1x PBS) wurden mit 10x PBS und doppelt destilliertem Wasser (ddH2O) bis zu einer Endkonzentration von 1x PBS hergestellt. - Übertragen Sie die Linsenfaserzellen in eine 60-mm-Schale mit 1 % PFA. Verwenden Sie ein scharfes Skalpell, um den Ball aus Faserzellen entlang seiner vorderen und hinteren Achse in zwei Hälften zu teilen (Abbildung 2B). Die Hälften entlang der gleichen Achse noch einmal halbieren, um Viertel zu erhalten.
HINWEIS: Die vordere-posteriore Achse ist leicht an der Richtung der Faserzellen in der Gewebemasse zu erkennen. - Verwenden Sie eine gerade Pinzette, um die Kernregion aus den Zellvierteln der Linsenfasern zu entfernen (Abbildung 2C).
HINWEIS: Die Linsenkernregion ist bei Nagetierlinsen starr, und die Mitte der Linse löst sich leicht von den weicheren kortikalen Fasern. - Fixieren Sie die Viertel der Linsenkortexregion in 200 μl 1 % PFA für 15 Minuten bei Raumtemperatur (RT) mit leichtem Schütteln (300 U/min auf einem Plattenschüttler).
- Waschen Sie die Gewebeviertel zweimal in 750 μl 1x PBS für jeweils 5 min mit leichtem Schütteln bei RT.
- Blockieren Sie die Proben mit 200 μl Blockierungslösung (5 % Serum, 0,3 % Triton X-100, 1x PBS) für 1 h bei RT mit leichtem Schütteln.
HINWEIS: Für die repräsentativen Daten in diesem Protokoll wurden die Proben nicht mit primären oder sekundären Antikörpern gefärbt. Nach dem Blockierungsschritt wurden die Proben mit Weizenkeimagglutinin (WGA; 1:100) und Phalloidin (1:100) (siehe Materialtabelle) für 3 h bei RT mit leichtem Schütteln und Lichtschutz inkubiert. Die Färbung von Primärantikörpern wurde in früheren Publikationennachgewiesen 22,23. - Mit 100 μl Primärantikörperlösung über Nacht bei 4 °C unter leichtem Schütteln inkubieren.
HINWEIS: Die Antikörper werden in Blockierungslösung verdünnt. Im Vergleich zu Objektträgern mit Gewebeschnitten befinden sich bei dieser Art der Präparation mehr Zellen. Die Konzentrationen der primären Antikörper sollten erhöht werden, um ausreichend Antikörper für die Färbung weiterer Zellen bereitzustellen. Es wird empfohlen, die Antikörperkonzentration im Vergleich zu dem, was auf Gewebeschnitten verwendet wird, zu verdoppeln. Gleiches gilt für Sekundärantikörper. - Waschen Sie die Gewebeviertel dreimal mit 1x PTX (0,1% Triton X-100, 1x PBS) für jeweils 5 min bei RT unter leichtem Schütteln.
- Inkubieren Sie die Faserzellen mit 100 μl sekundärer Antikörper-/Farbstofflösung für 3 h bei RT unter leichtem Schütteln. Schützen Sie die Proben bei diesem und den folgenden Schritten vor Licht.
HINWEIS: WGA, Phalloidin und andere Fluoreszenzfarbstoffe können der sekundären Antikörperlösung zugesetzt werden, um gleichzeitig die Zellmembran, das Zytoskelett oder andere Organellen zu markieren und gleichzeitig den primären Antikörper zu markieren. - Waschen Sie die Faserzellen viermal mit 1x PTX für jeweils 5 min bei RT mit leichtem Schütteln.
- Geben Sie einen Tropfen oder 50 μl Eindeckmedium auf einen gut geladenen Objektträger, bevor Sie die Gewebeviertel auf den Objektträger übertragen.
- Verwenden Sie eine Pinzette, um die Faserzellen vorsichtig voneinander zu trennen und versuchen Sie, die Überlappung der Zellbündel zu begrenzen.
- Tragen Sie vorsichtig ein Deckglas #1.5 auf die Probe in Eindeckmedien auf. Das Eindeckmedium sollte sich bis zum Rand des Deckglases ausbreiten. Wenn dies nicht der Fall ist, fügen Sie zusätzliche Eindeckmedien an den Rand des Deckglases hinzu. Saugen Sie überschüssiges Eindeckmaterial am Rand des Deckglases ab und verwenden Sie Nagellack, um die Kanten des Deckglases auf dem Objektträger zu versiegeln.
HINWEIS: Jede Art von Eindeckmedium, das für die konfokale Mikroskopie formuliert ist, kann für diese Experimente verwendet werden.
3. Färbung von Linsenkern-Einzelfaserzellen
- Schließen Sie die in Abschnitt 1 beschriebene Sektion ab.
- Entfernen Sie mechanisch die kortikalen Fasern von der Kugel der Linsenfaserzellen, wobei Sie den Linsenkern verlassen, indem Sie die Faserzellmasse vorsichtig auf nasse, behandschuhte Fingerspitzen übertragen und die Gewebemasse vorsichtig rollen.
ANMERKUNG: Bei Mäuselinsen ist das Rollen der Kugel von Linsenfaserzellen zwischen behandschuhten Fingerspitzen eine wirksame Methode zur Entfernung der kortikalen Faserzellen aus dem harten Linsenkern28,30. Bei Linsen, bei denen dieses mechanische Verfahren nicht wirksam ist, kann eine sorgfältige Dissektion oder ein Wirbelverfahren29 verwendet werden, um die kortikalen Faserzellen zu entfernen. - Den Linsenkern in eine frisch hergestellte 1%ige PFA-Lösung in eine Well-Platte überführen und über Nacht bei 4 °C unter leichtem Schütteln inkubieren.
- Die Probe wird in eine 60-mm-Schale mit 1 % PFA gegeben und mit einem scharfen Skalpell der Linsenkern entlang der vorderen und hinteren Achse gespalten. Halbieren Sie die Gewebeproben erneut, um Zellkernviertel zu erhalten.
- Befolgen Sie das in den Schritten 2.4-2.13 beschriebene Verfahren für die Immunfärbung und die Probeneinbettung.
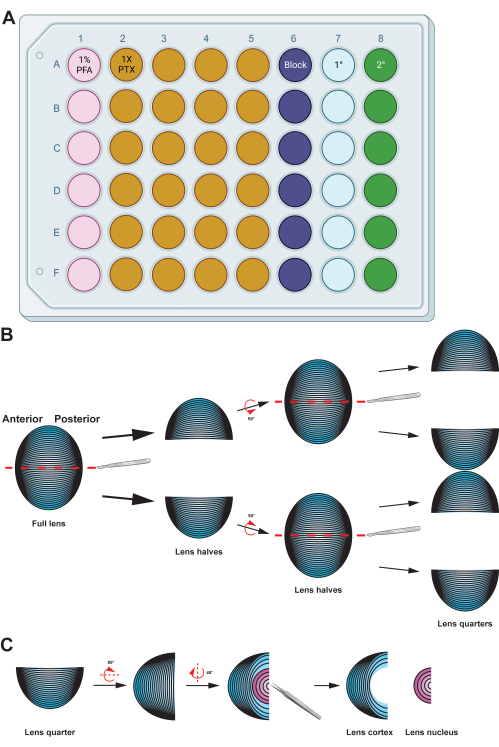
Abbildung 2: Grafische Zusammenfassung der Präparation und Immunfärbung von Linsenfaserzellen . (A) Diese 48-Well-Platte wurde nach Säulen farbcodiert, um einen Probenplattenaufbau für die beschriebenen Methoden zu demonstrieren, der einen einfachen Transfer von Proben zwischen den verschiedenen Immunfärbeschritten durch schonende Handhabung mit einer Pinzette ermöglicht. Während die repräsentativen Daten für dieses Protokoll nicht mit einem primären Antikörper inkubiert werden, enthält das Diagramm eine Spalte für die Inkubation von primären Antikörpern, und die Vertiefungen zum Waschen können wiederverwendet werden, nachdem verbrauchte Waschpuffer durch Aspiration entfernt wurden. (B) Nach der Fixierung der Zellmasse der Linsenfaser wird das Gewebe entlang der anterior-posterioren Achse gespalten (rote gestrichelte Linien), um die ursprüngliche Struktur der Zellen zu erhalten. Ist die Gewebemasse halbiert, werden die Proben gedreht und die Hälften entlang der vorder-posterioren Achse in Viertel geteilt (rote gestrichelte Linien). (C) Das Entfernen der Linsenkernregion (in rosa) kann einfach mit einer Pinzette durchgeführt werden, um das dichte zentrale Gewebe aus den kortikalen Faserzellen (in blau) herauszugraben. Cartoon-Diagramme wurden teilweise mit BioRender.com erstellt und nicht maßstabsgetreu gezeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Linsenfaserzellen werden aus dem Linsenkortex (differenzierende Fasern und reife Fasern) und dem Zellkern hergestellt, und die Zellen werden mit Phalloidin für F-Aktin und WGA für die Zellmembran gefärbt. Eine Mischung aus Zellbündeln oder einzelnen Linsenfasern (Abbildung 3) wird beobachtet und abgebildet. In der Linsenrinde finden sich zwei Arten von Zellen (Abbildung 3A). Die differenzierenden Faserzellen in der Linsenperipherie sind gerade, mit sehr klei...
Diskussion
Dieses Protokoll hat die Fixierungs-, Konservierungs- und Immunfärbemethoden demonstriert, die die 3D-Membranmorphologie von Bündeln oder einzelnen Linsenfaserzellen aus verschiedenen Tiefen in der Linse originalgetreu erhalten. Die gefärbten Linsenfasern werden mit REM-Präparaten verglichen, die seit langem zur Untersuchung der Zellmorphologie von Linsenfasern verwendet werden. Die Ergebnisse zeigen vergleichbare Membranstrukturen zwischen beiden Präparaten. EM ist nach wie vor der Goldstandard für die Untersuchun...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch das Stipendium R01 EY032056 (an CC) des National Eye Institute unterstützt. Die Autoren danken Dr. Theresa Fassel und Kimberly Vanderpool von der Scripps Research Core Microscopy Facility für ihre Unterstützung bei den elektronenmikroskopischen Bildern.
Materialien
| Name | Company | Catalog Number | Comments |
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Referenzen
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Developmental Biology. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe's Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe's Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten