Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation et coloration par immunofluorescence de faisceaux et de cellules à fibres uniques du cortex et du noyau du cristallin
Dans cet article
Résumé
Ce protocole décrit des méthodes pour préparer les cellules périphériques, matures et nucléaires de la fibre du cristallin de l’œil pour la coloration par immunofluorescence afin d’étudier les interdigitations complexes de cellule à cellule et l’architecture de la membrane.
Résumé
Le cristallin est un organe transparent et ellipsoïde situé dans la chambre antérieure de l’œil qui change de forme pour focaliser finement la lumière sur la rétine afin de former une image claire. La majeure partie de ce tissu est constituée de cellules fibreuses spécialisées et différenciées qui ont une section transversale hexagonale et s’étendent des pôles antérieur aux pôles postérieurs du cristallin. Ces cellules longues et maigres sont étroitement opposées aux cellules voisines et ont des interdigitations complexes sur toute la longueur de la cellule. Les structures d’emboîtement spécialisées sont nécessaires pour les propriétés biomécaniques normales de la lentille et ont été largement décrites à l’aide de techniques de microscopie électronique. Ce protocole démontre la première méthode permettant de préserver et d’immunocolorer des cellules de fibres de lentilles de souris afin de permettre la localisation détaillée des protéines au sein de ces cellules de forme complexe. Les données représentatives montrent une coloration des cellules périphériques, différenciantes, matures et des fibres nucléaires dans toutes les régions du cristallin. Cette méthode peut potentiellement être utilisée sur des cellules fibreuses isolées de lentilles d’autres espèces.
Introduction
Le cristallin est un tissu clair et ovoïde situé dans la chambre antérieure de l’œil, composé de deux types de cellules, les cellules épithéliales et les cellules fibreuses 1 (Figure 1). Il existe une monocouche de cellules épithéliales qui recouvre l’hémisphère antérieur du cristallin. Les cellules fibreuses sont différenciées des cellules épithéliales et constituent la majeure partie du cristallin. Les cellules fibreuses hautement spécialisées subissent une programmation d’allongement, de différenciation et de maturation, marquée par des changements distincts dans la morphologie de la membrane cellulaire de la périphérie du cristallinau centre du cristallin 2,3,4,5,6,7,8,9,10,11,12 , également connu sous le nom de noyau de lentille. La fonction de focalisation fine de la lentille provenant de différentes distances sur la rétine dépend de ses propriétés biomécaniques, notamment sa rigidité et son élasticité 13,14,15,16,17,18,19. Les interdigitations complexes des fibres du cristallin ont été supposées 20,21 et se sont récemment révélées importantes pour la rigidité du cristallin 22,23.
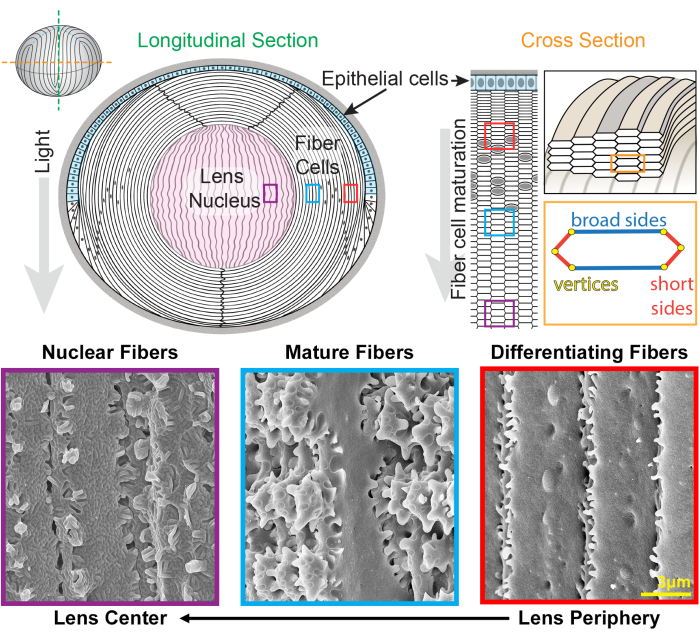
Figure 1 : Diagrammes d’anatomie du cristallin et images représentatives de la microscopie électronique à balayage (MEB) à partir des fibres du cristallin. La caricature montre une vue longitudinale (antérieure à postérieure de haut en bas) de la monocouche antérieure de cellules épithéliales (ombrée en bleu clair) et d’une masse massive de cellules de fibres de cristallin (blanche). Le centre du cristallin (en rose) est connu sous le nom de noyau et comprend des cellules fibreuses très compactes. Sur la droite, un dessin animé en coupe transversale révèle la forme allongée des cellules hexagonales des fibres de lentille qui sont emballées dans un motif en nid d’abeille. Les cellules fibreuses ont deux côtés larges et quatre côtés courts. Des images MEB représentatives le long de la partie inférieure montrent les interdigitations complexes de la membrane entre les cellules de fibre de lentille à différentes profondeurs de la lentille. À partir de la droite, les fibres de lentille nouvellement formées à la périphérie de la lentille présentent de petites protubérances le long des côtés courts et des boules et des douilles le long du côté large (cases rouges). Au cours de la maturation, les fibres du cristallin développent de grands domaines de pagaie qui sont décorés de petites protubérances le long des côtés courts (boîtes bleues). Les cellules fibreuses matures possèdent de grands domaines de pagaie illustrés par de petites protubérances. Ces domaines imbriqués sont importants pour les propriétés biomécaniques des lentilles. Les cellules fibreuses du noyau du cristallin ont moins de petites protubérances le long de leurs côtés courts et ont des interdigitations complexes en rainure et languette (boîtes violettes). Les côtés larges de la cellule présentent une morphologie de membrane globulaire. Le dessin animé a été modifié à partir de22,32 et n’a pas été dessiné à l’échelle. Barre d’échelle = 3 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La lentille se développe en ajoutant des coquilles de nouvelles cellules fibreuses superposées aux générations précédentes de fibres24,25. Les cellules fibreuses ont une forme de section transversale hexagonale allongée avec deux côtés larges et quatre côtés courts. Ces cellules s’étendent du pôle antérieur au pôle postérieur du cristallin, et selon les espèces, les fibres du cristallin peuvent mesurer plusieurs millimètres de long. Pour soutenir la structure de ces cellules allongées et maigres, des interdigitations spécialisées le long des côtés larges et courts créent des structures imbriquées pour maintenir la forme du cristallin et les propriétés biomécaniques. Les changements dans la forme de la membrane cellulaire au cours de la différenciation et de la maturation des cellules fibreuses ont été largement documentés par des études de microscopie électronique (EM) 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Les cellules fibreuses nouvellement formées ont des rotules et des douilles le long de leurs côtés larges avec de très petites protubérances le long de leurs côtés courts, tandis que les fibres matures ont des protubérances imbriquées et des palettes le long de leurs côtés courts. Les fibres nucléaires présentent des interdigitations à rainure et languette et une morphologie de membrane globulaire. On sait peu de choses sur les protéines nécessaires à ces membranes complexes qui s’emboîtent. Des études antérieures sur la localisation des protéines dans les cellules fibreuses se sont appuyées sur des coupes de tissu de lentille, qui ne permettent pas une visualisation claire de l’architecture cellulaire complexe.
Ces travaux ont permis de créer et de perfectionner une nouvelle méthode pour fixer les cellules individuelles et les faisceaux de fibres de cristallin afin de préserver la morphologie complexe et de permettre l’immunomarquage des protéines au niveau de la membrane cellulaire et du cytoplasme. Cette méthode préserve fidèlement l’architecture de la membrane cellulaire, comparable aux données des études EM, et permet la coloration avec des anticorps primaires pour des protéines spécifiques. Nous avons précédemment immunocoloré des fibres de cristallin cortical en cours de différenciation et de maturation22,23. Dans ce protocole, il existe également une nouvelle méthode pour colorer les cellules fibreuses du noyau du cristallin. Ce protocole ouvre la porte à la compréhension des mécanismes de formation et de modification des interdigitations membranaires au cours de la maturation des cellules fibreuses et du compactage du noyau du cristallin.
Protocole
Les souris ont été soignées sur la base d’un protocole animalier approuvé par le Comité institutionnel de soins et d’utilisation des animaux de l’Université de l’Indiana à Bloomington. Les souris utilisées pour générer des données représentatives étaient des animaux témoins (de type sauvage) dans le fond C57BL6/J, des femelles et âgées de 8 à 12 semaines. Les souris mâles et femelles peuvent être utilisées pour cette expérience, car il est très peu probable que le sexe des souris affecte le résultat de l’expérience.
1. Dissection et décapsulation du cristallin
- Euthanasier les souris en suivant le « Guide pour le soin et l’utilisation des animaux de laboratoire » des National Institutes of Health ainsi que les protocoles d’utilisation des animaux approuvés par l’établissement.
NOTE : Pour la présente étude, les souris ont été euthanasiées par surdose de CO2 suivie d’une luxation cervicale conformément à un protocole animal approuvé (Université de l’Indiana). - Énucléez les yeux des souris à l’aide d’une pince incurvée en appuyant sur le tissu autour des yeux avec un côté de la pince pour déplacer l’œil hors de l’orbite. Ensuite, fermez la pince sous l’œil et soulevez-la pour retirer l’œil de l’orbite. Transférez les yeux dans une solution saline tamponnée au phosphate (PBS) fraîche 1x dans un plateau de dissection.
- Coupez le nerf optique avec des ciseaux ultra-fins le plus près possible du globe oculaire. Insérez délicatement une pince à épiler droite à pointe fine dans le globe oculaire par la sortie du nerf optique à la postérieur de l’œil.
- Insérez soigneusement les ciseaux au même endroit que la pince à épiler à l’étape 1.3 et commencez à couper une incision du postérieur vers la jonction cornéen-sclérale.
REMARQUE : Les lentilles de rongeurs occupent ~30% de leurs yeux. Des dommages accidentels se produiront si la pince à épiler ou les ciseaux sont insérés trop profondément dans l’œil. - Continuez à couper le long de la jonction cornéen-sclérale jusqu’à ce qu’au moins la moitié de la jonction soit séparée.
- À l’aide d’une pince à épiler, appuyez doucement sur la cornée afin que la lentille puisse sortir par l’incision pratiquée aux étapes 1.4 et 1.5.
- Retirez délicatement tous les gros morceaux de tissu de la lentille à l’aide d’une pince à épiler droite à pointe fine. Inspectez la lentille pour trouver la région équatoriale.
- Percez superficiellement la lentille à l’aide d’une pince à épiler droite à pointe fine, puis retirez la capsule de la lentille. La masse des cellules de fibre du cristallin restera intacte et la monocouche épithéliale du cristallin restera attachée à la capsule du cristallin. Jetez la capsule de lentille.
2. Coloration des cellules à fibre unique de lentille
- Transférez la masse cellulaire de la fibre de lentille dans une plaque de puits avec 500 μL de solution de paraformaldéhyde (PFA) à 1 % fraîchement préparée et incubez les échantillons à 4 °C pendant la nuit avec une nutation douce (Figure 2A).
REMARQUE : Les volumes des solutions données sont optimisés pour les plaques à 48 puits. Si vous utilisez une plaque ou des tubes d’une autre taille, ajustez les volumes des solutions en conséquence. Des solutions de fixation, de blocage et de lavage (1x PTX, 0,1% Triton X-100 dans 1x PBS) ont été réalisées avec 10x PBS et de l’eau doublement distillée (ddH2O) jusqu’à une concentration finale de 1x PBS. - Transférez les cellules en fibre de lentille dans une parabole de 60 mm avec 1 % de PFA. À l’aide d’un scalpel bien aiguisé, divisez la boule de cellules fibreuses en deux le long de son axe antéro-postérieur (figure 2B). Coupez à nouveau les moitiés en deux le long du même axe pour obtenir des quartiers.
REMARQUE : L’axe antéro-postérieur est facilement reconnaissable par la direction des cellules fibreuses dans la masse tissulaire. - Utilisez une pince à épiler droite pour retirer la région du noyau des quartiers de cellules de la fibre du cristallin (Figure 2C).
REMARQUE : La région du noyau du cristallin est rigide dans les lentilles de rongeurs, et le centre du cristallin se séparera facilement des fibres corticales plus molles. - Post-fixer les quarts de la région du cortex du cristallin dans 200 μL de PFA à 1 % pendant 15 min à température ambiante (RT) en agitant doucement (300 tr/min sur un agitateur à plaque).
- Lavez les quartiers de mouchoirs deux fois dans 750 μL de 1x PBS pendant 5 minutes chacun en agitant doucement à RT.
- Bloquer les échantillons à l’aide de 200 μL de solution bloquante (sérum à 5 %, Triton X-100 à 0,3 %, 1 PBS) pendant 1 h à RT en agitant doucement.
REMARQUE : Pour les données représentatives de ce protocole, les échantillons n’ont pas été colorés avec des anticorps primaires ou secondaires. Après l’étape de blocage, les échantillons ont été incubés avec de l’agglutinine de germe de blé (WGA ; 1 :100) et de la phalloïdine (1 :100) (voir tableau des matériaux) pendant 3 h à RT avec une légère agitation et une protection contre la lumière. La coloration primaire des anticorps a été démontrée dans des publications antérieures22,23. - Incuber avec 100 μL de solution primaire d’anticorps pendant une nuit à 4 °C en agitant doucement.
REMARQUE : Les anticorps sont dilués dans une solution bloquante. Par rapport aux lames avec des coupes de tissus, il y a plus de cellules dans ce type de préparation. Les concentrations d’anticorps primaires doivent être augmentées pour fournir suffisamment d’anticorps pour colorer plus de cellules. Il est recommandé de doubler la concentration d’anticorps par rapport à ce qui est utilisé sur les coupes de tissus. Il en va de même pour les anticorps secondaires. - Lavez les quartiers de tissu trois fois avec 1x PTX (0,1% Triton X-100, 1x PBS) pendant 5 min chacun à RT en agitant doucement.
- Incuber les cellules fibreuses avec 100 μL de solution secondaire d’anticorps/colorant pendant 3 h à RT en agitant doucement. Protégez les échantillons de la lumière pendant cette étape et les suivantes.
REMARQUE : Le WGA, la phalloïdine et d’autres colorants fluorescents peuvent être ajoutés à la solution d’anticorps secondaire pour le marquage simultané de la membrane cellulaire, du cytosquelette ou d’autres organites tout en marquant l’anticorps primaire. - Lavez les cellules fibreuses quatre fois avec 1x PTX pendant 5 minutes chacune à RT en secouant doucement.
- Ajouter une goutte ou 50 μL de support de montage sur une lame de microscope chargée plus avant de transférer les quartiers de tissu sur la lame.
- Utilisez une pince à épiler pour séparer délicatement les cellules fibreuses les unes des autres et essayez de limiter le chevauchement des faisceaux de cellules.
- Appliquez délicatement une lamelle #1.5 sur le dessus de l’échantillon dans le support de montage. Le support de montage doit s’étendre jusqu’au bord de la lamelle ; Si ce n’est pas le cas, ajoutez un support de montage supplémentaire sur le bord de la lamelle. Aspirez tout excès de support de montage autour du bord de la lamelle et utilisez du vernis à ongles pour sceller les bords de la lamelle sur la lamelle.
REMARQUE : Tout type de milieu de montage formulé pour la microscopie confocale peut être utilisé pour ces expériences.
3. Coloration des cellules à fibre unique du noyau de lentille
- Complétez la dissection décrite à la section 1.
- Retirez mécaniquement les fibres corticales de la boule des cellules de la fibre du cristallin, en quittant le noyau du cristallin, en transférant doucement la masse cellulaire de la fibre au bout des doigts mouillés et gantés et en roulant doucement la masse tissulaire.
REMARQUE : Dans les lentilles de souris, faire rouler la boule de cellules de fibres de cristallin entre le bout des doigts gantés est une méthode efficace pour éliminer les cellules de fibres corticales du noyau dur du cristallin28,30. Pour les lentilles où cette méthode mécanique n’est pas efficace, une dissection minutieuse ou une méthode de vortex29 peut être utilisée pour enlever les cellules de la fibre corticale. - Transférez le noyau de la lentille dans une solution de PFA à 1 % fraîchement préparée dans une plaque à puits et incubez toute la nuit à 4 °C en agitant doucement.
- Transférez l’échantillon dans une boîte de 60 mm avec 1 % de PFA et utilisez un scalpel tranchant pour diviser le noyau du cristallin le long de l’axe antéro-postérieur. Coupez à nouveau les échantillons de tissus en deux pour obtenir des quartiers de noyau.
- Suivez le processus décrit aux étapes 2.4 à 2.13 pour l’immunomarquage et le montage de l’échantillon.
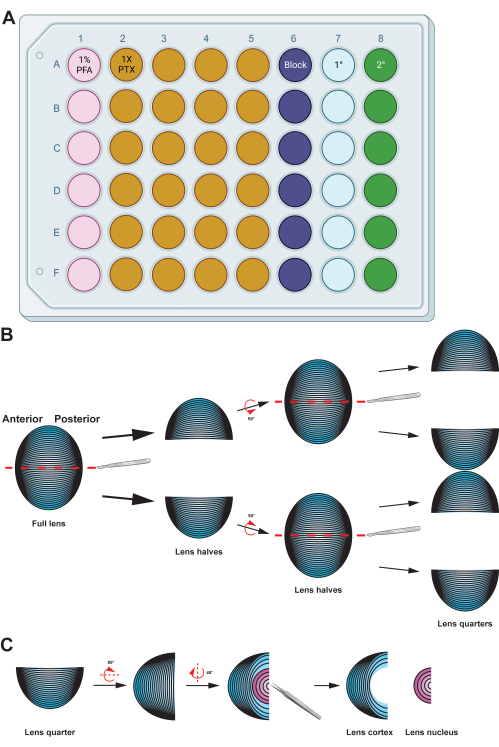
Figure 2 : Résumé graphique détaillant la préparation et l’immunomarquage des cellules de fibres de lentilles. (A) Cette plaque à 48 puits a été codée par couleur par colonne pour illustrer la configuration d’une plaque d’échantillon pour les méthodes décrites, permettant un transfert facile des échantillons entre les différentes étapes d’immunomarquage par manipulation délicate à l’aide d’une pince. Bien que les données représentatives de ce protocole ne soient pas incubées avec un anticorps primaire, le diagramme comprend une colonne pour l’incubation primaire des anticorps, et les puits pour le lavage peuvent être réutilisés après avoir retiré les tampons de lavage usagés par aspiration. (B) Après fixation de la masse cellulaire de la fibre du cristallin, le tissu est divisé le long de l’axe antéro-postérieur (lignes pointillées rouges) pour préserver la structure originale des cellules. Une fois que la masse tissulaire a été réduite de moitié, les échantillons sont tournés et les moitiés divisées en quartiers le long de l’axe antéro-postérieur (lignes pointillées rouges). (C) L’ablation de la région du noyau du cristallin (en rose) se fait facilement à l’aide d’une pince à épiler pour extraire le tissu central dense des cellules de la fibre corticale (en bleu). Les diagrammes de dessins animés ont été partiellement créés à l’aide de BioRender.com et non dessinés à l’échelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Les cellules à fibres de cristallin sont préparées à partir du cortex du cristallin (fibres de différenciation et fibres matures) et du noyau, et les cellules sont colorées avec de la phalloïdine pour l’actine F et du WGA pour la membrane cellulaire. Un mélange de faisceaux de cellules ou de fibres d’une seule lentille (Figure 3) est observé et imagé. Dans le cortex du cristallin, on trouve deux types de cellules (Figure 3A). Les cellules fibreuses...
Discussion
Ce protocole a démontré les méthodes de fixation, de préservation et d’immunomarquage qui préservent fidèlement la morphologie membranaire 3D de faisceaux ou de cellules de fibres de lentilles singulières à différentes profondeurs dans le cristallin. Les fibres de lentilles colorées sont comparées aux préparations MEB qui ont longtemps été utilisées pour étudier la morphologie des cellules des fibres de lentilles. Les résultats montrent des structures membranaires comparables entre les deux préparatio...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la subvention R01 EY032056 (à CC) du National Eye Institute. Les auteurs remercient la Dre Theresa Fassel et Kimberly Vanderpool de l’installation de microscopie de base de recherche Scripps pour leur aide avec les images au microscope électronique.
matériels
| Name | Company | Catalog Number | Comments |
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Références
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Developmental Biology. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe's Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe's Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon