Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка и иммунофлуоресцентное окрашивание пучков и клеток отдельных волокон коры и ядра хрусталика глаза
В этой статье
Резюме
В этом протоколе описаны методы подготовки периферических, зрелых и ядерных клеток волокон хрусталика глаза к иммунофлуоресцентному окрашиванию для изучения сложных межклеточных взаимосвязей и мембранной архитектуры.
Аннотация
Хрусталик представляет собой прозрачный эллипсоидный орган в передней камере глаза, который меняет форму, чтобы точно сфокусировать свет на сетчатке и сформировать четкое изображение. Основная часть этой ткани состоит из специализированных дифференцированных волоконных клеток, которые имеют шестиугольное поперечное сечение и простираются от переднего до заднего полюсов хрусталика. Эти длинные и тонкие клетки плотно противостоят соседним клеткам и имеют сложные межпальцевые соединения по длине клетки. Специализированные взаимосвязанные структуры необходимы для нормальных биомеханических свойств хрусталика и были подробно описаны с помощью методов электронной микроскопии. Этот протокол демонстрирует первый метод сохранения и иммуноокрашивания сингулярных клеток, а также пучков волокон хрусталика мыши, что позволяет детально локализовать белки в этих клетках сложной формы. Репрезентативные данные показывают окрашивание периферических, дифференцирующих, зрелых и ядерных волоконных клеток во всех областях хрусталика. Этот метод потенциально может быть использован на волоконных клетках, выделенных из линз других видов.
Введение
Хрусталик представляет собой прозрачную яйцевидную ткань в передней камере глаза, состоящую из двух типов клеток: эпителиальных и волоконныхклеток1 (рис. 1). Существует монослой эпителиальных клеток, который покрывает переднее полушарие хрусталика. Волоконные клетки дифференцируются от эпителиальных клеток и составляют основную часть хрусталика. Высокоспециализированные волоконные клетки подвергаются программированию удлинения, дифференцировки и созревания, отмеченному отчетливыми изменениями морфологии клеточной мембраны от периферии хрусталика к центру хрусталика 2,3,4,5,6,7,8,9,10,11,12 , также известный как ядро хрусталика. Функция хрусталика точно фокусировать свет, поступающий с различных расстояний на сетчатку, зависит от его биомеханических свойств, включая жесткость и эластичность 13,14,15,16,17,18,19. Были выдвинуты гипотезы о сложных взаимосвязях волокон хрусталика 20,21 и недавно показано, что они важны для жесткости хрусталика 22,23.
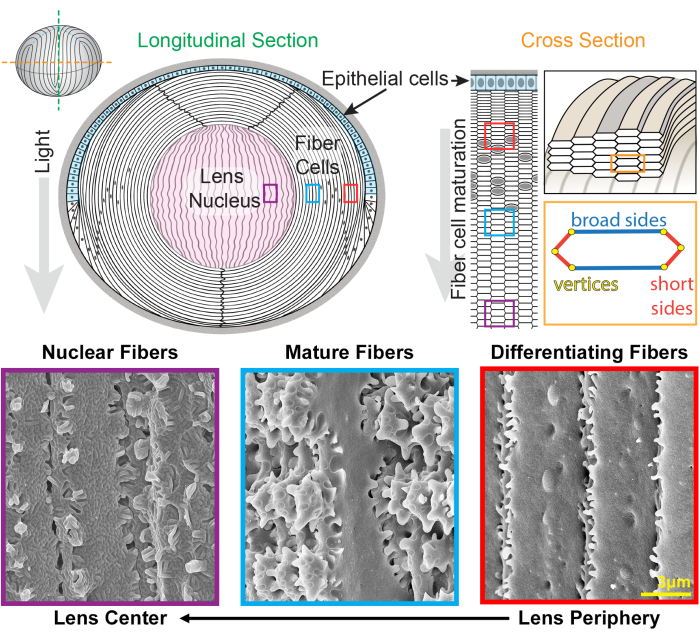
Рисунок 1: Диаграммы анатомии хрусталика и репрезентативные изображения волокон хрусталика методом сканирующей электронной микроскопии (СЭМ). На рисунке показан продольный (от переднего к заднему сверху вниз) вид переднего монослоя эпителиальных клеток (заштрихован светло-голубым цветом) и объемной массы клеток хрусталика (белый). Центр хрусталика (заштрихован розовым цветом) известен как ядро и состоит из сильно уплотненных волоконных клеток. Справа на поперечном срезе изображена вытянутая шестиугольная форма ячеек волокон хрусталика, упакованных в сотовый рисунок. Ячейки волокна имеют две широкие стороны и четыре короткие. Репрезентативные СЭМ-изображения вдоль дна показывают сложные мембранные взаимосвязи между клетками волокон хрусталика на разной глубине хрусталика. Справа новообразованные волокна хрусталика на периферии хрусталика имеют небольшие выступы по коротким сторонам и шарико-гнездовые гнезда по широкой стороне (красные прямоугольники). Во время созревания волокна хрусталика развивают крупные лопастные домены, которые украшены небольшими выступами по коротким сторонам (синими прямоугольниками). Зрелые волокнистые клетки обладают большими лопастичными доменами, проиллюстрированными небольшими выступами. Эти взаимосвязанные домены важны для биомеханических свойств линз. Волокнистые клетки в ядре хрусталика имеют меньше мелких выступов вдоль своих коротких сторон и имеют сложные шпунтовые интердигитации (фиолетовые коробочки). На широких сторонах клетки наблюдается морфология шаровой мембраны. Мультфильм был изменен с22,32 и не нарисован в масштабе. Масштабная линейка = 3 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Хрусталик растет за счет добавления оболочек из новых волоконных ячеек, наложенных поверх волокон предыдущих поколений24,25. Ячейки волокна имеют вытянутую, шестиугольную форму поперечного сечения с двумя широкими сторонами и четырьмя короткими сторонами. Эти клетки простираются от переднего до заднего полюса хрусталика, и в зависимости от вида, волокна хрусталика могут быть несколько миллиметров в длину. Чтобы поддерживать структуру этих удлиненных и тонких клеток, специализированные взаимосвязи вдоль широкой и короткой сторон создают взаимосвязанные структуры для поддержания формы хрусталика и биомеханических свойств. Изменения формы клеточной мембраны во время дифференцировки и созревания волоконных клеток были подробно задокументированы исследованиями электронной микроскопии (ЭМ) 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Новообразованные волокнистые клетки имеют шарики и гнезда вдоль своих широких сторон с очень маленькими выступами вдоль коротких сторон, в то время как зрелые волокна имеют взаимосвязанные выступы и лопасти вдоль коротких сторон. Ядерные волокна демонстрируют шпунтовые интердигитации и морфологию глобулярной мембраны. Мало что известно о белках, которые необходимы для этих сложных взаимосвязанных мембран. Предыдущие исследования локализации белков в волоконных клетках основывались на срезах ткани хрусталика, которые не позволяют четко визуализировать сложную клеточную архитектуру.
Эта работа создала и усовершенствовала новый метод фиксации отдельных и пучков клеток волокон хрусталика для сохранения сложной морфологии и обеспечения иммуноокрашивания белков на клеточной мембране и в цитоплазме. Этот метод достоверно сохраняет архитектуру клеточной мембраны, сопоставимую с данными ЭМ-исследований, и позволяет окрашивать первичными антителами к конкретным белкам. Ранее у нас были иммуноокрашенные кортикальные волокна хрусталика, подвергающиеся дифференцировке и созреванию22,23. В этом протоколе также есть новый метод окрашивания клеток волокна из ядра хрусталика. Этот протокол открывает дверь к пониманию механизмов формирования и изменений мембранных интердигитов во время созревания клеток волокна и уплотнения ядра хрусталика.
протокол
Уход за мышами осуществлялся на основе протокола, одобренного Комитетом по уходу за животными и их использованию в Университете Индианы в Блумингтоне. Мыши, использованные для получения репрезентативных данных, были контрольными (дикими) животными на фоне C57BL6/J, самками и в возрасте 8-12 недель. Для этого эксперимента можно использовать как самцов, так и самок мышей, так как пол мышей вряд ли повлияет на результат эксперимента.
1. Вскрытие и декапсулирование хрусталика
- Усыпляйте мышей в соответствии с «Руководством по уходу и использованию лабораторных животных» Национального института здравоохранения, а также протоколами использования животных, утвержденными учреждением.
ПРИМЕЧАНИЕ: В настоящем исследовании мышей усыпляли от передозировкиСО2 с последующим вывихом шейки матки в соответствии с утвержденным протоколом для животных (Университет Индианы). - Энуклейте глаза мышей с помощью изогнутых щипцов, вдавливая ткани вокруг глаз одной стороной щипцов, чтобы вытеснить глаз из глазницы. Затем закройте щипцы под глазом и поднимите, чтобы извлечь глаз из глазницы. Переложите глаза в свежий 1x фосфатно-солевой буфер (PBS) в лоток для вскрытия.
- Перережьте зрительный нерв ультратонкими ножницами как можно ближе к глазному яблоку. Осторожно введите тонкий прямой пинцет в глазное яблоко через выход зрительного нерва в задней части глаза.
- Осторожно вставьте ножницы в то же место, что и пинцет на шаге 1.3, и начните делать разрез сзади по направлению к роговично-склеральному соединению.
ПРИМЕЧАНИЕ: Линзы грызунов занимают ~30% их глаз. Случайное повреждение произойдет, если пинцет или ножницы будут введены слишком глубоко в глаз. - Продолжайте разрезать вдоль роговично-склерального соединения до тех пор, пока не будет отделена хотя бы половина соединения.
- С помощью пинцета осторожно надавите на роговицу, чтобы хрусталик мог выйти через разрез, выполненный шагами 1,4 и 1,5.
- Осторожно удалите крупные кусочки ткани с линзы с помощью прямого пинцета с тонким наконечником. Осмотрите линзу, чтобы найти экваториальную область.
- Неглубоко проткните линзу с помощью прямого пинцета с тонким наконечником, а затем снимите капсулу объектива. Масса клеток волокон хрусталика останется нетронутой, а эпителиальный монослой хрусталика останется прикрепленным к капсуле хрусталика. Выбросьте капсулу хрусталика.
2. Окрашивание одноволоконных ячеек линзы
- Перенесите клеточную массу волокна хрусталика в лунку с 500 мкл свежеприготовленного 1% раствора параформальдегида (PFA; в 1x PBS) и инкубируйте образцы при 4 °C в течение ночи с осторожной нутацией (рис. 2A).
ПРИМЕЧАНИЕ: Объемы для приведенных растворов оптимизированы для 48-луночных планшетов. Если используются скважинные пластины или трубки другого размера, отрегулируйте объемы растворов соответствующим образом. Растворы фиксации, блокировки и промывки (1x PTX, 0,1% Triton X-100 в 1x PBS) изготавливали с 10x PBS и двойной дистиллированной водой (ddH2O) до конечной концентрации 1x PBS. - Перенесите ячейки волокон хрусталика в чашку диаметром 60 мм с 1% PFA. Острым скальпелем разделите шарик из клеток волокна пополам вдоль его передне-задней оси (рис. 2Б). Разрежьте половинки еще раз пополам по той же оси, чтобы получились четвертинки.
ПРИМЕЧАНИЕ: Передне-задняя ось легко распознается по направлению волоконных клеток в тканевой массе. - С помощью прямого пинцета удалите область ядра из четвертей клетки волокна хрусталика (рис. 2C).
ПРИМЕЧАНИЕ: Область ядра хрусталика у грызунов жесткая, и центр хрусталика легко отделяется от более мягких кортикальных волокон. - После фиксации четверти области коры хрусталика в 200 мкл 1% PFA в течение 15 мин при комнатной температуре (RT) с легким встряхиванием (300 об/мин на шейкере).
- Промойте четвертинки ткани дважды в 750 мкл 1x PBS в течение 5 минут каждый с легким встряхиванием при RT.
- Блокируют образцы с помощью 200 мкл блокирующего раствора (5% сыворотка, 0,3% Triton X-100, 1x PBS) в течение 1 ч при RT с легким встряхиванием.
ПРИМЕЧАНИЕ: Для репрезентативных данных в этом протоколе образцы не были окрашены первичными или вторичными антителами. После этапа блокировки образцы инкубировали с агглютинином зародышей пшеницы (WGA; 1:100) и фаллоидином (1:100) (см. таблицу материалов) в течение 3 ч при RT с легким встряхиванием и защитой от света. Первичное окрашивание антителами было продемонстрировано в предыдущих публикациях22,23. - Инкубируют со 100 мкл раствора первичных антител в течение ночи при температуре 4 °C при легком встряхивании.
ПРИМЕЧАНИЕ: Антитела разводят в блокирующем растворе. По сравнению с предметными стеклами с тканевыми срезами, в этом типе препаратов больше клеток. Концентрация первичных антител должна быть увеличена, чтобы обеспечить достаточное количество антител для окрашивания большего количества клеток. Рекомендуется удвоить концентрацию антител по сравнению с тем, что используется на срезах тканей. То же самое относится и к вторичным антителам. - Вымойте четвертинки ткани три раза с помощью 1x PTX (0,1% Triton X-100, 1x PBS) в течение 5 минут каждая при RT с легким встряхиванием.
- Инкубируют клетки волокна со 100 мкл раствора вторичного антитела/красителя в течение 3 ч при ЛТ при легком встряхивании. Защищайте образцы от света на этом и последующих этапах.
ПРИМЕЧАНИЕ: WGA, фаллоидин и другие флуоресцентные красители могут быть добавлены во вторичный раствор антител для одновременного мечения клеточной мембраны, цитоскелета или других органелл, а также мечения первичного антитела. - Промойте ячейки волокна четыре раза с помощью 1x PTX в течение 5 минут каждый при RT с легким встряхиванием.
- Добавьте одну каплю или 50 мкл монтажной среды на предметное стекло микроскопа с плюс-зарядкой перед переносом четвертинок ткани на предметное стекло.
- Используйте пинцет, чтобы аккуратно отделить ячейки волокон друг от друга и постараться ограничить перекрытие пучков клеток.
- Аккуратно нанесите покровный слой #1.5 поверх образца в монтажной среде. Монтажный материал должен распространяться до края покровного стекла; Если этого не происходит, добавьте дополнительный монтажный материал к краю защитного стекла. Удалите излишки монтажного материала по краю покровного стекла и используйте лак для ногтей, чтобы запечатать края покровного стекла на предметном стекле.
ПРИМЕЧАНИЕ: Для этих экспериментов можно использовать любой тип монтажной среды, разработанной для конфокальной микроскопии.
3. Окрашивание ядра хрусталика одним волокном
- Завершите препарирование, описанное в разделе 1.
- Механически удаляют кортикальные волокна из шарика клеток хрусталика, покидая ядро хрусталика, аккуратно перенося клеточную массу волокна на влажные кончики пальцев в перчатках и осторожно перекатывая тканевую массу.
ПРИМЕЧАНИЕ: В мышиных линзах перекатывание шарика из клеток волокон хрусталика между кончиками пальцев в перчатках является эффективным методом удаления клеток кортикальных волокон из ядра твердого хрусталика28,30. Для линз, где этот механический метод неэффективен, для удаления клеток кортикальных волокон может быть использовано тщательное препарирование или вихревой метод29. - Переложите ядро хрусталика в свежеприготовленный 1% раствор PFA в лунке и инкубируйте в течение ночи при 4 °C при легком встряхивании.
- Перенесите образец в чашку диаметром 60 мм с 1% PFA и острым скальпелем расщепите ядро хрусталика вдоль передне-задней оси. Снова разрежьте образцы тканей пополам, чтобы получить четвертинки ядра.
- Следуйте процедуре, описанной в шагах 2.4-2.13 для иммуноокрашивания и монтирования образца.
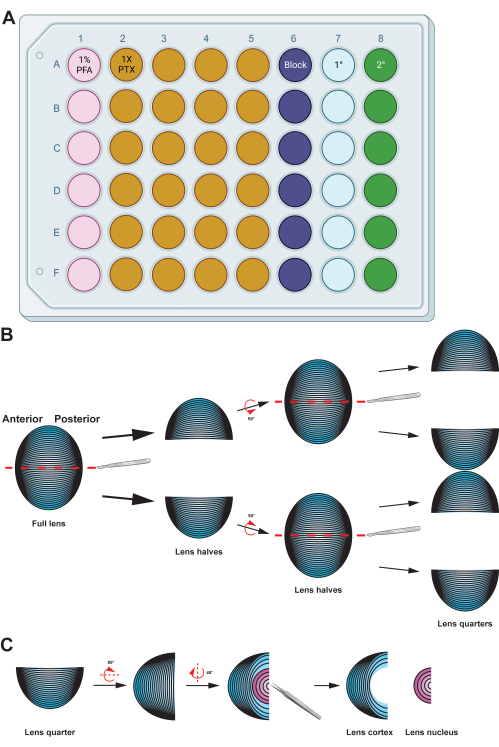
Рисунок 2: Графическая сводка с подробным описанием подготовки и иммуноокрашивания клеток волокон хрусталика . (A) Эта 48-луночная пластина имеет цветовую маркировку по столбцам, чтобы продемонстрировать настройку планшета для образцов для описанных методов, что позволяет легко перемещать образцы между различными этапами иммуноокрашивания путем бережного обращения с помощью щипцов. Несмотря на то, что репрезентативные данные для этого протокола не инкубируются с первичными антителами, диаграмма включает столбец для инкубации первичных антител, а лунки для промывки могут быть повторно использованы после удаления использованных промывочных буферов путем аспирации. (B) После фиксации клеточной массы волокон хрусталика ткань расщепляется вдоль передне-задней оси (красные пунктирные линии) для сохранения первоначальной структуры клеток. После того, как тканевая масса была уменьшена вдвое, образцы поворачивают, и половинки разделяют на четверти вдоль передне-задней оси (красные пунктирные линии). (C) Удаление области ядра хрусталика (розовый цвет) легко выполняется с помощью пинцета, чтобы выкопать плотную центральную ткань из клеток кортикальных волокон (синим цветом). Мультяшные диаграммы были частично созданы с использованием BioRender.com, а не нарисованы в масштабе. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Клетки волокон хрусталика получают из коры хрусталика (дифференцирующие волокна и зрелые волокна) и ядра, и клетки окрашивают фаллоидином для F-актина и WGA для клеточной мембраны. Наблюдается и визуализируется смесь пучков клеток или отдельных волокон хрусталика (рис. 3)....
Обсуждение
Этот протокол продемонстрировал методы фиксации, консервации и иммуноокрашивания, которые точно сохраняют морфологию 3D-мембраны пучков или отдельных клеток волокон хрусталика с различной глубины в хрусталике. Окрашенные волокна хрусталика сравниваются с препаратами SEM, которые уже ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом R01 EY032056 (CC) от Национального института глаза. Авторы благодарят д-ра Терезу Фассель и Кимберли Вандерпул из Исследовательского центра керновой микроскопии Скриппса за помощь в получении изображений с помощью электронного микроскопа.
Материалы
| Name | Company | Catalog Number | Comments |
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Ссылки
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Developmental Biology. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe's Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe's Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены