È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e colorazione in immunofluorescenza di fasci e cellule a fibra singola dalla corteccia e dal nucleo del cristallino dell'occhio
In questo articolo
Riepilogo
Questo protocollo descrive i metodi per preparare le cellule delle fibre periferiche, mature e nucleari del cristallino per la colorazione in immunofluorescenza per studiare le complesse interdigitazioni cellula-cellula e l'architettura della membrana.
Abstract
Il cristallino è un organo trasparente ed ellissoide nella camera anteriore dell'occhio che cambia forma per focalizzare finemente la luce sulla retina per formare un'immagine chiara. La maggior parte di questo tessuto è costituita da cellule fibrose specializzate e differenziate che hanno una sezione trasversale esagonale e si estendono dai poli anteriori a quelli posteriori del cristallino. Queste cellule lunghe e sottili sono strettamente opposte alle cellule vicine e hanno complesse interdigitazioni lungo la lunghezza della cellula. Le strutture ad incastro specializzate sono necessarie per le normali proprietà biomeccaniche della lente e sono state ampiamente descritte utilizzando tecniche di microscopia elettronica. Questo protocollo dimostra il primo metodo per preservare e immunocolorare singole cellule di fibre di lenti di topo e fasci di cellule di fibre di lenti di topo per consentire la localizzazione dettagliata delle proteine all'interno di queste cellule di forma complessa. I dati rappresentativi mostrano la colorazione delle cellule periferiche, differenzianti, mature e nucleari in tutte le regioni del cristallino. Questo metodo può potenzialmente essere utilizzato su cellule fibrose isolate da lenti di altre specie.
Introduzione
Il cristallino è un tessuto trasparente e ovoidale nella camera anteriore dell'occhio costituito da due tipi di cellule, cellule epiteliali e fibre 1 (Figura 1). C'è un monostrato di cellule epiteliali che copre l'emisfero anteriore del cristallino. Le cellule fibrose sono differenziate dalle cellule epiteliali e costituiscono la maggior parte del cristallino. Le cellule fibrose altamente specializzate subiscono una programmazione di allungamento, differenziazione e maturazione, caratterizzata da cambiamenti distinti nella morfologia della membrana cellulare dalla periferia del cristallino al centro del cristallino 2,3,4,5,6,7,8,9,10,11,12 , noto anche come nucleo del cristallino. La funzione del cristallino di mettere a fuoco con precisione la luce proveniente da varie distanze sulla retina dipende dalle sue proprietà biomeccaniche, tra cui rigidità ed elasticità 13,14,15,16,17,18,19. Le complesse interdigitazioni delle fibre del cristallino sono state ipotizzate20,21 e recentemente hanno dimostrato di essere importanti per la rigidità del cristallino22,23.
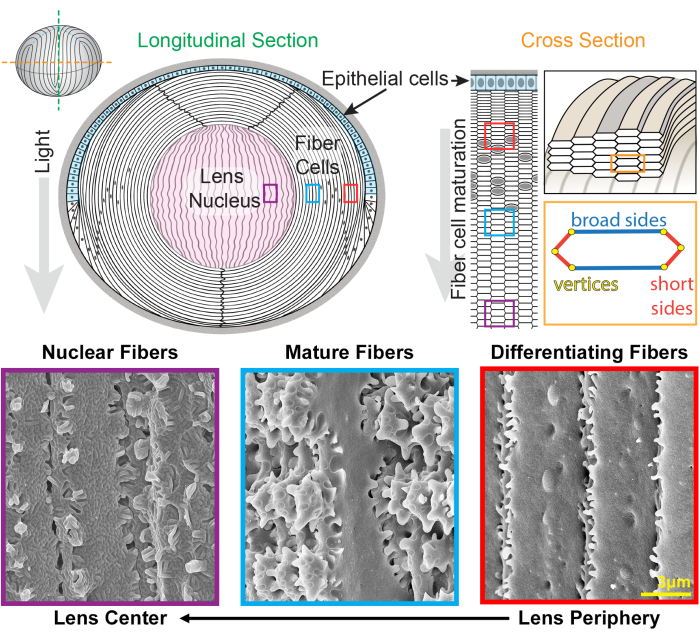
Figura 1: Diagrammi anatomici della lente e immagini rappresentative di microscopia elettronica a scansione (SEM) dalle fibre della lente. La vignetta mostra una vista longitudinale (da anteriore a posteriore dall'alto verso il basso) del monostrato anteriore di cellule epiteliali (ombreggiato in azzurro) e una massa di cellule in fibra del cristallino (bianco). Il centro della lente (sfumato in rosa) è noto come nucleo e comprende cellule di fibre altamente compattate. A destra, una vignetta in sezione trasversale rivela la forma allungata delle celle esagonali delle fibre delle lenti che sono impacchettate in un motivo a nido d'ape. Le celle in fibra hanno due lati larghi e quattro lati corti. Immagini SEM rappresentative lungo il fondo mostrano le complesse interdigitazioni della membrana tra le cellule delle fibre della lente a diverse profondità della lente. Da destra, le fibre della lente appena formate alla periferia della lente hanno piccole sporgenze lungo i lati corti e sfere e prese lungo il lato largo (caselle rosse). Durante la maturazione, le fibre del cristallino sviluppano ampi domini a paletta che sono decorati da piccole sporgenze lungo i lati corti (scatole blu). Le cellule fibrose mature possiedono ampi domini a paletta illustrati da piccole sporgenze. Questi domini ad incastro sono importanti per le proprietà biomeccaniche delle lenti. Le cellule fibrose nel nucleo del cristallino hanno meno piccole sporgenze lungo i loro lati corti e hanno complesse interdigitazioni maschio-femmina (scatole viola). I lati larghi della cellula mostrano una morfologia di membrana globulare. Il cartone animato è stato modificato da22,32 e non disegnato in scala. Barra della scala = 3 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La lente cresce aggiungendo gusci di nuove celle di fibre sovrapposte alle precedenti generazioni di fibre24,25. Le celle in fibra hanno una forma a sezione trasversale allungata ed esagonale con due lati larghi e quattro lati corti. Queste cellule si estendono dal polo anteriore a quello posteriore del cristallino e, a seconda della specie, le fibre del cristallino possono essere lunghe diversi millimetri. Per sostenere la struttura di queste cellule allungate e sottili, interdigitazioni specializzate lungo i lati larghi e corti creano strutture ad incastro per mantenere la forma della lente e le proprietà biomeccaniche. I cambiamenti nella forma della membrana cellulare durante la differenziazione e la maturazione delle cellule delle fibre sono stati ampiamente documentati dagli studi di microscopia elettronica (EM) 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Le cellule fibrose di nuova formazione hanno sfere e prese lungo i loro lati larghi con sporgenze molto piccole lungo i loro lati corti, mentre le fibre mature hanno sporgenze e pale ad incastro lungo i loro lati corti. Le fibre nucleari mostrano interdigitazioni maschio-femmina e morfologia della membrana globulare. Poco si sa sulle proteine necessarie per queste complesse membrane ad incastro. Precedenti studi sulla localizzazione delle proteine nelle cellule fibrose si sono basati su sezioni di tessuto del cristallino, che non consentono una chiara visualizzazione della complessa architettura cellulare.
Questo lavoro ha creato e perfezionato un nuovo metodo per fissare singole cellule e fasci di cellule a fibra del cristallino per preservare la complessa morfologia e per consentire l'immunocolorazione delle proteine alla membrana cellulare e all'interno del citoplasma. Questo metodo preserva fedelmente l'architettura della membrana cellulare, paragonabile ai dati degli studi EM, e consente la colorazione con anticorpi primari per proteine specifiche. In precedenza abbiamo immunocolorato le fibre del cristallino corticale in fase di differenziazione e maturazione22,23. In questo protocollo, c'è anche un nuovo metodo per colorare le cellule delle fibre dal nucleo del cristallino. Questo protocollo apre le porte alla comprensione dei meccanismi di formazione e dei cambiamenti nelle interdigitazioni di membrana durante la maturazione delle cellule fibrose e la compattazione del nucleo del cristallino.
Protocollo
I topi sono stati curati sulla base di un protocollo per animali approvato dall'Institutional Animal Care and Use Committee presso l'Università dell'Indiana a Bloomington. I topi utilizzati per generare dati rappresentativi erano animali di controllo (wild-type) nel background C57BL6/J, femmine e di età compresa tra 8 e 12 settimane. Sia i topi maschi che quelli femmine possono essere utilizzati per questo esperimento, poiché è molto improbabile che il sesso dei topi influenzi il risultato dell'esperimento.
1. Dissezione e decapsulamento delle lenti
- Sopprimere i topi seguendo la "Guida per la cura e l'uso degli animali da laboratorio" del National Institutes of Health e i protocolli per l'uso degli animali approvati dall'istituzione.
NOTA: Per il presente studio, i topi sono stati sottoposti a eutanasia mediante sovradosaggio di CO2 seguito da lussazione cervicale in conformità con un protocollo animale approvato (Università dell'Indiana). - Enucleare gli occhi dai topi usando una pinza curva premendo il tessuto intorno agli occhi con un lato della pinza per spostare l'occhio fuori dall'orbita. Quindi, chiudi la pinza sotto l'occhio e sollevala per rimuovere l'occhio dall'orbita. Trasferire gli occhi in 1 soluzione salina tamponata con fosfato (PBS) fresca in un vassoio di dissezione.
- Tagliare il nervo ottico con forbici ultrasottili il più vicino possibile al bulbo oculare. Inserire con cautela una pinzetta diritta a punta fine nel bulbo oculare attraverso l'uscita del nervo ottico nella parte posteriore dell'occhio.
- Inserire con cautela le forbici nella stessa posizione delle pinzette nel passaggio 1.3 e iniziare a praticare un'incisione dalla parte posteriore verso la giunzione corneale-sclerale.
NOTA: Le lenti dei roditori occupano ~ 30% dei loro occhi. Si verificheranno danni accidentali se le pinzette o le forbici vengono inserite troppo in profondità nell'occhio. - Continuare a tagliare lungo la giunzione corneale-sclerale fino a quando almeno metà della giunzione non è stata separata.
- Utilizzare una pinzetta per spingere delicatamente sulla cornea in modo che il cristallino possa uscire attraverso l'incisione effettuata con i passaggi 1.4 e 1.5.
- Rimuovere con cautela eventuali pezzi di tessuto di grandi dimensioni dall'obiettivo utilizzando una pinzetta dritta a punta fine. Ispeziona l'obiettivo per trovare la regione equatoriale.
- Forare superficialmente la lente usando una pinzetta dritta a punta fine, quindi rimuovere la capsula della lente. La massa delle cellule della fibra del cristallino rimarrà intatta e il monostrato epiteliale del cristallino rimarrà attaccato alla capsula del cristallino. Gettare la capsula dell'obiettivo.
2. Colorazione delle cellule a fibra singola della lente
- Trasferire la massa cellulare della fibra del cristallino in una piastra a pozzetti con 500 μL di soluzione di paraformaldeide all'1% (PFA; in 1x PBS) appena prodotta e incubare i campioni a 4 °C per una notte con una nutazione delicata (Figura 2A).
NOTA: I volumi per le soluzioni fornite sono ottimizzati per piastre a 48 pozzetti. Se si utilizzano piastre a pozzetto o provette di un'altra dimensione, regolare di conseguenza i volumi delle soluzioni. Le soluzioni di fissaggio, blocco e lavaggio (1x PTX, 0,1% Triton X-100 in 1x PBS) sono state realizzate con 10x PBS e acqua bidistillata (ddH2O) fino a una concentrazione finale di 1x PBS. - Trasferire le celle della fibra dell'obiettivo in un piatto da 60 mm con l'1% di PFA. Utilizzare un bisturi affilato per dividere la palla di cellule fibrose a metà lungo l'asse anteriore-posteriore (Figura 2B). Tagliate di nuovo le metà a metà lungo lo stesso asse per produrre dei quarti.
NOTA: L'asse antero-posteriore è facilmente riconoscibile dalla direzione delle cellule fibrose nella massa tissutale. - Utilizzare una pinzetta diritta per rimuovere la regione del nucleo dai quarti delle cellule della fibra del cristallino (Figura 2C).
NOTA: La regione del nucleo del cristallino è rigida nelle lenti per roditori e il centro del cristallino si separerà facilmente dalle fibre corticali più morbide. - Post-fissare i quarti della regione della corteccia del cristallino in 200 μL di PFA all'1% per 15 minuti a temperatura ambiente (RT) agitando delicatamente (300 giri/min su uno shaker per piastre).
- Lavare i quarti di tessuto due volte in 750 μL di 1x PBS per 5 minuti ciascuno con agitare delicatamente a RT.
- Bloccare i campioni utilizzando 200 μL di soluzione bloccante (5% di siero, 0,3% Triton X-100, 1x PBS) per 1 ora a RT con agitazione delicata.
NOTA: Per i dati rappresentativi di questo protocollo, i campioni non sono stati colorati con anticorpi primari o secondari. Dopo la fase di blocco, i campioni sono stati incubati con agglutinina del germe di grano (WGA; 1:100) e falloidina (1:100) (vedi Tabella dei materiali) per 3 ore a RT con agitazione delicata e protezione dalla luce. La colorazione primaria degli anticorpi è stata dimostrata in precedenti pubblicazioni22,23. - Incubare con 100 μL di soluzione anticorpale primaria per una notte a 4 °C agitando delicatamente.
NOTA: Gli anticorpi sono diluiti in soluzione bloccante. Rispetto ai vetrini con sezioni di tessuto, ci sono più cellule in questo tipo di preparazione. Le concentrazioni di anticorpi primari devono essere aumentate per fornire un'ampia quantità di anticorpi per colorare più cellule. Si raccomanda di raddoppiare la concentrazione di anticorpi rispetto a quella utilizzata sulle sezioni di tessuto. Lo stesso vale per gli anticorpi secondari. - Lavare i quarti di tessuto tre volte con 1x PTX (0,1% Triton X-100, 1x PBS) per 5 minuti ciascuno a RT agitando delicatamente.
- Incubare le cellule fibrose con 100 μL di soluzione anticorpo/colorante secondaria per 3 ore a RT agitando delicatamente. Proteggere i campioni dalla luce durante questa e le fasi successive.
NOTA: WGA, falloidina e altri coloranti fluorescenti possono essere aggiunti alla soluzione anticorpale secondaria per la marcatura simultanea della membrana cellulare, del citoscheletro o di altri organelli, marcando anche l'anticorpo primario. - Lavare le celle in fibra quattro volte con 1x PTX per 5 minuti ciascuna a RT con agitazione delicata.
- Aggiungere una goccia o 50 μL di terreno di montaggio su un vetrino da microscopio caricato più prima di trasferire i quarti di tessuto sul vetrino.
- Usa le pinzette per separare delicatamente le cellule della fibra l'una dall'altra e cerca di limitare la sovrapposizione dei fasci cellulari.
- Applicare delicatamente un vetrino coprioggetto #1.5 sopra il campione nel terreno di montaggio. Il supporto di montaggio deve diffondersi fino al bordo del vetrino coprioggetto; Se ciò non si verifica, aggiungere altri supporti di montaggio sul bordo del vetrino coprioggetti. Aspirare il materiale di montaggio in eccesso attorno al bordo del vetrino coprioggetto e utilizzare lo smalto per unghie per sigillare i bordi del vetrino coprioggetto sul vetrino.
NOTA: Per questi esperimenti è possibile utilizzare qualsiasi tipo di mezzo di montaggio formulato per la microscopia confocale.
3. Colorazione delle cellule a fibra singola del nucleo del cristallino
- Completare la dissezione descritta nella sezione 1.
- Rimuovere meccanicamente le fibre corticali dalla sfera delle cellule delle fibre del cristallino, lasciando il nucleo del cristallino, trasferendo delicatamente la massa cellulare della fibra sulla punta delle dita bagnate e guantate e facendo rotolare delicatamente la massa tissutale.
NOTA: Nelle lenti di topo, far rotolare la palla di cellule della fibra del cristallino tra i polpastrelli guantati è un metodo efficace per la rimozione delle cellule della fibra corticale dal nucleo del cristallinoduro 28,30. Per le lenti in cui questo metodo meccanico non è efficace, può essere utilizzata un'attenta dissezione o un metodo a vortice29 per rimuovere le cellule delle fibre corticali. - Trasferire il nucleo del cristallino in una soluzione di PFA all'1% appena preparata in una piastra a pozzetti e incubare per una notte a 4 °C agitando delicatamente.
- Trasferire il campione in un piatto da 60 mm con PFA all'1% e utilizzare un bisturi affilato per dividere il nucleo del cristallino lungo l'asse antero-posteriore. Dimezzare nuovamente i campioni di tessuto per produrre i quarti del nucleo.
- Seguire la procedura descritta nei passaggi 2.4-2.13 per l'immunocolorazione e il montaggio del campione.
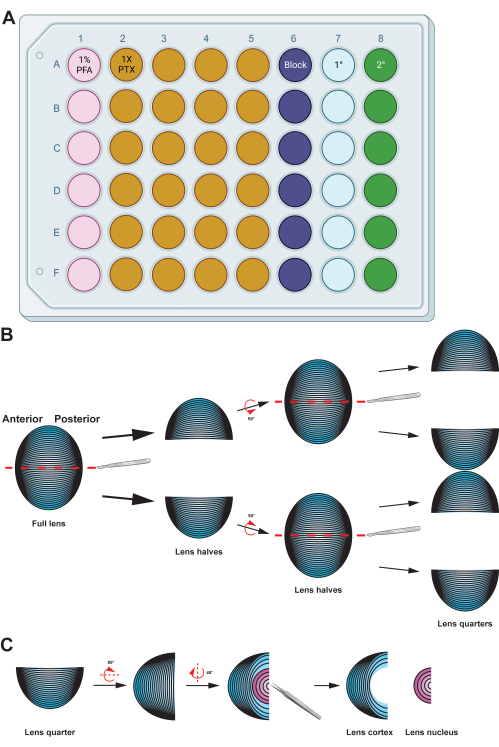
Figura 2: Riepilogo grafico che descrive in dettaglio la preparazione e l'immunocolorazione delle cellule delle fibre del cristallino . (A) Questa piastra a 48 pozzetti è stata codificata a colori per colonna per dimostrare una configurazione della piastra campione per i metodi descritti, consentendo un facile trasferimento dei campioni tra le varie fasi di immunocolorazione mediante una manipolazione delicata con le pinze. Sebbene i dati rappresentativi di questo protocollo non siano incubati con un anticorpo primario, il diagramma include una colonna per l'incubazione degli anticorpi primari e i pozzetti per il lavaggio possono essere riutilizzati dopo aver rimosso i tamponi di lavaggio usati mediante aspirazione. (B) Dopo la fissazione della massa cellulare della fibra del cristallino, il tessuto viene diviso lungo l'asse anteriore-posteriore (linee tratteggiate rosse) per preservare la struttura originale delle cellule. Una volta che la massa tissutale è stata dimezzata, i campioni vengono ruotati e le metà divise in quarti lungo l'asse antero-posteriore (linee tratteggiate rosse). (C) La rimozione della regione del nucleo del cristallino (in rosa) è facilmente eseguibile utilizzando una pinzetta per estrarre il denso tessuto centrale dalle cellule della fibra corticale (in blu). I diagrammi dei cartoni animati sono stati parzialmente creati utilizzando BioRender.com e non disegnati in scala. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Le cellule della fibra del cristallino vengono preparate dalla corteccia del cristallino (fibre differenzianti e fibre mature) e dal nucleo e le cellule vengono colorate con falloidina per la F-actina e WGA per la membrana cellulare. Una miscela di fasci di cellule o fibre di lenti singole (Figura 3) viene osservata e visualizzata. Dalla corteccia del cristallino si trovano due tipi di cellule (Figura 3A). Le cellule delle fibre differenzianti nella periferia de...
Discussione
Questo protocollo ha dimostrato i metodi di fissazione, conservazione e immunocolorazione che preservano fedelmente la morfologia della membrana 3D di fasci o singole cellule di fibre del cristallino da varie profondità nel cristallino. Le fibre colorate del cristallino vengono confrontate con i preparati SEM che sono stati a lungo utilizzati per studiare la morfologia delle cellule delle fibre del cristallino. I risultati mostrano strutture di membrana comparabili tra le due preparazioni. L'EM rimane il gold standard p...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione R01 EY032056 (a CC) del National Eye Institute. Gli autori ringraziano la dottoressa Theresa Fassel e Kimberly Vanderpool della Scripps Research Core Microscopy Facility per la loro assistenza con le immagini al microscopio elettronico.
Materiali
| Name | Company | Catalog Number | Comments |
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Riferimenti
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Developmental Biology. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe's Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe's Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon