Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cultivo Celular Tridimensional de Células Madre Derivadas del Temisio Adiposo en Hidrogel con Aumento de Fotobiomodulación
En este artículo
Resumen
Aquí, presentamos un protocolo que demuestra el uso del hidrogel como un marco de cultivo celular tridimensional (3D) para el cultivo de células madre derivadas de tejido adiposo (ADSC) e introduce la fotobiomodulación (PBM) para mejorar la proliferación de ADSC dentro del entorno de cultivo 3D.
Resumen
Las células madre derivadas del tejido adiposo (ADSC), que poseen características mesenquimales multipotentes similares a las células madre, se emplean con frecuencia en medicina regenerativa debido a su capacidad para una amplia gama de diferenciación celular y su capacidad para mejorar la migración, la proliferación y mitigar la inflamación. Sin embargo, las ADSC a menudo enfrentan desafíos en la supervivencia y el injerto dentro de las heridas, principalmente debido a condiciones inflamatorias desfavorables. Para abordar este problema, se han desarrollado hidrogeles para mantener la viabilidad de ADSC en heridas y acelerar el proceso de cicatrización de heridas. Aquí, nuestro objetivo fue evaluar el impacto sinérgico de la fotobiomodulación (PBM) en la proliferación y citotoxicidad de ADSC dentro de un marco de cultivo celular en 3D. Las ADSC inmortalizadas se sembraron en hidrogeles de 10 μL a una densidad de 2,5 x 103 células y se sometieron a irradiación utilizando diodos de 525 nm y 825 nm a fluencias de 5 J/cm2 y 10 J/cm2. Se evaluaron los cambios morfológicos, la citotoxicidad y la proliferación a las 24 h y 10 días después de la exposición a PBM. Las ADSC exhibieron una morfología redondeada y se dispersaron por todo el gel como células individuales o agregados esferoides. Es importante destacar que tanto el PBM como el marco de cultivo 3D no mostraron efectos citotóxicos en las células, mientras que el PBM mejoró significativamente las tasas de proliferación de ADSC. En conclusión, este estudio demuestra el uso del hidrogel como un entorno 3D adecuado para el cultivo de ADSC e introduce el PBM como una estrategia de aumento significativa, abordando particularmente las tasas de proliferación lenta asociadas con el cultivo celular 3D.
Introducción
Las ADSC son células progenitoras mesenquimales multipotentes con la capacidad de autorrenovarse y diferenciarse en varios linajes celulares. Estas células pueden extraerse de la fracción vascular estromal (FSV) del tejido adiposo durante un procedimiento de lipoaspiración1. Las ADSC se han convertido en un tipo de célula madre ideal para su uso en medicina regenerativa porque estas células son abundantes, mínimamente invasivas para la recolección, de fácil acceso ybien caracterizadas. La terapia con células madre ofrece una posible vía para la cicatrización de heridas al estimular la migración celular, la proliferación, la neovascularización y la reducción de la inflamación dentro de las heridas 3,4. Aproximadamente el 80% de la capacidad regenerativa de las ADSC es atribuible a la señalización paracrina a través de su secretoma5. Anteriormente, se sugirió que una inyección local directa de células madre o factores de crecimiento en el tejido dañado podría provocar suficientes mecanismos de reparación in vivo 6,7,8. Sin embargo, este enfoque enfrentó varios desafíos, como la baja supervivencia y la reducción del injerto de células madre dentro de los tejidos dañados como resultado del ambiente inflamatorio 9. Además, una de las razones citadas fue la falta de una matriz extracelular que apoyara la supervivencia y funcionalidad de las células trasplantadas10. Para superar estos desafíos, ahora se está haciendo hincapié en el desarrollo de portadores de biomateriales para apoyar la viabilidad y función de las células madre.
El cultivo celular tridimensional (3D) mejora la interacción célula a célula y célula a matriz in vitro para proporcionar un entorno que se asemeje mejor al entorno in vivo 11. Los hidrogeles se han estudiado ampliamente como una clase de portadores de biomateriales que proporcionan un entorno 3D para el cultivo de células madre. Estas estructuras están hechas de agua y polímeros reticulados12. La encapsulación de ADSC en hidrogel prácticamente no tiene ningún efecto citotóxico sobre las células durante el cultivo, manteniendo la viabilidad de las células6. Las células madre cultivadas en 3D demuestran una mayor retención de su madre y una mayor capacidad de diferenciación13. Del mismo modo, las ADSC sembradas con hidrogel demostraron una mayor viabilidad y un cierre acelerado de la herida en modelos animales14. Además, la encapsulación de hidrogel aumenta significativamente el injerto y la retención de ADSC en heridas15,16. TrueGel3D está hecho de un polímero, ya sea alcohol polivinílico o dextrano, solidificado por un reticulante, ya sea ciclodextrina o polietilenglicol17. El gel es un hidrogel sintético que no contiene ningún producto animal que pueda interferir con los experimentos o desencadenar una reacción inmune durante el trasplante del gel en un paciente, al tiempo que imita eficazmente una matriz extracelular18. El gel es totalmente personalizable modificando la composición y los componentes individuales. Puede albergar diferentes células madre y apoyar la diferenciación de varios tipos de células ajustando la rigidez del gel19. Los sitios de unión se pueden crear mediante la adición de péptidos20. El gel es degradable por la secreción de metaloproteasas, lo que permite la migración celular21. Por último, es transparente y permite realizar técnicas de imagen.
La PBM es una forma mínimamente invasiva y fácil de realizar de terapia con láser de bajo nivel que se utiliza para estimular los cromóforos intracelulares. Diferentes longitudes de onda provocan diferentes efectos en las células22. La luz en el rango del rojo al infrarrojo cercano estimula el aumento de la producción de trifosfato de adenosina (ATP) y especies reactivas de oxígeno (ROS) al mejorar el flujo a través de la cadena de transporte de electrones23. La luz en los rangos azul y verde estimula los canales iónicos activados por la luz, lo que permite la afluencia inespecífica de cationes, como el calcio y el magnesio, en las células, lo que se sabe que mejora la diferenciación24. El efecto neto es la generación de mensajeros secundarios que estimulan la transcripción de factores que desencadenan procesos celulares posteriores como la migración, la proliferación y la diferenciación25. El PBM se puede utilizar para preacondicionar las células para que proliferen o se diferencien antes de trasplantarlas a un entorno adverso, por ejemplo, tejido dañado26. La exposición a PBM antes y después del trasplante (630 nm y 810 nm) de ADSC mejoró significativamente la viabilidad y la función de estas células in vivo en un modelo de rata diabética27. La medicina regenerativa requiere un número adecuado de células para la reparación efectiva de los tejidos28. En el cultivo celular 3D, las ADSC se han asociado con tasas de proliferación más lentas en comparación con el cultivo celular bidimensional6. Sin embargo, el PBM se puede utilizar para aumentar el proceso de cultivo celular 3D de las ADSC al mejorar la viabilidad, la proliferación, la migración y la diferenciación29,30.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos y software utilizados en este protocolo. El protocolo se ha resumido gráficamente en la Figura 1.
1. Cultivo celular bidimensional (2D)
NOTA: Los ADSC inmortalizados (1 x106 células) se almacenan a -195,8 °C en nitrógeno líquido en un vial de criopreservación que contiene 1 ml de medio de congelación celular.
- Preparación del medio de recuperación celular 2D y del matraz de cultivo 2D
- Transfiera 39 ml del medio basal a un tubo de centrífuga de 50 ml
- Enriquecer el medio basal con 20% de suero fetal bovino (FBS; 10 mL) y antibióticos (1 mL) (0,5 mL de Penicilina-Estreptomicina y 0,5 mL de Anfotericina B).
- Preacondicionar un matraz T75 transfiriendo 6 ml del medio de recuperación celular al matraz e incubarlo a 37 °C, 5 % de CO2 y 85 % de humedad durante 45 minutos (esto se puede hacer mientras se realizan los pasos de recuperación celular para ahorrar tiempo).
NOTA: Calentar todo el medio a 37 °C antes de su uso y conservarlo a 4 °C durante un período máximo de 1 semana.
- Recuperación de células 2D
- Retire un criovial del tanque de almacenamiento de nitrógeno líquido y descongele rápidamente el vial en un baño de agua a 37 °C, hasta que esté completamente descongelado.
- Centrifugar el criovial con una centrífuga a 1006 x g durante 5 min (20 °C) y, a continuación, retirar el sobrenadante.
- Vuelva a suspender las células peletizadas utilizando 1 ml de medio de recuperación celular precalentado.
- Distribuir uniformemente las células suspendidas en el matraz preacondicionado (volumen final de 7 mL) e incubar a 37 °C, 5% de CO2 y 85% de humedad.
- Después de 24 h, deseche y reemplace el medio de recuperación celular.
- Reemplace el medio de cultivo cada 2-3 días hasta que el matraz confluya con las células.
- Cosecha de matraz de cultivo 2D en suspensión de una sola célula y recuento de células
- Retire el matraz de cultivo 2D de la incubadora y deseche los medios de cultivo en un contenedor de residuos adecuado.
- Transfiera 10 ml de solución de enjuague al matraz para enjuagar las células y eliminar los desechos y la acumulación de proteínas. Después de eso, deseche la solución de enjuague.
- Añadir 6 ml de solución de desprendimiento al matraz de cultivo para separar las células. Incubar el matraz a 37 °C, 5% de CO2 y 85% de humedad durante 2 min.
NOTA: Observe el matraz bajo un microscopio para confirmar que se han desprendido todas las células. De lo contrario, golpee suavemente el matraz e incube durante un minuto más. - Una vez que se hayan separado todas las células, transfiera la suspensión celular a un tubo de centrífuga de 15 ml y agregue 1 ml del medio de recuperación celular (que contiene 20% de FBS) al tubo. Esto neutralizará el efecto de la solución de desprendimiento.
- Centrifugar el tubo durante 5 min a 1711 x g (20 °C).
- Retire el sobrenadante y vuelva a suspender las células en 1 ml de medio completo.
- Retire 10 μL de la suspensión celular, colóquela en un tubo de microcentrífuga de 500 μL y mézclela con 10 μL de azul de tripano en una proporción de 1:1.
- Coloque 10 μL de la mezcla de solución de células azul de tripano en una cámara de recuento de células por duplicado.
- Coloque la cámara de recuento de células en el contador de células automatizado. El contador de células indicará el número total de células por ml, así como el número de células viables y muertas. Calcule el recuento medio de células viables y el número de células viables necesarias para incrustar en el hidrogel 3D (paso 2.2.6).
2. 3D cultivo celular
- Preparación del medio de cultivo completo 3D
- Transfiera 44 ml del medio basal a un tubo de centrífuga de 50 ml.
- Enriquezca el medio con FBS al 10% (5 mL) y antibióticos (1 mL) (0,5 mL de Penicilina-Estreptomicina y 0,5 mL de Anfotericina B).
NOTA: Caliente el medio completo a 37 °C antes de usarlo y guárdelo a 4 °C durante un máximo de una semana.
- Preparación del hidrogel
- Preparar el dextrano rápido centrifugando (1000 x g durante 30 s a 20 °C) el vial de dextrano rápido para concentrar el material. Añadir 175 μL de agua al vial de dextrano rápido para conseguir una concentración final de 30 mmol/L de grupos reactivos.
- Agitar el tubo (velocidad media durante 30 s) que contiene la solución de dextrano rápido hasta que el material se disuelva por completo. Incubar el material disuelto en hielo durante 5 min. Centrifuga el tubo, vórdelo brevemente y mantenlo en hielo durante el uso posterior.
- Centrifugar el reticulante (1000 x g durante 30 s a 20 °C) para concentrar el material. Añadir 188 μL de agua al vial de reticulante para conseguir una concentración final de 20 mmol/L de grupos tiol.
- Agite el tubo (velocidad media durante 30 s) que contiene la solución de reticulante hasta que se disuelva todo el material. Incubar el reticulante disuelto a temperatura ambiente (RT) durante 5 min. Centrifugar el tubo, brevemente en vórtice, y mantenerlo en RT durante su uso posterior.
- Adaptar el protocolo de hidrogel de 30 μL a 10 μL para reducir costes (ver Tabla 1 para detalles específicos).
- Prepare la suspensión celular para lograr una densidad de siembra de 2,5 x 103 celdas por hidrogel de 10 μL.
- Combine los componentes de acuerdo con la Tabla 1 para crear una mezcla maestra. Transfiera 9 μL de la mezcla maestra a un pocillo en una placa de tiras de 96 pocillos.
- Solidifique el gel agregando 1 μL del reticulante degradable 3 minutos después de transferir la mezcla maestra.
- Cubrir los hidrogeles con 170 μL de medio de cultivo completo precalentado. Incubar durante 1 h. Después de 1 h, reemplace el medio de cultivo.
NOTA: Las células incrustadas en hidrogel están listas para su posterior experimentación o análisis dentro del sistema de cultivo 3D. Siga los protocolos adicionales según sea necesario para las aplicaciones posteriores.
3. Exposición a la fotobiomodulación
- Configuración del láser
- Configure el sistema de láser de diodo para longitudes de onda verde (525 nm) o infrarrojo cercano (825 nm). Encienda los láseres y deje que se calienten durante el tiempo recomendado.
- Estabilice la potencia de salida de los láseres permitiéndoles alcanzar un estado estable. Esto garantiza una irradiación consistente y precisa.
- Mida la potencia de salida de los láseres con un medidor de potencia láser. Registre los valores de potencia para cada longitud de onda.
- Utilice la Ecuación 1 (Tiempo de irradiación láser) para calcular el tiempo de irradiación láser. Sustituya los valores de la Tabla 2 en la Ecuación 1 para determinar el tiempo de irradiación apropiado para cada fluidez. En la Ecuación 1, "r" representa el radio de la zona de irradiación del láser.
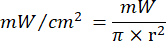
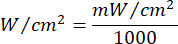
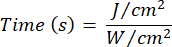
Ecuación 1 - Consulte la Tabla 2 para conocer los parámetros específicos necesarios para el cálculo, incluidas las fluencias (5 J/cm² o 10 J/cm²) y la potencia de salida del láser.
- Irradiación de los cultivos celulares 3D
- Después de reemplazar el medio completo (paso 2.2.9), coloque la placa de 96 pocillos que contiene celdas incrustadas en hidrogel debajo del sistema de láser de diodo. Irradiar los hidrogeles con el tiempo de irradiación láser calculado para la fluidez seleccionada (5 J/cm² o 10 J/cm²) en la longitud de onda elegida (verde o infrarrojo cercano). Por lo tanto, los cultivos solo recibirán una sola dosis.
- Asegúrese de que cada grupo experimental esté acompañado por un control (n = 4), que consista en ADSC incrustados en hidrogel sin exposición a PBM.
NOTA: Siempre use gafas de seguridad apropiadas para la longitud de onda de la luz con la que está trabajando. Los láseres se utilizan fuera de un gabinete de seguridad; Por lo tanto, es de vital importancia desinfectar el área antes de su uso. - Incubar las placas de cultivo a 37 °C, 5% de CO2 y 85% de humedad durante la duración de los experimentos. Incubar las placas durante 24 h para el primer análisis o 10 días para el segundo período de análisis, después de la irradiación.
4. Morfología
- Microscopía óptica invertida
- Encienda el microscopio de luz invertida y deje que se caliente durante unos minutos. Asegúrese de que el microscopio esté correctamente alineado y calibrado.
- Prepare la muestra para su observación en un portaobjetos de microscopio o en una placa de cultivo celular especializada, dependiendo de la configuración experimental. Calibre el microscopio para obtener condiciones óptimas de obtención de imágenes.
- Ajuste la configuración de enfoque, brillo y contraste según sea necesario. Seleccione la lente del objetivo de 20x en el microscopio para observar y registrar la morfología celular.
- Coloque la muestra en la platina del microscopio y enfoque las células de interés con el ocular. Utilizando la vista del ocular o de la cámara, observe y registre la morfología celular. Preste atención a la forma de la celda, el tamaño y cualquier característica distintiva.
- Conecte el módulo de la cámara al microscopio. Configure la cámara para la obtención de imágenes digitales. Asegúrese de que la conexión y la comunicación entre la cámara y el microscopio sean adecuadas.
- Usando la lente del objetivo de 20x, capture imágenes digitales de las células observadas. Utilice los controles de la cámara para ajustar la exposición, el enfoque y otros ajustes relevantes.
NOTA: Asegúrese de que las imágenes capturadas sean de alta calidad y proporcionen una vista representativa de la morfología celular. - Inicie el software de imágenes en la computadora. Capture la imagen y utilice las herramientas de análisis dentro del software para analizar la morfología celular.
- Mida las dimensiones de las células, cuente las células o realice cualquier análisis relevante en función de los objetivos experimentales.
- Agregue una barra de escala adecuada a las imágenes usando el software. Utilice el aumento conocido del objetivo del microscopio para representar con precisión la escala de las imágenes.
5. Ensayos bioquímicos
- Recuperación celular
NOTA: Las células deben recuperarse del hidrogel en una suspensión unicelular para realizar ensayos bioquímicos posteriores.- Prepare la solución de recuperación celular enzimática. En un entorno estéril, prepare una solución de trabajo diluyendo la solución de recuperación celular enzimática con solución salina tamponada con fosfato (PBS) en una proporción de 1:20 (Solución: PBS). Si se requiere la recuperación de células de un número específico de geles o pocillos, calcule el volumen total requerido en función de 30 μL de solución de recuperación por gel.
- Añadir 30 μL de la solución de trabajo a cada gel o pocillo que contenga las células que necesitan recuperación. Asegure una distribución completa y uniforme de la solución de recuperación balanceando o girando suavemente la placa. Incubar la placa con la solución de recuperación según el tiempo de incubación recomendado. Por lo general, esta información se puede encontrar en la hoja de datos del producto o en el protocolo proporcionado por el proveedor.
- Después del período de incubación, retire con cuidado la placa de la incubadora. Centrifugar las placas a 1409 x g durante 5 min (20 °C) para granular las células. Consulte la hoja de datos o el protocolo del producto para conocer las condiciones de centrifugación recomendadas. Una vez completada la centrifugación, deseche con cuidado el sobrenadante, teniendo cuidado de no alterar el gránulo celular.
- Resuspender suavemente las células peletizadas en 220 μL de PBS estéril. Asegure una mezcla completa para lograr una suspensión unicelular homogénea. Las células ya están listas para los ensayos bioquímicos posteriores. Seguir los protocolos específicos para los ensayos previstos, teniendo en cuenta la naturaleza de las células recuperadas y los requisitos de la configuración experimental.
- Ensayo de citotoxicidad de la lactato deshidrogenasa (LDH)
- Para cada pocillo, extraiga con cuidado 50 μL de medio de cultivo completo, asegurando una alteración mínima de la capa celular.
- Añadir 50 μL del reactivo de citotoxicidad directamente a cada pocillo que contenga los 50 μL restantes de medio de cultivo. Mezcle suavemente pipeteando hacia arriba y hacia abajo para garantizar una mezcla completa de la muestra con el reactivo.
- Prepara un control positivo. Configure pocillos por triplicado con 5 μL de solución de lisis 10x por cada 50 μL de células de control positivo incluidas en el kit.
- Incubar la placa a la temperatura y duración recomendadas. Este paso permite que el reactivo de citotoxicidad lise las células y libere LDH en el medio de cultivo.
- Después del período de incubación, añadir 50 μL de la solución de parada directamente a cada pocillo que contenga el reactivo de citotoxicidad y el lisado celular. Mezcle suavemente pipeteando hacia arriba y hacia abajo para asegurar una parada adecuada de la reacción.
NOTA: La solución de tope detiene la liberación de LDH y garantiza la estabilidad del desarrollo del color. - Configure el lector de placas espectrofotométricas de acuerdo con las instrucciones del fabricante. Registre la absorbancia de cada pocillo a 490 nm. Esta longitud de onda es específica para la detección colorimétrica del producto formazano generado por la reacción LDH.
- Reste las lecturas de absorbancia de fondo de ambos grupos de tratamiento y pozos de control. Obtener lecturas de fondo de pocillos que contienen medios y reactivos de citotoxicidad sin células.
- Analice los valores de absorbancia corregidos para cada muestra para determinar el nivel de citotoxicidad. Los valores de absorbancia más altos indican una mayor liberación de LDH y, en consecuencia, una mayor citotoxicidad.
- Asegúrese de que cada grupo experimental y control conste de cuatro repeticiones (paso 3.2.2) para mayor precisión estadística. Calcule e importe la absorbancia media de cada grupo y control en un programa estadístico adecuado.
- Comparar los resultados entre los grupos de tratamiento y los controles apropiados para evaluar los efectos citotóxicos con precisión y registrar todas las lecturas de absorbancia, los cálculos y las condiciones experimentales para futuras referencias.
- Ensayo de proliferación de ATP
- En un ambiente estéril, mezcle 50 μL de las células recuperadas con 50 μL del reactivo ATP en cada pocillo.
NOTA: Ajuste el volumen de las células y los reactivos en función del número de pocillos y el diseño experimental. Mantenga proporciones consistentes para obtener resultados precisos. - Coloque el plato en una coctelera y agite vigorosamente en la oscuridad durante 5 min. Este paso garantiza una mezcla completa de las células con el reactivo. Después de agitar, incube la placa durante 25 minutos más a RT. Este período de incubación permite que el reactivo lise las células y genere una señal luminiscente proporcional a la cantidad de ATP presente.
- Configure el lector de placas de acuerdo con las instrucciones del fabricante para la detección de luminiscencia. Mida la luminiscencia de cada pocillo que contenga el lisado celular y el reactivo ATP. Asegúrese de que el lector de placas esté configurado para medir la luminiscencia con los ajustes adecuados.
- Reste las lecturas de luminiscencia de fondo de ambos grupos de tratamiento y pozos de control. Obtenga lecturas de fondo de pocillos que contengan solo el reactivo ATP y PBS sin células.
- Analice los valores de luminiscencia corregidos para cada muestra para determinar los niveles de ATP, reflejando la proliferación celular o la viabilidad.
- Asegúrese de que cada grupo experimental y control conste de cuatro repeticiones (paso 3.2.2) para mayor precisión estadística. Calcule e importe la luminiscencia media de cada grupo y control en un programa estadístico adecuado.
- Comparar los resultados entre los grupos de tratamiento y los controles relevantes para evaluar con precisión la proliferación de ATP. Registre todas las lecturas de luminiscencia, los cálculos y las condiciones experimentales para futuras referencias.
NOTA: Para todos los análisis bioquímicos en forma de kit, siga el manual o el protocolo del kit proporcionado por el fabricante para obtener detalles específicos, como los tiempos de incubación recomendados, las concentraciones y cualquier paso o consideración adicional. Respete siempre las directrices de seguridad del laboratorio cuando manipule productos químicos y materiales biológicos.
- En un ambiente estéril, mezcle 50 μL de las células recuperadas con 50 μL del reactivo ATP en cada pocillo.
Resultados
Para evaluar la morfología e inspeccionar visualmente la densidad celular de los hidrogeles, se utilizó microscopía inversa (Figura 2). Los ADSC conservaron una morfología redondeada 24 h después de la siembra y la exposición a PBM. Las células se dispersaron por todo el gel como células individuales o en racimos similares a uvas. La morfología se mantuvo sin cambios después de 10 días en cultivo 3D. No se observaron diferencias definitivas en la morfología entre los grupos exper...
Discusión
Las ADSC son un tipo de célula ideal para la medicina regenerativa, ya que estimulan varios procesos para ayudar en la cicatrización de heridas 3,4. Sin embargo, hay varios desafíos que deben sortearse, por ejemplo, las bajas tasas de supervivencia y el injerto ineficaz de las células en el sitio de la lesión9. Las células inmortalizadas se utilizaron como una línea celular disponible comercialmente, ya que pueden pasar durante más...
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Esta investigación fue financiada por la Fundación Nacional de Investigación de Sudáfrica Thuthuka Instrument, subvención número TTK2205035996; el Centro Africano de Láser (ALC), financiado por el Departamento de Ciencia e Innovación (DSI), número de subvención HLHA23X tarea ALC-R007; el Consejo Universitario de Investigación, subvención número 2022URC00513; la Iniciativa de Cátedras de Investigación de Sudáfrica del Departamento de Ciencia y Tecnología (DST-NRF/SARChI), subvención número 98337. Los organismos financiadores no desempeñaron ningún papel en el diseño del estudio, la recopilación, el análisis, la interpretación de los datos o la redacción del manuscrito. Los autores agradecen a la Universidad de Johannesburgo (UJ) y al Centro de Investigación Láser (LRC) por el uso de las instalaciones y los recursos.
Materiales
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Referencias
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados