Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Culture cellulaire tridimensionnelle de cellules souches dérivées du tissu adipeux dans un hydrogel avec augmentation de la photobiomodulation
Dans cet article
Résumé
Ici, nous présentons un protocole démontrant l’utilisation de l’hydrogel comme cadre de culture cellulaire tridimensionnel (3D) pour la culture de cellules souches dérivées adipeuses (ADSC) et introduisant la photobiomodulation (PBM) pour améliorer la prolifération des ADSC dans le cadre de la culture 3D.
Résumé
Les cellules souches dérivées du tissu adipeux (ADSC), possédant des caractéristiques mésenchymateuses multipotentes semblables à celles des cellules souches, sont fréquemment utilisées en médecine régénérative en raison de leur capacité à diversifier les cellules et à améliorer la migration, la prolifération et atténuer l’inflammation. Cependant, les ADSC sont souvent confrontés à des défis de survie et de greffe dans les plaies, principalement en raison de conditions inflammatoires défavorables. Pour résoudre ce problème, des hydrogels ont été développés pour maintenir la viabilité de l’ADSC dans les plaies et accélérer le processus de cicatrisation des plaies. Ici, nous avons cherché à évaluer l’impact synergique de la photobiomodulation (PBM) sur la prolifération et la cytotoxicité des ADSC dans un cadre de culture cellulaire 3D. Les ADSC immortalisés ont été ensemencés dans des hydrogels de 10 μL à une densité de 2,5 x 103 cellules et soumis à une irradiation à l’aide de diodes de 525 nm et 825 nm à des fluidités de 5 J/cm2 et 10 J/cm2. Les changements morphologiques, la cytotoxicité et la prolifération ont été évalués 24 heures et 10 jours après l’exposition au PBM. Les ADSC présentaient une morphologie arrondie et étaient dispersées dans le gel sous forme de cellules individuelles ou d’agrégats sphéroïdes. Il est important de noter que le PBM et le cadre de culture 3D n’ont montré aucun effet cytotoxique sur les cellules, tandis que le PBM a considérablement augmenté les taux de prolifération des ADSC. En conclusion, cette étude démontre l’utilisation de l’hydrogel comme environnement 3D approprié pour la culture ADSC et présente la PBM comme une stratégie d’augmentation significative, en particulier pour traiter les taux de prolifération lents associés à la culture cellulaire 3D.
Introduction
Les ADSC sont des cellules progénitrices mésenchymateuses multipotentes ayant la capacité de s’auto-renouveler et de se différencier en plusieurs lignées cellulaires. Ces cellules peuvent être prélevées à partir de la fraction vasculaire stromale (SVF) du tissu adipeux lors d’une procédure de lipoaspiration1. Les ADSC sont apparus comme un type de cellules souches idéal à utiliser en médecine régénérative car ces cellules sont abondantes, peu invasives à récolter, facilement accessibles et bien caractérisées2. La thérapie par cellules souches offre une voie possible pour la cicatrisation des plaies en stimulant la migration cellulaire, la prolifération, la néovascularisation et la réduction de l’inflammation dans les plaies 3,4. Environ 80 % de la capacité de régénération des ADSC est attribuable à la signalisation paracrine via leur sécrétome5. Auparavant, il avait été suggéré qu’une injection locale directe de cellules souches ou de facteurs de croissance dans les tissus endommagés pourrait entraîner des mécanismes de réparation in vivo suffisants 6,7,8. Cependant, cette approche a été confrontée à plusieurs défis, tels qu’une faible survie et une réduction de la greffe de cellules souches dans les tissus endommagés en raison de l’environnement inflammatoire 9. De plus, l’une des raisons citées était l’absence d’une matrice extracellulaire pour soutenir la survie et la fonctionnalité des cellules transplantées10. Pour surmonter ces défis, l’accent est maintenant mis sur le développement de supports de biomatériaux pour soutenir la viabilité et la fonction des cellules souches.
La culture cellulaire tridimensionnelle (3D) améliore l’interaction entre cellules et entre cellules et matrices in vitro pour fournir un environnement qui ressemble davantage à l’environnement in vivo 11. Les hydrogels ont été largement étudiés en tant que classe de supports de biomatériaux qui fournissent un environnement 3D pour la culture de cellules souches. Ces structures sont constituées d’eau et de polymères réticulés12. L’encapsulation des ADSC dans de l’hydrogel n’a pratiquement aucun effet cytotoxique sur les cellules pendant la culture tout en maintenant la viabilité des cellules6. Les cellules souches cultivées en 3D démontrent une meilleure conservation de leur souche et une meilleure capacité de différenciation13. De même, les ADSC ensemencés en hydrogel ont démontré une viabilité accrue et une fermeture accélérée de la plaie dans des modèles animaux14. De plus, l’encapsulation d’hydrogel augmente considérablement la prise de greffe et la rétention des ADSC dans les plaies15,16. TrueGel3D est composé d’un polymère, soit de l’alcool polyvinylique ou du dextran, solidifié par un agent de réticulation, soit de la cyclodextrine ou du polyéthylène glycol17. Le gel est un hydrogel synthétique qui ne contient aucun produit animal susceptible d’interférer avec les expériences ou de déclencher une réaction immunitaire lors de la transplantation du gel chez un patient tout en imitant efficacement une matrice extracellulaire18. Le gel est entièrement personnalisable en modifiant la composition et les composants individuels. Il peut abriter différentes cellules souches et soutenir la différenciation de plusieurs types de cellules en ajustant la rigidité du gel19. Des sites d’attache peuvent être créés par l’ajout de peptides20. Le gel est dégradable par la sécrétion de métalloprotéases, permettant la migration cellulaire21. Enfin, il est clair et permet des techniques d’imagerie.
La PBM est une forme de thérapie au laser de faible intensité peu invasive et facile à réaliser utilisée pour stimuler les chromophores intracellulaires. Différentes longueurs d’onde provoquent des effets différents sur les cellules22. La lumière dans la gamme du rouge au proche infrarouge stimule la production accrue d’adénosine triphosphate (ATP) et d’espèces réactives de l’oxygène (ROS) en améliorant le flux à travers la chaîne de transport d’électrons23. La lumière dans les gammes bleue et verte stimule les canaux ioniques photodépendants, permettant l’afflux non spécifique de cations, tels que le calcium et le magnésium, dans les cellules, ce qui est connu pour améliorer la différenciation24. L’effet net est la génération de messagers secondaires qui stimulent la transcription des facteurs déclenchant les processus cellulaires en aval tels que la migration, la prolifération et la différenciation25. La PBM peut être utilisée pour préconditionner les cellules à proliférer ou à se différencier avant de les transplanter dans un environnement défavorable, par exemple dans un tissu endommagé26. L’exposition aux PBM avant et après la greffe (630 nm et 810 nm) des ADSC a considérablement amélioré la viabilité et la fonction de ces cellules in vivo dans un modèle de rat diabétique27. La médecine régénérative nécessite un nombre adéquat de cellules pour une réparation efficace des tissus28. En culture cellulaire 3D, les ADSC ont été associés à des taux de prolifération plus lents par rapport à la culture cellulaire bidimensionnelle6. Cependant, la PBM peut être utilisée pour augmenter le processus de culture cellulaire 3D des ADSC en améliorant la viabilité, la prolifération, la migration et la différenciation29,30.
Protocole
REMARQUE : Voir le tableau des matériaux pour plus de détails sur tous les matériaux, réactifs et logiciels utilisés dans ce protocole. Le protocole a été résumé graphiquement dans la figure 1.
1. Culture cellulaire bidimensionnelle (2D)
REMARQUE : Les ADSC immortalisés (1 x106 cellules) sont conservés à -195,8 °C dans de l’azote liquide dans un flacon de cryoconservation contenant 1 mL de milieu de congélation cellulaire.
- Préparation du milieu de récupération cellulaire 2D et du ballon de culture 2D
- Transvaser 39 mL du milieu de base dans un tube à centrifuger de 50 mL
- Enrichir le milieu de base avec 20 % de sérum fœtal bovin (FBS ; 10 ml) et des antibiotiques (1 ml) (0,5 ml de pénicilline-streptomycine et 0,5 ml d’amphotéricine B).
- Préconditionner une fiole T75 en transférant 6 mL du milieu de récupération cellulaire dans la fiole et l’incuber à 37 °C, 5 % de CO2 et 85 % d’humidité pendant 45 min (cela peut être fait pendant les étapes de récupération cellulaire pour gagner du temps).
REMARQUE : Réchauffez le milieu complet à 37 °C avant utilisation et conservez-le à 4 °C pendant une période maximale de 1 semaine.
- Récupération de cellules 2D
- Retirez un flacon cryogénique du réservoir de stockage d’azote liquide et dégivrez-le rapidement au bain-marie à 37 °C, jusqu’à ce qu’il soit complètement décongelé.
- Faire tourner le cryoflacon à l’aide d’une centrifugeuse à 1006 x g pendant 5 min (20 °C), puis retirer le surnageant.
- Remettre les cellules granulées en suspension à l’aide de 1 mL de milieu de récupération cellulaire préchauffé.
- Répartir uniformément les cellules en suspension dans le ballon préconditionné (volume final de 7 ml) et incuber à 37 °C, 5 % de CO2 et 85 % d’humidité.
- Après 24 h, jetez et remplacez le milieu de récupération cellulaire.
- Replacez le milieu de culture tous les 2-3 jours jusqu’à ce que le ballon conflue avec les cellules.
- Récolte du ballon de culture 2D en suspension unicellulaire et numération cellulaire
- Retirez le flacon de culture 2D de l’incubateur et jetez le milieu de culture dans un conteneur à déchets approprié.
- Transvaser 10 ml de solution de rinçage dans le ballon pour rincer les cellules et éliminer les déchets et l’accumulation de protéines. Après cela, jetez la solution de rinçage.
- Ajouter 6 mL de solution de détachement dans la fiole de culture pour détacher les cellules. Incuber la fiole à 37 °C, 5 % de CO2 et 85 % d’humidité pendant 2 min.
REMARQUE : Observez le flacon au microscope pour confirmer que toutes les cellules ont été détachées. Sinon, tapotez doucement sur la fiole et laissez incuber encore une minute. - Une fois que toutes les cellules ont été détachées, transférez la suspension cellulaire dans un tube à centrifuger de 15 mL et ajoutez 1 mL du milieu de récupération des cellules (contenant 20 % de FBS) dans le tube. Cela neutralisera l’effet de la solution de détachement.
- Centrifuger le tube pendant 5 min à 1711 x g (20 °C).
- Retirer le surnageant et remettre les cellules en suspension dans 1 mL de milieu complet.
- Retirez 10 μL de suspension cellulaire, placez-la dans un tube de microcentrifugation de 500 μL et mélangez-la avec 10 μL de bleu trypan dans un rapport de 1:1.
- Placer 10 μL du mélange de solution cellulaire de bleu trypan dans une chambre de comptage cellulaire en double.
- Placez la chambre de comptage des cellules dans le compteur de cellules automatisé. Le compteur de cellules indiquera le nombre total de cellules par ml ainsi que le nombre de cellules viables et mortes. Calculez le nombre moyen de cellules viables et le nombre de cellules viables nécessaires pour être intégrées dans l’hydrogel 3D (étape 2.2.6).
2. 3D culture cellulaire
- Préparation du milieu de culture complet 3D
- Transvaser 44 mL du milieu de base dans un tube à centrifuger de 50 mL.
- Enrichir le milieu avec 10 % de FBS (5 ml) et des antibiotiques (1 ml) (0,5 ml de pénicilline-streptomycine et 0,5 ml d’amphotéricine B).
REMARQUE : Réchauffez le support complet à 37 °C avant utilisation et conservez-le à 4 °C pendant une semaine maximum.
- Préparation de l’hydrogel
- Préparer le dextran rapide en centrifugeant (1000 x g pendant 30 s à 20 °C) le flacon de dextran rapide pour concentrer le matériau. Ajouter 175 μL d’eau dans le flacon de dextran rapide pour obtenir une concentration finale de 30 mmol/L de groupes réactifs.
- Agiter le tube (vitesse moyenne pendant 30 s) contenant la solution de dextran rapide jusqu’à ce que le matériau soit complètement dissous. Incuber la matière dissoute sur de la glace pendant 5 min. Centrifugez le tube, faites-le tourner brièvement et gardez-le sur de la glace pendant une utilisation ultérieure.
- Centrifuger le réticulant (1000 x g pendant 30 s à 20 °C) pour concentrer le matériau. Ajouter 188 μL d’eau dans le flacon de réticulation pour obtenir une concentration finale de 20 mmol/L de groupes thiols.
- Agiter le tube (vitesse moyenne pendant 30 s) contenant la solution de réticulation jusqu’à ce que tout le matériau soit dissous. Incuber le réticulant dissous à température ambiante (RT) pendant 5 min. Centrifugez le tube, faites un bref vortex et maintenez-le à RT pendant toute utilisation ultérieure.
- Adapter le protocole d’hydrogel de 30 μL à 10 μL pour réduire les coûts (voir le tableau 1 pour plus de détails).
- Préparez la suspension cellulaire pour obtenir une densité d’ensemencement de 2,5 x 103 cellules par 10 μL d’hydrogel.
- Combinez les composants conformément au tableau 1 pour créer un master mix. Transférer 9 μL du mélange maître dans un puits dans une plaque à bande de 96 puits.
- Solidifiez le gel en ajoutant 1 μL de réticulant dégradable 3 min après le transfert du mélange maître.
- Couvrir les hydrogels avec 170 μL de milieu de culture complet préchauffé. Incuber pendant 1 h. Après 1 h, replacez le milieu de culture.
REMARQUE : Les cellules intégrées à l’hydrogel sont prêtes pour une expérimentation ou une analyse ultérieure dans le système de culture 3D. Suivez les protocoles supplémentaires si nécessaire pour les applications en aval.
3. Exposition à la photobiomodulation
- Configuration du laser
- Configurez le système laser à diode pour les longueurs d’onde vertes (525 nm) ou proches infrarouges (825 nm). Allumez les lasers et laissez-les se réchauffer pendant la durée recommandée.
- Stabiliser la puissance de sortie des lasers en leur permettant d’atteindre un état stable. Cela garantit une irradiation constante et précise.
- Mesurez la puissance de sortie des lasers à l’aide d’un wattmètre laser. Enregistrez les valeurs de puissance pour chaque longueur d’onde.
- Utilisez l’équation 1 (Temps d’irradiation laser) pour calculer le temps d’irradiation laser. Substituez les valeurs du tableau 2 dans l’équation 1 pour déterminer le temps d’irradiation approprié pour chaque fluidité. Dans l’équation 1, « r » représente le rayon de la zone d’irradiation du laser.
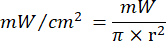
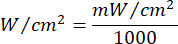
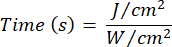
Équation 1 - Reportez-vous au tableau 2 pour les paramètres spécifiques nécessaires au calcul, y compris les fluences (5 J/cm² ou 10 J/cm²) et la puissance de sortie du laser.
- Irradiation des cultures cellulaires 3D
- Après avoir remplacé le média complet (étape 2.2.9), placez la plaque à 96 puits contenant des cellules intégrées à l’hydrogel sous le système laser à diode. Irradiez les hydrogels avec le temps d’irradiation laser calculé pour la fluidité sélectionnée (5 J/cm² ou 10 J/cm²) à la longueur d’onde choisie (vert ou proche infrarouge). Par conséquent, les cultures ne recevront qu’une seule dose.
- S’assurer que chaque groupe expérimental est accompagné d’un témoin (n = 4), constitué d’ADSC intégrés dans de l’hydrogel sans exposition aux PBM.
REMARQUE : Portez toujours des lunettes de sécurité adaptées à la longueur d’onde de la lumière avec laquelle vous travaillez. Les lasers sont utilisés à l’extérieur d’une armoire de sécurité ; Il est donc crucial de désinfecter la zone avant utilisation. - Incuber les plaques de culture à 37 °C, 5 % de CO2 et 85 % d’humidité pendant toute la durée des expériences. Incuber les plaques pendant 24 h pour la première analyse ou 10 jours pour la deuxième période d’analyse, après l’irradiation.
4. Morphologie
- Microscopie à lumière inversée
- Allumez le microscope à lumière inversée et laissez-le se réchauffer pendant quelques minutes. Assurez-vous que le microscope est correctement aligné et calibré.
- Préparez l’échantillon pour l’observation sur une lame de microscope ou une boîte de culture cellulaire spécialisée, selon la configuration expérimentale. Calibrez le microscope pour des conditions d’imagerie optimales.
- Ajustez les paramètres de mise au point, de luminosité et de contraste selon vos besoins. Sélectionnez l’objectif 20x du microscope pour observer et enregistrer la morphologie cellulaire.
- Placez l’échantillon sur la platine du microscope et concentrez-vous sur les cellules d’intérêt à l’aide de l’oculaire. À l’aide de l’oculaire ou de la vue de la caméra, observez et enregistrez la morphologie cellulaire. Faites attention à la forme, à la taille et aux caractéristiques distinctives des cellules.
- Fixez le module de caméra au microscope. Configurez l’appareil photo pour l’imagerie numérique. Assurez-vous d’une connexion et d’une communication correctes entre la caméra et le microscope.
- À l’aide de l’objectif 20x, capturez des images numériques des cellules observées. Utilisez les commandes de l’appareil photo pour régler l’exposition, la mise au point et d’autres paramètres pertinents.
REMARQUE : Assurez-vous que les images capturées sont de haute qualité et fournissent une vue représentative de la morphologie cellulaire. - Lancez le logiciel d’imagerie sur l’ordinateur. Capturez l’image et utilisez les outils d’analyse du logiciel pour analyser la morphologie cellulaire.
- Mesurez les dimensions des cellules, comptez les cellules ou effectuez toute analyse pertinente en fonction des objectifs expérimentaux.
- Ajoutez une barre d’échelle appropriée aux images à l’aide du logiciel. Utilisez le grossissement connu de l’objectif du microscope pour représenter avec précision l’échelle des images.
5. Essais biochimiques
- Récupération cellulaire
REMARQUE : Les cellules doivent être récupérées de l’hydrogel dans une suspension unicellulaire pour d’autres tests biochimiques en aval.- Préparez la solution enzymatique de récupération cellulaire. Dans un environnement stérile, préparer une solution de travail en diluant la solution enzymatique de récupération cellulaire avec une solution saline tamponnée au phosphate (PBS) dans un rapport de 1:20 (Solution : PBS). Si la récupération de cellules à partir d’un nombre spécifique de gels ou de puits est nécessaire, calculez le volume total requis en fonction de 30 μL de solution de récupération par gel.
- Ajouter 30 μL de la solution de travail à chaque gel ou puits contenant les cellules à récupérer. Assurez une distribution complète et uniforme de la solution de récupération en balançant ou en faisant tourner doucement la plaque. Incuber la plaque avec la solution de récupération selon le temps d’incubation recommandé. Ces informations se trouvent généralement dans la fiche technique du produit ou le protocole fourni par le fournisseur.
- Après la période d’incubation, retirez délicatement la plaque de l’incubateur. Centrifuger les plaques à 1409 x g pendant 5 min (20 °C) pour granuler les cellules. Reportez-vous à la fiche technique ou au protocole du produit pour connaître les conditions de centrifugation recommandées. Une fois la centrifugation terminée, jetez soigneusement le surnageant, en prenant soin de ne pas perturber la pastille cellulaire.
- Remettre doucement en suspension les cellules granulées dans 220 μL de PBS stérile. Assurez-vous d’un mélange complet pour obtenir une suspension unicellulaire homogène. Les cellules sont maintenant prêtes pour les tests biochimiques en aval. Suivre les protocoles spécifiques aux tests prévus, en tenant compte de la nature des cellules récupérées et des exigences du dispositif expérimental.
- Test de cytotoxicité de la lactate déshydrogénase (LDH)
- Pour chaque puits, retirez soigneusement 50 μL de milieu de culture complet, en veillant à perturber le moins possible la couche cellulaire.
- Ajouter 50 μL du réactif de cytotoxicité directement dans chaque puits contenant les 50 μL restants de milieu de culture. Mélanger doucement en pipetant de haut en bas pour assurer un mélange complet de l’échantillon avec le réactif.
- Préparez un contrôle positif. Installez des puits triples avec 5 μL de solution de lyse 10x par 50 μL de cellules de contrôle positif incluses dans la trousse.
- Incuber la plaque à la température et à la durée recommandées. Cette étape permet au réactif de cytotoxicité de lyser les cellules et de libérer de la LDH dans le milieu de culture.
- Après la période d’incubation, ajouter 50 μL de la solution d’arrêt directement dans chaque puits contenant le réactif de cytotoxicité et le lysat cellulaire. Mélanger doucement en pipetant de haut en bas pour assurer un arrêt correct de la réaction.
REMARQUE : La solution d’arrêt arrête la libération de LDH et assure la stabilité du développement de la couleur. - Configurez le lecteur de plaques spectrophotométriques selon les instructions du fabricant. Enregistrer l’absorbance de chaque puits à 490 nm. Cette longueur d’onde est spécifique à la détection colorimétrique du produit formazan généré par la réaction LDH.
- Soustrayez les lectures d’absorbance de fond des groupes de traitement et des puits témoins. Obtenir des lectures de fond à partir de puits contenant des milieux et des réactifs de cytotoxicité sans cellules.
- Analyser les valeurs d’absorbance corrigées pour chaque échantillon afin de déterminer le niveau de cytotoxicité. Des valeurs d’absorbance plus élevées indiquent une libération accrue de LDH et, par conséquent, une cytotoxicité plus élevée.
- S’assurer que chaque groupe expérimental et témoin était composé de quatre répétitions (étape 3.2.2) pour plus d’exactitude statistique. Calculer et importer l’absorbance moyenne de chaque groupe et contrôle dans un programme statistique approprié.
- Comparer les résultats entre les groupes de traitement et les témoins appropriés pour évaluer avec précision les effets cytotoxiques et enregistrer toutes les lectures d’absorbance, les calculs et les conditions expérimentales pour référence future.
- Essai de prolifération de l’ATP
- Dans un environnement stérile, mélanger 50 μL des cellules récupérées avec 50 μL de réactif ATP dans chaque puits.
REMARQUE : Ajustez le volume des cellules et des réactifs en fonction du nombre de puits et de la conception expérimentale. Maintenez des ratios constants pour des résultats précis. - Placez l’assiette sur un shaker et secouez vigoureusement dans le noir pendant 5 min. Cette étape assure un mélange complet des cellules avec le réactif. Après avoir secoué, incuber la plaque pendant 25 minutes supplémentaires à RT. Cette période d’incubation permet au réactif de lyser les cellules et de générer un signal luminescent proportionnel à la quantité d’ATP présente.
- Configurez le lecteur de plaques conformément aux instructions du fabricant pour la détection de la luminescence. Mesurez la luminescence de chaque puits contenant le lysat cellulaire et le réactif ATP. Assurez-vous que le lecteur de plaques est réglé pour mesurer la luminescence avec les réglages appropriés.
- Soustrayez les lectures de luminescence de fond des groupes de traitement et des puits témoins. Obtenez des lectures de fond à partir de puits contenant uniquement le réactif ATP et le PBS sans cellules.
- Analysez les valeurs de luminescence corrigées pour chaque échantillon afin de déterminer les niveaux d’ATP, reflétant la prolifération ou la viabilité des cellules.
- S’assurer que chaque groupe expérimental et témoin était composé de quatre répétitions (étape 3.2.2) pour plus d’exactitude statistique. Calculez et importez la luminescence moyenne de chaque groupe et contrôle dans un programme statistique approprié.
- Comparer les résultats entre les groupes de traitement et les témoins pertinents pour évaluer avec précision la prolifération de l’ATP. Enregistrez toutes les lectures de luminescence, les calculs et les conditions expérimentales pour référence future.
REMARQUE : Pour toutes les analyses biochimiques sous forme de trousse, suivez le manuel ou le protocole de la trousse fourni par le fabricant pour obtenir des détails spécifiques, tels que les temps d’incubation recommandés, les concentrations et toute étape ou considération supplémentaire. Respectez toujours les directives de sécurité en laboratoire lors de la manipulation de produits chimiques et de matières biologiques.
- Dans un environnement stérile, mélanger 50 μL des cellules récupérées avec 50 μL de réactif ATP dans chaque puits.
Résultats
Pour évaluer la morphologie et inspecter visuellement la densité cellulaire des hydrogels, la microscopie inverse a été utilisée (Figure 2). Les ADSC ont conservé une morphologie arrondie 24 h après l’ensemencement et l’exposition au PBM. Les cellules étaient dispersées dans le gel sous forme de cellules uniques ou en grappes ressemblant à des raisins. La morphologie était inchangée après 10 jours en culture 3D. Aucune différence morphologique définitive n’a été notée...
Discussion
Les ADSC sont un type de cellule idéal à utiliser pour la médecine régénérative car ils stimulent divers processus pour aider à la cicatrisation des plaies 3,4. Cependant, plusieurs défis doivent être contournés, par exemple, de faibles taux de survie et une greffe inefficace des cellules dans un site de lésion9. Les cellules immortalisées ont été utilisées comme lignée cellulaire disponible dans le commerce, car elles peuv...
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Cette recherche a été financée par la Fondation nationale de recherche d’Afrique du Sud Thuthuka Instrument, numéro de subvention TTK2205035996 ; le Centre africain de laser (ALC) financé par le ministère de la Science et de l’Innovation (DSI), numéro de subvention HLHA23X tâche ALC-R007 ; le Conseil de la recherche de l’université, numéro de subvention 2022URC00513 ; l’Initiative des chaires de recherche sud-africaines du ministère des Sciences et de la Technologie (DST-NRF/SARChI), numéro de subvention 98337. Les organismes de financement n’ont joué aucun rôle dans la conception de l’étude, la collecte, l’analyse, l’interprétation des données ou la rédaction du manuscrit. Les auteurs remercient l’Université de Johannesburg (UJ) et le Laser Research Centre (LRC) pour leur utilisation des installations et des ressources.
matériels
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Références
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon