Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трехмерная клеточная культура стволовых клеток жировой ткани в гидрогеле с фотобиомодуляционной аугментацией
В этой статье
Резюме
Здесь мы представляем протокол, демонстрирующий использование гидрогеля в качестве трехмерного (3D) каркаса клеточной культуры для культивирования стволовых клеток жировой ткани (ADSC) и внедрение фотобиомодуляции (PBM) для усиления пролиферации ADSC в условиях 3D-культуры.
Аннотация
Стволовые клетки, полученные из жировой ткани (ADSC), обладающие мультипотентными мезенхимальными характеристиками, близкими к стволовым клеткам, часто используются в регенеративной медицине из-за их способности к разнообразному диапазону клеточной дифференцировки и их способности усиливать миграцию, пролиферацию и смягчать воспаление. Тем не менее, ADSC часто сталкиваются с проблемами выживания и приживления в ранах, в первую очередь из-за неблагоприятных воспалительных условий. Для решения этой проблемы были разработаны гидрогели для поддержания жизнеспособности ADSC в ранах и ускорения процесса заживления ран. В данной работе мы поставили перед собой цель оценить синергетическое влияние фотобиомодуляции (ФБМ) на пролиферацию и цитотоксичность ADSC в рамках 3D-клеточной культуры. Иммортализированные АЦП высевали в гидрогели по 10 мкл плотностью 2,5 х 103 клетки и подвергали облучению с использованием диодов 525 нм и 825 нм при флюенциях 5 Дж/см2 и 10 Дж/см2. Морфологические изменения, цитотоксичность и пролиферацию оценивали через 24 ч и 10 дней после воздействия ПБМ. ADSC имели округлую морфологию и были рассеяны по всему гелю в виде отдельных клеток или сфероидных агрегатов. Важно отметить, что как PBM, так и 3D-культуральный каркас не оказывали цитотоксического воздействия на клетки, в то время как PBM значительно увеличивал скорость пролиферации ADSC. В заключение, это исследование демонстрирует использование гидрогеля в качестве подходящей 3D-среды для культуры ADSC и представляет PBM в качестве важной стратегии аугментации, в частности, для решения проблемы медленной скорости пролиферации, связанной с 3D-культурой клеток.
Введение
ADSC представляют собой мезенхимальные мультипотентные клетки-предшественники, обладающие способностью к самообновлению и дифференцировке в несколько клеточных линий. Эти клетки могут быть получены из стромально-васкулярной фракции (SVF) жировой ткани во время процедуры липоаспирации1. ADSC стали идеальным типом стволовых клеток для использования в регенеративной медицине, потому что эти клетки многочисленны, минимально инвазивны для сбора, легко доступны и хорошо охарактеризованы2. Терапия стволовыми клетками предлагает возможный путь к заживлению ран путем стимуляции миграции клеток, пролиферации, неоваскуляризации и уменьшения воспаления в ранах 3,4. Примерно 80% регенеративной способности ADSC связано с паракринной сигнализацией через их секретом5. Ранее предполагалось, что прямая местная инъекция стволовых клеток или факторов роста в поврежденную ткань может привести к возникновению достаточных механизмов репарации in vivo 6,7,8. Однако этот подход столкнулся с рядом проблем, таких как низкая выживаемость и снижение приживления стволовых клеток в поврежденных тканях в результате воспалительной среды 9. Кроме того, одной из названных причин было отсутствие внеклеточного матрикса для поддержки выживания и функциональности трансплантированныхклеток. Для преодоления этих проблем в настоящее время особое внимание уделяется разработке носителей биоматериала для поддержания жизнеспособности и функционирования стволовых клеток.
Трехмерная (3D) клеточная культура усиливает межклеточное и межматричное взаимодействие in vitro, обеспечивая среду, которая лучше напоминает среду in vivo 11. Гидрогели были широко изучены как класс носителей биоматериала, которые обеспечивают 3D-среду для культуры стволовых клеток. Эти структуры состоят из воды и сшитых полимеров12. Инкапсуляция АДСК в гидрогель практически не оказывает цитотоксического действия на клетки в процессе культивирования при сохранении жизнеспособности клеток6. Стволовые клетки, культивируемые в 3D, демонстрируют улучшенное сохранение своей стволовой способности и улучшенную способность к дифференцировке13. Аналогичным образом, засеянные гидрогелем ADSC продемонстрировали повышенную жизнеспособность и ускоренное закрытие ран на животных моделях14. Кроме того, гидрогелевая инкапсуляция значительно увеличивает приживление и удержание ADSC в ранах15,16. TrueGel3D изготавливается из полимера, поливинилового спирта или декстрана, затвердевающего сшивающим агентом, циклодекстрином или полиэтиленгликолем17. Гель представляет собой синтетический гидрогель, который не содержит каких-либо продуктов животного происхождения, которые могут помешать экспериментам или вызвать иммунную реакцию во время трансплантации геля пациенту, эффективно имитируя внеклеточный матрикс18. Гель полностью настраивается путем изменения состава и отдельных компонентов. Он может содержать различные стволовые клетки и поддерживать дифференцировку нескольких типов клеток, регулируя жесткость геля19. Сайты прикрепления могут быть созданы путем добавления пептидов20. Гель расщепляется за счет секреции металлопротеаз, что позволяет осуществлять миграцию клеток21. Наконец, он понятен и позволяет использовать методы визуализации.
ПБМ – это минимально инвазивная и легко выполняемая форма низкоуровневой лазерной терапии, используемая для стимуляции внутриклеточных хромофоров. Различные длины волн вызывают различное воздействие на клетки22. Свет в диапазоне от красного до ближнего инфракрасного стимулирует повышенную продукцию аденозинтрифосфата (АТФ) и активных форм кислорода (АФК) за счет усиления потока через цепь переноса электронов23. Свет в синем и зеленом диапазонах стимулирует светозависимые ионные каналы, обеспечивая неспецифический приток катионов, таких как кальций и магний, в клетки, что, как известно, усиливает дифференцировку. Конечным эффектом является генерация вторичных мессенджеров, которые стимулируют транскрипцию факторов, запускающих последующие клеточные процессы, такие как миграция, пролиферация и дифференцировка. PBM может быть использован для предварительной подготовки клеток к пролиферации или дифференцировке перед трансплантацией клеток в неблагоприятную среду, например, в поврежденную ткань26. До и после трансплантации ПБМ (630 нм и 810 нм) воздействие ADSC значительно повышало жизнеспособность и функцию этих клеток in vivo у крыс с диабетом модели27. Регенеративная медицина требует достаточного количества клеток для эффективного восстановления тканей28. В 3D-культуре клеток ADSC ассоциировались с более медленными темпами пролиферации по сравнению с двумерными клеточными культурами6. Тем не менее, PBM может быть использован для расширения процесса 3D-культивирования клеток ADSC за счет повышения жизнеспособности, пролиферации, миграции и дифференцировки29,30.
протокол
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, реагентам и программному обеспечению, используемым в этом протоколе. Протокол графически представлен на рисунке 1.
1. Двумерная (2D) клеточная культура
ПРИМЕЧАНИЕ: Иммортализированные ADSC (1 x106 клеток) хранятся при температуре -195,8 °C в жидком азоте в криоконсервационном флаконе, содержащем 1 мл среды для замораживания клеток.
- Подготовка 2D-среды для восстановления клеток и 2D-колбы для культивирования
- Перелейте 39 мл базальной среды в центрифужную пробирку объемом 50 мл
- Обогащают базальную среду 20% фетальной бычьей сывороткой (FBS; 10 мл) и антибиотиками (1 мл) (0,5 мл пенициллина-стрептомицина и 0,5 мл амфотерицина В).
- Предварительно подготовьте колбу T75, переложив в колбу 6 мл среды для регенерации клеток, и инкубируйте ее при температуре 37 °C, 5%CO2 и влажности 85% в течение 45 минут (это можно сделать во время выполнения этапов восстановления клеток для экономии времени).
ПРИМЕЧАНИЕ: Перед использованием нагрейте всю среду до 37 °C и храните ее при температуре 4 °C не более 1 недели.
- Восстановление 2D-клеток
- Извлеките криовиал из резервуара для хранения жидкого азота и быстро разморозьте флакон на водяной бане при температуре 37 °C, пока он полностью не разморозится.
- Открутите криовиал с помощью центрифуги при 1006 x g в течение 5 минут (20 °C), а затем удалите надосадочную жидкость.
- Ресуспендируйте гранулированные ячейки, используя 1 мл предварительно нагретой среды для регенерации клеток.
- Равномерно распределите взвешенные клетки в предварительно кондиционированной колбе (окончательный объем 7 мл) и инкубируйте при 37 °C, 5%CO2 и влажности 85%.
- Через 24 ч утилизируйте и замените питательную среду для регенерации ячейки.
- Заменяйте питательную среду каждые 2-3 дня до тех пор, пока колба не станет сливаться с клетками.
- Сбор 2D-колб для культуры в одноклеточной суспензии и количество клеток
- Извлеките колбу для 2D-культуры из инкубатора и выбросьте питательную среду в соответствующий контейнер для отходов.
- Перелейте 10 мл промывочного раствора в колбу, чтобы промыть клетки и удалить отходы и скопления белка. После этого раствор для полоскания выбросьте.
- Добавьте 6 мл раствора для отслоения в колбу для культивирования, чтобы отделить клетки. Инкубируйте колбу при температуре 37 °C, 5%CO2 и влажности 85% в течение 2 минут.
ПРИМЕЧАНИЕ: Осмотрите колбу под микроскопом, чтобы убедиться, что все клетки были отделены. Если нет, аккуратно постучите по колбе и выдержите еще минуту. - После того, как все клетки будут отделены, перенесите клеточную суспензию в центрифужную пробирку объемом 15 мл и добавьте в пробирку 1 мл среды для восстановления клеток (содержащей 20% FBS). Это позволит нейтрализовать действие раствора для отслоения.
- Центрифугируйте пробирку в течение 5 мин при 1711 x g (20 °C).
- Удалите надосадочную жидкость и ресуспендируйте клетки в 1 мл полной среды.
- Удалите 10 мкл клеточной суспензии, поместите ее в микроцентрифужную пробирку объемом 500 мкл и смешайте с 10 мкл трипанового синего в соотношении 1:1.
- Поместите 10 мкл смеси раствора трипановых синих клеток в камеру для подсчета клеток в двух экземплярах.
- Поместите камеру для подсчета клеток в автоматический счетчик клеток. Счетчик клеток покажет общее количество клеток на мл, а также количество жизнеспособных и мертвых клеток. Рассчитайте среднее количество жизнеспособных клеток и количество жизнеспособных клеток, которые необходимо внедрить в 3D-гидрогель (шаг 2.2.6).
2. 3D культуре клеток
- Подготовка 3D-среды для культивирования
- Перелейте 44 мл базальной среды в центрифужную пробирку объемом 50 мл.
- Обогащают среду 10% ФБС (5 мл) и антибиотиками (1 мл) (0,5 мл пенициллина-стрептомицина и 0,5 мл амфотерицина В).
ПРИМЕЧАНИЕ: Перед использованием нагрейте весь носитель до 37 °C и храните его при температуре 4 °C не более одной недели.
- Приготовление гидрогеля
- Приготовьте быстрый декстран центрифугированием (1000 x g в течение 30 с при 20 °C) флакон с быстрым декстраном для концентрирования материала. Добавьте 175 мкл воды во флакон с быстрым декстраном, чтобы получить концентрацию 30 ммоль/л реактивных групп.
- Вкрутите пробирку (со средней скоростью в течение 30 с), содержащую раствор быстрого декстрана, до полного растворения материала. Инкубируйте растворенный материал на льду в течение 5 мин. Центрифугируйте пробирку, кратковременно встряхните ее и держите на льду во время дальнейшего использования.
- Центрифугируйте сшиватель (1000 x g в течение 30 с при 20 °C) для концентрирования материала. Добавьте 188 мкл воды во флакон сшивающего агента, чтобы получить концентрацию тиоловых групп 20 ммоль/л.
- Вкрутите пробирку (со средней скоростью в течение 30 с), содержащую раствор сшивателя, до тех пор, пока весь материал не растворится. Инкубируйте растворенный сшиватель при комнатной температуре (RT) в течение 5 мин. Центрифугируйте пробирку, ненадолго встряхните и удерживайте ее на RT во время дальнейшего использования.
- Адаптируйте протокол гидрогеля с 30 мкл до 10 мкл для снижения затрат (см. Таблицу 1 для получения более подробной информации).
- Приготовьте клеточную суспензию для достижения плотности посева 2,5 x 10,3 клетки на 10 мкл гидрогеля.
- Объедините компоненты в соответствии с таблицей 1 , чтобы создать мастер-микс. Перелейте 9 мкл мастер-смеси в лунку в 96-луночном планшете.
- Гель затвердеть, добавив 1 мкл разлагаемого сшивателя через 3 минуты после переноса мастер-смеси.
- Накройте гидрогели предварительно нагретой питательной средой объемом 170 мкл. Выдерживают в течение 1 ч. Через 1 ч замените питательную среду.
ПРИМЕЧАНИЕ: Клетки, внедренные в гидрогель, готовы к дальнейшим экспериментам или анализу в системе 3D-культивирования. Следуйте дополнительным протоколам по мере необходимости для последующих приложений.
3. Фотобиомодуляционное воздействие
- Настройка лазера
- Настройте диодную лазерную систему на зеленую (525 нм) или ближнюю инфракрасную (825 нм) длину волны. Включите лазеры и дайте им прогреться в течение рекомендуемого времени.
- Стабилизируйте выходную мощность лазеров, позволив им достичь устойчивого состояния. Это обеспечивает последовательное и точное облучение.
- Измерьте выходную мощность лазеров с помощью измерителя мощности лазера. Запишите значения мощности для каждой длины волны.
- Используйте уравнение 1 (Время лазерного облучения) для расчета времени лазерного облучения. Подставьте значения из таблицы 2 в уравнение 1, чтобы определить подходящее время облучения для каждой текучести. В уравнении 1 "r" представляет собой радиус зоны облучения лазера.
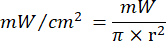
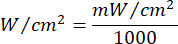
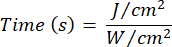
Уравнение 1 - В таблице 2 приведены конкретные параметры, необходимые для расчета, включая плавность (5 Дж/см² или 10 Дж/см²) и выходную мощность лазера.
- Облучение 3D-клеточных культур
- После полной замены носителя (шаг 2.2.9) поместите 96-луночную пластину с элементами, внедренными гидрогелем, под диодную лазерную систему. Облучают гидрогели с расчетным временем лазерного облучения для выбранной текучести (5 Дж/см² или 10 Дж/см²) на выбранной длине волны (зеленой или ближней инфракрасной). Поэтому культуры получат только одну дозу.
- Убедитесь, что каждая экспериментальная группа сопровождается контролем (n = 4), состоящим из АДСК, встроенных в гидрогель без воздействия ПБМ.
ПРИМЕЧАНИЕ: Всегда надевайте защитные очки, соответствующие длине волны света, с которой вы работаете. Лазеры используются вне защитного шкафа; Таким образом, крайне важно продезинфицировать область перед использованием. - Инкубируйте культуральные планшеты при температуре 37 °C, 5%CO2 и влажности 85% в течение всего эксперимента. Инкубируют планшеты в течение 24 ч для первого анализа или 10 дней для второго периода анализа, после облучения.
4. Морфология
- Микроскопия в инвертированном свете
- Включите микроскоп инвертированного света и дайте ему прогреться в течение нескольких минут. Убедитесь, что микроскоп правильно выровнен и откалиброван.
- Подготовьте образец для наблюдения на предметном стекле микроскопа или специализированной чашке для клеточных культур, в зависимости от экспериментальной установки. Откалибруйте микроскоп для получения оптимальных условий визуализации.
- При необходимости отрегулируйте параметры фокусировки, яркости и контрастности. Выберите объектив с 20-кратным увеличением на микроскопе для наблюдения и записи морфологии клеток.
- Поместите образец на предметный столик микроскопа и сосредоточьтесь на интересующих клетках с помощью окуляра. С помощью окуляра или камеры наблюдайте и записывайте морфологию клеток. Обратите внимание на форму, размер ячейки и любые отличительные особенности.
- Прикрепите модуль камеры к микроскопу. Настройте камеру для получения цифровых изображений. Обеспечьте правильное соединение и связь между камерой и микроскопом.
- Используя объектив с 20-кратным увеличением, сделайте цифровые снимки наблюдаемых клеток. Используйте элементы управления камерой для регулировки экспозиции, фокусировки и других важных параметров.
ПРИМЕЧАНИЕ: Убедитесь, что полученные изображения имеют высокое качество и дают репрезентативное представление о морфологии клеток. - Запустите программное обеспечение для работы с изображениями на компьютере. Сделайте снимок и используйте инструменты анализа в программном обеспечении для анализа морфологии клеток.
- Измеряйте размеры ячеек, подсчитывайте количество ячеек или выполняйте любой соответствующий анализ на основе целей эксперимента.
- Добавьте соответствующую масштабную линейку к изображениям с помощью программного обеспечения. Используйте известное увеличение объектива микроскопа, чтобы точно представить масштаб изображений.
5. Биохимические анализы
- Восстановление клеток
ПРИМЕЧАНИЕ: Клетки должны быть извлечены из гидрогеля в виде одноклеточной суспензии для дальнейшего биохимического анализа.- Приготовьте ферментативный раствор для восстановления клеток. В стерильной среде приготовьте рабочий раствор, разбавив ферментативный раствор для восстановления клеток фосфатно-солевым буфером (PBS) в соотношении 1:20 (Solution: PBS). Если требуется извлечение клеток из определенного количества гелей или лунок, рассчитайте общий требуемый объем из расчета 30 мкл раствора для восстановления на гель.
- Добавьте 30 мкл рабочего раствора в каждый гель или лунку, содержащую клетки, нуждающиеся в восстановлении. Обеспечьте тщательное и равномерное распределение раствора для восстановления, осторожно покачивая или вращая пластину. Инкубируйте планшет с восстановительным раствором в соответствии с рекомендуемым временем инкубации. Эту информацию обычно можно найти в техническом описании продукта или протоколе, предоставленном поставщиком.
- После инкубационного периода аккуратно извлеките пластину из инкубатора. Центрифугируйте планшеты при 1409 x g в течение 5 минут (20 °C), чтобы гранулировать клетки. Рекомендуемые условия центрифугирования см. в техническом описании продукта или протоколе. После завершения центрифугирования осторожно выбросьте надосадочную жидкость, стараясь не повредить гранулы клетки.
- Аккуратно ресуспендируйте гранулированные клетки в 220 мкл стерильного PBS. Обеспечьте тщательное перемешивание для получения однородной одноячеистой суспензии. Теперь клетки готовы к последующему биохимическому анализу. Следуйте конкретным протоколам для предполагаемых анализов, учитывая природу извлеченных клеток и требования экспериментальной установки.
- Анализ на цитотоксичность лактатдегидрогеназы (ЛДГ)
- Для каждой лунки осторожно удаляют 50 мкл полной питательной среды, обеспечивая минимальное воздействие на клеточный слой.
- Добавляют 50 мкл реагента цитотоксичности непосредственно в каждую лунку, содержащую оставшиеся 50 мкл питательной среды. Осторожно перемешайте, пипетируя вверх и вниз, чтобы обеспечить тщательное перемешивание образца с реагентом.
- Подготовьте положительный контроль. Установите тройные лунки с 5 мкл 10-кратного раствора лизиса на 50 мкл положительных контрольных ячеек, входящих в комплект.
- Инкубируйте планшет при рекомендуемой температуре и продолжительности. Этот этап позволяет реагенту цитотоксичности лизировать клетки и высвобождать ЛДГ в питательную среду.
- После инкубационного периода добавляют по 50 мкл стоп-раствора непосредственно в каждую лунку, содержащую реагент цитотоксичности и клеточный лизат. Осторожно перемешайте, пипетируя вверх и вниз, чтобы обеспечить надлежащую остановку реакции.
ПРИМЕЧАНИЕ: Стоп-раствор останавливает дальнейшее высвобождение ЛДГ и обеспечивает стабильность развития цвета. - Настройте считыватель спектрофотометрических пластин в соответствии с инструкциями производителя. Запишите поглощение каждой лунки на длине волны 490 нм. Эта длина волны специфична для колориметрического обнаружения продукта формазана, образующегося в результате реакции ЛДГ.
- Вычитание показаний фонового поглощения как из групп обработки, так и из контрольных скважин. Получение фоновых показаний из скважин, содержащих среды и реагенты цитотоксичности без клеток.
- Проанализируйте скорректированные значения абсорбции для каждого образца, чтобы определить уровень цитотоксичности. Более высокие значения абсорбции указывают на повышенное высвобождение ЛДГ и, следовательно, на более высокую цитотоксичность.
- Убедитесь, что каждая экспериментальная группа и контрольная группа состояла из четырех повторов (шаг 3.2.2) для статистической точности. Рассчитайте и импортируйте среднюю абсорбцию каждой группы и контроля в соответствующую статистическую программу.
- Сравните результаты между группами лечения и соответствующими контрольными группами, чтобы точно оценить цитотоксические эффекты и записать все показания абсорбции, расчеты и условия эксперимента для использования в будущем.
- Анализ на пролиферацию АТФ
- В стерильной среде смешайте 50 мкл восстановленных клеток с 50 мкл реагента АТФ в каждой лунке.
ПРИМЕЧАНИЕ: Регулируйте объем ячеек и реагентов в зависимости от количества лунок и плана эксперимента. Поддерживайте стабильные соотношения для получения точных результатов. - Поставьте тарелку на шейкер и энергично встряхивайте в темноте в течение 5 минут. Этот этап обеспечивает тщательное перемешивание клеток с реагентом. После встряхивания инкубируйте планшет еще 25 мин при РТ. Этот инкубационный период позволяет реагенту лизировать клетки и генерировать люминесцентный сигнал, пропорциональный количеству присутствующей АТФ.
- Настройте считыватель пластин в соответствии с инструкциями производителя для обнаружения люминесценции. Измерьте люминесценцию из каждой лунки, содержащей клеточный лизат и реагент АТФ. Убедитесь, что считыватель пластин настроен на измерение люминесценции с соответствующими настройками.
- Вычитание показаний фоновой люминесценции как из групп обработки, так и из контрольных скважин. Получение фоновых показаний из скважин, содержащих только реагент АТФ и PBS без ячеек.
- Проанализируйте скорректированные значения люминесценции для каждого образца, чтобы определить уровень АТФ, отражающий пролиферацию или жизнеспособность клеток.
- Убедитесь, что каждая экспериментальная группа и контрольная группа состояла из четырех повторов (шаг 3.2.2) для статистической точности. Рассчитать и импортировать среднюю люминесценцию каждой группы и контроля в соответствующую статистическую программу.
- Сравните результаты между группами лечения и соответствующими контрольными группами, чтобы точно оценить пролиферацию АТФ. Записывайте все показания люминесценции, расчеты и условия эксперимента для использования в будущем.
ПРИМЕЧАНИЕ: Для всех биохимических анализов в форме набора следуйте руководству или протоколу набора, предоставленному производителем, для получения конкретных деталей, таких как рекомендуемое время инкубации, концентрации и любые дополнительные шаги или соображения. Всегда соблюдайте правила техники безопасности при работе с химическими веществами и биологическими материалами.
- В стерильной среде смешайте 50 мкл восстановленных клеток с 50 мкл реагента АТФ в каждой лунке.
Результаты
Для оценки морфологии и визуального осмотра плотности клеток гидрогелей использовали обратную микроскопию (рис. 2). ADSC сохраняли округлую морфологию через 24 ч после посева и воздействия PBM. Клетки были разбросаны по всему гелю в виде одиночных клеток или в виноградоподо?...
Обсуждение
ADSC являются идеальным типом клеток для использования в регенеративной медицине, поскольку они стимулируют различные процессы, способствуя заживлению ран 3,4. Тем не менее, существует ряд проблем, которые необходимо обойти, например, низкая выживаемость и...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Это исследование финансировалось Национальным исследовательским фондом Южной Африки Thuthuka Instrument, грант No TTK2205035996; Департамент науки и инноваций (DSI) профинансировал Африканский лазерный центр (ALC), грант номер HLHA23X задание ALC-R007; Научно-исследовательский совет университета, номер гранта 2022URC00513; Южноафриканская инициатива по созданию научно-исследовательских кафедр Министерства науки и технологий (DST-NRF/SARChI), номер гранта 98337. Финансирующие организации не играли никакой роли в разработке исследования, сборе, анализе, интерпретации данных или написании рукописи. Авторы благодарят Университет Йоханнесбурга (UJ) и Лазерный исследовательский центр (LRC) за использование оборудования и ресурсов.
Материалы
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Ссылки
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены