Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hidrojel İçinde Yağ Kaynaklı Kök Hücrelerin Fotobiyomodülasyon Ogmentasyonu ile Üç Boyutlu Hücre Kültürü
Bu Makalede
Özet
Burada, adipoz kaynaklı kök hücre (ADSC) kültürü için üç boyutlu (3D) hücre kültürü çerçevesi olarak hidrojelin kullanımını gösteren ve 3D kültür ortamında ADSC'lerin proliferasyonunu arttırmak için fotobiyomodülasyonu (PBM) tanıtan bir protokol sunuyoruz.
Özet
Kök hücrelere benzer multipotent mezenkimal özelliklere sahip olan yağ kaynaklı kök hücreler (ADSC'ler), çok çeşitli hücre farklılaşması kapasiteleri ve göçü, proliferasyonu artırma ve iltihabı hafifletme yetenekleri nedeniyle rejeneratif tıpta sıklıkla kullanılmaktadır. Bununla birlikte, ADSC'ler, öncelikle elverişsiz enflamatuar koşullar nedeniyle, yaralarda sağkalım ve aşılamada sıklıkla zorluklarla karşılaşırlar. Bu sorunu çözmek için, yaralarda ADSC canlılığını sürdürmek ve yara iyileşme sürecini hızlandırmak için hidrojeller geliştirilmiştir. Burada, fotobiyomodülasyonun (PBM) ADSC proliferasyonu ve sitotoksisite üzerindeki sinerjik etkisini 3 boyutlu hücre kültürü çerçevesinde değerlendirmeyi amaçladık. Ölümsüzleştirilmiş ADSC'ler, 2.5 x 103 hücre yoğunluğunda 10 μL hidrojellere ekildi ve 5 J /cm2 ve 10 J /cm2 akıcılıklarında 525 nm ve 825 nm diyotlar kullanılarak ışınlamaya tabi tutuldu. Morfolojik değişiklikler, sitotoksisite ve proliferasyon, PBM maruziyetinden 24 saat ve 10 gün sonra değerlendirildi. ADSC'ler yuvarlak bir morfoloji sergiledi ve jel boyunca tek tek hücreler veya sferoid agregalar olarak dağıldı. Daha da önemlisi, hem PBM hem de 3D kültür çerçevesi hücreler üzerinde sitotoksik etki göstermezken, PBM ADSC'lerin proliferasyon oranlarını önemli ölçüde arttırdı. Sonuç olarak, bu çalışma, hidrojelin ADSC kültürü için uygun bir 3D ortam olarak kullanımını göstermekte ve PBM'yi, özellikle 3D hücre kültürü ile ilişkili yavaş proliferasyon oranlarını ele alan önemli bir büyütme stratejisi olarak tanıtmaktadır.
Giriş
ADSC'ler, kendi kendini yenileme ve çeşitli hücre soylarına farklılaşma kapasitesine sahip mezenkimal multipotent progenitör hücrelerdir. Bu hücreler, bir lipoaspirasyon prosedürü sırasında yağ dokusunun stromal vasküler fraksiyonundan (SVF) alınabilir1. ADSC'ler, rejeneratif tıpta kullanmak için ideal bir kök hücre tipi olarak ortaya çıkmıştır, çünkü bu hücreler bol miktarda bulunur, hasat için minimal invazivdir, kolay erişilebilir ve iyi karakterize edilmiştir2. Kök hücre tedavisi, hücre göçünü, proliferasyonu, neovaskülarizasyonu uyararak ve yaralardaki iltihabı azaltarak yara iyileşmesi için olası bir yol sunar 3,4. ADSC'lerin rejeneratif kapasitesinin kabaca %80'i, sekretomları5 aracılığıyla parakrin sinyalizasyonuna atfedilebilir. Daha önce, kök hücrelerin veya büyüme faktörlerinin hasarlı dokuya doğrudan lokal enjeksiyonunun in vivo onarım mekanizmalarını yeterince yasadışı hale getirebileceği öne sürülmüştür 6,7,8. Bununla birlikte, bu yaklaşım, enflamatuar ortamın bir sonucu olarak hasarlı dokularda zayıf sağkalım ve azalmış kök hücre aşılaması gibi çeşitli zorluklarla karşı karşıya kalmıştır 9. Ayrıca, belirtilen nedenlerden biri, nakledilen hücrelerin hayatta kalmasını ve işlevselliğini desteklemek için hücre dışı bir matrisin olmamasıydı10. Bu zorlukların üstesinden gelmek için, kök hücre canlılığını ve işlevini desteklemek için biyomateryal taşıyıcıların geliştirilmesine önem verilmektedir.
Üç boyutlu (3D) hücre kültürü, in vivo ortama daha iyi benzeyen bir ortam sağlamak için in vitro olarak hücreden hücreye ve hücreden matrise etkileşimi geliştirir11. Hidrojeller, kök hücre kültürü için 3 boyutlu bir ortam sağlayan bir biyomateryal taşıyıcı sınıfı olarak kapsamlı bir şekilde incelenmiştir. Bu yapılar su ve çapraz bağlı polimerlerdenyapılmıştır 12. ADSC'lerin hidrojel içinde kapsüllenmesi, hücrelerin canlılığını korurken kültür sırasında hücreler üzerinde neredeyse hiç sitotoksik etkiye sahip değildir6. 3D olarak kültürlenen kök hücreler, saplarının daha iyi tutulduğunu ve farklılaşma kapasitesinin arttığını gösterir13. Benzer şekilde, hidrojel tohumlu ADSC'ler, hayvan modellerinde artan canlılık ve hızlandırılmış yara kapanması göstermiştir14. Ayrıca, hidrojel kapsülleme, yaralarda ADSC'lerin aşılanmasını ve tutulmasını önemli ölçüde artırır15,16. TrueGel3D, siklodekstrin veya polietilen glikol17 gibi bir çapraz bağlayıcı ile katılaştırılmış, polivinil alkol veya dekstran polimerden yapılmıştır. Jel, hücre dışı bir matrisi etkili bir şekilde taklit ederken, jelin bir hastaya nakli sırasında deneylere müdahale edebilecek veya bir bağışıklık reaksiyonunu tetikleyebilecek herhangi bir hayvansal ürün içermeyen sentetik bir hidrojeldir18. Jel, bileşimi ve tek tek bileşenleri değiştirerek tamamen özelleştirilebilir. Farklı kök hücreleri barındırabilir ve jelin sertliğini ayarlayarak çeşitli hücre tiplerinin farklılaşmasını destekleyebilir19. Bağlanma bölgeleri, peptitlerin20 eklenmesiyle oluşturulabilir. Jel, metaloproteazların salgılanmasıyla parçalanabilir ve hücre göçüneizin verir 21. Son olarak, açıktır ve görüntüleme tekniklerine izin verir.
PBM, hücre içi kromoforları uyarmak için kullanılan minimal invaziv ve kolayca gerçekleştirilen düşük seviyeli bir lazer tedavisi şeklidir. Farklı dalga boyları hücreler üzerinde farklı etkiler ortaya çıkarır22. Kırmızı ila yakın kızılötesi aralığındaki ışık, elektron taşıma zinciri23 boyunca akıyı artırarak artan adenozin trifosfat (ATP) ve reaktif oksijen türleri (ROS) üretimini uyarır. Mavi ve yeşil aralıklardaki ışık, ışık kapılı iyon kanallarını uyararak, kalsiyum ve magnezyum gibi katyonların hücrelere spesifik olmayan akışına izin verir, bu da farklılaşmayı arttırdığı bilinmektedir24. Net etki, göç, proliferasyon ve farklılaşma gibi aşağı akış hücresel süreçleri tetikleyen faktörlerin transkripsiyonunu uyaran ikincil habercilerin üretilmesidir25. PBM, hücreleri olumsuz bir ortama, örneğin hasarlı dokuya nakletmeden önce hücrelerin çoğalmasını veya farklılaşmasını sağlamak için ön koşullandırmak için kullanılabilir26. ADSC'lerin nakil öncesi ve sonrası PBM (630 nm ve 810 nm) maruziyeti, diyabetik sıçan modelinde in vivo olarak bu hücrelerin canlılığını ve işlevini önemli ölçüde arttırdı27. Rejeneratif tıp, dokuların etkili bir şekilde onarılması için yeterli sayıda hücre gerektirir28. 3D hücre kültüründe, ADSC'ler, iki boyutlu hücre kültürüne kıyasla daha yavaş proliferasyon oranları ile ilişkilendirilmiştir6. Bununla birlikte, PBM, canlılığı, proliferasyonu, göçü ve farklılaşmayı artırarak ADSC'lerin 3D hücre kültürü sürecini artırmak için kullanılabilir29,30.
Protokol
NOT: Bu protokolde kullanılan tüm malzemeler, reaktifler ve yazılımlarla ilgili ayrıntılar için Malzeme Tablosuna bakın. Protokol, Şekil 1'de grafiksel olarak özetlenmiştir.
1. İki boyutlu (2D) hücre kültürü
NOT: Ölümsüzleştirilmiş ADSC'ler (1 x106 hücreli), 1 mL hücre dondurma ortamı içeren bir kriyoprezervasyon şişesinde sıvı nitrojen içinde -195.8 °C'de saklanır.
- 2D hücre geri kazanım ortamının ve 2D kültür şişesinin hazırlanması
- Bazal ortamın 39 mL'sini 50 mL'lik bir santrifüj tüpüne aktarın
- Bazal ortamı% 20 fetal sığır serumu (FBS; 10 mL) ve antibiyotikler (1 mL) (0.5 mL Penisilin-Streptomisin ve 0.5 mL Amfoterisin B) ile zenginleştirin.
- Hücre geri kazanım ortamının 6 mL'sini şişeye aktararak bir T75 şişesini önceden koşullandırın ve 37 °C, %5CO2 ve %85 nemde 45 dakika inkübe edin (bu, zamandan tasarruf etmek için hücre kurtarma adımlarını gerçekleştirirken yapılabilir).
NOT: Kullanmadan önce tüm ortamı 37 °C'ye ısıtın ve maksimum 4 hafta süreyle 1 °C'de saklayın.
- 2D hücre kurtarma
- Sıvı nitrojen depolama tankından bir kriyoviyal çıkarın ve şişeyi 37 °C'de bir su banyosunda tamamen çözülene kadar hızla çözün.
- Kriyoviyal 1006 x g'da bir santrifüj kullanarak 5 dakika (20 °C) döndürün ve ardından süpernatanı çıkarın.
- 1 mL önceden ısıtılmış hücre geri kazanım ortamı kullanarak peletlenmiş hücreleri yeniden süspanse edin.
- Askıdaki hücreleri önceden koşullandırılmış şişeye (7 mL'lik son hacim) eşit olarak dağıtın ve 37 °C, %5CO2 ve %85 nemde inkübe edin.
- 24 saat sonra hücre geri kazanım ortamını atın ve değiştirin.
- Şişe hücrelerle birleşene kadar kültür ortamını her 2-3 günde bir değiştirin.
- Tek hücreli süspansiyonda 2D kültür şişesinin hasadı ve hücre sayımı
- 2D kültür şişesini inkübatörden çıkarın ve kültür ortamını uygun bir atık kabına atın.
- Hücreleri durulamak ve atık ve protein birikimini gidermek için şişeye 10 mL durulama solüsyonu aktarın. Bundan sonra, durulama çözeltisini atın.
- Hücreleri ayırmak için kültür şişesine 6 mL ayırma çözeltisi ekleyin. Şişeyi 37 °C, %5CO2 ve %85 nemde 2 dakika inkübe edin.
NOT: Tüm hücrelerin ayrıldığını doğrulamak için şişeyi mikroskop altında gözlemleyin. Değilse, şişeye hafifçe vurun ve bir dakika daha inkübe edin. - Tüm hücreler ayrıldıktan sonra, hücre süspansiyonunu 15 mL'lik bir santrifüj tüpüne aktarın ve tüpe 1 mL hücre geri kazanım ortamı (% 20 FBS içeren) ekleyin. Bu, ayrılma çözümünün etkisini etkisiz hale getirecektir.
- Tüpü 1711 x g'de (20 °C) 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve hücreleri 1 mL tam ortamda yeniden süspanse edin.
- 10 μL hücre süspansiyonunu çıkarın, 500 μL'lik bir mikrosantrifüj tüpüne yerleştirin ve 10:1 oranında 1 μL tripan mavisi ile karıştırın.
- 10 μL tripan mavi hücre çözeltisi karışımını iki kopya halinde bir hücre sayma odasına yerleştirin.
- Hücre sayma odasını otomatik hücre sayacına yerleştirin. Hücre sayacı, mL başına toplam hücre sayısının yanı sıra canlı ve ölü hücrelerin sayısını gösterecektir. Ortalama canlı hücre sayısını ve 3D hidrojele gömülmesi gereken canlı hücre sayısını hesaplayın (adım 2.2.6).
2. 3D hücre kültürü
- 3D komple kültür ortamının hazırlanması
- Bazal ortamın 44 mL'sini 50 mL'lik bir santrifüj tüpüne aktarın.
- Ortamı% 10 FBS (5 mL) ve antibiyotikler (1 mL) (0.5 mL Penisilin-Streptomisin ve 0.5 mL Amfoterisin B) ile zenginleştirin.
NOT: Kullanmadan önce tüm ortamı 37 °C'ye ısıtın ve en fazla bir hafta boyunca 4 °C'de saklayın.
- Hidrojelin hazırlanması
- Malzemeyi konsantre etmek için hızlı dekstran şişesini santrifüjleyerek (20 ° C'de 30 saniye boyunca 1000 x g ) hızlı dekstranı hazırlayın. 30 mmol / L reaktif grupların nihai konsantrasyonunu elde etmek için hızlı dekstran şişeye 175 μL su ekleyin.
- Malzeme tamamen eriyene kadar hızlı dekstran çözeltisini içeren tüpü (30 saniye boyunca orta hızda) vorteksleyin. Çözünmüş materyali buz üzerinde 5 dakika inkübe edin. Tüpü santrifüjleyin, kısaca girdap yapın ve daha sonraki kullanımlarda buz üzerinde tutun.
- Malzemeyi konsantre etmek için çapraz bağlayıcıyı (20 °C'de 30 saniye boyunca 1000 x g ) santrifüjleyin. 20 mmol/L tiyol grubu nihai konsantrasyonunu elde etmek için çapraz bağlayıcı şişesine 188 μL su ekleyin.
- Tüm malzeme çözülene kadar çapraz bağlayıcı çözeltisini içeren tüpü (30 s boyunca orta hız) vorteksleyin. Çözünmüş çapraz bağlayıcıyı oda sıcaklığında (RT) 5 dakika inkübe edin. Tüpü santrifüjleyin, kısaca vorteksleyin ve daha sonraki kullanımlarda RT'de tutun.
- Maliyeti düşürmek için hidrojel protokolünü 30 μL'den 10 μL'ye uyarlayın (belirli ayrıntılar için Tablo 1'e bakın).
- 10 μL hidrojel başına 2,5 x 103 hücrelik bir tohumlama yoğunluğu elde etmek için hücre süspansiyonunu hazırlayın.
- Bir ana karışım oluşturmak için bileşenleri Tablo 1'e göre birleştirin. Ana karışımın 9 μL'sini 96 oyuklu bir şerit plakasındaki bir kuyuya aktarın.
- Ana karışım aktarıldıktan 3 dakika sonra 1 μL parçalanabilir çapraz bağlayıcı ekleyerek jeli katılaştırın.
- Hidrojelleri 170 μL önceden ısıtılmış tam kültür ortamı ile kaplayın. 1 saat inkübe edin. 1 saat sonra kültür ortamını değiştirin.
NOT: Hidrojel gömülü hücreler, 3D kültür sistemi içinde daha fazla deney veya analiz için hazırdır. Aşağı akış uygulamaları için gereken ek protokolleri izleyin.
3. Fotobiyomodülasyona maruz kalma
- Lazerin ayarlanması
- Diyot lazer sistemini yeşil (525 nm) veya yakın kızılötesi (825 nm) dalga boyları için ayarlayın. Lazerleri açın ve önerilen süre boyunca ısınmalarına izin verin.
- Lazerlerin sabit bir duruma ulaşmalarına izin vererek güç çıkışını stabilize edin. Bu, tutarlı ve doğru ışınlama sağlar.
- Bir lazer güç ölçer kullanarak lazerlerin güç çıkışını ölçün. Her dalga boyu için güç değerlerini kaydedin.
- Lazer ışınlama süresini hesaplamak için Denklem 1'i (Lazer ışınlama süresi) kullanın. Her akıcılık için uygun ışınlama süresini belirlemek için Tablo 2'deki değerleri Denklem 1'e değiştirin. Denklem 1'de "r", lazerin ışınlama bölgesinin yarıçapını temsil eder.
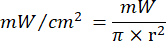
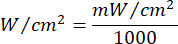
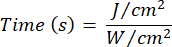
Denklem 1 - Akıcılık (2 J/cm² veya 5 J/cm²) ve lazer güç çıkışı dahil olmak üzere hesaplama için gereken belirli parametreler için Tablo 10'ye bakın.
- 3D hücre kültürlerinin ışınlanması
- Tüm ortamı değiştirdikten sonra (adım 2.2.9), hidrojel gömülü hücreler içeren 96 oyuklu plakayı diyot lazer sisteminin altına yerleştirin. Hidrojelleri, seçilen dalga boyunda (yeşil veya yakın kızılötesi) seçilen akıcılık (5 J/cm² veya 10 J/cm²) için hesaplanan lazer ışınlama süresiyle ışınlayın. Bu nedenle, kültürler sadece tek bir doz alacaktır.
- Her deney grubuna, PBM'ye maruz kalmadan hidrojel içine gömülü ADSC'lerden oluşan bir kontrolün (n = 4) eşlik ettiğinden emin olun.
NOT: Daima çalıştığınız ışığın dalga boyuna uygun koruyucu gözlük takın. Lazerler bir güvenlik kabininin dışında kullanılır; Bu nedenle, kullanmadan önce alanı dezenfekte etmek çok önemlidir. - Deneyler süresince kültür plakalarını 37 °C, %5CO2 ve %85 nemde inkübe edin. Plakaları ilk analiz için 24 saat veya ışınlama sonrası ikinci analiz dönemi için 10 gün inkübe edin.
4. Morfoloji
- Ters ışık mikroskobu
- Ters çevrilmiş ışık mikroskobunu açın ve birkaç dakika ısınmasına izin verin. Mikroskobun uygun şekilde hizalandığından ve kalibre edildiğinden emin olun.
- Deney düzeneğine bağlı olarak numuneyi bir mikroskop lamı veya özel bir hücre kültürü kabı üzerinde gözlem için hazırlayın. Optimum görüntüleme koşulları için mikroskobu kalibre edin.
- Odak, parlaklık ve kontrast ayarlarını gerektiği gibi ayarlayın. Hücre morfolojisini gözlemlemek ve kaydetmek için mikroskopta 20x objektif lensi seçin.
- Numuneyi mikroskop sahnesine yerleştirin ve göz merceğini kullanarak ilgilenilen hücrelere odaklanın. Göz merceğini veya kamera görüntüsünü kullanarak hücre morfolojisini gözlemleyin ve kaydedin. Hücre şekline, boyutuna ve ayırt edici özelliklerine dikkat edin.
- Kamera modülünü mikroskoba takın. Fotoğraf makinesini dijital görüntüleme için ayarlayın. Kamera ve mikroskop arasında doğru bağlantı ve iletişim sağlayın.
- 20x objektif lensi kullanarak, gözlemlenen hücrelerin dijital resimlerini çekin. Pozlamayı, odağı ve diğer ilgili ayarları yapmak için kamera kontrollerini kullanın.
NOT: Yakalanan görüntülerin yüksek kalitede olduğundan ve hücre morfolojisinin temsili bir görünümünü sağladığından emin olun. - Bilgisayarda görüntüleme yazılımını başlatın. Görüntüyü yakalayın ve hücre morfolojisini analiz etmek için yazılım içindeki analiz araçlarını kullanın.
- Hücre boyutlarını ölçün, hücreleri sayın veya deneysel hedeflere dayalı olarak ilgili analizleri gerçekleştirin.
- Yazılımı kullanarak görüntülere uygun bir ölçek çubuğu ekleyin. Görüntülerin ölçeğini doğru bir şekilde temsil etmek için mikroskop objektifinin bilinen büyütmesini kullanın.
5. Biyokimyasal tahliller
- Hücre kurtarma
NOT: Daha sonraki aşağı akış biyokimyasal tahlilleri için hücrelerin tek hücreli bir süspansiyonda hidrojelden geri kazanılması gerekir.- Enzimatik hücre geri kazanım çözeltisini hazırlayın. Steril bir ortamda, enzimatik hücre geri kazanım solüsyonunu fosfat tamponlu salin (PBS) ile 1:20 oranında seyrelterek bir çalışma solüsyonu hazırlayın (Solüsyon: PBS). Belirli sayıda jel veya oyuktan hücrelerin geri kazanılması gerekiyorsa, jel başına 30 μL geri kazanım çözeltisine dayalı olarak gereken toplam hacmi hesaplayın.
- Her jele 30 μL çalışma solüsyonu ekleyin veya iyileşmeye ihtiyaç duyan hücreleri içeren kuyucuğu ekleyin. Plakayı hafifçe sallayarak veya döndürerek geri kazanım solüsyonunun tam ve eşit dağılımını sağlayın. Plakayı, önerilen inkübasyon süresine göre geri kazanım solüsyonu ile inkübe edin. Bu bilgiler genellikle tedarikçi tarafından sağlanan ürün veri sayfasında veya protokolde bulunabilir.
- Kuluçka süresinden sonra, plakayı inkübatörden dikkatlice çıkarın. Hücreleri peletlemek için plakaları 1409 x g'da 5 dakika (20 °C) santrifüjleyin. Önerilen santrifüj koşulları için ürün veri sayfasına veya protokolüne bakın. Santrifüjleme tamamlandıktan sonra, hücre peletini rahatsız etmemeye dikkat ederek süpernatanı dikkatlice atın.
- Peletlenmiş hücreleri 220 μL steril PBS'de nazikçe yeniden süspanse edin. Homojen bir tek hücreli süspansiyon elde etmek için iyice karıştırdığınızdan emin olun. Hücreler artık aşağı akış biyokimyasal tahliller için hazırdır. Geri kazanılan hücrelerin doğasını ve deney düzeneğinin gereksinimlerini göz önünde bulundurarak amaçlanan tahliller için spesifik protokolleri izleyin.
- Laktat dehidrojenaz (LDH) sitotoksisite testi
- Her kuyucuk için, hücre tabakasında minimum rahatsızlık sağlamak için 50 μL tam kültür ortamını dikkatlice çıkarın.
- Kalan 50 μL kültür ortamını içeren her bir oyuğa doğrudan 50 μL sitotoksisite reaktifi ekleyin. Numunenin reaktifle iyice karışmasını sağlamak için yukarı ve aşağı pipetleyerek nazikçe karıştırın.
- Pozitif bir kontrol hazırlayın. Kitte bulunan 50 μL pozitif kontrol hücresi başına 5 μL 10x lizis çözeltisi ile üçlü kuyucuklar oluşturun.
- Plakayı önerilen sıcaklık ve sürede inkübe edin. Bu adım, sitotoksisite reaktifinin hücreleri parçalamasına ve LDH'yi kültür ortamına bırakmasına izin verir.
- İnkübasyon süresinden sonra, sitotoksisite reaktifi ve hücre lizatını içeren her bir oyuğa doğrudan 50 μL durdurma çözeltisi ekleyin. Reaksiyonun düzgün bir şekilde durmasını sağlamak için yukarı ve aşağı pipetleyerek nazikçe karıştırın.
NOT: Durdurma çözeltisi daha fazla LDH salınımını durdurur ve renk gelişiminin kararlılığını sağlar. - Spektrofotometrik plaka okuyucuyu üreticinin talimatlarına göre ayarlayın. Her bir kuyucuğun absorbansını 490 nm'de kaydedin. Bu dalga boyu, LDH reaksiyonu tarafından üretilen formazan ürününün kolorimetrik tespitine özgüdür.
- Hem tedavi gruplarından hem de kontrol kuyularından arka plan absorbans okumalarını çıkarın. Hücresiz ortam ve sitotoksisite reaktifleri içeren kuyucuklardan arka plan okumaları elde edin.
- Sitotoksisite seviyesini belirlemek için her numune için düzeltilmiş absorbans değerlerini analiz edin. Daha yüksek absorbans değerleri, artmış LDH salınımını ve sonuç olarak daha yüksek sitotoksisiteyi gösterir.
- İstatistiksel doğruluk için her deney grubunun ve kontrolün dört tekrardan oluştuğundan emin olun (adım 3.2.2). Her grubun ortalama absorbansını hesaplayın ve uygun bir istatistiksel programa kontrol edin.
- Sitotoksik etkileri doğru bir şekilde değerlendirmek için tedavi grupları ve uygun kontroller arasındaki sonuçları karşılaştırın ve ileride başvurmak üzere tüm absorbans okumalarını, hesaplamaları ve deneysel koşulları kaydedin.
- ATP proliferasyon testi
- Steril bir ortamda, her bir oyukta 50 μL geri kazanılmış hücreleri 50 μL ATP reaktifi ile karıştırın.
NOT: Hücrelerin ve reaktiflerin hacmini, kuyucuk sayısına ve deneysel tasarıma göre ayarlayın. Doğru sonuçlar için tutarlı oranları koruyun. - Plakayı bir çalkalayıcıya yerleştirin ve karanlıkta 5 dakika kuvvetlice çalkalayın. Bu adım, hücrelerin reaktifle iyice karıştırılmasını sağlar. Çalkaladıktan sonra, plakayı RT'de 25 dakika daha inkübe edin. Bu inkübasyon süresi, reaktifin hücreleri parçalamasına ve mevcut ATP miktarıyla orantılı ışıldayan bir sinyal üretmesine izin verir.
- Lüminesans algılama için plaka okuyucuyu üreticinin talimatlarına göre ayarlayın. Hücre lizatı ve ATP reaktifi içeren her bir kuyucuktan lüminesansı ölçün. Plaka okuyucunun uygun ayarlarla lüminesansı ölçecek şekilde ayarlandığından emin olun.
- Hem tedavi gruplarından hem de kontrol kuyularından arka plan lüminesans okumalarını çıkarın. Yalnızca ATP reaktifi ve hücresiz PBS içeren kuyucuklardan arka plan okumaları elde edin.
- Hücre proliferasyonunu veya canlılığını yansıtan ATP seviyelerini belirlemek için her numune için düzeltilmiş lüminesans değerlerini analiz edin.
- İstatistiksel doğruluk için her deney grubunun ve kontrolün dört tekrardan oluştuğundan emin olun (adım 3.2.2). Her grubun ortalama lüminesansını hesaplayın ve uygun bir istatistiksel programa kontrol edin.
- ATP proliferasyonunu doğru bir şekilde değerlendirmek için tedavi grupları ve ilgili kontroller arasındaki sonuçları karşılaştırın. İleride başvurmak üzere tüm lüminesans okumalarını, hesaplamaları ve deney koşullarını kaydedin.
NOT: Kit formundaki tüm biyokimyasal analizler için, önerilen inkübasyon süreleri, konsantrasyonlar ve ek adımlar veya hususlar gibi belirli ayrıntılar için kitin kılavuzunu veya üretici tarafından sağlanan protokolü izleyin. Kimyasalları ve biyolojik malzemeleri kullanırken daima laboratuvar güvenlik yönergelerine uyun.
- Steril bir ortamda, her bir oyukta 50 μL geri kazanılmış hücreleri 50 μL ATP reaktifi ile karıştırın.
Sonuçlar
Morfolojiyi değerlendirmek ve hidrojellerin hücre yoğunluğunu görsel olarak incelemek için ters mikroskopi kullanıldı (Şekil 2). ADSC'ler, tohumlama ve PBM maruziyetinden 24 saat sonra yuvarlak bir morfolojiyi korudu. Hücreler jel boyunca tek hücreler halinde veya üzüm benzeri kümeler halinde dağılmıştır. Morfoloji, 3D kültürde 10 gün sonra değişmedi. Deney grupları ve kontroller arasında veya farklı deney grupları arasında morfolojide kesin bir fark görülmedi....
Tartışmalar
ADSC'ler, yara iyileşmesine yardımcı olmak için çeşitli süreçleri uyardıkları için rejeneratif tıp için ideal bir hücre tipidir 3,4. Bununla birlikte, aşılması gereken birkaç zorluk vardır, örneğin, zayıf hayatta kalma oranları ve bir yaralanma bölgesindeki hücrelerin etkisiz aşılanması9. Ölümsüzleştirilmiş hücreler, birincil hücrelere kıyasla daha fazla nesil boyunca geçebildikleri, hasat edilmeleri ge...
Açıklamalar
Yazarlar hiçbir çıkar çatışması beyan etmezler.
Teşekkürler
Bu araştırma, Güney Afrika Ulusal Araştırma Vakfı Thuthuka Instrument, hibe numarası TTK2205035996 tarafından finanse edilmiştir; Bilim ve Yenilik Departmanı (DSI) tarafından finanse edilen Afrika Lazer Merkezi (ALC), ALC-R007 görevi HLHA23X hibe numarası; Üniversite Araştırma Konseyi, hibe numarası 2022URC00513; Bilim ve Teknoloji Bakanlığı'nın Güney Afrika Araştırma Sandalyeleri Girişimi (DST-NRF/SARChI), hibe numarası 98337. Finansman kuruluşları, çalışmanın tasarımında, toplanmasında, analizinde, verilerin yorumlanmasında veya makalenin yazılmasında hiçbir rol oynamamıştır. Yazarlar, Johannesburg Üniversitesi'ne (UJ) ve Lazer Araştırma Merkezi'ne (LRC) tesisleri ve kaynakları kullandıkları için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Referanslar
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır