È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Colture cellulari tridimensionali di cellule staminali derivate dal tessuto adiposo in un idrogel con aumento della fotobiomodulazione
In questo articolo
Riepilogo
Qui, presentiamo un protocollo che dimostra l'uso dell'idrogel come struttura di coltura cellulare tridimensionale (3D) per la coltura di cellule staminali derivate dal tessuto adiposo (ADSC) e introduciamo la fotobiomodulazione (PBM) per migliorare la proliferazione di ADSC all'interno dell'ambiente di coltura 3D.
Abstract
Le cellule staminali derivate dal tessuto adiposo (ADSC), che possiedono caratteristiche mesenchimali multipotenti simili alle cellule staminali, sono spesso impiegate nella medicina rigenerativa grazie alla loro capacità di differenziazione cellulare e alla loro capacità di migliorare la migrazione, la proliferazione e mitigare l'infiammazione. Tuttavia, le ADSC spesso affrontano sfide nella sopravvivenza e nell'attecchimento all'interno delle ferite, principalmente a causa di condizioni infiammatorie sfavorevoli. Per affrontare questo problema, sono stati sviluppati idrogel per sostenere la vitalità dell'ADSC nelle ferite e accelerare il processo di guarigione delle ferite. Qui, abbiamo mirato a valutare l'impatto sinergico della fotobiomodulazione (PBM) sulla proliferazione e sulla citotossicità dell'ADSC all'interno di un quadro di coltura cellulare 3D. Gli ADSC immortalizzati sono stati seminati in idrogel da 10 μL ad una densità di 2,5 x 103 cellule e sottoposti a irradiazione utilizzando diodi da 525 nm e 825 nm a fluenze di 5 J/cm2 e 10 J/cm2. I cambiamenti morfologici, la citotossicità e la proliferazione sono stati valutati a 24 ore e 10 giorni dopo l'esposizione al PBM. Gli ADSC hanno mostrato una morfologia arrotondata e sono stati dispersi in tutto il gel come singole cellule o aggregati sferoidi. È importante sottolineare che sia il PBM che la struttura di coltura 3D non hanno mostrato effetti citotossici sulle cellule, mentre il PBM ha migliorato significativamente i tassi di proliferazione delle ADSC. In conclusione, questo studio dimostra l'uso dell'idrogel come ambiente 3D adatto per la coltura ADSC e introduce il PBM come una significativa strategia di aumento, affrontando in particolare i lenti tassi di proliferazione associati alla coltura cellulare 3D.
Introduzione
Le ADSC sono cellule progenitrici mesenchimali multipotenti con la capacità di auto-rinnovarsi e differenziarsi in diverse linee cellulari. Queste cellule possono essere prelevate dalla frazione vascolare stromale (SVF) del tessuto adiposo durante una procedura di lipoaspirazione1. Le ADSC sono emerse come un tipo di cellule staminali ideale da utilizzare nella medicina rigenerativa perché queste cellule sono abbondanti, minimamente invasive da raccogliere, facilmente accessibili e ben caratterizzate2. La terapia con cellule staminali offre una possibile strada per la guarigione delle ferite stimolando la migrazione cellulare, la proliferazione, la neovascolarizzazione e riducendo l'infiammazione all'interno delle ferite 3,4. Circa l'80% della capacità rigenerativa delle ADSC è attribuibile alla segnalazione paracrina attraverso il loro secretoma5. In precedenza, è stato suggerito che un'iniezione locale diretta di cellule staminali o fattori di crescita nel tessuto danneggiato potrebbe illecito meccanismi di riparazione in vivo sufficienti 6,7,8. Tuttavia, questo approccio ha dovuto affrontare diverse sfide, come la scarsa sopravvivenza e la riduzione dell'attecchimento delle cellule staminali all'interno dei tessuti danneggiati a causa dell'ambiente infiammatorio 9. Inoltre, uno dei motivi citati era la mancanza di una matrice extracellulare per supportare la sopravvivenza e la funzionalità delle cellule trapiantate10. Per superare queste sfide, l'accento è ora posto sullo sviluppo di vettori di biomateriali per sostenere la vitalità e la funzione delle cellule staminali.
La coltura cellulare tridimensionale (3D) migliora l'interazione cellula-cellula e cellula-matrice in vitro per fornire un ambiente più simile all'ambiente in vivo 11. Gli idrogel sono stati ampiamente studiati come una classe di vettori di biomateriali che forniscono un ambiente 3D per la coltura di cellule staminali. Queste strutture sono costituite da acqua e polimeri reticolati12. L'incapsulamento delle ADSC in idrogel non ha praticamente alcun effetto citotossico sulle cellule durante la coltura, pur mantenendo la vitalità delle cellule6. Le cellule staminali coltivate in 3D dimostrano una maggiore ritenzione della loro staminalità e una migliore capacità di differenziazione13. Allo stesso modo, le ADSC con semi di idrogel hanno dimostrato una maggiore vitalità e una chiusura accelerata della ferita nei modelli animali14. Inoltre, l'incapsulamento dell'idrogel aumenta significativamente l'attecchimento e la ritenzione delle ADSC nelle ferite15,16. TrueGel3D è costituito da un polimero, alcol polivinilico o destrano, solidificato da un reticolante, ciclodestrina o polietilenglicole17. Il gel è un idrogel sintetico che non contiene prodotti di origine animale che possano interferire con gli esperimenti o innescare una reazione immunitaria durante il trapianto del gel in un paziente, imitando efficacemente una matrice extracellulare18. Il gel è completamente personalizzabile modificando la composizione e i singoli componenti. Può ospitare diverse cellule staminali e supportare la differenziazione di diversi tipi di cellule regolando la rigidità del gel19. I siti di attacco possono essere creati attraverso l'aggiunta di peptidi20. Il gel è degradabile dalla secrezione di metalloproteasi, consentendo la migrazione cellulare21. Infine, è chiaro e consente tecniche di imaging.
Il PBM è una forma minimamente invasiva e di facile esecuzione di terapia laser a basso livello utilizzata per stimolare i cromofori intracellulari. Diverse lunghezze d'onda suscitano effetti diversi sulle cellule22. La luce nella gamma dal rosso al vicino infrarosso stimola l'aumento della produzione di adenosina trifosfato (ATP) e di specie reattive dell'ossigeno (ROS) migliorando il flusso attraverso la catena di trasporto degli elettroni23. La luce nelle gamme blu e verde stimola i canali ionici dipendenti dalla luce, consentendo l'afflusso non specifico di cationi, come calcio e magnesio, nelle cellule, che è noto per migliorare la differenziazione24. L'effetto netto è la generazione di messaggeri secondari che stimolano la trascrizione di fattori che innescano processi cellulari a valle come la migrazione, la proliferazione e la differenziazione25. Il PBM può essere utilizzato per pre-condizionare le cellule a proliferare o differenziarsi prima di trapiantarle in un ambiente avverso, ad esempio tessuto danneggiato26. L'esposizione pre e post-trapianto di PBM (630 nm e 810 nm) di ADSC ha migliorato significativamente la vitalità e la funzione di queste cellule in vivo in un modello di ratto diabetico27. La medicina rigenerativa richiede un numero adeguato di cellule per un'efficace riparazione dei tessuti28. Nelle colture cellulari 3D, le ADSC sono state associate a tassi di proliferazione più lenti rispetto alle colture cellulari bidimensionali6. Tuttavia, il PBM può essere utilizzato per aumentare il processo di coltura cellulare 3D delle ADSC migliorando la vitalità, la proliferazione, la migrazione e la differenziazione29,30.
Protocollo
NOTA: Vedere la Tabella dei materiali per i dettagli relativi a tutti i materiali, i reagenti e il software utilizzati in questo protocollo. Il protocollo è stato riassunto graficamente nella Figura 1.
1. Colture cellulari bidimensionali (2D)
NOTA: Gli ADSC immortalizzati (1 x106 cellule) vengono conservati a -195,8 °C in azoto liquido in una fiala di crioconservazione contenente 1 mL di terreno di congelamento cellulare.
- Preparazione del terreno di recupero delle cellule 2D e del pallone di coltura 2D
- Trasferire 39 mL di terreno basale in una provetta da centrifuga da 50 mL
- Arricchire il terreno basale con il 20% di siero fetale bovino (FBS; 10 mL) e antibiotici (1 mL) (0,5 mL di Penicillina-Streptomicina e 0,5 mL di Amfotericina B).
- Precondizionare un matraccio T75 trasferendo 6 mL del terreno di recupero cellulare nel matraccio e incubarlo a 37 °C, 5% di CO2 e 85% di umidità per 45 minuti (questo può essere fatto durante l'esecuzione delle fasi di recupero delle cellule per risparmiare tempo).
NOTA: Riscaldare il terreno completo a 37 °C prima dell'uso e conservarlo a 4 °C per un periodo massimo di 1 settimana.
- Recupero cellulare 2D
- Rimuovere un crioviale dal serbatoio di stoccaggio dell'azoto liquido e scongelare rapidamente il flaconcino a bagnomaria a 37 °C, fino a quando non è completamente scongelato.
- Centrifugare il crioviale con una centrifuga a 1006 x g per 5 minuti (20 °C) e quindi rimuovere il surnatante.
- Risospendere le cellule pellettate utilizzando 1 mL di terreno di recupero cellulare preriscaldato.
- Distribuire uniformemente le cellule sospese nel matraccio precondizionato (volume finale di 7 mL) e incubare a 37 °C, 5% di CO2 e 85% di umidità.
- Dopo 24 ore gettare e sostituire il mezzo di recupero cellulare.
- Sostituire il terreno di coltura ogni 2-3 giorni fino a quando il pallone diventa confluente con le cellule.
- Raccolta del pallone di coltura 2D in sospensione di una singola cellula e conta cellulare
- Rimuovere il pallone di coltura 2D dall'incubatore e gettare il terreno di coltura in un contenitore per rifiuti appropriato.
- Trasferire 10 ml di soluzione di risciacquo nel matraccio per sciacquare le cellule e rimuovere le scorie e l'accumulo di proteine. Successivamente, gettare la soluzione di risciacquo.
- Aggiungere 6 mL di soluzione di distacco al matraccio di coltura per staccare le cellule. Incubare il matraccio a 37 °C, 5% di CO2 e 85% di umidità per 2 min.
NOTA: Osservare il pallone al microscopio per verificare che tutte le cellule siano state staccate. In caso contrario, picchiettare delicatamente sul pallone e incubare per un altro minuto. - Una volta che tutte le cellule sono state staccate, trasferire la sospensione cellulare in una provetta da centrifuga da 15 mL e aggiungere 1 mL del terreno di recupero cellulare (contenente il 20% di FBS) alla provetta. Ciò neutralizzerà l'effetto della soluzione di distacco.
- Centrifugare la provetta per 5 minuti a 1711 x g (20 °C).
- Rimuovere il surnatante e risospendere le cellule in 1 mL di terreno completo.
- Rimuovere 10 μL della sospensione cellulare, inserirla in una provetta per microcentrifuga da 500 μL e mescolarla con 10 μL di blu di tripano in rapporto 1:1.
- Disporre 10 μL della miscela di soluzione di cellule blu tripano in una camera per il conteggio delle cellule in duplicato.
- Posizionare la camera di conteggio delle cellule nel contatore automatico di cellule. Il contatore di cellule indicherà il numero totale di cellule per mL e il numero di cellule vitali e morte. Calcolare il numero medio di cellule vitali e il numero di cellule vitali che devono essere incorporate nell'idrogel 3D (passaggio 2.2.6).
2. 3D coltura cellulare
- Preparazione del terreno di coltura completo 3D
- Trasferire 44 mL del terreno basale in una provetta da centrifuga da 50 mL.
- Arricchire i terreni con FBS al 10% (5 mL) e antibiotici (1 mL) (0,5 mL di Penicillina-Streptomicina e 0,5 mL di Amfotericina B).
NOTA: Riscaldare l'intero terreno a 37 °C prima dell'uso e conservarlo a 4 °C per un massimo di una settimana.
- Preparazione dell'idrogel
- Preparare il destrano veloce centrifugando (1000 x g per 30 s a 20 °C) il flaconcino di destrano veloce per concentrare il materiale. Aggiungere 175 μL di acqua al flaconcino di destrano rapido per ottenere una concentrazione finale di 30 mmol/L di gruppi reattivi.
- Vorticare la provetta (velocità media per 30 s) contenente la soluzione di destrano veloce fino a quando il materiale non è completamente sciolto. Incubare il materiale disciolto su ghiaccio per 5 min. Centrifugare la provetta, farla vorticare brevemente e tenerla sul ghiaccio durante l'ulteriore utilizzo.
- Centrifugare il reticolante (1000 x g per 30 s a 20 °C) per concentrare il materiale. Aggiungere 188 μL di acqua al flaconcino reticolante per ottenere una concentrazione finale di 20 mmol/L di gruppi tiolici.
- Vorticare il tubo (velocità media per 30 s) contenente la soluzione reticolante fino a quando tutto il materiale non è sciolto. Incubare il reticolante disciolto a temperatura ambiente (RT) per 5 minuti. Centrifugare la provetta, vorticarla brevemente e tenerla a RT durante l'ulteriore utilizzo.
- Adattare il protocollo idrogel da 30 μL a 10 μL per ridurre i costi (vedere la Tabella 1 per dettagli specifici).
- Preparare la sospensione cellulare per ottenere una densità di semina di 2,5 x 103 cellule per idrogel da 10 μL.
- Combinate i componenti secondo la Tabella 1 per creare un mix master. Trasferire 9 μL della miscela master in un pozzetto in una piastra a nastro da 96 pozzetti.
- Solidificare il gel aggiungendo 1 μL di reticolante degradabile 3 minuti dopo il trasferimento della miscela principale.
- Coprire gli idrogel con terreni di coltura completi preriscaldati da 170 μL. Incubare per 1 h. Dopo 1 ora, sostituire il terreno di coltura.
NOTA: Le cellule incorporate nell'idrogel sono pronte per ulteriori sperimentazioni o analisi all'interno del sistema di coltura 3D. Seguire i protocolli aggiuntivi necessari per le applicazioni a valle.
3. Esposizione alla fotobiomodulazione
- Impostazione del laser
- Impostare il sistema laser a diodi per lunghezze d'onda verdi (525 nm) o nel vicino infrarosso (825 nm). Accendere i laser e lasciarli riscaldare per la durata consigliata.
- Stabilizzare la potenza in uscita dei laser consentendo loro di raggiungere uno stato stazionario. Ciò garantisce un'irradiazione costante e accurata.
- Misurare la potenza erogata dai laser utilizzando un misuratore di potenza laser. Registrare i valori di potenza per ciascuna lunghezza d'onda.
- Utilizzare l'equazione 1 (tempo di irradiazione laser) per calcolare il tempo di irradiazione laser. Sostituisci i valori della Tabella 2 nell'equazione 1 per determinare il tempo di irradiazione appropriato per ciascuna fluidità. Nell'equazione 1, "r" rappresenta il raggio della zona di irradiazione del laser.
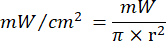
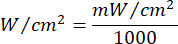
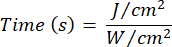
Equazione 1 - Fare riferimento alla Tabella 2 per i parametri specifici necessari per il calcolo, comprese le fluenze (5 J/cm² o 10 J/cm²) e la potenza di uscita del laser.
- Irradiazione delle colture cellulari 3D
- Dopo aver sostituito il terreno completo (passaggio 2.2.9), posizionare la piastra a 96 pozzetti contenente celle incorporate in idrogel sotto il sistema laser a diodi. Irradiare gli idrogel con il tempo di irradiazione laser calcolato per la fluidità selezionata (5 J/cm² o 10 J/cm²) alla lunghezza d'onda scelta (verde o vicino infrarosso). Pertanto, le colture riceveranno solo una singola dose.
- Assicurarsi che ogni gruppo sperimentale sia accompagnato da un controllo (n = 4), costituito da ADSC incorporate in idrogel senza esposizione a PBM.
NOTA: Indossare sempre occhiali di sicurezza appropriati alla lunghezza d'onda della luce con cui si sta lavorando. I laser vengono utilizzati all'esterno di un armadio di sicurezza; Pertanto, è di fondamentale importanza disinfettare l'area prima dell'uso. - Incubare le piastre di coltura a 37 °C, 5% di CO2 e 85% di umidità per tutta la durata degli esperimenti. Incubare le piastre per 24 ore per la prima analisi o 10 giorni per il secondo periodo di analisi, dopo l'irradiazione.
4. Morfologia
- Microscopia a luce invertita
- Accendere il microscopio a luce invertita e lasciarlo riscaldare per qualche minuto. Assicurarsi che il microscopio sia correttamente allineato e calibrato.
- Preparare il campione per l'osservazione su un vetrino da microscopio o su una piastra di coltura cellulare specializzata, a seconda della configurazione sperimentale. Calibrare il microscopio per ottenere condizioni di imaging ottimali.
- Regolare le impostazioni di messa a fuoco, luminosità e contrasto in base alle esigenze. Selezionare l'obiettivo 20x del microscopio per osservare e registrare la morfologia cellulare.
- Posizionare il campione sul tavolino del microscopio e mettere a fuoco le cellule di interesse utilizzando l'oculare. Utilizzando l'oculare o la telecamera view, osservare e registrare la morfologia cellulare. Presta attenzione alla forma, alle dimensioni e alle caratteristiche distintive delle cellule.
- Collegare il modulo fotocamera al microscopio. Impostare la fotocamera per l'imaging digitale. Assicurarsi che la connessione e la comunicazione tra la fotocamera e il microscopio siano corrette.
- Utilizzando l'obiettivo 20x, è possibile acquisire immagini digitali delle cellule osservate. Utilizzare i controlli della fotocamera per regolare l'esposizione, la messa a fuoco e altre impostazioni pertinenti.
NOTA: Assicurarsi che le immagini acquisite siano di alta qualità e forniscano una visione rappresentativa della morfologia cellulare. - Avviare il software di imaging sul computer. Cattura l'immagine e utilizza gli strumenti di analisi all'interno del software per analizzare la morfologia cellulare.
- Misurare le dimensioni delle celle, contare le cellule o eseguire qualsiasi analisi pertinente in base agli obiettivi sperimentali.
- Aggiungi una barra di scala appropriata alle immagini utilizzando il software. Utilizzare l'ingrandimento noto dell'obiettivo del microscopio per rappresentare con precisione la scala delle immagini.
5. Saggi biochimici
- Recupero cellulare
NOTA: Le cellule devono essere recuperate dall'idrogel in una sospensione unicellulare per ulteriori saggi biochimici a valle.- Preparare la soluzione enzimatica per il recupero cellulare. In ambiente sterile, preparare una soluzione di lavoro diluendo la soluzione enzimatica di recupero cellulare con soluzione salina tamponata con fosfato (PBS) in un rapporto di 1:20 (soluzione: PBS). Se è necessario recuperare le cellule da un numero specifico di gel o pozzetti, calcolare il volume totale richiesto in base a 30 μL di soluzione di recupero per gel.
- Aggiungere 30 μL della soluzione di lavoro a ciascun gel o pozzetto contenente le cellule da recuperare. Garantire una distribuzione completa e uniforme della soluzione di recupero facendo oscillare o roteare delicatamente la piastra. Incubare la piastra con la soluzione di recupero secondo il tempo di incubazione consigliato. Queste informazioni si trovano in genere nella scheda tecnica del prodotto o nel protocollo fornito dal fornitore.
- Dopo il periodo di incubazione, rimuovere con cautela la piastra dall'incubatrice. Centrifugare le piastre a 1409 x g per 5 minuti (20 °C) per pellettare le cellule. Fare riferimento alla scheda tecnica o al protocollo del prodotto per le condizioni di centrifugazione consigliate. Una volta completata la centrifugazione, scartare con cura il surnatante, facendo attenzione a non disturbare il pellet cellulare.
- Risospendere delicatamente le cellule pellettate in 220 μL di PBS sterile. Garantire una miscelazione accurata per ottenere una sospensione omogenea a cellula singola. Le cellule sono ora pronte per i saggi biochimici a valle. Seguire i protocolli specifici per i saggi previsti, considerando la natura delle cellule recuperate e i requisiti del setup sperimentale.
- Test di citotossicità della lattato deidrogenasi (LDH)
- Per ogni pozzetto, rimuovere con cautela 50 μL di terreno di coltura completo, garantendo il minimo disturbo allo strato cellulare.
- Aggiungere 50 μL del reagente di citotossicità direttamente a ciascun pozzetto contenente i restanti 50 μL di terreno di coltura. Miscelare delicatamente pipettando verso l'alto e verso il basso per garantire una miscelazione accurata del campione con il reagente.
- Preparare un controllo positivo. Impostare pozzetti triplicati con 5 μL di soluzione di lisi 10x per 50 μL di celle di controllo positivo incluse nel kit.
- Incubare la piastra alla temperatura e alla durata consigliate. Questo passaggio consente al reagente di citotossicità di lisare le cellule e rilasciare LDH nel terreno di coltura.
- Dopo il periodo di incubazione, aggiungere 50 μL della soluzione di arresto direttamente a ciascun pozzetto contenente il reagente di citotossicità e il lisato cellulare. Mescolare delicatamente pipettando su e giù per garantire un corretto arresto della reazione.
NOTA: La soluzione di arresto arresta l'ulteriore rilascio di LDH e garantisce la stabilità dello sviluppo del colore. - Configurare il lettore di lastre spettrofotometriche secondo le istruzioni del produttore. Registrare l'assorbanza di ciascun pozzetto a 490 nm. Questa lunghezza d'onda è specifica per la rilevazione colorimetrica del prodotto formazano generato dalla reazione LDH.
- Sottrarre le letture dell'assorbanza di fondo sia dai gruppi di trattamento che dai pozzetti di controllo. Ottenere letture di fondo da pozzetti contenenti terreni e reagenti di citotossicità senza cellule.
- Analizzare i valori di assorbanza corretti per ciascun campione per determinare il livello di citotossicità. Valori di assorbanza più elevati indicano un aumento del rilascio di LDH e, di conseguenza, una maggiore citotossicità.
- Assicurarsi che ogni gruppo sperimentale e controllo consistesse di quattro ripetizioni (passaggio 3.2.2) per l'accuratezza statistica. Calcolare e importare l'assorbanza media di ciascun gruppo e controllo in un apposito programma statistico.
- Confrontare i risultati tra i gruppi di trattamento e i controlli appropriati per valutare accuratamente gli effetti citotossici e registrare tutte le letture di assorbanza, i calcoli e le condizioni sperimentali per riferimento futuro.
- Test di proliferazione dell'ATP
- In un ambiente sterile, miscelare 50 μL delle cellule recuperate con 50 μL del reagente ATP in ciascun pozzetto.
NOTA: Regolare il volume delle cellule e dei reagenti in base al numero di pozzetti e al disegno sperimentale. Mantieni rapporti coerenti per risultati accurati. - Mettere il piatto su uno shaker e agitare energicamente al buio per 5 min. Questa fase garantisce un'accurata miscelazione delle cellule con il reagente. Dopo l'agitazione, incubare la piastra per altri 25 minuti a RT. Questo periodo di incubazione consente al reagente di lisare le cellule e generare un segnale luminescente proporzionale alla quantità di ATP presente.
- Configurare il lettore di piastre secondo le istruzioni del produttore per il rilevamento della luminescenza. Misurare la luminescenza da ciascun pozzetto contenente il lisato cellulare e il reagente ATP. Assicurarsi che il lettore di piastre sia impostato per misurare la luminescenza con le impostazioni appropriate.
- Sottrarre le letture della luminescenza di fondo sia dai gruppi di trattamento che dai pozzetti di controllo. Ottenere letture di fondo da pozzetti contenenti solo il reagente ATP e PBS senza cellule.
- Analizza i valori di luminescenza corretti per ciascun campione per determinare i livelli di ATP, che riflettono la proliferazione o la vitalità cellulare.
- Assicurarsi che ogni gruppo sperimentale e controllo consistesse di quattro ripetizioni (passaggio 3.2.2) per l'accuratezza statistica. Calcolare e importare la luminescenza media di ciascun gruppo e controllo in un apposito programma statistico.
- Confrontare i risultati tra i gruppi di trattamento e i controlli pertinenti per valutare accuratamente la proliferazione dell'ATP. Registra tutte le letture di luminescenza, i calcoli e le condizioni sperimentali per riferimento futuro.
NOTA: Per tutte le analisi biochimiche in kit, seguire il manuale o il protocollo del kit fornito dal produttore per dettagli specifici, come i tempi di incubazione consigliati, le concentrazioni e qualsiasi passaggio o considerazione aggiuntiva. Attenersi sempre alle linee guida di sicurezza del laboratorio quando si maneggiano sostanze chimiche e materiali biologici.
- In un ambiente sterile, miscelare 50 μL delle cellule recuperate con 50 μL del reagente ATP in ciascun pozzetto.
Risultati
Per valutare la morfologia e ispezionare visivamente la densità cellulare degli idrogel, è stata utilizzata la microscopia inversa (Figura 2). Gli ADSC hanno mantenuto una morfologia arrotondata 24 ore dopo la semina e l'esposizione al PBM. Le cellule erano sparse in tutto il gel come cellule singole o in grappoli simili a grappoli d'uva. La morfologia è rimasta invariata dopo 10 giorni nella coltura 3D. Non è stata notata alcuna differenza definitiva nella morfologia tra i gruppi sperim...
Discussione
Le ADSC sono un tipo di cellula ideale da utilizzare per la medicina rigenerativa in quanto stimolano vari processi per aiutare la guarigione delle ferite 3,4. Tuttavia, ci sono diverse sfide che devono essere aggirate, ad esempio gli scarsi tassi di sopravvivenza e l'attecchimento inefficace delle cellule in un sito di lesione9. Le cellule immortalizzate sono state utilizzate come linea cellulare disponibile in commercio, in quanto posson...
Divulgazioni
Gli autori dichiarano di non avere interessi contrastanti.
Riconoscimenti
Questa ricerca è stata finanziata dalla National Research Foundation of South Africa Thuthuka Instrument, numero di sovvenzione TTK2205035996; il Dipartimento di Scienza e Innovazione (DSI) ha finanziato l'African Laser Centre (ALC), numero di sovvenzione HLHA23X compito ALC-R007; il Consiglio delle Ricerche di Ateneo, bando numero 2022URC00513; l'iniziativa sudafricana delle cattedre di ricerca del Dipartimento di Scienza e Tecnologia (DST-NRF/SARChI), numero di sovvenzione 98337. Gli enti finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta, nell'analisi, nell'interpretazione dei dati o nella stesura del manoscritto. Gli autori ringraziano l'Università di Johannesburg (UJ) e il Laser Research Centre (LRC) per l'uso delle strutture e delle risorse.
Materiali
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Riferimenti
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon