Method Article
Liberación consistente de virus adenoasociados a través de la inyección lateral de la vena de la cola en ratones adultos
En este artículo
Resumen
Aquí detallamos un protocolo optimizado para la inyección de venas laterales de cola en ratones para administrar sistémicamente virus adenoasociados (AAV) en ratones adultos. Además, describimos los protocolos de los ensayos comúnmente utilizados para evaluar la transducción de AAV.
Resumen
Muchos trastornos afectan a múltiples órganos o involucran a diferentes regiones del cuerpo, por lo que es fundamental administrar terapias sistémicas para dirigirse a las células afectadas ubicadas en diferentes sitios. La inyección intravenosa es una vía de administración sistémica ampliamente utilizada en estudios preclínicos que evalúan tratamientos destinados a la administración en todo el cuerpo. En ratones adultos, implica la administración intravenosa del agente terapéutico en las venas laterales de la cola del ratón. Cuando se dominan, las inyecciones en las venas de cola son seguras y rápidas, y solo requieren herramientas simples y comúnmente disponibles. Sin embargo, las inyecciones en las venas de cola son técnicamente desafiantes y requieren una amplia capacitación y práctica continua para garantizar la administración precisa de la dosis prevista.
Aquí describimos un protocolo de inyección lateral de venas de cola detallado y optimizado que hemos desarrollado en base a nuestra experiencia y a las recomendaciones que habían sido reportadas previamente por otros grupos. Aparte de los retenedores para ratones y las jeringas de insulina, este protocolo solo requiere reactivos y equipos que están disponibles en la mayoría de los laboratorios. Descubrimos que seguir este protocolo da como resultado una administración intravenosa consistentemente exitosa del virus adenoasociado (AAV) en las venas de la cola de ratones no sedados de 7 a 9 semanas de edad. Además, describimos los protocolos optimizados para la detección histológica de proteínas indicadoras fluorescentes y la cuantificación del genoma vectorial por genoma diploide (vg/dg) utilizados para evaluar la transducción y biodistribución de AAV. El objetivo de este protocolo es ayudar a los experimentadores a realizar fácilmente inyecciones en las venas de cola con éxito y de manera consistente, lo que puede reducir el tiempo de práctica necesario para dominar la técnica.
Introducción
Los trastornos monogénicos constituyen el 80% de las enfermedades raras, que afectan colectivamente a 300 millones de personas en todo el mundo 1,2. Actualmente no existen terapias curativas aprobadas para la mayoría de estos trastornos raros muy debilitantes 1,2,3. Sin embargo, los trastornos monogénicos son candidatos ideales para terapias génicas que pueden reemplazar, complementar, corregir o silenciar genes disfuncionales 4,5. En la actualidad, se están desarrollando y utilizando múltiples vectores para administrar terapias génicas a tipos específicos de células 4,6. Uno de esos vectores es el virus adenoasociado (AAV). El AAV es un parvovirus no patógeno que se utiliza cada vez más como vector de terapia génica7. En comparación con otros vectores virales, el AAV tiene menor inmunogenicidad, menor potencial para integrarse en el genoma del huésped y la capacidad de transducir eficientemente células en división y no división en varios tejidos 7,8. Además, se han desarrollado múltiples enfoques para diseñar e identificar AAVs con características deseables como el tropismo tisular específico o una inmunogenicidad aún más reducida, lo que mejora en gran medida la versatilidad de AAV como vector viral para diferentes indicaciones9. Estos factores han convertido al AAV en un vector de terapia génica ampliamente investigado y han llevado al desarrollo de múltiples terapias génicas basadas en AAV aprobadas por la FDA10.
Los modelos de ratón se utilizan habitualmente para probar posibles terapias génicas in vivo y comprender mejor los mecanismos patológicos de los trastornos monogénicos. Esto se debe a la recapitulación de las patologías de diferentes condiciones en los modelos de ratón, a la similitud de su genoma con el genoma humano y a la relativa facilidad de manejo, mantenimiento y generación de ratones 11,12,13. Las pruebas in vivo son particularmente importantes cuando se estudian trastornos que afectan a múltiples sistemas o regiones del cuerpo, como las distrofias musculares. Para estos trastornos, las pruebas in vitro podrían no ser suficientes para evaluar de manera integral la seguridad, la eficacia, la farmacocinética y la farmacodinámica de las terapias destinadas a llegar a diferentes regiones del cuerpo después de la administración sistémica14.
Se pueden utilizar varias vías de administración sistémica para administrar fármacos. Cada ruta tiene sus ventajas, inconvenientes y grado de compatibilidad con el modelo animal y el fármaco que se investiga15. La inyección intravenosa (IV) en la vena lateral de la cola es una vía comúnmente utilizada para la administración sistémica de AAV en ratones16. Las inyecciones laterales en las venas de la cola permiten la administración rápida y directa del inyectado en el torrente sanguíneo del ratón, lo que garantiza una alta biodisponibilidad del fármaco en la circulación sistémica17. También requieren herramientas relativamente simples y comúnmente disponibles para ser realizados. Sin embargo, debido principalmente al pequeño diámetro de la vena de cola y a la dificultad de localización de la vena, las inyecciones laterales de la vena de cola son técnicamente desafiantes y requieren un alto grado de habilidad y práctica constante para evitar intentos fallidos de inyección o una administración incompleta de la dosis 16,17,18,19. Esto puede resultar en la pérdida de reactivos costosos o resultados inexactos, especialmente si la inyección incompleta no se reconoce mientras se realiza la inyección. Nuestra experiencia resumida aquí se basa en protocolos informados en artículos bien documentados que hemos adaptado para nuestro uso, optimizando varios pasos del procedimiento de inyección de la vena lateral de la cola para garantizar inyecciones consistentemente exitosas 20,21,22,23,24,25,26,27.
Aquí, describimos este protocolo detallado y optimizado de inyección de venas laterales de cola para administrar AAV en ratones no sedados de 7 a 9 semanas de edad utilizando herramientas simples y comúnmente disponibles. Además, proporcionamos los protocolos de los métodos utilizados para evaluar la entrega y biodistribución de AAV. Estos protocolos cubren la recolección de tejido posterior a la inyección, la fijación de tejidos, la extracción de ADN y la cuantificación del genoma vectorial de la reacción en cadena de la polimerasa digital (dPCR) por genoma diploide (vg/dg). El protocolo de inyección intravenosa y los indicadores proporcionados aquí tienen como objetivo mejorar la facilidad de realizar con éxito las inyecciones de las venas laterales de la cola. Esto potencialmente ayudará a reducir el tiempo necesario para dominar las habilidades de inyección y, al mismo tiempo, mejorará la precisión y la consistencia de las inyecciones.
Protocolo
Todos los procedimientos de manejo e inyección de animales fueron aprobados por el Comité de Cuidado de Animales del NINDS. Todos los procedimientos con animales se llevaron a cabo de acuerdo con las pautas de cuidado y uso de animales del NINDS.
1. Preparación previa a la inyección
- Preparación de la dosis de AAV
- Determine el peso promedio de los ratones que serán inyectados.
- Calcule el volumen máximo permitido de inyectar de acuerdo con las pautas de cuidado animal de la institución, como se muestra en la ecuación (1). El volumen máximo de inyección suele ser un valor de volumen (μL)/peso del ratón (g) (por ejemplo, 10 μL/g.).
Volumen máximo de inyección (μL)/ratón= (volumen máximo de inyección (μL/g)) × (peso medio del ratón (g)) (1)
NOTA: Cálculo de la muestra: Volumen máximo de inyectado/ratón= 10 μL/g × 20 g/ratón= 200 μL/ratón - Establezca la dosis del genoma vectorial (vg) de AAV que se administrará por ratón.
NOTA: Este podría ser el mismo valor absoluto en diferentes ratones (por ejemplo, todos los ratones reciben 1,5 × 1012 vg, independientemente de cuánto pese cada ratón). O bien, la dosis puede estar en vg/kg, por lo que el total de vg que se inyectará por ratón debe calcularse para cada ratón de acuerdo con el peso de ese ratón el día de la inyección.- Si la dosis es en vg/kg, pesar cada ratón el día de la inyección antes de la preparación de la dosis.
- Calcule los genomas vectoriales que se entregarán para cada ratón de acuerdo con su peso utilizando la ecuación (2):
Genomas vectoriales que se entregarán en un ratón específico (vg) = Valor preespecificado de vg/kg (vg/kg) ×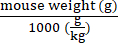 (2)
(2)
NOTA: El uso de vg/kg como unidad de dosis en lugar de vg/ratón podría ser más apropiado en ciertos estudios preclínicos para garantizar comparaciones válidas entre las dosis inyectadas. Esto se debe a las diferencias de peso entre ratones machos y hembras de la misma edad o posiblemente entre ratones del mismo sexo. - Utilícese el volumen máximo de inyección y la dosis de AAV (vg) para calcular los volúmenes de AAV en stock y solución salina estéril tamponada con fosfato (PBS) que se necesitan para preparar la dosis requerida (véanse las ecuaciones (3-6)). Asegúrese de que el volumen a inyectar sea igual o inferior al volumen máximo de inyección permitido. Prepare siempre un volumen de inyección que sea al menos 15 μL mayor que el volumen que se inyectará para tener en cuenta los errores de pipeteo y el espacio muerto de la jeringa.
Concentración de inyectado (vg/μL) =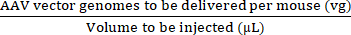 (3)
(3)
Total de genomas de vectores AAV que deben añadirse para preparar el inyectado (vg) = Concentración de inyectado (vg/μL) × volumen que debe prepararse (μL) (4)
Volumen de caldo de AAV que debe añadirse para preparar el inyectado) (μL) =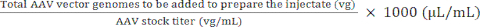 (5)
(5)
Volumen de PBS que debe añadirse para preparar el inyectado (μL) = Volumen que debe prepararse (μL) - Volumen de material de AAV que debe añadirse para preparar el inyectado (μL) (6)
NOTA: Ejemplo de cálculo:
6 × 1013 vg/kg (la dosis) se administrará en 200 μL/ratón (el volumen a inyectar) en un ratón que pese 25 g. El título de stock de AAV es de 3,0 × 1013 (vg/mL)
Genomas vectoriales que se entregarán en este ratón específico (vg) = 6 × 1013 (vg/kg) ×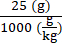 = 1,5 × 1012 vg para este ratón
= 1,5 × 1012 vg para este ratón
Concentración de inyectado=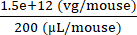 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Total de genomas de vectores AAV que deben añadirse para preparar la inyección = 7,5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1,6125 ×10 12 (vg)
Volumen de stock de AAV que debe añadirse para preparar el inyectado =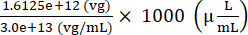 = 53,75 (μL)
= 53,75 (μL)
Volumen de PBS que debe añadirse para preparar el inyectado = 215 (μL) - 53,75 (μL) = 161,25 (μL)
- Procedimiento de preparación de la dosis de AAV
NOTA: Siguiendo las pautas de bioseguridad y EPP de la institución para el manejo de AAV, en un tubo de microcentrífuga estéril de 1,7 mL sin RNasa y sin DNasa esterilizado en autoclave, prepare la inyección de AAV utilizando el stock de AAV y PBS estéril de acuerdo con los cálculos del paso 1.1.3.3. Mantenga siempre el AAV de stock y el AAV inyectado en hielo. Utilice micropipetas limpias y nuevas cajas de puntas de micropipeta para garantizar la esterilidad. Deseche las puntas de micropipeta contaminadas con AAV de acuerdo con las pautas de gestión de residuos de la institución.- Descongele el AAV original con hielo.
NOTA: Evite descongelar y volver a congelar el stock de AAV. Pida o prepare el stock de AAV en alícuotas de 100-200 μL para evitar tener un exceso de AAV después de la preparación de la dosis que tendrá que volver a congelarse.
- Descongele el AAV original con hielo.
- Preparación de la estación de inyección
- Limpieza
- Limpie el área de trabajo con etanol (EtOH) al 70%.
- Desinfecte el área de trabajo con reactivos bactericidas, fungicidas y virucidas.
- Limpie el sujetador del tubo del ratón con agua y jabón.
- Configuración de las herramientas de la estación
- Coloque un tubo cónico limpio y vacío de 15 ml en un soporte/rejilla para tubos.
- Coloque una plataforma elevada en la que se colocará el sujetador del tubo del ratón (Figura 1A, B).
- Coloque el sujetador de tubo de ratón limpio en el área de trabajo.
- Si inyecta ratones que son mucho más pequeños que el tubo de retención de ratón disponible, use un cono de plástico para roedores para hacer una funda de restricción. Consulte los pasos 2.1.3-4.
- Coloque las jeringas que se utilizarán para las inyecciones en el área de trabajo. Utilice jeringas de insulina de 0,3 ml con agujas de 29 g.
- Coloque el contenedor de residuos lo más cerca posible de la estación de inyección para permitir la eliminación inmediata de las herramientas contaminadas con AAV.
- Tire y empuje el émbolo de cada jeringa varias veces para asegurarse de que el émbolo se mueva suavemente para que no haya resistencia causada por la jeringa durante la inyección. Si el émbolo no se mueve suavemente, deseche esta jeringa y reemplácela por una nueva.
- Tenga una báscula de ratón y una mini centrífuga disponibles junto al área de inyección.
- Tenga listo el AAV preparado en hielo en el área de inyección.
- Prepare agua tibia (38-40 °C). Tenga cuidado de que la temperatura del agua no supere los 40 °C para evitar causar quemaduras en la cola del ratón.
- Limpieza
2. Procedimiento de inyección
- Restricción del ratón
- Pesar cada ratón para calcular la dosis en vg/kg si es necesario.
- Asegúrese de que el mouse esté completamente sujeto y no pueda moverse.
NOTA: Si el ratón no está completamente sujeto, podría moverse durante la administración intravenosa, lo que provocaría el desplazamiento de la aguja. Esto puede hacer que la aguja se salga de la vena y/o lesione al ratón. - Para el retenedor de tubo:
- Lave el protector con agua tibia y jabón entre ratones para limpiar y calentar el soporte.
- Sostén el ratón por la cola. Inserta la cola del ratón en la abertura superior del tubo; Luego, tire lentamente del mouse en el sujetador de tubos. Si el tamaño del sujetador de tubo es adecuado para el tamaño del ratón, coloque el tapón delante del ratón para evitar que el ratón se escape.
NOTA: El enchufe debe estar lo suficientemente cerca del mouse para evitar que el mouse se mueva o gire dentro del tubo, pero el enchufe no debe obstruir la nariz del mouse para permitir que el mouse respire libremente. Si el ratón es más pequeño que el tamaño del sistema de retención del tubo, utilice un cono de restricción desechable flexible además del sistema de retención del tubo, como se describe a continuación en el paso 2.1.4.
- Para los conos de sujeción desechables flexibles si es necesario (para hacer una funda de sujeción para ratones más pequeños):
- Haz un corte en el extremo de la nariz del cono para asegurarte de que la nariz del ratón no esté obstruida y que tenga suficiente espacio para respirar.
- Corte la parte posterior del cono de modo que el cono tenga casi la misma longitud que el ratón (para que el cono quepa dentro del tubo) (Figura 1A, B).
- Coloque el ratón en el sujetador de tubos como se describe anteriormente en los pasos 2.1.3. Mientras sostiene la cola del ratón, inserte primero el cono de restricción con el lado de apertura más ancho en el tubo.
- Mientras sostienes la cola del ratón, deja que el ratón camine hacia el cono; Luego, desliza el resto del cono dentro del tubo. Asegúrate de que la cola del ratón esté completamente fuera de la parte posterior del tubo y que el ratón tenga espacio para respirar dentro del cono.
- Asegure el tapón del tubo inmediatamente frente a la abertura de la nariz del cono mientras se asegura de que el mouse esté completamente sujeto y tenga suficiente espacio para respirar.
- Inyectar el ratón
- Llene el tubo cónico de 15 ml con agua tibia.
- Coloque el sujetador de tubo con el ratón dentro de él en la plataforma elevada (Figura 1B).
- Sumerja tanto como sea posible de la cola del ratón sujeta en el agua tibia durante al menos 1 minuto hasta que las venas laterales estén claramente dilatadas y visibles (Figura 1B).
- Durante el paso de calentamiento de la cola, cargue la dosis de AAV en la jeringa.
- Coloque el tubo de microcentrífuga de 1,7 mL sin tapar que contiene AAV en una rejilla para tubos. Inserte la aguja verticalmente en el tubo con la mano dominante. Una vez que la aguja esté dentro del tubo, sostenga el tubo con la mano no dominante.
NOTA: La inserción vertical de la aguja evita daños a la aguja que podrían ser causados por el contacto con la pared del tubo. Se pueden utilizar otros métodos alternativos de carga de jeringas, pero se debe garantizar la seguridad del experimentador y del ratón inyectado. Sujetar el tubo con la mano no dominante protege contra lesiones accidentales por punción de la aguja si la aguja se inserta mientras se sostiene el tubo. - Con la aguja dentro del tubo, levante el tubo y la jeringa simultáneamente a la altura de los ojos mientras se asegura de que la aguja no toque la pared del tubo. Apoya ambos brazos sobre la mesa para estabilizarlos. Introduzca lentamente la dosis en la jeringa.
NOTA: La aspiración lenta evita que las burbujas de aire finas se adhieran a los lados del cilindro de la jeringa. - Expulse las burbujas de aire de la jeringa. Si inyecta AAV, asegúrese de que las burbujas de aire sean expulsadas de la jeringa sobre una almohadilla absorbente desechable que se desechará en una caja de riesgo biológico.
- Mantenga la inyección durante al menos 40 segundos para calentarla.
NOTA: Asegúrese siempre de que la inyección esté tibia antes de la inyección. Si se administra una inyección fría, es posible que la inyección no fluya a través de la vena, excepto los primeros μL. - Revisa las venas de la cola cada minuto.
NOTA: Las venas deben ser MUY visibles hasta el sitio de la inyección (agregue tiempo de calentamiento de la cola y reemplácelo con agua tibia fresca según sea necesario hasta que la vena sea claramente visible, pero sin exceder el tiempo de restricción del ratón permitido por el protocolo de manejo de animales de la institución). - Después de asegurarse de que las venas sean claramente visibles, retire el sujetador de tubo de la parte superior de la plataforma elevada y colóquelo directamente sobre la mesa. Coloque el ratón en el sujetador con los pies hacia abajo y no hacia los lados para facilitar el manejo de la cola.
NOTA: El mouse no debe estar de lado o hacia atrás dentro del restricción. El ratón debe estar completamente sujeto, y no puede moverse o girar dentro del sujetador ni mover/tirar de su cola. - Limpie rápidamente la cola con una gasa para secar la cola; Limpie la cola con un hisopo con alcohol y luego séquela con una gasa seca.
NOTA: Use una gasa seca para que la cola esté lo suficientemente seca como para permitir un agarre seguro de la cola, pero no completamente seca. Puede ser más difícil ver la vena cuando la cola está completamente seca. - Gira la cola aproximadamente 90° hacia la izquierda o hacia la derecha para que una de las dos venas laterales quede hacia arriba. Ubique un sitio de inyección adecuado dentro del tercio medio de la cola. Inicie la inyección inicial distalmente (más cerca de la punta de la cola) y muévase proximalmente si se requieren inyecciones adicionales debido a intentos fallidos o si el diseño experimental lo requiere.
NOTA: No intente inyectar distal a un sitio de inyección anterior, ya que la inyección podría filtrarse fuera de ese sitio de inyección anterior. Opcional: utilice el pulgar y el índice de la mano no dominante para aplicar presión proximal (aguas arriba/más cerca del cuerpo del ratón) en el lugar de la inyección durante 10 s. Los dedos actúan como torniquetes para dilatar aún más la vena en el lugar de la inyección. Inmediatamente después del torniquete de 10 s, suelte los dedos del torniquete y asegúrese de que una de las dos venas laterales esté hacia arriba y sea claramente visible. - Sujete la cola con la mano no dominante utilizando el pulgar y el índice inmediatamente distales al lugar de la inyección. Doble la cola sobre el dedo índice para que el sitio de la inyección quede plano sobre el dedo índice. Tire hacia atrás de la cola para que la cola quede estirada y el sitio de inyección esté completamente horizontal (a 0°) (paralelo a la mesa horizontal) (Figura 1C).
- Sostenga la jeringa con los dedos índice y medio de la mano dominante a cada lado del reborde del cilindro de la jeringa mientras mantiene el pulgar listo en el émbolo.
NOTA: Esto hará que sea más fácil no mover el pulgar o la aguja una vez que la aguja esté dentro de la vena (Figura 1C). - Apoye ambas manos sobre la mesa para estabilizarlas y coloque la aguja directamente sobre y paralela a la cola y la vena con el bisel hacia arriba. Mantenga el sitio de inyección cerca del dedo índice que sostiene la cola para mejorar el control y la estabilidad del sitio de inyección.
NOTA: El sujetador del tubo debe estar lo suficientemente profundo en la mesa para que ambas manos estén apoyadas en la mesa. - Mientras mantiene la aguja paralela a la vena de la cola y aplica presión hacia abajo sobre la aguja, deslice la aguja hacia adelante en la vena.
NOTA: La presión hacia abajo debe ser suficiente para insertar la aguja en el ángulo correcto en la vena. La vena es extremadamente poco profunda, por lo que la aguja debe ser lo más plana posible cuando se intente entrar en la vena. - Inyecte lentamente la solución en la vena. Después de administrar la dosis, retire lentamente la aguja e inmediatamente aplique presión con una gasa en el lugar de la inyección durante al menos 10 segundos para detener el sangrado.
NOTA: Aplique la presión todo el tiempo que sea necesario hasta que el sangrado se haya detenido por completo para evitar la posible pérdida del reactivo inyectado. Por lo general, aparece una gota de sangre después de retirar la aguja, lo que indica que la aguja ha penetrado en la vena. En ocasiones, la gota de sangre no aparece incluso con una inyección exitosa. La gota de sangre no indica que la inyección sea exitosa; solo indica que la aguja penetró en la vena. El indicador fiable de éxito de la inyección es la ausencia total de resistencia del émbolo durante la inyección. Si la aguja está dentro de la vena, no debe haber resistencia en el émbolo de la aguja durante la inyección del inyecto, y la vena proximal al sitio de inyección aparecerá momentáneamente de un color ligeramente más claro (blanqueamiento) (el blanqueamiento de la vena puede no ser muy claro en algunas cepas de ratón). Si hay resistencia y/o comienza a aparecer una protuberancia en el lugar de la inyección, entonces la aguja no está colocada correctamente dentro de la vena. Si esto ocurre, retire completamente la aguja de la cola e intente inyectar la vena en un nuevo sitio de inyección proximal al sitio de inyección fallido (más cerca del cuerpo del ratón). - Deseche las jeringas y tubos contaminados con AAV de acuerdo con las pautas de manejo de desechos de la institución.
- Libere al ratón de los grilletes y colóquelo de nuevo en una nueva jaula separada de los ratones no inyectados. Monitoree los ratones durante 10 minutos para garantizar niveles normales de actividad después de la inyección.
NOTA: Esto evita la posible transmisión de agentes inyectables a ratones no inyectados si se administran agentes transmisibles. - Desinfecte el área de trabajo con reactivos bactericidas, fungicidas y virucidas y EtOH al 70%. Limpie el sujetador del tubo del ratón con agua y jabón.
- Coloque el tubo de microcentrífuga de 1,7 mL sin tapar que contiene AAV en una rejilla para tubos. Inserte la aguja verticalmente en el tubo con la mano dominante. Una vez que la aguja esté dentro del tubo, sostenga el tubo con la mano no dominante.
3. Disección y recolección y fijación de tejidos27
- Preparación de la estación de recolección de tejidos
- Limpie la estación de trabajo con un reactivo de degradación de ADN de acuerdo con las instrucciones del fabricante para degradar el ADN contaminante que pueda estar presente en el área de trabajo.
- Coloque el metilbutano en un recipiente de metal. Coloque el recipiente de metal de metilbutano dentro de una caja de espuma de poliestireno; Luego, rodee el recipiente de metal con hielo seco para que el nivel de hielo seco que rodea el recipiente sea más alto que el nivel de metilbutano dentro del recipiente.
- Etiquete y coloque los tubos vacíos de almacenamiento de tejido de microcentrífuga de 2 ml sobre el hielo seco. Deje que los tubos de almacenamiento de metilbutano y tejidos se enfríen en hielo seco durante al menos 20 minutos antes de comenzar a congelar los tejidos. Coloque pinzas de transferencia de tejido sobre hielo seco.
- Etiquete y llene otro juego de tubos de almacenamiento de tejidos de microcentrífuga de 2 ml con paraformaldehído (PFA) fresco al 4% y manténgalos a temperatura ambiente. Agregue suficiente PFA al 4% a cada tubo para sumergir completamente los tejidos que se colocarán en el tubo.
- Recolección y fijación de tejidos
- Eutanasiar al ratón de acuerdo con las pautas de cuidado animal de la institución.
NOTA: Aquí, los ratones fueron sacrificados utilizando la dislocación cervical. - Rocíe completamente el mouse con 70% de EtOH.
- Recoja los pañuelos necesarios.
NOTA: El protocolo de recolección y fijación descrito aquí se probó en los músculos esqueléticos y el hígado. - En el caso de los tejidos que se utilizarán para la extracción de ADN:
- Deje caer el tejido en metilbutano preenfriado sobre hielo seco y deje el tejido en metilbutano durante al menos 1 minuto. Utilice las pinzas de transferencia preenfriadas para transferir los tejidos congelados del metilbutano a los tubos de almacenamiento de tejidos de microcentrífuga vacíos de 2 ml preenfriados. Almacene el pañuelo a -80 °C.
NOTA: Opcional: El tejido se puede cortar en trozos de 20 mg antes de sumergirlo en metilbutano para que esté listo para ser utilizado en el paso 4.1.4.
- Deje caer el tejido en metilbutano preenfriado sobre hielo seco y deje el tejido en metilbutano durante al menos 1 minuto. Utilice las pinzas de transferencia preenfriadas para transferir los tejidos congelados del metilbutano a los tubos de almacenamiento de tejidos de microcentrífuga vacíos de 2 ml preenfriados. Almacene el pañuelo a -80 °C.
- En el caso de los tejidos que se utilizarán para el análisis histológico y para preservar la fluorescencia de las proteínas reporteras:
- Usando una pinza designada para PFA que se mantiene a temperatura ambiente, coloque los tejidos en su respectivo tubo de microcentrífuga que contiene un 4% de PFA (mantenido a temperatura ambiente) mientras se asegura de que el tejido esté completamente sumergido en la solución de PFA al 4%.
NOTA: La contaminación por PFA puede afectar negativamente a diferentes ensayos moleculares posteriores. Solo use pinzas designadas para PFA cuando manipule PFA para evitar la contaminación de PFA de otros tejidos o herramientas. - Coloque los tubos de la microcentrífuga en una rejilla y cúbrala con papel de aluminio para mantener los tubos en la oscuridad. Incubar la rejilla cubierta a 4 °C en una coctelera agitando suavemente durante la noche.
- Después de la incubación durante la noche, prepare sacarosa al 5% (% p/v) en 1x PBS disolviendo 5,0 g. de sacarosa en 70 mL de 1x PBS agitando vigorosamente. Agregue suficiente 1x PBS a un volumen total final de 100 mL para lograr una solución de sacarosa al 5% (% p/v).
- Esterilice la solución de sacarosa al 5% con el filtro de jeringa de 0,22 μm. Etiquete y llene los tubos de microcentrífuga de 2,0 ml con sacarosa al 5% recién preparada.
- Transfiera los tejidos de PFA al 4% a su respectivo tubo de microcentrífuga que contiene un 5% de sacarosa (mantenido a temperatura ambiente) mientras se asegura de que el tejido esté completamente sumergido en la solución de sacarosa al 5%.
- Coloque los tubos de la microcentrífuga en una rejilla y cúbrala con papel de aluminio para mantener los tubos en la oscuridad. Incubar la rejilla cubierta a 4 °C en una coctelera agitando suavemente durante la noche.
- Después de la incubación durante la noche, prepare sacarosa al 20% (% p/v) en 1x PBS disolviendo 20,0 g. de sacarosa en 70 mL de 1x PBS agitando vigorosamente. Agregue suficiente 1x PBS a un volumen total final de 100 mL para lograr una solución de sacarosa al 20% (% p/v).
- Esterilice la solución de sacarosa al 20% con un filtro de jeringa de 0,22 μm. Etiquete y llene los tubos de microcentrífuga de 2,0 ml con sacarosa al 20% recién preparada.
- Transfiera los tejidos de sacarosa al 5% a su respectivo tubo de microcentrífuga que contiene un 20% de sacarosa (mantenida a temperatura ambiente) mientras se asegura de que el tejido esté completamente sumergido en la solución de sacarosa al 20%.
- Coloque los tubos de la microcentrífuga en una rejilla y cúbrala con papel de aluminio para mantener los tubos en la oscuridad. Incubar la rejilla cubierta a 4 °C en una coctelera agitando suavemente durante la noche.
- Después de la incubación durante la noche, coloque el metilbutano en un recipiente de metal y coloque el recipiente de metal de metilbutano dentro de una caja de espuma de poliestireno. Rodee el recipiente de metal con hielo seco para que el nivel de hielo seco que rodea el recipiente sea más alto que el nivel de metilbutano dentro del recipiente.
- Etiquete y coloque los tubos vacíos de almacenamiento de tejido de microcentrífuga de 2 ml sobre hielo seco. Deje que los tubos de almacenamiento de metilbutano y tejidos se enfríen en hielo seco durante al menos 20 minutos antes de comenzar a congelar los tejidos. Coloque pinzas de transferencia sobre hielo seco.
- Seque rápidamente los pañuelos con toallitas de precisión para eliminar el exceso de sacarosa al 20%. Deje caer el tejido en metilbutano preenfriado sobre hielo seco. Deje el tejido en metilbutano durante al menos 1 minuto.
- Utilice las pinzas de transferencia preenfriadas para transferir los tejidos congelados del metilbutano a los tubos de almacenamiento de tejidos de microcentrífuga vacíos de 2 ml preenfriados. Almacene el pañuelo a -80 °C.
- Usando una pinza designada para PFA que se mantiene a temperatura ambiente, coloque los tejidos en su respectivo tubo de microcentrífuga que contiene un 4% de PFA (mantenido a temperatura ambiente) mientras se asegura de que el tejido esté completamente sumergido en la solución de PFA al 4%.
- Eutanasiar al ratón de acuerdo con las pautas de cuidado animal de la institución.
4. dPCR para la cuantificación de vg/dg
- Extracción de ADN de los tejidos y digestión inicial del ARN
NOTA: El manual del kit de extracción de ADN que figura en la Tabla de Materiales se utilizó para derivar este protocolo de extracción de ADN. Mantenga siempre los tubos que contienen los trozos de tejido congelados sobre hielo seco.- Prepara un cubo de hielo.
- Para cada muestra de ADN, etiquete un tubo de perlas de lisis de 1,5 mL y dos tubos de microcentrífuga vacíos sin RNasa y sin DNasa de 1,7 mL.
- Añada 180 μL del primer tampón del kit de extracción de ADN a cada tubo de perlas. Tara el primer tubo de perlas que contiene tampón.
NOTA: Si los pañuelos no fueron precortados en el paso 3.2.4.1, use una cuchilla de afeitar previamente enfriada en hielo seco para cortar el pañuelo en trozos de 20 mg. Este paso debe realizarse dentro de un criostato limpio mantenido a -20 °C o más frío. - Agregue un pedazo de pañuelo en el tubo; Pesar y registrar el peso del tejido (que sea ~20 mg.).
- Coloque inmediatamente el tubo de perlas de lisis con el tejido en él sobre hielo. El búfer podría cristalizarse.
- Repita los pasos anteriores para cada muestra de tejido.
- Transfiera los tubos a la mezcladora de tubos de bolas de lisis y hágalos funcionar durante 1 min a velocidad máxima (velocidad 10) a 4 °C.
- Coloque las muestras en hielo para transferirlas a la centrífuga. Centrifugar durante 1 min a 20.000 × g a 4 °C.
- Durante la etapa de centrifugación, agregue 20 μL de proteinasa K a la primera serie de tubos de microcentrífuga de 1,7 mL. Después de la etapa de centrifugación, transfiera el sobrenadante de los homogeneizados a los tubos de 1,7 mL que contienen la proteinasa K y mezcle bien. Incubar a 56 °C durante 15 min, con una mezcla de 500 RPM.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Incubar a temperatura ambiente durante 2 min.
- Añadir 4 μL de RNasa A y mezclar mediante un breve vórtice de pulsos. Incubar a temperatura ambiente durante 2 min. Vórtice de pulso durante 15 s.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Añadir 200 μL del segundo tampón del kit de extracción de ADN. Vórtice de pulso durante 15 s.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Añadir 200 μL de EtOH al 100%. Vórtice de pulso durante 15 s.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Transfiera los lisados a la columna de centrifugación de extracción de ADN. Centrifugar a 6.000 × g durante 1 min.
- Coloque la columna de centrifugación en un nuevo tubo de recolección. Añada 500 μL del tercer tampón del kit de extracción de ADN a la columna de centrifugación. Girar a 6.000 × g durante 1 min.
- Coloque la columna de centrifugación en un nuevo tubo de recolección. Añada 500 μL del cuarto tampón del kit de extracción de ADN a la columna de centrifugación. Centrifugar a 20.000 × g durante 3 min.
- Coloque la columna de centrifugación en un nuevo tubo de microcentrífuga de 1,7 ml. Agregue 100 μL de agua de grado molecular a la columna de centrifugación. Incubar a temperatura ambiente durante 1 min. Centrifugar a 6.000 × g durante 1 min a temperatura ambiente.
- Mida la concentración de ADN si es necesario. Almacenar a 4 °C para almacenamiento a corto plazo o a -20 °C para almacenamiento a largo plazo.
- Extracción de ADN de células clasificadas por FACS
NOTA: El manual del kit de extracción de ADN que figura en la Tabla de Materiales se utilizó para derivar este protocolo de extracción de ADN.- Después de clasificar las células, centrifugue las muestras a 300 × g durante 5 s para recoger todas las gotas de los lados y la tapa. Asegúrese de recoger todas las gotas.
NOTA: Si el volumen de la muestra es inferior a 1,5 ml, continúe directamente con el siguiente paso. Si el volumen de la muestra es superior a 1,5 mL, retire con cuidado y deseche la parte superior del sobrenadante con una micropipeta, dejando 1-1,5 mL de la muestra. - Mezcle la muestra pipeteando hacia arriba y hacia abajo varias veces y transfiera la muestra a un tubo de microcentrífuga de 1,7 mL. Centrifugar a 515 × g durante 1 min a temperatura ambiente.
- Deseche el sobrenadante a excepción de los últimos 50 μL. Vuelva a suspender el pellet en 50 μL del primer tampón del kit de extracción de ADN para un volumen final de 100 μL.
- Siga el protocolo del fabricante para el aislamiento de ADN genómico a partir de pequeños volúmenes de sangre (ver Tabla de Materiales).
- Añadir 10 μL de proteinasa K y 100 μL de segundo tampón del kit de extracción de ADN; Mezclar por pulso-vórtice durante 15 s. Incubar las muestras a 56 °C durante 10 min mezclando a 300 RPM. Mezcle las muestras dos veces mediante una inversión suave durante este período de incubación.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Añadir 50 μL de EtOH al 100% y mezclar por pulso-vórtice durante 15 s. Incubar las muestras a temperatura ambiente durante 5 min.
- Recoja las gotas de las paredes y la tapa del tubo centrifugando el tubo durante 1-2 s con una mini centrífuga. Transfiera las muestras a la columna de extracción de ADN (la columna está en un tubo de recolección de 2 mL) sin mojar el borde. Centrifugar a 6.000 × g durante 1 min.
- Después de colocar la columna en un tubo de recolección limpio de 2 mL, deseche el tubo de recolección que contiene el flujo. Añadir 500 μL del tercer tampón del kit de extracción de ADN a la columna sin mojar el borde y centrifugar a 6.000 × g durante 1 min.
- Nuevamente, después de colocar la columna en un tubo de recolección limpio de 2 mL, deseche el tubo de recolección que contiene el flujo. Añadir 500 μL del cuarto tampón del kit de extracción de ADN a la columna sin mojar el borde y centrifugar a 6.000 × g durante 1 min.
- Coloque la columna en un tubo colector limpio de 2 ml y deseche el tubo colector que contiene el flujo. Centrifugar a 20.000 × g durante 3 min.
- Coloque la columna en un tubo de microcentrífuga limpio de 1,7 ml y deseche el tubo de recolección que contiene el flujo. Agregue 20 μL de agua de grado molecular al centro de la membrana de la columna para la elución; Cierre la tapa e incube las muestras con agua de grado molecular a temperatura ambiente durante 5 min.
- Centrifugar a 20.000 × g durante 1 min. Almacene el ADN eluido a 4 °C para almacenamiento a corto plazo o a -20 °C para almacenamiento a largo plazo.
- Después de clasificar las células, centrifugue las muestras a 300 × g durante 5 s para recoger todas las gotas de los lados y la tapa. Asegúrese de recoger todas las gotas.
- Digestión y limpieza de ARN
NOTA: El manual del kit de extracción de ADN que figura en la Tabla de Materiales se utilizó para derivar este protocolo de limpieza de ADN. Dependiendo de las condiciones de dPCR, los reactivos y los diseños de cebadores y sondas, puede ser necesario garantizar la ausencia completa de ARN en la muestra de ADN antes de proceder a la cuantificación de dPCR vg/dg. La contaminación por ARN puede dar lugar a varios grados de valores vg/dg inexactos en determinadas condiciones de dPCR.- En un tubo de PCR de 0,2 ml o en un tubo de microcentrífuga de 1,7 ml, añada como máximo 20 μl de la muestra de ADN extraída y 1,5 μl de la RNasa libre de DNasa a cada muestra de ADN. Si el volumen de la mezcla de ADN/ARNasa es inferior a 21,5 μL, añada suficiente agua de grado molecular hasta un volumen final de 21,5 μL y mezcle 25 veces invirtiendo los tubos. Incubar a 37 °C durante 30 min con mezclas periódicas cada 10 min invirtiendo los tubos.
NOTA: La cantidad total de ácidos nucleicos añadidos al tubo debe estar entre 175 ng y 700 ng. Es posible que sea necesario realizar modificaciones si las muestras de ADN contienen volúmenes o cantidades de ácidos nucleicos fuera de este rango o si las muestras de ADN se aislaron de manera diferente. - Coloque sobre hielo durante 2 min. Agregue suficiente agua de grado molecular a cada mezcla de ADN/RNasa hasta un volumen final de 100 μL.
NOTA: Se recomienda la RNasa enumerada aquí, ya que digiere el ARN contaminante sin afectar negativamente al ADN objetivo ni a los ensayos de PCR posteriores. - Siga el protocolo del fabricante para la limpieza del ADN genómico (consulte la tabla de materiales).
- Agregue 10 μL del primer tampón del kit de extracción de ADN y 250 μL del segundo tampón del kit de extracción de ADN. Mezclar por pulso-vórtice durante 10 s.
- Transfiera las muestras a la columna de extracción de ADN en un tubo de recolección de 2 ml sin mojar el borde. Centrifugar a 6.000 × g durante 1 min.
- Después de colocar la columna en un tubo de recolección limpio de 2 mL, deseche el tubo de recolección que contiene el flujo. Añada 500 μL del segundo tampón del kit de extracción de ADN a la columna sin mojar el borde. Centrifugar a 6.000 × g durante 1 min.
- Coloque la columna en un tubo colector limpio de 2 ml y deseche el tubo colector que contiene el flujo. Centrifugar a 20.000 × g durante 6 min.
- Coloque la columna en un tubo de microcentrífuga limpio de 1,7 ml y deseche el tubo de recolección que contiene el flujo. Agregue 20 μL de agua de grado molecular al centro de la membrana de la columna para la elución, cierre la tapa e incube las muestras con agua de grado molecular a temperatura ambiente durante 5 min.
- Centrifugar a 20.000 × g durante 1 min. Almacenar a 4 °C para almacenamiento a corto plazo o a -20 °C para almacenamiento a largo plazo.
- Confirme la ausencia de contaminación por ARN en la muestra digerida por ARNasa con PCR o dPCR de punto final o PCR cuantitativa (qPCR) utilizando un par de cebadores de PCR que amplificarían una región de ARNm que abarca múltiples exones y no solo un exón.
NOTA: El objetivo de ARNm debe ser de un gen altamente expresado en el tejido/tipo de célula objetivo para garantizar que la contaminación por ARNm se identifique correctamente si está presente. Los amplicones que abarcan múltiples exones diferencian entre las bandas resultantes de la contaminación del ARNm y el ADN genómico. Tenga siempre una muestra de ADN digerida sin ARNasa como control positivo para la reacción de PCR para asegurarse de que se detectará la contaminación por ARNm si está presente.
- En un tubo de PCR de 0,2 ml o en un tubo de microcentrífuga de 1,7 ml, añada como máximo 20 μl de la muestra de ADN extraída y 1,5 μl de la RNasa libre de DNasa a cada muestra de ADN. Si el volumen de la mezcla de ADN/ARNasa es inferior a 21,5 μL, añada suficiente agua de grado molecular hasta un volumen final de 21,5 μL y mezcle 25 veces invirtiendo los tubos. Incubar a 37 °C durante 30 min con mezclas periódicas cada 10 min invirtiendo los tubos.
- PCR digital (dPCR)
- PCR de punto final para comprobar la especificidad de los cebadores y las condiciones óptimas de PCR (opcional)
- Diseñar pares de cebadores y sondas de dPCR para el genoma del vector y pares de cebadores de dPCR y sondas para el gen de referencia del ratón que se utilizarán para cuantificar los genomas diploides de la muestra.
NOTA: Apunte a un tamaño de amplicón entre 60 pb y 150 pb. El gen de referencia del ratón debe ser un gen que tenga un número constante de copias genéticas por genoma diploide. Para los cálculos enumerados aquí, el gen de referencia (Polr2a) tiene dos copias por genoma diploide. - Para una reacción de PCR de punto final de 10 μL, prepare la mezcla de PCR utilizando los reactivos y las concentraciones finales que se utilizarán posteriormente para la reacción de dPCR. Agregue la muestra de ADN molde digerido por RNasa (rango de cantidad de ácidos nucleicos 56-223 ng) a una concentración final de 1x mezcla maestra de dPCR que contenga la ADN polimerasa y dNTP, 0,8 μM de cada cebador directo, 0,8 μM de cada cebador inverso, 0,4 μM de cada sonda y 0,025 U/μL de enzima de restricción (la concentración final de la enzima de restricción depende de la enzima de restricción y la marca utilizada). Agregue agua de grado molecular para alcanzar un volumen final de 10 μL.
NOTA: Debe haber al menos dos pares de cebadores y dos sondas en la mezcla de PCR: un par de cebadores y una sonda para detectar el genoma del vector y un par de cebadores y una sonda para detectar el genoma del ratón. - Condiciones de ciclo térmico de PCR: Paso inicial de activación del calor a 95 °C durante 2 min, seguido de 35-45 ciclos de un paso de desnaturalización a 95 °C durante 25 s y un paso combinado de recocido/extensión a 58-62 °C durante 1 min.
NOTA: Se debe determinar la temperatura óptima de recocido para cada par de amplicones y cebadores. El número de ciclos se puede ajustar de acuerdo con la cantidad de ADN molde en la muestra. - Visualice el producto de PCR en un gel de agarosa utilizando electroforesis en gel para determinar la presencia de las bandas de amplicón objetivo y cualquier posible banda de amplificación no específica.
- Continúe con el siguiente paso de dPCR después de confirmar que los pares de cebadores y las condiciones de ciclo dan como resultado una amplificación específica de las secuencias objetivo.
- Diseñar pares de cebadores y sondas de dPCR para el genoma del vector y pares de cebadores de dPCR y sondas para el gen de referencia del ratón que se utilizarán para cuantificar los genomas diploides de la muestra.
- Reacción de dPCR
- Para una reacción de dPCR de 40 μL, agregue hasta 4 μL de la muestra de ADN molde digerida por RNasa (rango de cantidad de ácidos nucleicos de 50 a 330 ng) a una concentración final de 1x mezcla maestra de dPCR que contenga la ADN polimerasa y dNTP, 0,8 μM de cada cebador directo, 0,8 μM de cada cebador inverso, 0,4 μM de cada sonda, y 0,025 U/μL de enzima de restricción (la concentración final de la enzima de restricción depende de la enzima de restricción y de la marca utilizada). Agregue agua de grado molecular para alcanzar un volumen final de 40 μL.
- Condiciones de ciclo térmico de dPCR: Paso inicial de activación por calor a 95 °C durante 2 min, seguido de 40-50 ciclos de un paso de desnaturalización a 95 °C durante 25 s, y un paso combinado de recocido/extensión a 58-62 °C durante 1 min.
NOTA: Se debe determinar la temperatura óptima de recocido para cada par de amplicones y cebadores. El número de ciclos se puede ajustar de acuerdo con la cantidad de ADN molde en la muestra. Los volúmenes, concentraciones y condiciones enumerados aquí están optimizados para las placas, los reactivos y el dispositivo de dPCR enumerados en la Tabla de materiales. Estas condiciones reducen el efecto de cualquier inhibidor potencial de dPCR que pueda reducir la precisión de la reacción. - Después de ejecutar la reacción de dPCR y obtener los valores absolutos de los genomas del vector y del gen de referencia del ratón, calcule vg/dg en la muestra utilizando las ecuaciones (7-8).
Para genes de referencia con dos copias de genes/genoma diploide:
Valor absoluto de los genomas diploides (dg) =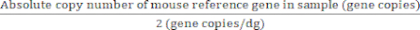 (7)
(7)
vg/dg =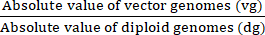 (8)
(8) - Compruebe el diagrama de dispersión 1D de la reacción de dPCR para confirmar la validez del ensayo y la cuantificación (Figura 3A,C). Para que el ensayo sea válido, confirme que el diagrama de dispersión 1D cumple todos los criterios siguientes: la presencia de particiones positivas y negativas; separación clara entre las particiones positiva y negativa para permitir una determinación precisa del umbral; y la presencia de gotas nulas o pocas entre las particiones positiva y negativa (también conocida como lluvia), lo que puede reducir la precisión de la cuantificación de la dPCR.
- PCR de punto final para comprobar la especificidad de los cebadores y las condiciones óptimas de PCR (opcional)
Resultados
Ratones machos de siete a nueve semanas de edad fueron inyectados con AAV a través de una inyección lateral en la vena de la cola a 1,5 × 1012 vg/ratón administrados en 150-200 μL de volumen de inyectado. El AAV de ssDNA utilizado aquí liberó el transgén recombinasa Cre impulsado por el promotor del CMV. Los ratones inyectados fueron homocigotos para el alelo Ai14 reportero de Cre. Cuando se exponen a la recombinasa Cre, las células que contienen alelos Ai14 expresan la proteína fluorescente tdTomato. Dado que la expresión de tdTomato es causada por la recombinación genómica inducida por Cre, las células que expresan tdTomato indican células que fueron transducidas directamente por el AAV o eran células de progenie de células transducidas. Los datos que se muestran aquí son de ratones inyectados con AAV9-CMV-Cre a 1,5 × 1012 vg/ratón administrados en 160 μL (5,8-5,9 × 1013 vg/kg). Los ratones se sacrificaron 28 días después de la inyección y los tejidos se recolectaron como se describió anteriormente. Se digierieron algunos músculos esqueléticos y lóbulos hepáticos, y sus células se recolectaron mediante FACS. Algunos lóbulos hepáticos se congelaron inmediatamente utilizando metilbutano preenfriado para la extracción de ácido nucleico. Algunos músculos esqueléticos y lóbulos hepáticos se fijaron y congelaron para obtener imágenes histológicas de tdTomato fluorescente. El tomate tdTomato se expresó de forma difusa en todo el hígado (Figura 2A) y en el cuádriceps (Figura 2C), lo que indica que AAV9 alcanzó y transdució ampliamente diferentes regiones de ambos tejidos.
El ADN extraído del hígado fresco congelado y las células clasificadas por FACS se utilizaron para cuantificar vg/dg mediante dPCR. La cuantificación de Vg/dg se puede utilizar para evaluar la consistencia de la inyección y la eficiencia de transducción de AAV en la muestra analizada. Se utilizaron los diagramas de dispersión de gotas 1D de la muestra de tejido hepático fresco congelado y las células clasificadas por FACS para garantizar la validez del ensayo (Figura 3A,C). El diagrama de dispersión mostró la presencia de particiones positivas y negativas, una separación clara entre las particiones positivas y negativas que permite una determinación precisa del umbral de detección y la presencia de gotas entre las particiones positivas y negativas, lo que puede reducir la precisión del ensayo de dPCR. El cumplimiento de todos estos criterios indicaba que los resultados del ensayo de dPCR eran válidos. Se cuantificó el número de copias del gen Polr2a en cada muestra para determinar el número de genomas diploides de ratón (2 copias del gen Polr2a/genoma diploide de ratón), y se utilizaron cebadores/sonda contra la secuencia del transgén recombinasa Cre para cuantificar el genoma viral (1 copia de transgén/genoma viral, Tabla 1). El valor de vg/dg se cuantificó para la muestra de tejido hepático fresco congelado y las células clasificadas por FACS y mostró la presencia de 187,7 vg/dg y 4,7 vg/dg en cada muestra, respectivamente (Figura 3B,D). Se utilizaron muestras de ratones inyectados con PBS y controles no molde que no contenían ácidos nucleicos como controles negativos.

Figura 1: Descripción general de la estación de inyección intravenosa. (A) Herramientas necesarias para realizar la inyección intravenosa. Aquí se muestra el (1) temporizador, (2) el retenedor del tubo del ratón, (3) los conos del restriccionador de plástico sin cortar y (4) cortados, (5) el hisopo con alcohol, (6) la caja vacía de puntas de pipeta utilizada como plataforma para elevar el retenedor del tubo del ratón, (7) las almohadillas absorbentes desechables, (8) el tubo cónico de 15 mL con agua tibia, (9) el soporte del tubo de 15 mL, (10) la gasa y (11) la jeringa de insulina. (B) El ratón se coloca primero dentro del sistema de retención del tubo. A continuación, se inserta el cono de restricción cortado para crear un manguito de sujeción alrededor del ratón, si el ratón es demasiado pequeño para ser restringido solo por el tubo de sujeción. Asegúrese de que la respiración del ratón no esté obstruida por los sujetadores. El retenedor de tubo se coloca en la parte superior de la plataforma elevada para permitir la colocación de la cola de ratón en agua tibia. (C) Posición de la cola del ratón y ángulo de sujeción de la aguja inmediatamente antes de realizar la inyección. Tire hacia atrás de la cola para que la cola se estire y el sitio de inyección quede completamente horizontal. La aguja es paralela a la cola y a la vena, y el bisel está hacia arriba. Haga clic aquí para ver una versión más grande de esta figura.
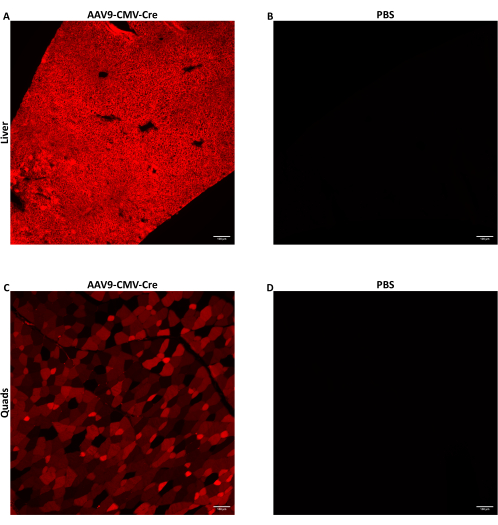
Figura 2: Detección de la proteína reportera fluorescente después de la inyección intravenosa. Ratones machos de siete a nueve semanas de edad que albergaban el alelo Ai14 reportero de Cre fueron inyectados por vía intravenosa con AAV9-CMV-Cre a 1,5 ×10 12 vg/ratón, administrados en 160 μL (5,8-5,9 × 10,13 vg/kg) o PBS. Imágenes de fluorescencia representativas de secciones de hígado (A) o cuádriceps (C) de ratón después de la administración de la inyección de Cre IV por AAV9. (B) Se tomaron imágenes de secciones de hígado o (D) cuádriceps de ratones inyectados con PBS para que sirvieran como controles negativos. Los tejidos se recolectaron y se congelaron fijamente 28 días después de la inyección intravenosa. Después de la exposición a Cre, la proteína fluorescente tdTomato se expresa en células transducidas y células de progenie de células transducidas. Se obtuvieron imágenes de secciones de 10 μm de espesor con un aumento de 10x. Barras de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
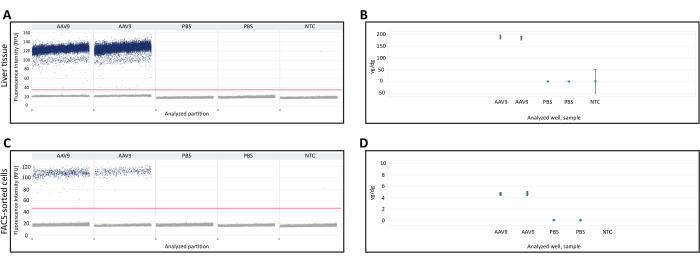
Figura 3: Cuantificación del genoma vectorial por genoma diploide (vg/dg). Diagrama de dispersión 1D de la cuantificación de genomas vectoriales de dPCR en (A) tejido hepático o (C) células clasificadas por FACS recogidas de ratones inyectados con AAV9-CMV-Cre o PBS. Los diagramas de dispersión muestran las particiones de dPCR positivas y negativas, así como el umbral de detección indicado por la línea horizontal a través de las muestras. (B,D) Cuantificación de vg/dg después de cuantificar los genomas diploides de ratón y los genomas de vectores en (B) tejido hepático o (D) muestras de células clasificadas por FACS. Los resultados que se muestran aquí son de un solo mouse inyectado en AAV9 y un solo mouse inyectado en PBS con un duplicado técnico de dPCR para cada mouse. Las barras de error indican el intervalo de confianza del 95% para cada muestra. Abreviaturas: NTC= Control sin plantilla; dPCR = PCR digital; FACS = clasificación celular activada por fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
| Cebador | Secuencia |
| Imprimación Cre forward | CTGACGGTGGGAGAATGTTAAT |
| Imprimación inversa Cre | CATCGCTCGACCAGTTTAGTT |
| Sonda Cre | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Imprimación delantera Polr2a | GACTCCTTCACTCACTGTCTTC |
| Imprimación inversa Polr2a | TCTTGCTAGGCAGTCCATTATC |
| Sonda Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tabla 1: Secuencias de cebadores y sondas utilizadas para la cuantificación de vg/dg. Se utilizaron cebadores y sonda de Cre para cuantificar el genoma del vector. Se utilizaron cebadores y sonda Polr2a para cuantificar el genoma diploide del ratón.
Discusión
Las terapias basadas en AAV tienen un gran potencial para los trastornos monogénicos debido a la versatilidad de la AAV como vector de terapia génica, lo que permite personalizar los AAV para satisfacer las diversas necesidades de administración de diferentes trastornos 4,5,7,9. Los AAV se administran comúnmente a través de inyección intravenosa en modelos preclínicos de ratón para probar la seguridad y eficacia de posibles terapias16. Dado que las diferentes dosis inyectadas de AAV pueden dar lugar a marcadas diferencias en los resultados experimentales, es fundamental que los experimentadores puedan inyectar sistemáticamente la dosis prevista de AAV para garantizar la validez y la solidez de los datos in vivo generados28. Las inyecciones intravenosas son ampliamente utilizadas, pero son técnicamente desafiantes y requieren una amplia capacitación y práctica continua para desarrollar y mantener un nivel de habilidad que garantice el éxito constante de las inyecciones 16,17,18,19. Además de inyectar correctamente el AAV, generalmente se desea utilizar ensayos para evaluar la biodistribución y la eficiencia de entrega del AAV inyectado a los tejidos o células diana29,30.
Este protocolo tiene como objetivo ayudar a los experimentadores a realizar fácilmente inyecciones intravenosas con éxito y de manera consistente mediante la descripción detallada de los detalles de un protocolo optimizado de inyección intravenosa para administrar AAV en ratones sin sedar de 7 a 9 semanas de edad. Es importante tener en cuenta que los ratones que son marcadamente más pequeños o más grandes que los ratones de tipo salvaje en el rango de edad utilizado aquí pueden presentar un mayor desafío debido a una visibilidad reducida de las venas o incompatibilidad con los retenedores utilizados en este método. Se ha informado previamente que las inyecciones intravenosas de cola no son apropiadas para administrar reactivos por vía intravenosa en ratones menores de 6 semanas de edad debido al pequeño tamaño del vaso31. Aunque es posible, puede ser difícil inyectar consistentemente ratones que pesan menos de 22,0 g. con éxito. Es posible que los investigadores que utilizan ratones de tamaño atípico deban hacer adaptaciones al procedimiento. Este protocolo también describe varios ensayos que se pueden utilizar para evaluar la biodistribución de AAV y la eficiencia de la transducción.
Hay que tener en cuenta algunos puntos críticos al seguir este protocolo. Durante la inyección, las agujas de 29 G proporcionan una mayor resistencia si la aguja no está dentro de la vena. Esto reduce el volumen perdido por la inyección perivascular accidental de la solución durante los intentos fallidos de inyección. Las jeringas de insulina tienen volúmenes muertos más pequeños que las jeringas normales. Si se utiliza una jeringa y/o aguja diferente a las enumeradas aquí, es posible que sea necesario preparar un volumen de inyección adicional en los pasos del protocolo 1.1.3.3 para tener en cuenta el mayor volumen de espacio muerto (por ejemplo, agregue 30 μL a la dosis prevista en lugar de 15 μL).
Si se forman burbujas de aire finas causadas por la aspiración en los lados de la jeringa mientras se aspira la dosis de AAV en la jeringa, tire lentamente de la inyección más arriba de la jeringa. Esto eliminará la mayoría de las burbujas de aire pequeñas. Cargue al menos 10-15 μL adicionales de AAV hasta el volumen previsto para inyectar. Este volumen adicional es para tener en cuenta cualquier volumen que pueda perderse durante la expulsión de burbujas de aire o posibles intentos fallidos de inyección. (por ejemplo, si el volumen objetivo a inyectar es de 150 μL, cargue 165 μL en la jeringa (a medio camino entre las marcas de 160 μL y 170 μL en la escala de la jeringa). Si la aguja está correctamente colocada dentro de la vena y el volumen de la jeringa es de 165 μL inmediatamente antes del intento de inyección exitoso, administre el reactivo hasta que queden 15 μL en la jeringa (a medio camino entre las marcas de 10 μL y 20 μL), administrando así 150 μL (165 μL - 150 μL = 15 μL)). La alineación del lumen biselado (bisel hacia arriba) con la escala de la jeringa permite realizar un seguimiento del volumen suministrado durante la inyección.
Algunos experimentadores pueden preferir colocar al ratón de lado de modo que una de sus venas sea recta y fácilmente accesible en comparación con un ratón en sus pies. Sin embargo, la cola de un ratón de lado estará inclinada en diferentes ángulos dependiendo del tamaño del ratón, lo que requerirá un ajuste del ángulo de inyección cuando se inyecten ratones de diferentes tamaños. Esto podría afectar negativamente la consistencia del éxito del procedimiento. Durante los intentos iniciales de práctica, los experimentadores pueden probar ambas orientaciones de restricción del ratón para determinar su enfoque preferido. Tener el ratón de pie permite un acceso rápido y fácil a ambas venas laterales de la cola. Esto reduce el tiempo de restricción cuando es necesario acceder a ambas venas en el caso de múltiples intentos fallidos de inyección.
Si inyecta la vena lateral cerca de la base de la cola (más cerca del cuerpo del ratón) (especialmente para ratones que pesan >30 g.), ajuste el ángulo de inyección de paralelo a la vena a 5°-10° a la vena, ya que la vena en la base de la cola es ligeramente más profunda que distalmente.
Los protocolos de digestión de ARNasa y control de contaminación por ARN enumerados aquí se verificaron en muestras de ADN aisladas de tejidos hepáticos recién congelados que contenían un total de 175-700 ng de ácidos nucleicos en 20 μL. El protocolo de digestión de ARNasa también se probó en muestras de ADN aisladas de tejidos hepáticos frescos congelados y células clasificadas por FACS para confirmar la presencia del genoma del vector y el genoma del ratón después de la digestión de la ARNasa. Los resultados se visualizaron mediante electroforesis en gel de agarosa de la amplificación por PCR de punto final de los amplicones diana.
Seguir la metodología descrita puede reducir el entrenamiento y el tiempo de práctica necesarios para dominar las inyecciones intravenosas y dar como resultado una mayor tasa de inyección exitosa, lo que ahorraría reactivos. Este protocolo utiliza herramientas simples y de uso común sin la necesidad de equipos avanzados o configuraciones que podrían no estar fácilmente disponibles. Además, los pasos de inyección intravenosa enumerados aquí se pueden aplicar a una amplia gama de inyectos que deben administrarse por vía intravenosa, como los oligonucleótidos antisentido (ASO), con las modificaciones adecuadas en los pasos de preparación de la inyección según la inyección.
Divulgaciones
Los autores no tienen ninguna divulgación que sea relevante para el trabajo publicado en este artículo.
Agradecimientos
Los autores desean agradecer al personal del centro de cuidado animal del NINDS por su apoyo. Este trabajo fue apoyado por la División de Investigación Intramuros de los NIH, NINDS (Informe Anual Número 1ZIANS003129). El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones oficiales de los Institutos Nacionales de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Referencias
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados