Method Article
Последовательная доставка аденоассоциированного вируса через инъекцию боковой хвостовой вены взрослым мышам
В этой статье
Резюме
В данной статье мы подробно описываем оптимизированный протокол инъекции латеральной хвостовой вены мыши для системного введения аденоассоциированного вируса (AAV) взрослым мышам. Кроме того, мы описываем протоколы часто используемых анализов для оценки трансдукции AAV.
Аннотация
Многие расстройства поражают несколько органов или затрагивают разные области тела, поэтому крайне важно системно доставлять терапевтические препараты для воздействия на пораженные клетки, расположенные в разных местах. Внутривенная инъекция является широко используемым системным путем доставки в доклинических исследованиях, в которых оцениваются методы лечения, предназначенные для введения в организм по всему организму. У взрослых мышей он предполагает внутривенное введение терапевтического средства в боковые хвостовые вены мыши. После освоения инъекции в хвостовую вену безопасны и быстры, и для них требуются только простые и общедоступные инструменты. Тем не менее, инъекции в хвостовую вену являются технически сложными и требуют обширной подготовки и непрерывной практики для обеспечения точной доставки предполагаемой дозы.
Здесь мы описываем подробный, оптимизированный протокол инъекции боковой хвостовой вены, который мы разработали на основе нашего опыта и рекомендаций, о которых ранее сообщали другие группы. Помимо удерживающих устройств для мышей и инсулиновых шприцев, этот протокол требует только реагентов и оборудования, которые легко доступны в большинстве лабораторий. Мы обнаружили, что следование этому протоколу приводит к стабильно успешной внутривенной доставке аденоассоциированного вируса (AAV) в хвостовые вены мышей без седации в возрасте 7-9 недель. Кроме того, мы описываем оптимизированные протоколы гистологического обнаружения флуоресцентных репортерных белков и количественного определения векторного генома на диплоидный геном (vg/dg), используемые для оценки трансдукции и биораспределения AAV. Цель этого протокола состоит в том, чтобы помочь экспериментаторам легко и успешно выполнять инъекции в хвостовую вену, что может сократить время практики, необходимое для освоения техники.
Введение
Моногенные расстройства составляют 80% редких заболеваний, которые в совокупности поражают 300 миллионов человек во всеммире1,2. В настоящее время не существует одобренных методов лечения для большинства этих сильно изнурительных редких расстройств 1,2,3. Тем не менее, моногенные расстройства являются идеальными кандидатами для генной терапии, которая может заменить, дополнить, исправить или заглушить дисфункциональные гены 4,5. В настоящее время разрабатываются множественные векторы, которые используются для доставки генной терапии к конкретным типам клеток 4,6. Одним из таких переносчиков является аденоассоциированный вирус (AAV). AAV является непатогенным парвовирусом, который все чаще используется в качестве вектора геннойтерапии7. По сравнению с другими вирусными векторами, AAV обладает более низкой иммуногенностью, меньшим потенциалом интеграции в геном хозяина и способностью эффективно трансдуцировать делящиеся и неделящиеся клетки в различных тканях 7,8. Кроме того, было разработано несколько подходов для разработки и идентификации AAV с желательными характеристиками, такими как специфический тканевой тропизм или дальнейшая сниженная иммуногенность, что значительно повышает универсальность AAV в качестве вирусного вектора при различных показаниях9. Эти факторы сделали AAV широко исследованным вектором генной терапии и привели к разработке нескольких одобренных FDA методов генной терапии на основе AAV.
Мышиные модели обычно используются для тестирования потенциальных генных терапий in vivo и лучшего понимания патомеханизмов моногенных заболеваний. Это связано с тем, что мышиные модели повторяют патологии различных состояний, сходство их генома с геномом человека, а также относительную простоту в обращении, обслуживании и поколении 11,12,13. Тестирование in vivo особенно важно при изучении заболеваний, которые влияют на несколько систем или областей тела, таких как мышечные дистрофии. Для этих расстройств тестирование in vitro может быть недостаточным для всесторонней оценки безопасности, эффективности, фармакокинетики и фармакодинамики терапевтических средств, предназначенных для достижения различных областей тела после системноговведения.
Для доставки лекарственных препаратов могут использоваться различные системные пути введения. Каждый путь имеет свои преимущества, недостатки и степень совместимости с исследуемой моделью животного и лекарственным препаратом. Внутривенная (IV) инъекция боковой хвостовой вены является широко используемым путем системной доставки AAV у мышей16. Боковые инъекции в хвостовую вену позволяют быстро и непосредственно вводить инъекцию в кровоток мыши, обеспечивая высокую биодоступность препарата в системном кровотоке17. Они также требуют относительно простых и общедоступных инструментов. Однако, в основном из-за малого диаметра хвостовой вены и трудности с локализацией вены, инъекции в боковую хвостовую вену являются технически сложными и требуют высокой степени мастерства и постоянной практики, чтобы избежать неудачных попыток инъекции или неполной доставки дозы 16,17,18,19. Это может привести к потере дорогостоящих реагентов или неточным результатам, особенно если неполная инъекция не распознается во время выполнения инъекции. Наш опыт, обобщенный здесь, основан на протоколах, изложенных в хорошо документированных статьях, которые мы адаптировали для нашего использования, оптимизируя различные этапы процедуры инъекции боковой хвостовой вены для обеспечения неизменно успешных инъекций 20,21,22,23,24,25,26,27.
Здесь мы опишем этот подробный оптимизированный протокол инъекции боковой хвостовой вены для доставки AAV мышам без седации в возрасте 7-9 недель с использованием простых и общедоступных инструментов. Кроме того, мы предоставляем протоколы для методов, используемых для оценки доставки и биораспределения AAV. Эти протоколы охватывают сбор тканей после инъекции, фиксацию тканей, экстракцию ДНК и количественное определение вектора цифровой полимеразной цепной реакции (dPCR) для каждого диплоидного генома (vg/dg). Протокол внутривенного введения и приведенные здесь указания направлены на облегчение успешного выполнения инъекций в боковую хвостовую вену. Это потенциально поможет сократить время, необходимое для овладения навыками инъекций, одновременно повышая точность и стабильность инъекций.
протокол
Все процедуры обращения с животными и инъекций были одобрены Комитетом по уходу за животными в NINDS. Все процедуры на животных проводились в соответствии с рекомендациями NINDS по уходу за животными и их использованию.
1. Прединъекционная подготовка
- Приготовление дозы AAV
- Определите средний вес мышей, которым будет вводиться инъекция.
- Рассчитайте максимально допустимый объем инъекции в соответствии с рекомендациями учреждения по уходу за животными, как показано в уравнении (1). Максимальный объем инжекта обычно равен объему (μл)/весу мыши (г) (например, 10 μл/г).
Максимальный объем инжектата (μл)/мышь = (максимальный объем инжекта (μл/г)) × (средний вес мыши (г)) (1)
ПРИМЕЧАНИЕ: Расчет примера: Максимальный объем инжекта на мышь = 10 мкл/г × 20 г/мышь = 200 мкл/мышь - Установите дозу векторного генома AAV (vg), которая должна доставляться на одну мышь.
ПРИМЕЧАНИЕ: Это может быть одно и то же абсолютное значение для разных мышей (например, все мыши получают 1,5 ×10 12 vg, независимо от того, сколько весит каждая мышь). Или доза может быть в vg/kg, поэтому общее vg, которое должно быть введено на одну мышь, должно быть рассчитано для каждой мыши в соответствии с весом этой мыши в день инъекции.- Если доза указана в vg/кг, взвесьте каждую мышь в день инъекции до приготовления дозы.
- Рассчитаем векторные геномы, которые должны быть доставлены для каждой мыши в соответствии с ее весом, используя уравнение (2):
Векторные геномы, которые должны быть доставлены в конкретную мышь (vg) = Заданное значение vg/кг (vg/кг) ×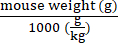 (2)
(2)
ПРИМЕЧАНИЕ: Использование vg/kg в качестве единицы дозы вместо vg/mouse может быть более целесообразным в некоторых доклинических исследованиях для обеспечения достоверных сравнений между вводимыми дозами. Это связано с различиями в весе между самцами и самками мышей одного возраста или, возможно, между мышами одного пола. - Используйте максимальный объем инъекции и дозу AAV (vg) для расчета объемов запасного AAV и стерильного фосфатно-солевого буфера (PBS), которые необходимы для приготовления требуемой дозы (см. уравнения (3-6)). Убедитесь, что вводимый объем равен или меньше допустимого максимального объема инъекции. Всегда готовьте объем для инъекции, который по крайней мере на 15 мкл больше объема, который будет вводиться, чтобы учесть ошибки пипетирования и мертвое пространство шприца.
Концентрация инжекта (vg/μL) =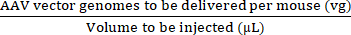 (3)
(3)
Общее количество векторных геномов AAV, которые должны быть добавлены для приготовления инъекции (vg) = Концентрация инжектата (vg/μл) × объеме, который должен быть приготовлен (μл) (4)
Объем запаса AAV, который должен быть добавлен для приготовления инъекции) (μл) =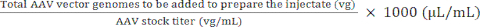 (5)
(5)
Объем PBS, который должен быть добавлен для приготовления инжекта (μл) = Объем, который должен быть приготовлен (μл) - Объем запаса AAV, который должен быть добавлен для приготовления инжекта (μл) (6)
ПРИМЕЧАНИЕ: Пример расчета:
6 ×10 13 вг/кг (доза) будет вводиться в 200 мкл/мышь (объем для инъекции) в мышь весом 25 г. Титр запасов AAV составляет 3,0 × 1013 (vg/мл)
Векторные геномы, которые должны быть доставлены этой конкретной мыши (vg) = 6 ×10 13 (vg/кг) ×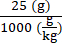 = 1,5 × 1012 vg для этой мыши
= 1,5 × 1012 vg для этой мыши
Концентрация инжекта =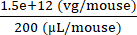 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Общее количество векторных геномов AAV, которые должны быть добавлены для приготовления инъекции = 7,5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1,6125 × 1012 (vg)
Объем запаса AAV, который должен быть добавлен для приготовления инъекции =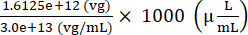 = 53,75 (μл)
= 53,75 (μл)
Объем PBS, добавляемый для приготовления инъекции = 215 (μл) - 53,75 (μл) = 161,25 (μл)
- Процедура подготовки дозы AAV
ПРИМЕЧАНИЕ: В соответствии с рекомендациями учреждения по биобезопасности и СИЗ для работы с AAV, в автоклавной стерильной микроцентрифужной пробирке объемом 1,7 мл без РНКазы и ДНКазы приготовьте инъекцию AAV, используя запас AAV и стерильную PBS в соответствии с расчетами на шаге 1.1.3.3. Всегда держите стоковый AAV и впрыскиваемый AAV на льду. Используйте чистые микропипетки и новые коробки с наконечниками для микропипеток для обеспечения стерильности. Выбросьте кончики для микропипеток, загрязненные AAV, в соответствии с рекомендациями учреждения по обращению с отходами.- Разморозьте стоковый AAV на льду.
ПРИМЕЧАНИЕ: Избегайте размораживания и повторного замораживания запасов AAV. Либо заказывайте, либо приготовьте запас AAV в аликвотах объемом 100-200 μл, чтобы избежать избытка AAV после приготовления дозы, которую необходимо будет повторно заморозить.
- Разморозьте стоковый AAV на льду.
- Подготовка станции впрыска
- Чистка
- Очистите рабочую зону 70% этанолом (EtOH).
- Продезинфицируйте рабочую зону с помощью бактерицидного, фунгицидного и вирулицидного реагента(ов).
- Очистите ограничитель трубки мыши водой с мылом.
- Настройка станционного инструмента
- Поместите чистую пустую коническую пробирку объемом 15 мл в держатель/штатив для пробирок.
- Установите приподнятую платформу, на которой будет размещен ограничитель для трубки мыши (рис. 1A, B).
- Поместите чистый ограничитель трубки мыши в рабочую зону.
- Если вы вводите мышам, размер которых намного меньше доступного ограничителя мышиной трубки, используйте пластиковый конус для защиты от грызунов, чтобы сделать удерживающую втулку. Смотрите шаги 2.1.3-4.
- Поместите шприцы, которые будут использоваться для инъекций, в рабочую зону. Используйте инсулиновые шприцы объемом 0,3 мл с иглами 29 G.
- Разместите контейнер для отходов как можно ближе к станции впрыска, чтобы обеспечить немедленную утилизацию инструментов, загрязненных AAV.
- Потяните и нажмите на поршень каждого шприца несколько раз, чтобы убедиться, что поршень движется плавно, чтобы во время инъекции не было сопротивления, вызванного шприцем. Если поршень движется не плавно, выбросьте этот шприц и замените его новым.
- Рядом с местом инъекции должны быть весы для мыши и мини-центрифуга.
- Подготовьте AAV на льду в зоне инъекций.
- Подготовьте теплую воду (38-40 °C). Следите за тем, чтобы температура воды не превышала 40 °C, чтобы не вызвать ожоги хвоста мыши.
- Чистка
2. Процедура инъекции
- Сдерживание мыши
- Взвесьте каждую мышь, чтобы при необходимости рассчитать дозу в vg/кг.
- Убедитесь, что мышь полностью ограничена и не может двигаться.
ПРИМЕЧАНИЕ: Если мышь не полностью удерживается, она может двигаться во время внутривенного введения, что приведет к смещению иглы. Это может привести к тому, что игла выйдет из вены и/или поранит мышь. - Для ограничителя трубки:
- Промойте ограничитель теплой водой с мылом между мышами, чтобы очистить и прогреть держатель.
- Держите мышь за хвост. Вставьте хвост мыши в верхнее отверстие трубки; Затем медленно втяните мышь в ограничитель трубки. Если размер ограничителя трубки подходит для размера мыши, поместите вилку впереди мыши, чтобы предотвратить побег мыши.
ПРИМЕЧАНИЕ: Вилка должна находиться достаточно близко к мыши, чтобы предотвратить ее движение или вращение внутри трубки, но вилка не должна закрывать нос мыши, чтобы мышь могла свободно дышать. Если размер мыши меньше размера ограничителя трубки, используйте гибкий одноразовый конус ограничителя в дополнение к ограничителю трубки, как описано ниже в шаге 2.1.4.
- Для гибких одноразовых удерживающих конусов при необходимости (чтобы сделать удерживающий рукав для маленьких мышей):
- Сделайте надрез на носовом конце конуса, чтобы нос мыши не был закрыт и у мыши было достаточно места для дыхания.
- Обрежьте заднюю часть конуса так, чтобы конус был почти такой же длины, как мышь (чтобы конус поместился внутри трубки) (рис. 1A, B).
- Поместите мышь в ограничитель трубки, как описано выше в шагах 2.1.3. Удерживая хвост мыши, вставьте конус удерживателя более широкой открывающейся стороной сначала в трубку.
- Держа мышь за хвост, дайте ей войти в конус; Затем вставьте оставшуюся часть конуса в трубку. Убедитесь, что хвост мыши полностью выходит из задней части трубки, и у мыши есть место для дыхания внутри конуса.
- Закрепите заглушку трубки непосредственно перед отверстием в носу конуса, убедившись, что мышь полностью зафиксирована и у нее достаточно места для дыхания.
- Внедрение мыши
- Наполните коническую трубку объемом 15 мл теплой водой.
- Поместите ограничитель трубки вместе с мышью внутри него на возвышенную платформу (рисунок 1B).
- Опустите как можно больше хвоста мыши в теплую воду не менее чем на 1 минуту, пока боковые вены не станут четко расширены и не станут видны (рисунок 1B).
- На этапе подогрева хвоста загрузите дозу AAV в шприц.
- Поместите незакрытую микроцентрифужную пробирку объемом 1,7 мл, содержащую AAV, в штатив для пробирок. Вставьте иглу вертикально в трубку доминирующей рукой. Как только игла окажется внутри трубки, удерживайте трубку недоминирующей рукой.
ПРИМЕЧАНИЕ: Вертикальное введение иглы предотвращает повреждение иглы, которое может быть вызвано прикосновением к стенке трубки. Можно использовать и другие альтернативные методы загрузки шприца, но при этом должна быть обеспечена безопасность экспериментатора и инъекционной мыши. Удержание трубки недоминирующей рукой защищает от случайных травм от прокола иглы, если игла вводится во время удержания трубки. - Когда игла находится внутри трубки, поднимите трубку и шприц одновременно на уровень глаз, следя за тем, чтобы игла не касалась стенки трубки. Положите обе руки на стол, чтобы стабилизировать их. Медленно наберите дозу в шприц.
ПРИМЕЧАНИЕ: Медленная аспирация предотвращает прикрепление мелких пузырьков воздуха к стенкам цилиндра шприца. - Изгоните пузырьки воздуха из шприца. При введении AAV убедитесь, что пузырьки воздуха выводятся из шприца через одноразовую абсорбирующую прокладку, которая будет утилизирована в коробке для биологически опасных веществ.
- Удерживайте инъекцию не менее 40 с, чтобы она прогрелась.
ПРИМЕЧАНИЕ: Перед инъекцией всегда следите за тем, чтобы инъекция была теплой. При введении холодного инъекта инъекция может не протекать через вену, за исключением первых нескольких литров. - Проверяйте вены хвоста каждую минуту.
ПРИМЕЧАНИЕ: Вены должны быть ОЧЕНЬ заметными на всем пути до места инъекции (добавьте время для прогрева хвоста и замените свежей теплой водой по мере необходимости, пока вена не станет четко видимой, но не превышайте время удержания мыши, разрешенное протоколом обращения с животными учреждения). - Убедившись, что вены хорошо видны, снимите ограничитель трубки с верхней части приподнятой платформы и положите ограничитель трубки прямо на стол. Расположите мышь в ограничителе ногами вниз, а не в сторону, чтобы облегчить работу с хвостом.
ПРИМЕЧАНИЕ: Мышь не должна лежать на боку или спиной внутри ограничителя. Мышь должна быть полностью зафиксирована и не должна перемещаться или вращаться внутри ограничителя или двигать/тянуть его хвост. - Быстро протрите хвост марлей, чтобы он высох; Протрите хвост спиртовым тампоном, а затем вытрите его насухо сухой марлей.
ПРИМЕЧАНИЕ: Используйте сухую марлю, чтобы хвост был достаточно сухим, чтобы обеспечить надежное сцепление с хвостом, но не полностью сухим. Увидеть вену может быть сложнее, когда хвост полностью сухой. - Поверните хвост примерно на 90° влево или вправо так, чтобы одна из двух боковых жилок была обращена вверх. Найдите подходящее место для инъекции в средней трети хвоста. Начинайте первоначальную инъекцию дистально (ближе к кончику хвоста) и двигайтесь проксимально, если дополнительные инъекции требуются из-за неудачных попыток или по экспериментальному плану.
ПРИМЕЧАНИЕ: Не пытайтесь делать инъекцию дистальнее места предыдущей инъекции, так как инъекция может вытекать из этого предыдущего места инъекции. Необязательно: с помощью большого и указательного пальцев недоминирующей руки надавите проксимально (вверх/ближе к телу мыши) на место инъекции в течение 10 с. Пальцы действуют как жгуты для дальнейшего расширения вены в месте инъекции. Сразу после 10 с жгута отпустите пальцы жгута и убедитесь, что одна из двух боковых вен обращена вверх и хорошо видна. - Удерживайте хвост недоминантной рукой с помощью большого и указательного пальцев непосредственно дистальнее места инъекции. Загните хвост на указательный палец так, чтобы место инъекции лежало ровно на указательном пальце. Потяните хвост назад так, чтобы хвост был растянут, а место инъекции было полностью горизонтально (под углом 0°) (параллельно горизонтальному столу) (рисунок 1C).
- Удерживайте шприц указательным и средним пальцами доминирующей руки по обе стороны от фланца цилиндра шприца, держа большой палец наготове у поршня.
ПРИМЕЧАНИЕ: Это облегчит перемещение большого пальца или иглы, когда игла находится внутри вены (Рисунок 1C). - Положите обе руки на стол, чтобы стабилизировать их, и положите иглу прямо на хвост и вену параллельно им, а фаска направлена вверх. Держите место инъекции близко к указательному пальцу, держащему хвост, чтобы улучшить контроль и стабильность места инъекции.
ПРИМЕЧАНИЕ: Ограничитель трубки должен быть достаточно глубоко в столе, чтобы обе руки опирались на стол. - Держа иглу параллельно хвостовой вене и оказывая давление вниз на иглу, сдвиньте иглу вперед в вену.
ПРИМЕЧАНИЕ: Давление вниз должно быть достаточным для введения иглы под правильным углом в вену. Вена крайне неглубокая, поэтому игла должна быть максимально плоской при попытке попасть в вену. - Медленно вводите раствор в вену. После введения дозы медленно извлечь иглу и немедленно прижать марлю к месту инъекции не менее чем на 10 с, чтобы остановить кровотечение.
ПРИМЕЧАНИЕ: Давите столько, сколько необходимо, пока кровотечение полностью не остановится, чтобы избежать потенциальной потери введенного реагента. После извлечения иглы обычно появляется капля крови, указывающая на то, что игла проникла в вену. Изредка капли крови не появляются даже при удачном уколе. Капля крови не свидетельствует об успешной инъекции; Она лишь указывает на то, что игла проникла в вену. Надежным показателем успешного впрыска является полное отсутствие сопротивления плунжера во время впрыска. Если игла находится внутри вены, во время инъекции не должно быть сопротивления в поршне иглы, и вена, расположенная ближе к месту инъекции, на мгновение будет казаться немного светлее по цвету (бледнеет) (у некоторых линий мышей побледнение вены может быть не очень четким). Если есть сопротивление и/или в месте инъекции начинает появляться выпуклость, значит, игла неправильно размещена внутри вены. В этом случае полностью удалите иглу из хвоста и попытайтесь ввести вену в новое место инъекции, расположенное проксимальнее места неудачной инъекции (ближе к телу мыши). - Выбросьте шприцы и трубки, загрязненные AAV, в соответствии с инструкциями учреждения по обращению с отходами.
- Освободите мышь от ограничителей и поместите ее обратно в новую клетку, отдельную от неинъекционных мышей. Наблюдайте за мышами в течение 10 минут, чтобы обеспечить нормальный уровень активности после инъекции.
ПРИМЕЧАНИЕ: Это позволяет избежать потенциальной передачи инъекционных агентов неинъекционным мышам при введении трансмиссивных агентов. - Продезинфицируйте рабочую зону с помощью бактерицидного, фунгицидного и вирулицидного реагента (реагентов) и 70% этида. Очистите ограничитель трубки мыши водой с мылом.
- Поместите незакрытую микроцентрифужную пробирку объемом 1,7 мл, содержащую AAV, в штатив для пробирок. Вставьте иглу вертикально в трубку доминирующей рукой. Как только игла окажется внутри трубки, удерживайте трубку недоминирующей рукой.
3. Диссекция, забор и фиксация тканей27
- Подготовка станции забора тканей
- Очистите рабочую станцию реагентом для деградации ДНК в соответствии с инструкциями производителя, чтобы разрушить загрязняющую ДНК, которая может присутствовать в рабочей зоне.
- Поместите метилбутан в металлическую емкость. Поместите металлический контейнер с метилбутаном в коробку из пенополистирола; Затем окружите металлический контейнер сухим льдом так, чтобы уровень сухого льда вокруг контейнера был выше, чем уровень метилбутана внутри контейнера.
- Наклейте этикетку и положите на сухой лед пустые пробирки для хранения салфеток микроцентрифуги объемом 2 мл. Оставьте пробирки для хранения метилбутана и тканей остыть на сухом льду не менее чем на 20 минут, прежде чем начать замораживать ткани. Поместите щипцы для переноса тканей на сухой лед.
- Пометьте и наполните еще один набор микроцентрифужных пробирок для хранения тканей объемом 2 мл свежим 4% параформальдегидом (PFA) и храните их при комнатной температуре. Добавьте достаточное количество 4% PFA в каждую трубку, чтобы полностью погрузить ткани, которые будут помещены в трубку.
- Забор и фиксация тканей
- Усыпьте мышь в соответствии с рекомендациями учреждения по уходу за животными.
ПРИМЕЧАНИЕ: Здесь мыши были усыплены с помощью шейного вывиха. - Полностью распылите на мышь 70% EtOH.
- Соберите необходимые салфетки.
ПРИМЕЧАНИЕ: Описанный здесь протокол сбора и фиксации был протестирован на скелетных мышцах и печени. - Для тканей, которые будут использоваться для экстракции ДНК:
- Опустите ткань в предварительно охлажденный на сухом льду метилбутан и оставьте ткань в метилбутане не менее чем на 1 минуту. Используйте предварительно охлажденные передаточные щипцы для переноса замороженных тканей из метилбутана в предварительно охлажденные пустые микроцентрифужные пробирки для хранения тканей объемом 2 мл. Храните салфетку при температуре -80 °C.
ПРИМЕЧАНИЕ: Необязательно: Ткань можно разрезать на кусочки по 20 мг перед добавлением метилбутана, чтобы она была готова к использованию на шаге 4.1.4.
- Опустите ткань в предварительно охлажденный на сухом льду метилбутан и оставьте ткань в метилбутане не менее чем на 1 минуту. Используйте предварительно охлажденные передаточные щипцы для переноса замороженных тканей из метилбутана в предварительно охлажденные пустые микроцентрифужные пробирки для хранения тканей объемом 2 мл. Храните салфетку при температуре -80 °C.
- Для тканей, которые будут использоваться для гистологического анализа и сохранения флуоресценции репортерных белков:
- С помощью щипцов, предназначенных для PFA, хранящихся при комнатной температуре, опустите ткани в соответствующую микроцентрифужную пробирку, содержащую 4% PFA (при комнатной температуре), убедившись, что ткань полностью погружена в 4% раствор PFA.
ПРИМЕЧАНИЕ: Загрязнение PFA может негативно повлиять на различные молекулярные анализы, расположенные ниже по потоку. При работе с PFA используйте только щипцы, предназначенные для PFA, чтобы предотвратить загрязнение PFA других тканей или инструментов. - Поместите микроцентрифужные пробирки на решетку и накройте ее фольгированной бумагой, чтобы пробирки оставались в темноте. Инкубируйте закрытую решетку при температуре 4 °C в шейкере с легким встряхиванием в течение ночи.
- После ночной инкубации приготовьте 5% сахарозы (% по массе) в 1x PBS, растворив 5,0 г сахарозы в 70 мл 1x PBS путем энергичного встряхивания. Добавьте достаточное количество PBS к конечному общему объему 100 мл для получения 5% раствора сахарозы (% по массе).
- Стерилизуйте 5% раствор сахарозы с помощью шприцевого фильтра 0,22 мкм. Пробирки для микроцентрифуг объемом 2,0 мл промаркируйте и наполните свежеприготовленной 5% сахарозой.
- Перенесите ткани из 4% PFA в соответствующую микроцентрифужную пробирку, содержащую 5% сахарозы (при комнатной температуре), убедившись, что ткань полностью погружена в 5% раствор сахарозы.
- Поместите микроцентрифужные пробирки на решетку и накройте ее фольгированной бумагой, чтобы пробирки оставались в темноте. Инкубируйте закрытую решетку при температуре 4 °C в шейкере с легким встряхиванием в течение ночи.
- После ночной инкубации приготовьте 20% сахарозы (% по массе) в 1x PBS, растворив 20,0 г сахарозы в 70 мл 1x PBS путем энергичного встряхивания. Добавьте достаточное количество PBS в 100 мл к конечному общему объему 100 мл, чтобы получить 20% раствор сахарозы (% по массе).
- 20% раствор сахарозы простерилизовать с помощью шприцевого фильтра 0,22 мкм. Маркируйте и заполняйте микроцентрифужные пробирки объемом 2,0 мл свежеприготовленной 20% сахарозой.
- Перенесите ткани из 5% сахарозы в соответствующую микроцентрифужную пробирку, содержащую 20% сахарозы (при комнатной температуре), убедившись, что ткань полностью погружена в 20% раствор сахарозы.
- Поместите микроцентрифужные пробирки на решетку и накройте ее фольгированной бумагой, чтобы пробирки оставались в темноте. Инкубируйте закрытую решетку при температуре 4 °C в шейкере с легким встряхиванием в течение ночи.
- После ночной инкубации поместите метилбутан в металлический контейнер и поместите металлический контейнер с метилбутаном в коробку из пенополистирола. Окружите металлический контейнер сухим льдом так, чтобы уровень сухого льда вокруг контейнера был выше, чем уровень метилбутана внутри контейнера.
- Наклейте этикетку и поместите пустые микроцентрифужные пробирки для хранения салфеток объемом 2 мл на сухой лед. Оставьте пробирки для хранения метилбутана и тканей остыть на сухом льду не менее чем на 20 минут, прежде чем начать замораживать ткани. Поместите пересадочные щипцы на сухой лед.
- Быстро промокните салфетки с помощью точных салфеток, чтобы удалить излишки 20% сахарозы. Опустите салфетку в предварительно охлажденный на сухом льду метилбутан. Оставьте салфетку в метилбутане не менее чем на 1 минуту.
- Используйте предварительно охлажденные передаточные щипцы для переноса замороженных тканей из метилбутана в предварительно охлажденные пустые микроцентрифужные пробирки для хранения тканей объемом 2 мл. Храните салфетку при температуре -80 °C.
- С помощью щипцов, предназначенных для PFA, хранящихся при комнатной температуре, опустите ткани в соответствующую микроцентрифужную пробирку, содержащую 4% PFA (при комнатной температуре), убедившись, что ткань полностью погружена в 4% раствор PFA.
- Усыпьте мышь в соответствии с рекомендациями учреждения по уходу за животными.
4. dPCR для количественного определения vg/dg
- Экстракция ДНК из тканей и первичное расщепление РНК
ПРИМЕЧАНИЕ: Руководство по набору для экстракции ДНК, указанному в Таблице материалов , было использовано для получения этого протокола экстракции ДНК. Всегда держите пробирки с замороженными кусочками ткани на сухом льду.- Приготовьте ведро со льдом.
- Для каждого образца ДНК пометьте одну пробирку для лизисных шариков объемом 1,5 мл и две пустые пробирки для микроцентрифуги объемом 1,7 мл без РНКазы и без ДНКазы.
- Добавьте 180 мкл первого буфера из набора для экстракции ДНК в каждую пробирку с шариками. Тарируйте первую шариковую трубку, содержащую буфер.
ПРИМЕЧАНИЕ: Если ткани не были предварительно разрезаны на шаге 3.2.4.1, используйте лезвие бритвы, предварительно охлажденное на сухом льду, чтобы разрезать ткань на кусочки по 20 мг. Этот шаг должен быть выполнен в чистом криостате, хранящемся при температуре -20 °C или ниже. - Добавьте в трубку один кусочек салфетки; Взвесьте и запишите вес ткани (должен быть ~20 мг.).
- Сразу же поместите на лед трубку для лизиса с находящейся в ней тканью. Буфер может кристаллизоваться.
- Повторите предыдущие шаги для каждого образца ткани.
- Переложите пробирки в блендер для лизирующих шариков и работайте 1 мин на максимальной скорости (скорость 10) при 4 °C.
- Поместите образцы на лед, чтобы перенести их в центрифугу. Центрифугируйте в течение 1 минуты при 20 000 × г при 4 °C.
- На этапе центрифугирования добавьте 20 мкл протеиназы К в первую серию микроцентрифужных пробирок объемом 1,7 мл. После этапа центрифугирования перенесите надосадочную жидкость гомогенатов в пробирки объемом 1,7 мл, содержащие протеиназу К, и хорошо перемешайте. Инкубировать при температуре 56 °C в течение 15 минут, перемешивая со скоростью 500 об/мин.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Выдерживать при комнатной температуре в течение 2 минут.
- Добавьте 4 мкл РНКазы А и перемешайте путем кратковременного импульсного вихревого перемешивания. Выдерживать при комнатной температуре в течение 2 минут. Импульсно-вихревой в течение 15 с.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Добавьте 200 мкл второго буфера из набора для экстракции ДНК. Импульсно-вихревой в течение 15 с.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Добавьте 200 μL 100% EtOH. Импульсно-вихревой в течение 15 с.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Перенесите лизаты в спиновую колонку для экстракции ДНК. Вращайте при 6 000 × g в течение 1 минуты.
- Поместите спиновую колонку в новую пробирку для сбора. Добавьте 500 мкл третьего буфера набора для экстракции ДНК в спиновую колонку. Вращайте при 6 000 × g в течение 1 минуты.
- Поместите спиновую колонку в новую пробирку для сбора. Добавьте 500 мкл четвертого буфера из набора для экстракции ДНК в спиновую колонку. Вращайте при 20 000 × g в течение 3 минут.
- Поместите спиновую колонку в новую микроцентрифужную пробирку объемом 1,7 мл. Добавьте в спиновую колонну 100 μл молекулярной воды. Выдерживать при комнатной температуре в течение 1 мин. Вращайте при 6 000 × г в течение 1 минуты при комнатной температуре.
- При необходимости измерьте концентрацию ДНК. Хранить при температуре 4 °C при кратковременном хранении или при температуре -20 °C при длительном хранении.
- Экстракция ДНК из клеток, отсортированных методом FACS
ПРИМЕЧАНИЕ: Руководство по набору для экстракции ДНК, указанному в Таблице материалов , было использовано для получения этого протокола экстракции ДНК.- После сортировки ячеек центрифугируйте образцы при 300 × г в течение 5 с, чтобы собрать все капли с боков и крышки. Убедитесь, что все капли собраны.
ПРИМЕЧАНИЕ: Если объем образца меньше 1,5 мл, переходите непосредственно к следующему шагу. Если объем образца превышает 1,5 мл, осторожно извлеките и выбросьте верхнюю часть надосадочной жидкости с помощью микропипетки, оставив 1-1,5 мл образца. - Перемешайте образец, пипетируя вверх и вниз несколько раз, и переложите образец в микроцентрифужную пробирку объемом 1,7 мл. Центрифугировать при 515 × г в течение 1 мин при комнатной температуре.
- Выбросьте надосадочную жидкость, за исключением последних 50 мкл. Повторно суспендируйте гранулу в 50 мкл первого буфера набора для экстракции ДНК до конечного объема 100 мкл.
- Следуйте протоколу производителя по выделению геномной ДНК из небольших объемов крови (см. Таблицу материалов).
- Добавьте 10 мкл протеиназы К и 100 мкл второго буфера набора для экстракции ДНК; Перемешивание методом импульсно-вортексирования в течение 15 с. Инкубируйте образцы при температуре 56 °C в течение 10 минут при перемешивании со скоростью 300 об/мин. В течение этого инкубационного периода дважды перемешайте образцы путем мягкой инверсии.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Добавьте 50 μL 100% EtOH и перемешайте путем импульсного вихревого нагревания в течение 15 с. Инкубируйте образцы при комнатной температуре в течение 5 минут.
- Соберите капли со стенок и крышки пробирки, центрифугируя пробирку в течение 1-2 с с помощью мини-центрифуги. Перенесите образцы в колонку для экстракции ДНК (колонка находится в пробирке для сбора объемом 2 мл), не смачивая ободок. Центрифугируйте при 6 000 × г в течение 1 мин.
- Поместив колонку в чистую сборную пробирку объемом 2 мл, выбросьте сборную трубку, содержащую проточный проход. Добавьте в колонку 500 мкл буфера третьего набора для экстракции ДНК, не смачивая ободок, и центрифугируйте при 6000 × г в течение 1 мин.
- Опять же, поместив колонку в чистую сборную пробирку объемом 2 мл, выбросьте сборную трубку, содержащую проточный проход. Добавьте 500 мкл четвертого буфера набора для экстракции ДНК в колонку, не смачивая ободок, и центрифугируйте при 6000 × г в течение 1 мин.
- Поместите колонку в чистую пробирку для сбора объемом 2 мл и выбросьте проточную пробирку для сбора. Центрифугируйте при 20 000 × г в течение 3 мин.
- Поместите колонку в чистую микроцентрифужную пробирку объемом 1,7 мл и выбросьте проточную пробирку для сбора. Добавьте 20 μL молекулярной воды в центр мембраны колонны для элюирования; Закройте крышку и инкубируйте образцы с молекулярной водой комнатной температуры в течение 5 минут.
- Центрифугируйте при 20 000 × г в течение 1 мин. Храните элюированную ДНК при температуре 4 °C при кратковременном хранении или при -20 °C при длительном хранении.
- После сортировки ячеек центрифугируйте образцы при 300 × г в течение 5 с, чтобы собрать все капли с боков и крышки. Убедитесь, что все капли собраны.
- Расщепление и очистка РНК
ПРИМЕЧАНИЕ: Руководство по набору для извлечения ДНК, указанному в Таблице материалов , было использовано для получения этого протокола очистки ДНК. В зависимости от условий дПЦР, реагентов, а также конструкций праймеров и зондов, может потребоваться убедиться в полном отсутствии РНК в образце ДНК, прежде чем приступать к количественному определению vg/dg методом дПЦР. Контаминация РНК может привести к различной степени неточности значений vg/dg при определенных условиях дПЦР.- В ПЦР-пробирку объемом 0,2 мл или микроцентрифужную пробирку объемом 1,7 мл добавьте не более 20 мкл экстрагированного образца ДНК и 1,5 мкл РНКазы, свободной от ДНКазы, к каждому образцу ДНК. Если объем смеси ДНК/РНКазы составляет менее 21,5 мкл, добавьте достаточное количество молекулярной воды до конечного объема 21,5 мкл и перемешайте 25 раз, перевернув пробирки. Инкубировать при температуре 37 °C в течение 30 минут с периодическим перемешиванием каждые 10 минут, переворачивая пробирки.
ПРИМЕЧАНИЕ: Общее количество нуклеиновых кислот, добавляемых в пробирку, должно составлять от 175 нг до 700 нг. Модификации могут потребоваться, если образцы ДНК содержат объемы или количества нуклеиновых кислот за пределами этого диапазона или если образцы ДНК были выделены иначе. - Выложите на лед на 2 минуты. Добавьте достаточное количество молекулярной воды в каждую смесь ДНК/РНКазы до конечного объема 100 μл.
ПРИМЕЧАНИЕ: РНКаза, указанная здесь, рекомендуется, поскольку она переваривает загрязняющую РНК без негативного влияния на целевую ДНК или последующие ПЦР-анализы. - Следуйте протоколу производителя по очистке геномной ДНК (см. Таблицу материалов).
- Добавьте 10 мкл первого буфера для экстракции ДНК и 250 мкл второго буфера для набора для экстракции ДНК. Перемешиваем импульсно-вихревым действием в течение 10 с.
- Перенесите образцы в колонку для экстракции ДНК в пробирке для сбора объемом 2 мл, не смачивая ободок. Центрифугируйте при 6 000 × г в течение 1 мин.
- Поместив колонку в чистую сборную пробирку объемом 2 мл, выбросьте сборную трубку, содержащую проточный проход. Добавьте в колонку 500 мкл второго буфера из набора для экстракции ДНК, не смачивая ободок. Центрифугируйте при 6 000 × г в течение 1 мин.
- Поместите колонку в чистую пробирку для сбора объемом 2 мл и выбросьте проточную пробирку для сбора. Центрифуга при 20 000 × г в течение 6 мин.
- Поместите колонку в чистую микроцентрифужную пробирку объемом 1,7 мл и выбросьте сборную трубку, в которой находится проточный проход. Добавьте 20 мкл молекулярной воды в центр мембраны колонки для элюирования, закройте крышку и инкубируйте образцы с молекулярной водой при комнатной температуре в течение 5 минут.
- Центрифугируйте при 20 000 × г в течение 1 мин. Хранить при температуре 4 °C при кратковременном хранении или при температуре -20 °C при длительном хранении.
- Подтвердите отсутствие контаминации РНК в расщепленном образце РНКазы с помощью конечной ПЦР или дПЦР или количественной ПЦР (кПЦР) с использованием пары праймеров ПЦР, которая амплифицирует область мРНК, охватывающую несколько экзонов, а не только один экзон.
ПРИМЕЧАНИЕ: Мишень мРНК должна иметь ген с высокой экспрессией в ткани/типе клеток-мишени, чтобы гарантировать правильную идентификацию контаминации мРНК, если она присутствует. Ампликоны, охватывающие несколько экзонов, дифференцируют полосы, полученные в результате загрязнения мРНК и геномной ДНК. Всегда имейте при себе образец ДНК, не расщепленный РНКазой, в качестве положительного контроля для ПЦР-реакции, чтобы гарантировать обнаружение контаминации мРНК, если она присутствует.
- В ПЦР-пробирку объемом 0,2 мл или микроцентрифужную пробирку объемом 1,7 мл добавьте не более 20 мкл экстрагированного образца ДНК и 1,5 мкл РНКазы, свободной от ДНКазы, к каждому образцу ДНК. Если объем смеси ДНК/РНКазы составляет менее 21,5 мкл, добавьте достаточное количество молекулярной воды до конечного объема 21,5 мкл и перемешайте 25 раз, перевернув пробирки. Инкубировать при температуре 37 °C в течение 30 минут с периодическим перемешиванием каждые 10 минут, переворачивая пробирки.
- Цифровая ПЦР (дПЦР)
- ПЦР в конечной точке для проверки специфичности праймеров и оптимальных условий ПЦР (опционально)
- Разработка пар праймеров и зондов dPCR для векторного генома и пар праймеров dPCR и зондов для референсного гена мыши, которые будут использоваться для количественной оценки диплоидных геномов в образце.
ПРИМЕЧАНИЕ: Стремитесь к размеру ампликона от 60 до 150.н. Референсный ген мыши должен быть геном, который имеет постоянное число копий гена на диплоидный геном. Для перечисленных здесь расчетов референсный ген (Polr2a) имеет две копии на диплоидный геном. - Для ПЦР-реакции с конечной точкой объемом 10 мкл приготовьте смесь для ПЦР с использованием реагентов и конечных концентраций, которые будут использованы позже для реакции дПЦР. Добавьте расщепленный РНКазой образец матричной ДНК (количество нуклеиновых кислот в диапазоне 56-223 нг) до конечной концентрации 1x мастер-смеси dPCR, содержащей ДНК-полимеразу и dNTP, 0,8 мкМ каждого прямого праймера, 0,8 мкМ каждого обратного праймера, 0,4 мкМ каждого зонда и 0,025 Ед/мкл фермента рестрикции (конечная концентрация фермента рестрикции зависит от используемого фермента рестрикции и марки). Добавьте молекулярную воду до конечного объема 10 мкл.
ПРИМЕЧАНИЕ: В смеси для ПЦР должно быть не менее двух пар праймеров и двух зондов: одна пара праймеров и один зонд для детектирования векторного генома и одна пара-праймер и один зонд для детектирования генома мыши. - Условия термического циклирования ПЦР: начальная стадия тепловой активации при 95 °C в течение 2 мин, за которой следуют 35-45 циклов стадии денатурации при 95 °C в течение 25 с и комбинированная стадия отжига/удлинения при 58-62 °C в течение 1 мин.
ПРИМЕЧАНИЕ: Оптимальная температура отжига должна быть определена для каждой пары ампликона и праймера. Количество циклов может быть скорректировано в соответствии с количеством матричной ДНК в образце. - Визуализируйте продукт ПЦР на агарозном геле с помощью гель-электрофореза для определения наличия целевых полос ампликона и любых возможных неспецифических полос амплификации.
- Переходите к следующему этапу дПЦР после подтверждения того, что пары праймеров и условия циклирования приводят к специфической амплификации целевых последовательностей.
- Разработка пар праймеров и зондов dPCR для векторного генома и пар праймеров dPCR и зондов для референсного гена мыши, которые будут использоваться для количественной оценки диплоидных геномов в образце.
- реакция дПЦР
- Для реакции дПЦР объемом 40 мкл добавьте до 4 мкл расщепленного РНКазой образца матричной ДНК (количество нуклеиновых кислот в диапазоне 50-330 нг) до конечной концентрации 1x мастер-смеси дПЦР, содержащей ДНК-полимеразу и дНТФ, 0,8 мкМ каждого прямого праймера, 0,8 мкМ каждого обратного праймера, 0,4 мкМ каждого зонда, и 0,025 Ед/мкл фермента рестрикции (конечная концентрация фермента рестрикции зависит от используемого фермента рестрикции и марки). Добавьте молекулярную воду до конечного объема 40 мкл.
- Условия термического циклирования dPCR: начальная стадия активации нагрева при 95 °C в течение 2 мин, за которой следуют 40-50 циклов стадии денатурации при 95 °C в течение 25 с и комбинированная стадия отжига/удлинения при 58-62 °C в течение 1 мин.
ПРИМЕЧАНИЕ: Оптимальная температура отжига должна быть определена для каждой пары ампликона и праймера. Количество циклов может быть скорректировано в соответствии с количеством матричной ДНК в образце. Объемы, концентрации и условия, перечисленные здесь, оптимизированы для планшетов, реагентов и устройств для дПЦР, перечисленных в Таблице материалов. Эти условия снижают действие любых потенциальных ингибиторов дПЦР, которые могут снизить точность реакции. - После проведения реакции дПЦР и получения абсолютных значений векторных геномов и референсного гена мыши рассчитать vg/dg в образце с помощью уравнений (7-8).
Для референсных генов с двумя копиями генов/диплоидным геномом:
Абсолютное значение диплоидных геномов (dg) =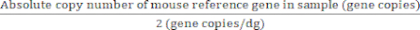 (7)
(7)
vg/dg =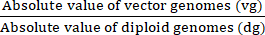 (8)
(8) - Проверьте 1D-диаграмму рассеяния реакции dPCR, чтобы подтвердить достоверность анализа и количественной оценки (рис. 3A, C). Чтобы анализ был валидным, убедитесь, что 1D диаграмма рассеяния удовлетворяет всем следующим критериям: наличие положительных и отрицательных разбиений; четкое разделение между положительными и отрицательными разделами для точного определения пороговых значений; и отсутствие капель между положительным и отрицательным разделами (также известное как дождь), что может снизить точность количественного определения dPCR.
- ПЦР в конечной точке для проверки специфичности праймеров и оптимальных условий ПЦР (опционально)
Результаты
Мышам в возрасте от 7 до 9 недель вводили AAV через боковую инъекцию в хвостовую вену в дозе 1,5 ×10 12 vg/мышь в объеме 150-200 μл. Использованный здесь AAV ssDNA доставляет трансген Cre-рекомбиназы, управляемый промотором ЦМВ. Инъецированные мыши были гомозиготны по аллелю Ai14 репортера Cre. При воздействии Cre-рекомбиназы клетки, содержащие аллель Ai14, экспрессируют флуоресцентный белок tdTomato. Поскольку экспрессия tdTomato вызвана Cre-индуцированной геномной рекомбинацией, клетки, экспрессирующие tdTomato, указывают на клетки, которые либо были непосредственно трансдуцированы AAV, либо были клетками-потомками трансдуцированных клеток. Представленные здесь данные относятся к мышам, которым вводили AAV9-CMV-Cre в дозе 1,5 ×10 12 вг/мышь в дозе 160 мкл (5,8-5,9 ×10 13 вг/кг). Мышей умерщвляли через 28 дней после инъекции, а ткани собирали, как описано выше. Несколько скелетных мышц и долей печени были переварены, а их клетки были собраны с помощью FACS. Несколько долей печени были немедленно заморожены с использованием предварительно охлажденного метилбутана для экстракции нуклеиновых кислот. Несколько скелетных мышц и долей печени были зафиксированы-заморожены для гистологической визуализации флуоресцентного tdTomato. tdTomato диффузно экспрессировался по всей печени (рис. 2A) и квадрицепсам (рис. 2C), что указывает на то, что AAV9 широко достигал и трансдуцировал различные области обеих тканей.
ДНК, экстрагированная из свежезамороженной печени и отсортированных с помощью FACS клеток, использовалась для количественного определения vg/dg с помощью дПЦР. Количественное определение Vg/dg может быть использовано для оценки консистенции впрыска и эффективности трансдукции AAV в анализируемом образце. Для обеспечения валидности анализа были использованы одномерные диаграммы рассеяния капель из свежезамороженного образца ткани печени и клеток, отсортированных методом FACS (рис. 3A, C). Диаграмма рассеяния показала наличие положительных и отрицательных разделов, четкое разделение между положительными и отрицательными разделами, позволяющее точно определить порог обнаружения, и отсутствие капель между положительным и отрицательным разделами, что может снизить точность анализа dPCR. Соответствие всем этим критериям свидетельствовало о том, что результаты анализа дПЦР были действительными. Количество копий гена Polr2a в каждом образце количественно оценивали для определения количества диплоидных геномов мыши (2 копии гена Polr2a /диплоидный геном мыши), а для количественной оценки вирусного генома использовали праймеры/зонд против трансгенной последовательности Cre-рекомбиназы (1 копия трансгена/вирусный геном, Таблица 1). Значение vg/dg было количественно определено для свежезамороженного образца ткани печени и клеток, отсортированных методом FACS, и показало наличие 187,7 vg/dg и 4,7 vg/dg в каждом образце соответственно (рис. 3B, D). В качестве отрицательного контроля использовали образцы от мышей, которым вводили PBS, и контрольных мышей, не содержащих нуклеиновых кислот.

Рисунок 1: Обзор станции внутривенных инъекций. (A) Инструменты, необходимые для выполнения внутривенной инъекции. Здесь представлены (1) таймер, (2) ограничитель для мышиной трубки, (3) неразрезанные и (4) вырезанные пластиковые конусы, (5) спиртовой тампон, (6) пустая коробка для наконечников для пипетки, используемая в качестве платформы для подъема ограничителя мышиной трубки, (7) одноразовые абсорбирующие прокладки, (8) коническая трубка объемом 15 мл с теплой водой, (9) держатель трубки объемом 15 мл, (10) марля и (11) инсулиновый шприц. (B) Мышь сначала помещается внутрь ограничителя трубки. Затем вставляется отрезанный конус ограничителя для создания ограничивающего рукава вокруг мыши, если мышь слишком мала и ее можно удерживать только с помощью ограничителя трубки. Следите за тем, чтобы удерживающие устройства не препятствовали дыханию мыши. Ограничитель трубки размещается на возвышенной платформе, чтобы хвост мыши мог находиться в теплой воде. (C) Положение хвоста мыши и угол удержания иглы непосредственно перед выполнением инъекции. Оттяните хвост назад, чтобы хвост был растянут, а место укола было полностью горизонтальным. Игла расположена параллельно хвосту и жилке, а скос – вверх. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
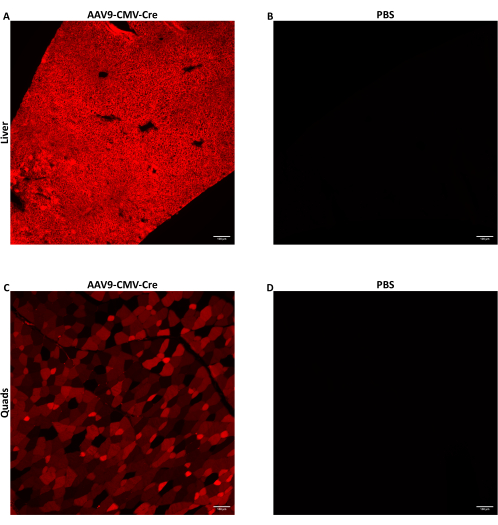
Рисунок 2: Обнаружение флуоресцентного репортерного белка после внутривенного введения. Мышам-самцам в возрасте от 7 до 9 недель, содержащим аллель Ai14 Cre reporter, вводили либо AAV9-CMV-Cre в дозе 1,5 ×10 12 vg/мышь, доставляемым в 160 мкл (5,8-5,9 ×10 13 vg/кг), либо PBS. Репрезентативные флуоресцентные изображения срезов печени (А) или квадрицепса (С) мыши после AAV9 при внутривенном введении Cre. (B) Срезы печени или (D) четырехглавой мышцы мышей, которым вводили PBS, были визуализированы в качестве отрицательного контроля. Ткани были собраны и зафиксировано-заморожены через 28 дней после внутривенной инъекции. После воздействия Cre флуоресцентный белок tdTomato экспрессируется в трансдуцированных клетках и клетках-потомках трансдуцированных клеток. Срезы толщиной 10 мкм были получены с 10-кратным увеличением. Масштабные линейки = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
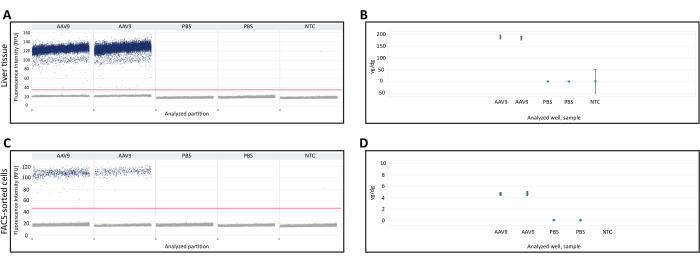
Рисунок 3: Количественное определение векторного генома для каждого диплоидного генома (vg/dg). 1D-диаграмма рассеяния векторных геномов dPCR в (A) ткани печени или (C) FACS-отсортированных клетках, собранных у мышей, которым вводили AAV9-CMV-Cre или PBS. На диаграммах рассеяния показаны положительные и отрицательные разделы dPCR, а также порог обнаружения, обозначенный горизонтальной линией поперек образцов. (B,D) количественное определение vg/dg после количественного определения диплоидных геномов мыши и векторных геномов в (B) ткани печени или (D) образцах клеток, отсортированных методом FACS. Показанные здесь результаты получены от одной мыши, введенной AAV9, и одной мыши, введенной PBS, с техническим дубликатом dPCR для каждой мыши. Полосы погрешностей указывают 95% доверительный интервал для каждой выборки. Сокращения: NTC= Нешаблонное управление; dPCR = цифровая ПЦР; FACS = флуоресцентно-активируемая сортировка клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Букварь | Последовательность |
| Прямолинейный праймер Cre | CTGACGGTGGGAGAATGTTAAT |
| Обратная грунтовка Cre | CATCGCTCGACCAGTTTAGTT |
| Щуп Cre | /56-FAM/CGCAGGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Передний праймер Polr2a | GACTCCTTCACTCACTCTTC |
| Обратная грунтовка Polr2a | TCTTGCTAGGCAGTCCATTATC |
| Щуп Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Таблица 1: Последовательности праймеров и зондов, используемых для количественного определения vg/dg. Для количественной оценки векторного генома были использованы праймеры Cre и зонд. Праймеры и зонд Polr2a были использованы для количественной оценки диплоидного генома мыши.
Обсуждение
Терапия на основе AAV обладает большим потенциалом для лечения моногенных заболеваний благодаря универсальности AAV в качестве вектора генной терапии, что позволяет настраивать AAV для удовлетворения различных потребностей в доставке различных расстройств 4,5,7,9. AAV обычно вводят путем внутривенного введения на доклинических моделях мышей для проверки безопасности и эффективности потенциальных терапевтических средств16. Поскольку различные дозы вводимого AAV могут приводить к заметным различиям в экспериментальных результатах, для экспериментаторов крайне важно иметь возможность последовательно вводить предполагаемую дозу AAV, чтобы обеспечить достоверность и надежность полученных in vivo данных28. Внутривенные инъекции широко используются, но они технически сложны, требуют обширной подготовки и постоянной практики для развития и поддержания уровня навыков, обеспечивающего неизменно успешные инъекции 16,17,18,19. В дополнение к правильному введению AAV, обычно желательно использовать анализы для оценки биораспределения введенного AAV и эффективности его доставки к тканям или клеткам-мишеням29,30.
Этот протокол направлен на то, чтобы помочь экспериментаторам легко и успешно выполнять внутривенные инъекции, подробно описывая детали оптимизированного протокола внутривенных инъекций для введения AAV мышам в возрасте 7-9 недель без седативных препаратов. Важно отметить, что мыши, которые заметно меньше или крупнее, чем мыши дикого типа в возрастном диапазоне, используемом здесь, могут представлять большую проблему из-за ограниченной видимости вен или несовместимости с ограничителями, используемыми в этом методе. Ранее сообщалось, что внутривенные инъекции хвостового раствора не подходят для внутривенного введения реагентов мышам младше 6 недель из-за небольшого размера сосуда31. Несмотря на то, что это возможно, может быть трудно успешно последовательно вводить мышам весом менее 22,0 г. Исследователям, использующим мышей нетипичного размера, может потребоваться внести изменения в процедуру. В этом протоколе также описаны несколько анализов, которые могут быть использованы для оценки биораспределения AAV и эффективности трансдукции.
При следовании этому протоколу необходимо помнить о некоторых критических моментах. Во время инъекции иглы 29 G обеспечивают большее сопротивление, если игла не находится внутри вены. Это уменьшает объем, потерянный при случайном периваскулярном введении раствора при неудачных попытках инъекции. Инсулиновые шприцы имеют меньший мертвый объем, чем обычные шприцы. При использовании шприца и/или иглы, отличной от перечисленных здесь, может потребоваться подготовка дополнительного объема инъекции на этапах протокола 1.1.3.3 для учета большего объема мертвого пространства (например, добавьте 30 мкл к предполагаемой дозе вместо 15 мкл).
Если во время аспирации дозы AAV в шприц на стенках шприца образуются мелкие пузырьки воздуха, вызванные аспирацией, медленно протяните инъекцию дальше по шприцу. Это позволит удалить большинство мелких пузырьков воздуха. Загрузите не менее 10-15 μл AAV дополнительно к предполагаемому объему для впрыскивания. Этот дополнительный объем предназначен для учета любого объема, который может быть потерян во время вытеснения пузырьков воздуха или возможных неудачных попыток впрыска. (например, если целевой объем для введения составляет 150 мкл, загрузите 165 мкл в шприц (на полпути между отметками 160 мкл и 170 мкл на шкале шприца). Если игла правильно помещена внутрь вены, а объем в шприце находится на уровне 165 мкл непосредственно перед успешной попыткой инъекции, подавайте реагент до тех пор, пока в шприце не останется 15 мкл (на полпути между отметками 10 мкл и 20 мкл), таким образом, доставляя 150 мкл (165 мкл - 150 мкл = 15 мкл)). Выравнивание просвета скоса (фаска вверх) со шкалой шприца позволяет отслеживать подаваемый объем во время инъекции.
Некоторые экспериментаторы могут предпочесть положить мышь на бок так, чтобы одна из ее вен была прямой и легко доступной, по сравнению с мышью на ногах. Однако хвост мыши на бок будет наклонен под разными углами в зависимости от размера мыши, что требует регулировки угла инъекции при инъекции мышам разных размеров. Это может негативно сказаться на стабильности успеха процедуры. Во время первоначальных практических попыток экспериментаторы могут попробовать обе ориентации для ограничения мыши, чтобы определить предпочтительный подход. Наличие мыши на ногах обеспечивает быстрый и легкий доступ к обеим боковым хвостовым венам. Это сокращает время сдерживания, когда необходим доступ к обеим венам в случае многократных неудачных попыток инъекции.
При введении боковой вены близко к основанию хвоста (ближе к телу мыши) (особенно для мышей весом >30 г) отрегулируйте угол инъекции от параллельного к вене до 5°-10° к вене, так как вена у основания хвоста находится немного глубже, чем дистально.
Перечисленные здесь протоколы проверки расщепления РНКазы и контаминации РНК были проверены на образцах ДНК, выделенных из свежезамороженных тканей печени, содержащих в общей сложности 175-700 нг нуклеиновых кислот в 20 мкл. Протокол расщепления РНКазы также был протестирован на образцах ДНК, выделенных из свежезамороженных тканей печени и FACS-отсортированных клеток, чтобы подтвердить наличие векторного генома и генома мыши после расщепления РНКазы. Результаты визуализировали с помощью электрофореза в агарозном геле конечной ПЦР-амплификации ампликонов-мишеней.
Следование описанной методологии может сократить время обучения и практики, необходимое для освоения внутривенных инъекций, и привести к более высокой частоте успешных инъекций, что позволит сэкономить реагенты. Этот протокол использует простые и часто используемые инструменты без необходимости в передовом оборудовании или настройках, которые могут быть недоступны. Кроме того, перечисленные здесь этапы внутривенного введения могут быть применены к широкому спектру инъекций, которые необходимо вводить внутривенно, таких как антисмысловые олигонуклеотиды (АСО), с соответствующими модификациями, вносимыми в стадии подготовки инъекции в зависимости от инъекции.
Раскрытие информации
Авторы не имеют никаких разоблачений, имеющих отношение к работе, опубликованной в данной статье.
Благодарности
Авторы хотели бы поблагодарить персонал учреждения по уходу за животными NINDS за их поддержку. Эта работа была поддержана Отделом внутренних исследований NIH, NINDS (Годовой отчет No 1ZIANS003129). Ответственность за содержание лежит исключительно на авторах и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Ссылки
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены