Method Article
Administration constante du virus adéno-associé par injection latérale dans la veine caudale chez des souris adultes
Dans cet article
Résumé
Nous détaillons ici un protocole optimisé pour l’injection latérale de la veine caudale chez la souris afin d’administrer systématiquement le virus adéno-associé (AAV) chez les souris adultes. De plus, nous décrivons les protocoles des tests couramment utilisés pour évaluer la transduction des AAV.
Résumé
De nombreux troubles affectent plusieurs organes ou impliquent différentes régions du corps, il est donc essentiel d’administrer des traitements de manière systémique pour cibler les cellules affectées situées dans différents sites. L’injection intraveineuse est une voie d’administration systémique largement utilisée dans les études précliniques qui évaluent les traitements destinés à une administration à l’échelle du corps. Chez les souris adultes, il implique l’administration intraveineuse de l’agent thérapeutique dans les veines latérales de la queue de la souris. Lorsqu’elles sont maîtrisées, les injections de la veine caudale sont sûres et rapides, et ne nécessitent que des outils simples et couramment disponibles. Cependant, les injections de la veine caudale sont techniquement difficiles et nécessitent une formation approfondie et une pratique continue pour assurer l’administration précise de la dose prévue.
Nous décrivons ici un protocole d’injection latérale de la veine caudale détaillé et optimisé que nous avons développé sur la base de notre expérience et des recommandations qui avaient déjà été rapportées par d’autres groupes. Outre les dispositifs de contention pour souris et les seringues à insuline, ce protocole ne nécessite que des réactifs et du matériel facilement disponibles dans la plupart des laboratoires. Nous avons constaté que le respect de ce protocole permet une administration intraveineuse réussie et constante du virus adéno-associé (AAV) dans les veines de la queue de souris âgées de 7 à 9 semaines non sédatives. De plus, nous décrivons les protocoles optimisés pour la détection histologique des protéines rapporteures fluorescentes et la quantification du génome du vecteur par génome diploïde (vg/dg) utilisés pour évaluer la transduction et la biodistribution des AAV. L’objectif de ce protocole est d’aider les expérimentateurs à effectuer facilement des injections de la veine caudale avec succès et cohérence, ce qui peut réduire le temps de pratique nécessaire pour maîtriser la technique.
Introduction
Les maladies monogéniques représentent 80 % des maladies rares, qui touchent collectivement 300 millions de personnes dans le monde 1,2. Il n’existe actuellement aucun traitement curatif approuvé pour la majorité de ces maladies rares très débilitantes 1,2,3. Cependant, les troubles monogéniques sont des candidats idéaux pour les thérapies géniques qui peuvent remplacer, compléter, corriger ou réduire au silence les gènes dysfonctionnels 4,5. À l’heure actuelle, de multiples vecteurs sont mis au point et utilisés pour administrer des thérapies géniques à des types de cellules spécifiques 4,6. L’un de ces vecteurs est le virus adéno-associé (AAV). L’AAV est un parvovirus non pathogène qui est de plus en plus utilisé comme vecteur de thérapie génique7. Comparé à d’autres vecteurs viraux, l’AAV a une immunogénicité plus faible, un potentiel d’intégration plus faible dans le génome de l’hôte et la capacité de transduire efficacement les cellules en division et non divisées dans divers tissus 7,8. De plus, de multiples approches ont été développées pour concevoir et identifier des AAV présentant des caractéristiques souhaitables telles qu’un tropisme tissulaire spécifique ou une immunogénicité encore réduite, ce qui améliore considérablement la polyvalence des AAV en tant que vecteur viral pour différentes indications9. Ces facteurs ont fait de l’AAV un vecteur de thérapie génique largement étudié et ont conduit au développement de plusieurs thérapies géniques à base d’AAV approuvées par la FDA10.
Les modèles murins sont couramment utilisés pour tester des thérapies géniques potentielles in vivo et mieux comprendre les mécanismes pathologiques des maladies monogéniques. Cela est dû à la récapitulation par les modèles murins des pathologies de différentes conditions, à la similitude de leur génome avec le génome humain et à la facilité relative de manipulation, d’entretien et de génération de souris 11,12,13. Les tests in vivo sont particulièrement importants lorsqu’il s’agit d’étudier des troubles qui affectent plusieurs systèmes ou régions du corps, tels que les dystrophies musculaires. Pour ces troubles, les tests in vitro peuvent ne pas être suffisants pour évaluer de manière exhaustive l’innocuité, l’efficacité, la pharmacocinétique et la pharmacodynamique des traitements destinés à atteindre différentes régions du corps après une administration systémique14.
Diverses voies d’administration systémique peuvent être utilisées pour administrer des médicaments. Chaque voie a ses avantages, ses inconvénients et son degré de compatibilité avec le modèle animal et le médicament étudiés15. L’injection intraveineuse latérale (IV) dans la veine caudale est une voie couramment utilisée pour l’administration systémique d’AAV chez la souris16. Les injections latérales de la veine caudale permettent une administration rapide et directe de l’injectat dans la circulation sanguine de la souris, assurant une biodisponibilité élevée du médicament dans la circulation systémique17. Ils nécessitent également des outils relativement simples et couramment disponibles pour être exécutés. Cependant, principalement en raison du petit diamètre de la veine de la queue et de la difficulté à localiser la veine, les injections latérales de la veine de la queue sont techniquement difficiles et nécessitent un haut degré de compétence et une pratique constante pour éviter les tentatives d’injection ratées ou l’administration incomplète de la dose 16,17,18,19. Ceux-ci peuvent entraîner la perte de réactifs coûteux ou des résultats imprécis, surtout si l’injection incomplète n’est pas reconnue lors de l’injection. Notre expérience résumée ici est basée sur des protocoles rapportés dans des articles bien documentés que nous avons adaptés à notre usage, en optimisant les différentes étapes de la procédure d’injection latérale de la veine caudale pour assurer des injections toujours réussies 20,21,22,23,24,25,26,27.
Ici, nous décrivons ce protocole d’injection latérale optimisé et détaillé de la veine caudale pour administrer de l’AAV à des souris non sédatives âgées de 7 à 9 semaines à l’aide d’outils simples et couramment disponibles. De plus, nous fournissons les protocoles pour les méthodes utilisées pour évaluer l’administration et la biodistribution des AAV. Ces protocoles couvrent la collecte de tissus post-injection, la fixation tissulaire, l’extraction de l’ADN et la quantification du génome du vecteur par génome diploïde (vg/dg) par réaction en chaîne par polymérase numérique (dPCR). Le protocole d’injection IV et les conseils fournis ici visent à améliorer la facilité d’effectuer avec succès des injections latérales de la veine caudale. Cela pourrait aider à réduire le temps nécessaire pour maîtriser les compétences d’injection tout en améliorant simultanément la précision et la cohérence des injections.
Protocole
Toutes les procédures de manipulation et d’injection des animaux ont été approuvées par le Comité de protection des animaux du NINDS. Toutes les procédures sur les animaux ont été menées conformément aux directives du NINDS sur le soin et l’utilisation des animaux.
1. Préparation pré-injection
- Préparation de la dose d’AAV
- Déterminez le poids moyen des souris qui seront injectées.
- Calculer le volume d’injection maximal autorisé selon les lignes directrices de l’établissement en matière de soins aux animaux, comme l’indique l’équation (1). Le volume maximal d’injection est généralement une valeur de volume (μL)/poids de souris (g) (par exemple, 10 μL/g).
Volume maximal d’injection (μL)/souris = (volume maximal d’injection (μL/g)) × (poids moyen de la souris (g)) (1)
REMARQUE : Calcul de l’échantillon : Volume d’injection maximum / souris = 10 μL / g × 20 g / souris = 200 μL / souris - Définissez la dose du génome du vecteur AAV (vg) à administrer par souris.
REMARQUE : Il peut s’agir de la même valeur absolue sur différentes souris (par exemple, toutes les souris reçoivent 1,5 × 1012 vg, quel que soit le poids de chaque souris). Ou la dose peut être en vg/kg, de sorte que le total de vg à injecter par souris doit être calculé pour chaque souris en fonction du poids de cette souris le jour de l’injection.- Si la dose est en vg/kg, peser chaque souris le jour de l’injection avant la préparation de la dose.
- Calculez les génomes vectoriels à délivrer pour chaque souris en fonction de son poids à l’aide de l’équation (2) :
Génomes de vecteurs à délivrer chez une souris spécifique (vg) = Valeur prédéterminée vg/kg (vg/kg) ×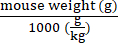 (2)
(2)
REMARQUE : L’utilisation de vg/kg comme unité de dose au lieu de vg/souris pourrait être plus appropriée dans certaines études précliniques pour garantir des comparaisons valides entre les doses injectées. Cela est dû aux différences de poids entre les souris mâles et femelles du même âge ou éventuellement entre les souris du même sexe. - Utilisez le volume maximal d’injection et la dose d’AAV (vg) pour calculer les volumes d’AAV de base et de solution saline tamponnée au phosphate stérile (PBS) nécessaires pour préparer la dose requise (voir les équations (3-6)). Assurez-vous que le volume à injecter est égal ou inférieur au volume d’injection maximal autorisé. Préparez toujours un volume d’injection supérieur d’au moins 15 μL au volume qui sera injecté pour tenir compte des erreurs de pipetage et de l’espace mort de la seringue.
Concentration de l’injectat (vg/μL) =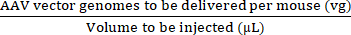 (3)
(3)
Génomes totaux des vecteurs AAV à ajouter pour préparer l’injectat (vg) = Concentration de l’injectat (vg/μL) × volume à préparer (μL) (4)
Volume de stock d’AAV à ajouter pour préparer l’injection) (μL) =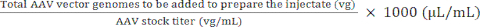 (5)
(5)
Volume de PBS à ajouter pour préparer l’injectat (μL) = Volume à préparer (μL) - Volume de stock AAV à ajouter pour préparer l’injectat (μL) (6)
REMARQUE : Exemple de calcul :
6 × 1013 vg/kg (la dose) sera délivrée dans 200 μL/souris (le volume à injecter) dans une souris qui pèse 25 g. Le titre de stock d’AAV est de 3,0 × 1013 (vg/mL)
Génomes vectoriels à délivrer chez cette souris spécifique (vg) = 6 × 1013 (vg/kg) ×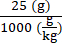 = 1,5 × 1012 vg pour cette souris
= 1,5 × 1012 vg pour cette souris
Concentration de l’injectat=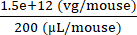 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Nombre total de génomes de vecteurs AAV à ajouter pour préparer l’injectat = 7,5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1,6125 × 1012 (vg)
Volume de stock d’AAV à ajouter pour préparer l’injectat =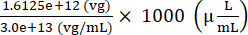 = 53,75 (μL)
= 53,75 (μL)
Volume de PBS à ajouter pour préparer l’injectat = 215 (μL) - 53,75 (μL) = 161,25 (μL)
- Procédure de préparation de la dose d’AAV
REMARQUE : Conformément aux lignes directrices de l’établissement en matière de biosécurité et d’EPI pour la manipulation des AAV, dans un tube à microcentrifuger stérile autoclavé de 1,7 mL, sans RNase et sans DNase, préparer l’injectat AAV à l’aide du stock d’AAV et du PBS stérile conformément aux calculs de l’étape 1.1.3.3. Gardez toujours l’AAV d’origine et l’injection d’AAV sur de la glace. Utilisez des micropipettes propres et des boîtes d’embouts de micropipette neuves pour garantir la stérilité. Jetez les pointes de micropipette contaminées par l’AAV conformément aux directives de gestion des déchets de l’établissement.- Décongelez l’AAV d’origine sur de la glace.
REMARQUE : Évitez de décongeler et de recongeler le stock AAV. Commandez ou préparez le stock d’AAV en aliquotes de 100 à 200 μL pour éviter d’avoir un excès d’AAV après la préparation de la dose qui devra être recongelé.
- Décongelez l’AAV d’origine sur de la glace.
- Préparation de la station d’injection
- Nettoyage
- Nettoyez la zone de travail avec de l’éthanol à 70 % (EtOH).
- Désinfectez la zone de travail à l’aide d’un ou de plusieurs réactifs bactéricides, fongicides et virucides.
- Nettoyez le dispositif de contention du tube de souris avec de l’eau et du savon.
- Configuration des outils de la station
- Placez un tube conique vide et propre de 15 ml dans un support/support de tube.
- Installez une plate-forme surélevée sur laquelle le tube de retenue de la souris sera placé (Figure 1A,B).
- Placez le dispositif de retenue du tube de souris propre dans la zone de travail.
- Si vous injectez des souris beaucoup plus petites que le tube de retenue de souris disponible, utilisez un cône de retenue de rongeur en plastique pour fabriquer un manchon de contention. Voir les étapes 2.1.3-4.
- Placez les seringues qui seront utilisées pour les injections dans la zone de travail. Utilisez des seringues à insuline de 0,3 ml avec des aiguilles de 29 g.
- Placez le conteneur à déchets le plus près possible de la station d’injection pour permettre l’élimination immédiate des outils contaminés par l’AAV.
- Tirez et poussez le piston de chaque seringue plusieurs fois pour vous assurer que le piston se déplace en douceur afin qu’il n’y ait pas de résistance causée par la seringue pendant l’injection. Si le piston ne se déplace pas en douceur, jetez cette seringue et remplacez-la par une neuve.
- Ayez une balance à souris et une mini-centrifugeuse à côté de la zone d’injection.
- Préparez l’AAV sur glace dans la zone d’injection.
- Préparez de l’eau tiède (38-40 °C). Veillez à ce que la température de l’eau ne dépasse pas 40 °C pour éviter de brûler la queue de la souris.
- Nettoyage
2. Procédure d’injection
- Contention des souris
- Pesez chaque souris pour calculer la dose en vg/kg si nécessaire.
- Assurez-vous que la souris est entièrement retenue et qu’elle ne peut pas bouger.
REMARQUE : Si la souris n’est pas complètement retenue, elle peut bouger pendant l’administration IV, ce qui entraîne le déplacement de l’aiguille. Cela pourrait faire sortir l’aiguille de la veine et/ou blesser la souris. - Pour la retenue de tube :
- Lavez le dispositif de contention à l’eau tiède et au savon entre les souris pour nettoyer et réchauffer le support.
- Tenez la souris par sa queue. Insérez la queue de la souris dans l’ouverture supérieure du tube ; Ensuite, tirez lentement la souris dans le tube de contention. Si la taille du tube de retenue est adaptée à la taille de la souris, placez la prise devant la souris pour éviter que la souris ne s’échappe.
REMARQUE : La prise doit être suffisamment proche de la souris pour empêcher la souris de bouger ou de tourner à l’intérieur du tube, mais la prise ne doit pas obstruer le nez de la souris pour permettre à la souris de respirer librement. Si la souris est plus petite que la taille du tube de contention, utilisez un cône de contention jetable flexible en plus du tube de contention comme décrit ci-dessous à l’étape 2.1.4.
- Pour les cônes de contention jetables flexibles si nécessaire (pour faire un manchon de retenue pour les souris plus petites) :
- Faites une incision à l’extrémité du nez du cône pour vous assurer que le nez de la souris n’est pas obstrué et que la souris a suffisamment d’espace pour respirer.
- Coupez l’arrière du cône de manière à ce qu’il soit presque de la même longueur que celui de la souris (afin que le cône puisse s’insérer à l’intérieur du tube) (Figure 1A,B).
- Placez la souris dans le tube de retenue comme décrit ci-dessus à l’étape 2.1.3. Tout en tenant la queue de la souris, insérez le cône de retenue avec le côté de l’ouverture le plus large en premier dans le tube.
- Tout en tenant la queue de la souris, laissez la souris marcher dans le cône ; Ensuite, glissez le reste du cône dans le tube. Assurez-vous que la queue de la souris est complètement à l’extérieur de l’arrière du tube et que la souris a de la place pour respirer à l’intérieur du cône.
- Fixez le bouchon du tube immédiatement devant l’ouverture du nez du cône tout en vous assurant que la souris est complètement retenue et qu’elle a suffisamment d’espace pour respirer.
- Injection de la souris
- Remplissez le tube conique de 15 ml avec de l’eau tiède.
- Placez le tube de retenue avec la souris à l’intérieur sur la plate-forme surélevée (Figure 1B).
- Trempez autant que possible la queue de la souris immobilisée dans l’eau chaude pendant au moins 1 minute jusqu’à ce que les nervures latérales soient clairement dilatées et visibles (figure 1B).
- Pendant l’étape de réchauffement de la queue, chargez la dose d’AAV dans la seringue.
- Placez le tube de microcentrifugation de 1,7 mL contenant des AAV non bouchés dans un rack de tubes. Insérez l’aiguille verticalement dans le tube avec la main dominante. Une fois que l’aiguille est à l’intérieur du tube, tenez le tube avec la main non dominante.
REMARQUE : L’insertion verticale de l’aiguille évite d’endommager l’aiguille qui pourrait être causé par le contact avec la paroi du tube. D’autres méthodes alternatives de chargement de la seringue peuvent être utilisées, mais la sécurité de l’expérimentateur et de la souris injectée doit être assurée. Tenir le tube avec la main non dominante protège contre les blessures accidentelles par perforation d’aiguille si l’aiguille est insérée pendant que vous tenez le tube. - Avec l’aiguille à l’intérieur du tube, soulevez simultanément le tube et la seringue au niveau des yeux tout en vous assurant que l’aiguille ne touche pas la paroi du tube. Posez les deux bras sur la table pour les stabiliser. Tirez lentement la dose dans la seringue.
REMARQUE : L’aspiration lente empêche les fines bulles d’air de se fixer sur les côtés du corps de la seringue. - Expulsez les bulles d’air de la seringue. Si vous injectez de l’AAV, assurez-vous que les bulles d’air sont expulsées de la seringue au-dessus d’un tampon absorbant jetable qui sera jeté dans une boîte à risque biologique.
- Maintenez l’injectat pendant au moins 40 secondes pour le réchauffer.
REMARQUE : Assurez-vous toujours que l’injectat est chaud avant l’injection. Si l’injection froide est administrée, l’injection peut ne pas circuler dans la veine, à l’exception des premiers μL. - Vérifiez les veines de la queue toutes les minutes.
REMARQUE : Les veines doivent être TRÈS visibles jusqu’au site d’injection (ajouter le temps de réchauffement de la queue et le remplacer par de l’eau chaude fraîche au besoin jusqu’à ce que la veine soit clairement visible, mais ne pas dépasser le temps de contention des souris autorisé par le protocole de manipulation des animaux de l’établissement). - Après vous être assuré que les veines sont clairement visibles, retirez le dispositif de retenue du tube du haut de la plate-forme surélevée et placez le dispositif de retenue du tube directement sur la table. Positionnez la souris dans la contention avec ses pieds vers le bas et non sur le côté pour faciliter la manipulation de la queue.
REMARQUE : La souris ne doit pas être sur le côté ou à l’arrière à l’intérieur du dispositif de contention. La souris doit être entièrement retenue et incapable de bouger ou de pivoter à l’intérieur du dispositif de retenue ou de déplacer/tirer sa queue. - Essuyez rapidement la queue avec une gaze pour sécher la queue ; Essuyez la queue avec un tampon imbibé d’alcool, puis essuyez-la avec une gaze sèche.
REMARQUE : Utilisez de la gaze sèche pour rendre la queue suffisamment sèche pour permettre une prise sûre de la queue, mais pas complètement sèche. Il peut être plus difficile de voir la veine lorsque la queue est complètement sèche. - Faites pivoter la queue d’environ 90° vers la gauche ou la droite de sorte que l’une des deux nervures latérales soit tournée vers le haut. Localisez un site d’injection approprié dans le tiers médian de la queue. Commencer l’injection initiale distalement (plus près de l’extrémité de la queue) et se déplacer vers la proximale si des injections supplémentaires sont nécessaires en raison de tentatives infructueuses ou rendues nécessaires par le plan expérimental.
REMARQUE : N’essayez pas d’injecter distal à un site d’injection précédent, car l’injectat pourrait s’échapper de ce site d’injection précédent. Facultatif : utilisez le pouce et l’index de la main non dominante pour appliquer une pression proximale (en amont/plus près du corps de la souris) sur le site d’injection pendant 10 s. Les doigts agissent comme des garrots pour dilater davantage la veine au site d’injection. Immédiatement après le garrot de 10 secondes, relâchez les doigts du garrot et assurez-vous que l’une des deux veines latérales est tournée vers le haut et est clairement visible. - Tenez la queue avec la main non dominante à l’aide du pouce et de l’index immédiatement distaux du site d’injection. Repliez la queue sur l’index de manière à ce que le site d’injection repose à plat sur l’index. Tirez sur la queue de manière à ce qu’elle soit étirée et que le site d’injection soit complètement horizontal (à 0°) (parallèle à la table horizontale) (figure 1C).
- Tenez la seringue à l’aide de l’index et du majeur de la main dominante de chaque côté de la bride du corps de la seringue tout en gardant le pouce prêt au niveau du piston.
REMARQUE : Il sera ainsi plus facile de ne pas bouger le pouce ou l’aiguille une fois que l’aiguille est à l’intérieur de la veine (Figure 1C). - Posez les deux mains sur la table pour les stabiliser et placez l’aiguille directement sur et parallèlement à la queue et à la veine avec le biseau vers le haut. Gardez le site d’injection près de l’index en tenant la queue pour améliorer le contrôle et la stabilité du site d’injection.
REMARQUE : Le retenant de tube doit être suffisamment profond dans la table pour que les deux mains soient soutenues sur la table. - Tout en gardant l’aiguille parallèle à la veine de la queue et en appliquant une pression vers le bas sur l’aiguille, faites glisser l’aiguille vers l’avant dans la veine.
REMARQUE : La pression vers le bas doit être suffisante pour insérer l’aiguille à l’angle correct dans la veine. La veine est extrêmement peu profonde, de sorte que l’aiguille doit être aussi plate que possible lorsque vous essayez d’entrer dans la veine. - Injectez lentement la solution dans la veine. Après avoir administré la dose, retirez lentement l’aiguille et appliquez immédiatement une pression avec une gaze au site d’injection pendant au moins 10 s pour arrêter le saignement.
REMARQUE : Appliquez la pression aussi longtemps que nécessaire jusqu’à ce que le saignement s’arrête complètement pour éviter la perte potentielle du réactif injecté. Une goutte de sang apparaît généralement après le retrait de l’aiguille, indiquant que l’aiguille a pénétré dans la veine. Parfois, la goutte de sang n’apparaît pas, même avec une injection réussie. La goutte de sang n’indique pas que l’injection a réussi ; Cela indique seulement que l’aiguille a pénétré dans la veine. L’indicateur fiable de réussite de l’injection est l’absence totale de résistance du piston lors de l’injection. Si l’aiguille est à l’intérieur de la veine, il ne devrait pas y avoir de résistance au niveau du piston de l’aiguille lors de l’injection de l’injecté, et la veine proximale au site d’injection apparaîtra momentanément de couleur légèrement plus claire (blanches) (le blanchiment de la veine peut ne pas être très clair chez certaines souches de souris). S’il y a une résistance et/ou qu’un renflement commence à apparaître au site d’injection, l’aiguille n’est pas correctement placée à l’intérieur de la veine. Si cela se produit, retirez complètement l’aiguille de la queue et essayez d’injecter la veine à un nouveau site d’injection proximal au site d’injection échoué (plus près du corps de la souris). - Jetez les seringues et les tubes contaminés par l’AAV conformément aux directives de gestion des déchets de l’établissement.
- Libérez la souris des dispositifs de contention et remettez-la dans une nouvelle cage séparée des souris non injectées. Surveillez les souris pendant 10 minutes pour vous assurer que les niveaux d’activité sont normaux après l’injection.
REMARQUE : Cela permet d’éviter la transmission potentielle d’agents injectés à des souris non injectées si des agents transmissibles sont administrés. - Désinfectez la zone de travail à l’aide de réactifs bactéricides, fongicides et virucides et de 70 % d’EtOH. Nettoyez le dispositif de contention du tube de souris avec de l’eau et du savon.
- Placez le tube de microcentrifugation de 1,7 mL contenant des AAV non bouchés dans un rack de tubes. Insérez l’aiguille verticalement dans le tube avec la main dominante. Une fois que l’aiguille est à l’intérieur du tube, tenez le tube avec la main non dominante.
3. Dissection, prélèvement et fixation de tissus27
- Préparation de la station de prélèvement de tissus
- Nettoyez le poste de travail avec un réactif de dégradation de l’ADN conformément aux instructions du fabricant pour dégrader l’ADN contaminant qui pourrait être présent dans la zone de travail.
- Placez le méthylbutane dans un récipient métallique. Placez le récipient métallique de méthylbutane à l’intérieur d’une boîte en polystyrène ; Ensuite, entourez le récipient métallique de glace sèche de sorte que le niveau de glace carbonique entourant le récipient soit supérieur au niveau de méthylbutane à l’intérieur du récipient.
- Étiquetez et placez les tubes vides de stockage de tissus de la microcentrifugeuse de 2 mL sur la glace sèche. Laissez refroidir les tubes de stockage de méthylbutane et de tissus sur de la glace sèche pendant au moins 20 minutes avant de commencer à congeler les tissus. Placez une pince de transfert de tissu sur de la glace sèche.
- Étiquetez et remplissez un autre ensemble de tubes de stockage de tissus de microcentrifugeuse de 2 ml avec du paraformaldéhyde frais à 4 % (PFA) et conservez-les à température ambiante. Ajoutez suffisamment de 4 % de PFA dans chaque tube pour immerger complètement les tissus qui seront placés dans le tube.
- Prélèvement et fixation de tissus
- Euthanasier la souris selon les directives de l’établissement en matière de soins aux animaux.
REMARQUE : Ici, les souris ont été euthanasiées par luxation cervicale. - Vaporisez entièrement la souris avec 70% d’EtOH.
- Prélevez les mouchoirs nécessaires.
REMARQUE : Le protocole de collecte et de fixation décrit ici a été testé sur les muscles squelettiques et le foie. - Pour les tissus qui seront utilisés pour l’extraction de l’ADN :
- Déposez le tissu dans du méthylbutane pré-refroidi sur de la glace sèche et laissez le tissu dans du méthylbutane pendant au moins 1 min. À l’aide de la pince de transfert prérefroidie, les tissus congelés du méthylbutane sont transférés dans les tubes de stockage de tissus de la microcentrifugeuse de 2 mL et prérefroidis. Conservez le mouchoir à -80 °C.
REMARQUE : Facultatif : Le tissu peut être coupé en morceaux de 20 mg avant d’être déposé dans du méthylbutane pour être prêt à être utilisé à l’étape 4.1.4.
- Déposez le tissu dans du méthylbutane pré-refroidi sur de la glace sèche et laissez le tissu dans du méthylbutane pendant au moins 1 min. À l’aide de la pince de transfert prérefroidie, les tissus congelés du méthylbutane sont transférés dans les tubes de stockage de tissus de la microcentrifugeuse de 2 mL et prérefroidis. Conservez le mouchoir à -80 °C.
- Pour les tissus qui seront utilisés pour l’analyse histologique et pour la préservation de la fluorescence des protéines rapporteures :
- À l’aide d’une pince désignée par le PFA et conservée à température ambiante, déposez les tissus dans leur tube de microcentrifugation respectif qui contient 4 % de PFA (conservé à température ambiante) tout en vous assurant que le tissu est complètement immergé dans la solution de PFA à 4 %.
REMARQUE : La contamination par le PFA peut avoir un effet négatif sur différents tests moléculaires en aval. N’utilisez des forceps désignés par PFA que lors de la manipulation de PFA afin d’éviter la contamination d’autres tissus ou outils par PFA. - Placez les tubes de microcentrifugation sur une grille et couvrez la grille de papier d’aluminium pour garder les tubes dans l’obscurité. Incuber la grille couverte à 4 °C sur un agitateur en secouant doucement pendant la nuit.
- Après une nuit d’incubation, préparer 5 % de saccharose (% p/v) dans 1 x PBS en dissolvant 5,0 g de saccharose dans 70 mL de 1 x PBS en agitant vigoureusement. Ajouter suffisamment de 1 fois PBS à un volume total final de 100 mL pour obtenir une solution de saccharose à 5 % (% p/v).
- Stérilisez la solution de saccharose à 5 % à l’aide du filtre à seringue de 0,22 μm. Étiquetez et remplissez des tubes de microcentrifugation de 2,0 ml de saccharose à 5 % fraîchement préparé.
- Transférez les tissus de 4 % de PFA dans leur tube de microcentrifugation respectif qui contient 5 % de saccharose (conservé à température ambiante) tout en vous assurant que le tissu est complètement immergé dans la solution de saccharose à 5 %.
- Placez les tubes de microcentrifugation sur une grille et couvrez la grille de papier d’aluminium pour garder les tubes dans l’obscurité. Incuber la grille couverte à 4 °C sur un agitateur en secouant doucement pendant la nuit.
- Après une nuit d’incubation, préparer 20 % de saccharose (% p/v) dans 1 x PBS en dissolvant 20,0 g de saccharose dans 70 mL de 1 x PBS en agitant vigoureusement. Ajouter suffisamment de 1x PBS à un volume total final de 100 mL pour obtenir une solution de saccharose à 20 % (% p/v).
- Stérilisez la solution de saccharose à 20 % à l’aide d’un filtre à seringue de 0,22 μm. Étiquetez et remplissez des tubes de microcentrifugation de 2,0 ml avec du saccharose à 20 % fraîchement préparé.
- Transférez les tissus à 5 % de saccharose dans leur tube de microcentrifugation respectif qui contient 20 % de saccharose (conservé à température ambiante) tout en vous assurant que le tissu est complètement immergé dans la solution de saccharose à 20 %.
- Placez les tubes de microcentrifugation sur une grille et couvrez la grille de papier d’aluminium pour garder les tubes dans l’obscurité. Incuber la grille couverte à 4 °C sur un agitateur en secouant doucement pendant la nuit.
- Après une nuit d’incubation, placez le méthylbutane dans un récipient métallique et placez le récipient métallique de méthylbutane dans une boîte en polystyrène. Entourez le récipient métallique de glace sèche de sorte que le niveau de glace sèche entourant le récipient soit supérieur au niveau de méthylbutane à l’intérieur du récipient.
- Étiquetez et placez les tubes vides de stockage de tissus de la microcentrifugeuse de 2 ml sur de la glace sèche. Laissez refroidir les tubes de stockage de méthylbutane et de tissus sur de la glace sèche pendant au moins 20 minutes avant de commencer à congeler les tissus. Placez une pince de transfert sur de la glace sèche.
- Épongez rapidement les tissus à l’aide de lingettes de précision pour éliminer tout excès de 20% de saccharose. Déposez le tissu dans du méthylbutane pré-refroidi sur de la glace sèche. Laissez le tissu dans le méthylbutane pendant au moins 1 min.
- À l’aide de la pince de transfert prérefroidie, les tissus congelés du méthylbutane sont transférés dans les tubes de stockage de tissus de la microcentrifugeuse de 2 mL et prérefroidis. Conservez le mouchoir à -80 °C.
- À l’aide d’une pince désignée par le PFA et conservée à température ambiante, déposez les tissus dans leur tube de microcentrifugation respectif qui contient 4 % de PFA (conservé à température ambiante) tout en vous assurant que le tissu est complètement immergé dans la solution de PFA à 4 %.
- Euthanasier la souris selon les directives de l’établissement en matière de soins aux animaux.
4. dPCR pour la quantification vg/dg
- Extraction de l’ADN des tissus et digestion initiale de l’ARN
REMARQUE : Le manuel de la trousse d’extraction d’ADN figurant dans la Table des matériaux a été utilisé pour calculer ce protocole d’extraction d’ADN. Conservez toujours les tubes contenant les morceaux de tissu congelés sur de la glace sèche.- Préparez un seau de glace.
- Pour chaque échantillon d’ADN, étiquetez un tube à billes de lyse de 1,5 ml et deux tubes à centrifuger vides de 1,7 ml sans RNase et sans DNase.
- Ajoutez 180 μL du premier tampon du kit d’extraction d’ADN dans chaque tube à billes. Tare le premier tube de perle contenant un tampon.
REMARQUE : Si les tissus n’ont pas été prédécoupés à l’étape 3.2.4.1, utilisez une lame de rasoir pré-refroidie sur de la glace sèche pour couper le tissu en morceaux de 20 mg. Cette étape doit être effectuée à l’intérieur d’un cryostat propre maintenu à -20 °C ou moins. - Ajouter un morceau de tissu dans le tube ; peser et consigner le poids du tissu (~20 mg).
- Placez immédiatement le tube de billes de lyse avec le tissu qu’il contient sur de la glace. Le tampon peut cristalliser.
- Répétez les étapes précédentes pour chaque échantillon de tissu.
- Transférez les tubes dans le mélangeur de tubes à billes de lyse et faites-les fonctionner pendant 1 min à vitesse maximale (vitesse 10) à 4 °C.
- Placez les échantillons sur de la glace pour les transférer dans la centrifugeuse. Centrifugeuse pendant 1 min à 20 000 × g à 4 °C.
- Au cours de l’étape de centrifugation, ajoutez 20 μL de protéinase K à la première série de tubes de microcentrifugation de 1,7 mL. Après l’étape de centrifugation, transvaser le surnageant des homogénats dans les tubes de 1,7 mL contenant la protéinase K et bien mélanger. Incuber à 56 °C pendant 15 min, avec un mélange à 500 tr/min.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Incuber à température ambiante pendant 2 min.
- Ajouter 4 μL de RNase A et mélanger par bref vortex d’impulsions. Incuber à température ambiante pendant 2 min. Vortex d’impulsion pendant 15 s.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Ajouter 200 μL du deuxième tampon du kit d’extraction d’ADN. Vortex d’impulsion pendant 15 s.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Ajouter 200 μL de 100 % d’EtOH. Vortex d’impulsion pendant 15 s.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Transférez les lysats dans la colonne de spin d’extraction de l’ADN. Essorer à 6 000 × g pendant 1 min.
- Placez la colonne d’essorage dans un nouveau tube de collecte. Ajoutez 500 μL du troisième tampon du kit d’extraction d’ADN à la colonne de spin. Essorer à 6 000 × g pendant 1 min.
- Placez la colonne d’essorage dans un nouveau tube de collecte. Ajouter 500 μL du quatrième tampon du kit d’extraction d’ADN à la colonne de spin. Faites tourner à 20 000 × g pendant 3 min.
- Placez la colonne de centrifugation dans un nouveau tube de microcentrifugation de 1,7 ml. Ajoutez 100 μL d’eau de qualité moléculaire dans la colonne de spin. Incuber à température ambiante pendant 1 min. Essorer à 6 000 × g pendant 1 min à température ambiante.
- Mesurez la concentration d’ADN si nécessaire. Conserver à 4 °C pour un stockage à court terme ou à -20 °C pour un stockage à long terme.
- Extraction d’ADN à partir de cellules triées par FACS
REMARQUE : Le manuel de la trousse d’extraction d’ADN figurant dans la Table des matériaux a été utilisé pour calculer ce protocole d’extraction d’ADN.- Après avoir trié les cellules, centrifuger les échantillons à 300 × g pendant 5 s pour recueillir toutes les gouttes sur les côtés et le couvercle. Assurez-vous que toutes les gouttes sont collectées.
REMARQUE : Si le volume de l’échantillon est inférieur à 1,5 ml, passez directement à l’étape suivante. Si le volume de l’échantillon est supérieur à 1,5 ml, retirer et jeter soigneusement la partie supérieure du surnageant à l’aide d’une micropipette en laissant 1 à 1,5 ml de l’échantillon. - Mélangez l’échantillon en pipetant plusieurs fois de haut en bas et transférez l’échantillon dans un tube de microcentrifugation de 1,7 ml. Centrifuger à 515 × g pendant 1 min à température ambiante.
- Jeter le surnageant, à l’exception des derniers 50 μL. Remettre la pastille en suspension dans 50 μL du premier tampon du kit d’extraction d’ADN pour un volume final de 100 μL.
- Suivez le protocole du fabricant pour l’isolement de l’ADN génomique à partir de petits volumes de sang (voir le tableau des matériaux).
- Ajouter 10 μL de protéinase K et 100 μL de deuxième tampon du kit d’extraction d’ADN ; Mixage par vortex pulsé pendant 15 s. Incuber les échantillons à 56 °C pendant 10 min avec un mélange à 300 tr/min. Mélangez les échantillons deux fois par inversion douce pendant cette période d’incubation.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Ajouter 50 μL d’EtOH à 100 % et mélanger par vortex pulsé pendant 15 s. Incuber les échantillons à température ambiante pendant 5 min.
- Récupérez les gouttes des parois et du couvercle du tube en centrifugeant le tube pendant 1 à 2 s à l’aide d’une mini-centrifugeuse. Transférez les échantillons dans la colonne d’extraction d’ADN (la colonne est dans un tube de prélèvement de 2 ml) sans mouiller le bord. Centrifugeuse à 6 000 × g pendant 1 min.
- Après avoir placé la colonne dans un tube de collecte propre de 2 ml, jetez le tube de collecte contenant le passage continu. Ajouter 500 μL du troisième tampon du kit d’extraction d’ADN dans la colonne sans mouiller le bord et centrifuger à 6 000 × g pendant 1 min.
- Encore une fois, après avoir placé la colonne dans un tube de collecte propre de 2 ml, jetez le tube de collecte contenant le passage à eau. Ajouter 500 μL du quatrième tampon du kit d’extraction d’ADN dans la colonne sans mouiller le bord et centrifuger à 6 000 × g pendant 1 min.
- Placez la colonne dans un tube de collecte propre de 2 mL et jetez le tube de collecte contenant l’écoulement continu. Centrifugeuse à 20 000 × g pendant 3 min.
- Placez la colonne dans un tube de microcentrifugation propre de 1,7 mL et jetez le tube de collecte contenant l’écoulement continu. Ajouter 20 μL d’eau de qualité moléculaire au centre de la membrane de la colonne pour l’élution ; Fermez le couvercle et incubez les échantillons avec de l’eau de qualité moléculaire à température ambiante pendant 5 min.
- Centrifugeuse à 20 000 × g pendant 1 min. Stockez l’ADN élué à 4 °C pour un stockage à court terme ou à -20 °C pour un stockage à long terme.
- Après avoir trié les cellules, centrifuger les échantillons à 300 × g pendant 5 s pour recueillir toutes les gouttes sur les côtés et le couvercle. Assurez-vous que toutes les gouttes sont collectées.
- Digestion et nettoyage de l’ARN
REMARQUE : Le manuel de la trousse d’extraction d’ADN répertorié dans la Table des matériaux a été utilisé pour calculer ce protocole de nettoyage de l’ADN. En fonction des conditions de la dPCR, des réactifs et de la conception des amorces et des sondes, il peut être nécessaire de s’assurer de l’absence totale d’ARN dans l’échantillon d’ADN avant de procéder à la quantification de la dPCR vg/dg. La contamination par l’ARN peut entraîner divers degrés de valeurs vg/dg inexactes dans certaines conditions de dPCR.- Dans un tube PCR de 0,2 mL ou un tube de microcentrifugation de 1,7 mL, ajoutez au plus 20 μL de l’échantillon d’ADN extrait et 1,5 μL de la RNase libre de DNase à chaque échantillon d’ADN. Si le volume du mélange ADN/RNase est inférieur à 21,5 μL, ajoutez suffisamment d’eau de qualité moléculaire à un volume final de 21,5 μL et mélangez 25 fois en inversant les tubes. Incuber à 37 °C pendant 30 min avec un mélange périodique toutes les 10 min en inversant les tubes.
REMARQUE : La quantité totale d’acides nucléiques ajoutés dans le tube doit être comprise entre 175 ng et 700 ng. Des modifications peuvent être nécessaires si les échantillons d’ADN contiennent des volumes ou des quantités d’acides nucléiques en dehors de cette plage ou si les échantillons d’ADN ont été isolés différemment. - Placer sur la glace pendant 2 min. Ajouter suffisamment d’eau de qualité moléculaire à chaque mélange d’ADN et de RNase jusqu’à un volume final de 100 μL.
REMARQUE : La RNase répertoriée ici est recommandée car elle digère l’ARN contaminant sans affecter négativement l’ADN cible ou les tests PCR en aval. - Suivez le protocole du fabricant pour le nettoyage de l’ADN génomique (voir le tableau des matériaux).
- Ajoutez 10 μL du premier tampon du kit d’extraction d’ADN et 250 μL du deuxième tampon du kit d’extraction d’ADN. Mixage par pulse-vortex pendant 10 s.
- Transférez les échantillons dans la colonne d’extraction d’ADN dans un tube de prélèvement de 2 mL sans mouiller le bord. Centrifugeuse à 6 000 × g pendant 1 min.
- Après avoir placé la colonne dans un tube de collecte propre de 2 ml, jetez le tube de collecte contenant le passage continu. Ajoutez 500 μL du deuxième tampon du kit d’extraction d’ADN à la colonne sans mouiller le bord. Centrifugeuse à 6 000 × g pendant 1 min.
- Placez la colonne dans un tube de collecte propre de 2 mL et jetez le tube de collecte contenant l’écoulement continu. Centrifugeuse à 20 000 × g pendant 6 min.
- Placez la colonne dans un tube de microcentrifugation propre de 1,7 mL et jetez le tube de collecte contenant le passage d’eau. Ajoutez 20 μL d’eau de qualité moléculaire au centre de la membrane de la colonne pour l’élution, fermez le couvercle et incubez les échantillons avec de l’eau de qualité moléculaire à température ambiante pendant 5 min.
- Centrifugeuse à 20 000 × g pendant 1 min. Conserver à 4 °C pour un stockage à court terme ou à -20 °C pour un stockage à long terme.
- Confirmez l’absence de contamination par l’ARN dans l’échantillon digéré par la RNase à l’aide d’une PCR ou d’une dPCR quantitative (qPCR) à l’aide d’une paire d’amorces de PCR qui amplifierait une région d’ARNm qui s’étend sur plusieurs exons et pas seulement un seul exon.
REMARQUE : La cible de l’ARNm doit être d’un gène fortement exprimé dans le type de tissu/cellule cible pour s’assurer que la contamination par l’ARNm sera correctement identifiée si elle est présente. Les amplicons qui s’étendent sur plusieurs exons différencient les bandes résultant de la contamination de l’ARNm de l’ADN génomique. Ayez toujours un échantillon d’ADN non digéré par la RNase comme contrôle positif pour la réaction PCR afin de vous assurer que la contamination par l’ARNm sera détectée si elle est présente.
- Dans un tube PCR de 0,2 mL ou un tube de microcentrifugation de 1,7 mL, ajoutez au plus 20 μL de l’échantillon d’ADN extrait et 1,5 μL de la RNase libre de DNase à chaque échantillon d’ADN. Si le volume du mélange ADN/RNase est inférieur à 21,5 μL, ajoutez suffisamment d’eau de qualité moléculaire à un volume final de 21,5 μL et mélangez 25 fois en inversant les tubes. Incuber à 37 °C pendant 30 min avec un mélange périodique toutes les 10 min en inversant les tubes.
- PCR numérique (dPCR)
- PCR finale pour vérifier la spécificité des amorces et les conditions optimales de PCR (en option)
- Concevoir des paires d’amorces et des sondes dPCR pour le génome du vecteur, ainsi que des paires d’amorces et des sondes pour le gène de référence de la souris qui seront utilisées pour quantifier les génomes diploïdes de l’échantillon.
REMARQUE : Visez une taille d’amplicon comprise entre 60 pb et 150 pb. Le gène de référence de la souris doit être un gène qui a un nombre constant de copies de gènes par génome diploïde. Pour les calculs énumérés ici, le gène de référence (Polr2a) a deux copies par génome diploïde. - Pour une réaction PCR finale de 10 μL, préparez le mélange PCR à l’aide des réactifs et des concentrations finales à utiliser ultérieurement pour la réaction dPCR. Ajoutez l’échantillon d’ADN matrice digéré par la RNase (quantité d’acides nucléiques comprise entre 56 et 223 ng) à une concentration finale de 1 mélange maître dPCR contenant l’ADN polymérase et les dNTP, 0,8 μM de chaque amorce directe, 0,8 μM de chaque amorce inverse, 0,4 μM de chaque sonde et 0,025 U/μL d’enzyme de restriction (la concentration finale de l’enzyme de restriction dépend de l’enzyme de restriction et de la marque utilisée). Ajouter de l’eau de qualité moléculaire pour atteindre un volume final de 10 μL.
REMARQUE : Il doit y avoir au moins deux paires d’amorces et deux sondes dans le mélange PCR : une paire d’amorces et une sonde pour détecter le génome du vecteur et une paire d’amorces et une sonde pour détecter le génome de la souris. - Conditions de cycle thermique PCR : Étape initiale d’activation thermique à 95 °C pendant 2 min, suivie de 35 à 45 cycles d’une étape de dénaturation à 95 °C pendant 25 s et d’une étape combinée recuit/extension à 58-62 °C pendant 1 min.
REMARQUE : La température de recuit optimale doit être déterminée pour chaque paire d’amplicon et d’amorce. Le nombre de cycles pourrait être ajusté en fonction de la quantité d’ADN matrice dans l’échantillon. - Visualisez le produit de PCR sur un gel d’agarose à l’aide de l’électrophorèse sur gel pour déterminer la présence des bandes d’amplicon cibles et de toute bande d’amplification non spécifique possible.
- Passez à l’étape dPCR suivante après avoir vérifié que les paires d’amorces et les conditions de cyclage entraînent une amplification spécifique des séquences cibles.
- Concevoir des paires d’amorces et des sondes dPCR pour le génome du vecteur, ainsi que des paires d’amorces et des sondes pour le gène de référence de la souris qui seront utilisées pour quantifier les génomes diploïdes de l’échantillon.
- Réaction dPCR
- Pour une réaction dPCR de 40 μL, ajoutez jusqu’à 4 μL de l’échantillon d’ADN matrice digéré par la RNase (plage de quantité d’acides nucléiques de 50 à 330 ng) à une concentration finale de 1x mélange maître dPCR contenant l’ADN polymérase et les dNTP, 0,8 μM de chaque amorce directe, 0,8 μM de chaque amorce inverse, 0,4 μM de chaque sonde, et 0,025 U/μL d’enzyme de restriction (la concentration finale de l’enzyme de restriction dépend de l’enzyme de restriction et de la marque utilisée). Ajouter de l’eau de qualité moléculaire pour atteindre un volume final de 40 μL.
- Conditions de cycle thermique dPCR : Étape initiale d’activation thermique à 95 °C pendant 2 min, suivie de 40 à 50 cycles d’une étape de dénaturation à 95 °C pendant 25 s et d’une étape combinée de recuit/extension à 58-62 °C pendant 1 min.
REMARQUE : La température de recuit optimale doit être déterminée pour chaque paire d’amplicon et d’amorce. Le nombre de cycles a pu être ajusté en fonction de la quantité d’ADN matrice dans l’échantillon. Les volumes, les concentrations et les conditions répertoriés ici sont optimisés pour les plaques, les réactifs et les dispositifs d’orthophonie dPCR répertoriés dans la table des matériaux. Ces conditions réduisent l’effet de tout inhibiteur potentiel de la dPCR qui peut réduire la précision de la réaction. - Après avoir exécuté la réaction dPCR et obtenu les valeurs absolues pour les génomes du vecteur et le gène de référence de la souris, calculez vg/dg dans l’échantillon à l’aide des équations (7-8).
Pour les gènes de référence avec deux copies de gènes/génome diploïde :
Valeur absolue des génomes diploïdes (dg) =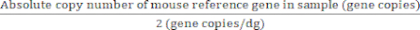 (7)
(7)
vg/dg =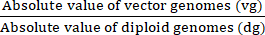 (8)
(8) - Vérifiez le nuage de points 1D de la réaction dPCR pour confirmer la validité du test et de la quantification (Figure 3A,C). Pour que le test soit valide, confirmez que le nuage de points 1D répond à tous les critères suivants : la présence de partitions positives et négatives ; séparation claire entre les cloisons positives et négatives pour permettre une détermination précise du seuil ; et la présence de gouttelettes peu ou pas nombreuses entre les cloisons positives et négatives (également appelées pluie), ce qui peut réduire la précision de la quantification par dPCR.
- PCR finale pour vérifier la spécificité des amorces et les conditions optimales de PCR (en option)
Résultats
Des souris mâles âgées de sept à neuf semaines ont reçu une injection d’AAV par injection latérale dans la veine de la queue à 1,5 × 1012 vg par souris dans un volume d’injection de 150 à 200 μL. L’AAV ssDNA utilisé ici a délivré le transgène Cre recombinase piloté par le promoteur CMV. Les souris injectées étaient homozygotes pour l’allèle Cre reporter Ai14. Lorsqu’elles sont exposées à la recombinase Cre, les cellules contenant l’allèle Ai14 expriment la protéine fluorescente tdTomato. Étant donné que l’expression de tdTomato est causée par la recombinaison génomique induite par Cre, les cellules exprimant tdTomato indiquent des cellules qui ont été soit directement transduites par l’AAV, soit étaient des cellules de descendance de cellules transduites. Les données présentées ici concernent des souris auxquelles on a injecté de l’AAV9-CMV-Cre à 1,5 × 1012 vg/souris administrées dans 160 μL (5,8-5,9 × 1013 vg/kg). Les souris ont été sacrifiées 28 jours après l’injection, et les tissus ont été prélevés comme décrit ci-dessus. Quelques muscles squelettiques et lobes hépatiques ont été digérés, et leurs cellules ont été collectées à l’aide de FACS. Quelques lobes du foie ont été congelés immédiatement à l’aide de méthylbutane prérefroidi pour l’extraction des acides nucléiques. Quelques muscles squelettiques et lobes hépatiques ont été congelés pour l’imagerie histologique de la tomate td fluorescente. tdTomato a été exprimé de manière diffuse dans le foie (figure 2A) et le quadriceps (figure 2C), ce qui indique que l’AAV9 a largement atteint et transduit différentes régions des deux tissus.
L’ADN extrait de foie fraîchement congelé et de cellules triées par FACS a été utilisé pour quantifier vg/dg à l’aide de la dPCR. La quantification Vg/dg peut être utilisée pour évaluer la cohérence de l’injection et l’efficacité de transduction de l’AAV dans l’échantillon analysé. Les diagrammes de dispersion des gouttelettes 1D de l’échantillon de tissu hépatique fraîchement congelé et des cellules triées par FACS ont été utilisés pour garantir la validité du test (figures 3A, C). Le nuage de points a montré la présence de partitions positives et négatives, une séparation claire entre les partitions positives et négatives qui permet une détermination précise du seuil de détection, et la présence de gouttelettes peu ou pas nombreuses entre les partitions positives et négatives, ce qui peut réduire la précision du test dPCR. Le fait de répondre à tous ces critères indiquait que les résultats de l’essai dPCR étaient valides. Le nombre de copies du gène Polr2a dans chaque échantillon a été quantifié pour déterminer le nombre de génomes diploïdes de souris (2 copies du gène Polr2a/génome diploïde de souris), et des amorces/sondes contre la séquence du transgène de la recombinase Cre ont été utilisées pour quantifier le génome viral (1 copie de transgène/génome viral, tableau 1). La valeur vg/dg a été quantifiée pour l’échantillon de tissu hépatique fraîchement congelé et les cellules triées par FACS et a montré la présence de 187,7 vg/dg et 4,7 vg/dg dans chaque échantillon, respectivement (figures 3B,D). Des échantillons de souris injectées de PBS et de témoins non matriciels ne contenant pas d’acides nucléiques ont été utilisés comme témoins négatifs.

Figure 1 : Vue d’ensemble de la station d’injection intraveineuse. (A) Outils nécessaires pour effectuer l’injection IV. On y voit (1) la minuterie, (2) le dispositif de retenue du tube de souris, (3) les cônes de retenue en plastique non coupés et (4) coupés, (5) le tampon d’alcool, (6) la boîte d’embouts de pipette vide utilisée comme plate-forme pour élever le dispositif de retenue du tube de souris, (7) les tampons absorbants jetables, (8) le tube conique de 15 ml avec de l’eau chaude, (9) le porte-tube de 15 ml, (10) la gaze et (11) la seringue à insuline. (B) La souris est d’abord placée à l’intérieur du tube de retenue. Ensuite, le cône de retenue coupé est inséré pour créer un manchon de retenue autour de la souris, si la souris est trop petite pour être retenue par le tube de retenue uniquement. Assurez-vous que la respiration de la souris n’est pas obstruée par les dispositifs de contention. Le tube de retenue est placé sur le dessus de la plate-forme surélevée pour permettre le placement de la queue de souris dans de l’eau chaude. (C) Positionnement de la queue de souris et angle de maintien de l’aiguille immédiatement avant d’effectuer l’injection. Tirez sur la queue pour que la queue soit étirée et que le site d’injection soit complètement horizontal. L’aiguille est parallèle à la queue et à la veine, et le biseau est tourné vers le haut. Veuillez cliquer ici pour voir une version agrandie de cette figure.
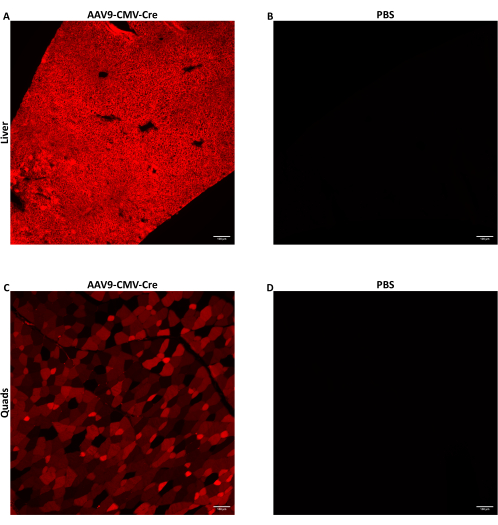
Figure 2 : Détection de la protéine rapporteure fluorescente après l’injection IV. Des souris mâles âgées de sept à neuf semaines hébergeant l’allèle rapporteur Cre Ai14 ont reçu par voie intraveineuse soit AAV9-CMV-Cre à 1,5 × 1012 vg/souris administrées dans 160 μL (5,8-5,9 × 1013 vg/kg) ou PBS. Images représentatives de fluorescence de coupes du foie (A) ou du quadriceps (C) de souris après l’injection de Cre IV par AAV9. (B) Des coupes du foie ou (D) du quadriceps de souris injectées de PBS ont été imagées pour servir de témoins négatifs. Les tissus ont été prélevés et congelés 28 jours après l’injection IV. Après l’exposition Cre, la protéine tdTomato fluorescente est exprimée dans les cellules transduites et les cellules de descendance des cellules transduites. Des coupes de 10 μm d’épaisseur ont été imagées à un grossissement de 10x. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
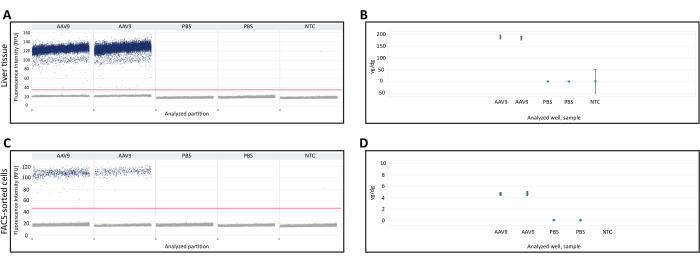
Figure 3 : Quantification du génome du vecteur par génome diploïde (vg/dg). Nuage de points 1D de la quantification des génomes des vecteurs dPCR dans (A) le tissu hépatique ou (C) les cellules triées par FACS prélevées sur des souris injectées avec AAV9-CMV-Cre ou PBS. Les nuages de points montrent les partitions dPCR positives et négatives, ainsi que le seuil de détection indiqué par la ligne horizontale traversant les échantillons. Quantification (B,D) vg/dg après quantification des génomes diploïdes de souris et des génomes de vecteurs dans le tissu hépatique (B) ou (D) des échantillons de cellules triés par FACS. Les résultats présentés ici proviennent d’une seule souris injectée d’AAV9 et d’une seule souris injectée de PBS avec un duplicata technique dPCR pour chaque souris. Les barres d’erreur indiquent l’intervalle de confiance à 95 % pour chaque échantillon. Abréviations : NTC = Non-template control ; dPCR = PCR numérique ; FACS = tri cellulaire activé par fluorescence. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Amorce | Séquence |
| Cre apprêt avant | CTGACGGTGGGAGAATGTTAAT |
| Apprêt inversé Cre | CATCGCTCGACCAGTTTAGTT |
| Sonde Cre | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Apprêt avant Polr2a | GACTCCTTCACTCACTGTCTTC |
| Amorce inversée Polr2a | TCTTGCTAGGCAGTCCATTATC |
| Sonde Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tableau 1 : Séquences d’amorces et de sondes utilisées pour la quantification vg/dg. Des amorces et une sonde Cre ont été utilisées pour quantifier le génome du vecteur. Des amorces et une sonde Polr2a ont été utilisées pour quantifier le génome diploïde de la souris.
Discussion
Les thérapies à base d’AAV présentent un grand potentiel pour les troubles monogéniques en raison de la polyvalence de l’AAV en tant que vecteur de thérapie génique, ce qui permet de personnaliser les AAV pour répondre aux divers besoins d’administration de différents troubles 4,5,7,9. Les AAV sont couramment administrés par injection IV dans des modèles murins précliniques pour tester l’innocuité et l’efficacité de traitements potentiels16. Étant donné que différentes doses d’AAV injectées peuvent entraîner des différences marquées dans les résultats expérimentaux, il est essentiel que les expérimentateurs soient en mesure d’injecter systématiquement la dose d’AAV prévue pour garantir la validité et la robustesse des données in vivo générées28. Les injections IV sont largement utilisées, mais elles sont techniquement difficiles et nécessitent une formation approfondie et une pratique continue pour développer et maintenir un niveau de compétence qui garantit des injections toujours réussies 16,17,18,19. En plus de l’injection correcte de l’AAV, il est généralement souhaitable d’utiliser des tests pour évaluer la biodistribution de l’AAV injecté et l’efficacité de l’administration dans les tissus ou les cellules cibles29,30.
Ce protocole vise à aider les expérimentateurs à effectuer facilement des injections IV avec succès et de manière cohérente en décrivant en détail les détails d’un protocole d’injection IV optimisé pour administrer l’AAV chez des souris non sédatives âgées de 7 à 9 semaines. Il est important de noter que les souris qui sont nettement plus petites ou plus grandes que les souris de type sauvage dans la tranche d’âge utilisée ici peuvent présenter un plus grand défi en raison d’une visibilité réduite des veines ou d’une incompatibilité avec les dispositifs de retenue utilisés dans cette méthode. Il a déjà été signalé que les injections par voie intraveineuse ne sont pas appropriées pour l’administration de réactifs par voie intraveineuse chez les souris de moins de 6 semaines en raison de la petite taille des vaisseaux31. Bien que possible, il peut être difficile d’injecter régulièrement des souris pesant moins de 22,0 g avec succès. Les chercheurs utilisant des souris de taille atypique peuvent avoir besoin d’adapter la procédure. Ce protocole décrit également plusieurs tests qui peuvent être utilisés pour évaluer la biodistribution et l’efficacité de la transduction des AAV.
Certains points critiques doivent être gardés à l’esprit lors du suivi de ce protocole. Lors de l’injection, les aiguilles de 29 G offrent une plus grande résistance si l’aiguille n’est pas à l’intérieur de la veine. Cela réduit le volume perdu lors d’une injection périvasculaire accidentelle de la solution lors de tentatives d’injection infructueuses. Les seringues à insuline ont des volumes morts plus petits que les seringues ordinaires. Si vous utilisez une seringue et/ou une aiguille différentes de celles énumérées ici, il peut être nécessaire de préparer un volume d’injection supplémentaire aux étapes 1.1.3.3 du protocole pour tenir compte d’un volume d’espace mort plus important (p. ex., ajouter 30 μL à la dose prévue au lieu de 15 μL).
Si de fines bulles d’air provoquées par l’aspiration se forment sur les côtés de la seringue lors de l’aspiration de la dose d’AAV dans la seringue, tirez lentement l’injectat plus haut dans la seringue. Cela éliminera la plupart des petites bulles d’air. Chargez au moins 10 à 15 μL supplémentaires d’AAV au volume prévu à injecter. Ce volume supplémentaire doit tenir compte de tout volume qui pourrait être perdu lors de l’expulsion de bulles d’air ou d’éventuelles tentatives d’injection infructueuses. (p. ex., si le volume cible à injecter est de 150 μL, chargez 165 μL dans la seringue (à mi-chemin entre les marques de 160 μL et de 170 μL sur l’échelle de la seringue). Si l’aiguille est correctement placée à l’intérieur de la veine et que le volume de la seringue est de 165 μL immédiatement avant la tentative d’injection réussie, délivrez le réactif jusqu’à ce qu’il reste 15 μL dans la seringue (à mi-chemin entre les marques de 10 μL et de 20 μL), délivrant ainsi 150 μL (165 μL - 150 μL = 15 μL)). L’alignement de la lumière du biseau (biseau vers le haut) avec l’échelle de la seringue permet de suivre le volume délivré pendant l’injection.
Certains expérimentateurs préféreront peut-être placer la souris sur le côté de manière à ce que l’une de ses veines soit droite et facilement accessible par rapport à une souris sur ses pieds. Cependant, la queue d’une souris sur le côté sera inclinée à des angles différents en fonction de la taille de la souris, ce qui nécessite un ajustement de l’angle d’injection lors de l’injection de souris de différentes tailles. Cela pourrait avoir un impact négatif sur la cohérence du succès de la procédure. Lors des premières tentatives d’entraînement, les expérimentateurs peuvent essayer les deux orientations de contention des souris pour déterminer leur approche préférée. Le fait d’avoir la souris sur ses pieds permet un accès rapide et facile aux deux veines latérales de la queue. Cela réduit le temps de contention lorsque l’accès aux deux veines est nécessaire en cas de tentatives d’injection multiples infructueuses.
Si vous injectez la veine latérale près de la base de la queue (plus près du corps de la souris) (en particulier pour les souris pesant >30 g), ajustez l’angle d’injection de parallèle à la veine à 5°-10° par rapport à la veine, car la veine à la base de la queue est légèrement plus profonde qu’elle ne l’est distalement.
Les protocoles de digestion de la RNase et de contrôle de la contamination par l’ARN énumérés ici ont été vérifiés sur des échantillons d’ADN isolés de tissus hépatiques fraîchement congelés contenant un total de 175 à 700 ng d’acides nucléiques dans 20 μL. Le protocole de digestion de la RNase a également été testé sur des échantillons d’ADN isolés de tissus hépatiques fraîchement congelés et de cellules triées par FACS pour confirmer la présence du génome du vecteur et du génome de la souris après la digestion de la RNase. Les résultats ont été visualisés à l’aide de l’électrophorèse sur gel d’agarose de l’amplification PCR finale des amplicons cibles.
Suivre la méthodologie décrite peut réduire le temps de formation et de pratique nécessaire pour maîtriser les injections IV et entraîner un taux d’injection réussi plus élevé, ce qui permettrait d’économiser des réactifs. Ce protocole utilise des outils simples et couramment utilisés sans avoir besoin d’équipements avancés ou de configurations qui pourraient ne pas être facilement disponibles. De plus, les étapes d’injection IV énumérées ici peuvent être appliquées à une large gamme d’injections qui doivent être administrées par voie intraveineuse, telles que les oligonucléotides antisens (ASOs), avec les modifications appropriées apportées aux étapes de préparation de l’injection en fonction de l’injection.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation pertinente pour le travail publié dans cet article.
Remerciements
Les auteurs tiennent à remercier le personnel de l’établissement de soins aux animaux du NINDS pour son soutien. Ce travail a été soutenu par la Division de la recherche intra-muros des NIH, NINDS (rapport annuel numéro 1ZIANS003129). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Références
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon