Method Article
Entrega consistente de vírus adeno-associado por injeção lateral na veia da cauda em camundongos adultos
Neste Artigo
Resumo
Aqui, detalhamos um protocolo otimizado para injeção de veia da cauda lateral de camundongo para administrar sistemicamente o vírus adeno-associado (AAV) em camundongos adultos. Além disso, descrevemos protocolos de ensaios comumente usados para avaliar a transdução de AAV.
Resumo
Muitos distúrbios afetam vários órgãos ou envolvem diferentes regiões do corpo, por isso é fundamental fornecer terapêutica sistemicamente para atingir as células afetadas localizadas em diferentes locais. A injeção intravenosa é uma via de administração sistêmica amplamente utilizada em estudos pré-clínicos que avaliam tratamentos destinados à administração em todo o corpo. Em camundongos adultos, envolve a administração intravenosa do agente terapêutico nas veias laterais da cauda do camundongo. Quando dominadas, as injeções nas veias da cauda são seguras e rápidas e requerem apenas ferramentas simples e comumente disponíveis. No entanto, as injeções nas veias da cauda são tecnicamente desafiadoras e exigem treinamento extensivo e prática contínua para garantir a entrega precisa da dose pretendida.
Aqui descrevemos um protocolo detalhado, otimizado, de injeção de veia da cauda lateral que desenvolvemos com base em nossa experiência e em recomendações que haviam sido relatadas anteriormente por outros grupos. Além dos aparelhos de retenção de camundongos e seringas de insulina, este protocolo requer apenas reagentes e equipamentos que estão prontamente disponíveis na maioria dos laboratórios. Descobrimos que seguir este protocolo resulta em uma entrega intravenosa consistentemente bem-sucedida de vírus adeno-associado (AAV) nas veias da cauda de camundongos de 7 a 9 semanas de idade não sedados. Além disso, descrevemos os protocolos otimizados para a detecção histológica de proteínas repórter fluorescentes e quantificação do genoma vetorial por genoma diplóide (vg / dg) usados para avaliar a transdução e biodistribuição de AAV. O objetivo deste protocolo é ajudar os experimentadores a realizar facilmente injeções nas veias da cauda com sucesso e consistência, o que pode reduzir o tempo de prática necessário para dominar a técnica.
Introdução
As doenças monogênicas representam 80% das doenças raras, que afetam coletivamente 300 milhões de indivíduos em todo o mundo 1,2. Atualmente, não há terapias curativas aprovadas para a maioria dessas doenças raras altamente debilitantes 1,2,3. No entanto, os distúrbios monogênicos são candidatos ideais para terapias gênicas que podem substituir, suplementar, corrigir ou silenciar genes disfuncionais 4,5. Atualmente, vários vetores estão sendo desenvolvidos e usados para fornecer terapias gênicas a tipos específicosde células 4,6. Um desses vetores é o vírus adeno-associado (AAV). O AAV é um parvovírus não patogênico que está sendo cada vez mais usado como vetor de terapia gênica7. Em comparação com outros vetores virais, o AAV tem menor imunogenicidade, menor potencial de integração ao genoma do hospedeiro e capacidade de transduzir eficientemente células em divisão e não divisão em vários tecidos 7,8. Além disso, várias abordagens foram desenvolvidas para projetar e identificar AAVs com características desejáveis, como tropismo tecidual específico ou imunogenicidade ainda mais reduzida, o que aumenta muito a versatilidade do AAV como vetor viral para diferentes indicações9. Esses fatores tornaram o AAV um vetor de terapia gênica amplamente investigado e levaram ao desenvolvimento de várias terapias genéticas baseadas em AAV aprovadas pela FDA10.
Modelos de camundongos são comumente usados para testar possíveis terapias genéticas in vivo e entender melhor os mecanismos patológicos de distúrbios monogênicos. Isso se deve à recapitulação dos modelos de camundongos das patologias de diferentes condições, à semelhança de seu genoma com o genoma humano e à relativa facilidade de manuseio, manutenção e geração de camundongos 11,12,13. O teste in vivo é particularmente importante ao estudar distúrbios que afetam vários sistemas ou regiões do corpo, como distrofias musculares. Para esses distúrbios, os testes in vitro podem não ser suficientes para avaliar de forma abrangente a segurança, eficácia, farmacocinética e farmacodinâmica da terapêutica destinada a atingir diferentes regiões do corpo após administração sistêmica14.
Várias vias de administração sistêmica podem ser usadas para administrar medicamentos. Cada via tem suas vantagens, desvantagens e grau de compatibilidade com o modelo animal e o medicamento investigado15. A injeção intravenosa (IV) da veia da cauda lateral é uma via comumente usada para a administração sistêmica de AAV em camundongos16. As injeções laterais nas veias da cauda permitem a administração rápida e direta do injetado na corrente sanguínea do camundongo, garantindo alta biodisponibilidade do medicamento na circulação sistêmica17. Eles também exigem ferramentas relativamente simples e comumente disponíveis para serem executadas. No entanto, principalmente devido ao pequeno diâmetro da veia da cauda e à dificuldade de localização da veia, as injeções laterais da veia da cauda são tecnicamente desafiadoras e requerem um alto grau de habilidade e prática constante para evitar tentativas fracassadas de injeção ou administração incompleta da dose 16,17,18,19. Isso pode resultar na perda de reagentes caros ou resultados imprecisos, especialmente se a injeção incompleta não for reconhecida durante a injeção. Nossa experiência resumida aqui é baseada em protocolos relatados em artigos bem documentados que adaptamos para nosso uso, otimizando várias etapas do procedimento de injeção da veia da cauda lateral para garantir injeções consistentemente bem-sucedidas 20,21,22,23,24,25,26,27.
Aqui, descrevemos este protocolo detalhado de injeção de veia da cauda lateral otimizado para administrar AAV em camundongos não sedados de 7 a 9 semanas usando ferramentas simples e comumente disponíveis. Além disso, fornecemos os protocolos para métodos usados para avaliar a entrega e a biodistribuição de AAV. Esses protocolos abrangem coleta de tecido pós-injeção, fixação de tecido, extração de DNA e genoma vetorial de reação em cadeia da polimerase digital (dPCR) por quantificação do genoma diplóide (vg/dg). O protocolo de injeção IV e as dicas fornecidas aqui visam aumentar a facilidade de realizar com sucesso injeções laterais na veia da cauda. Isso ajudará potencialmente a reduzir o tempo necessário para dominar as habilidades de injeção e, ao mesmo tempo, melhorar a precisão e a consistência das injeções.
Protocolo
Todos os procedimentos de manuseio e injeção de animais foram aprovados pelo Comitê de Cuidados com Animais do NINDS. Todos os procedimentos com animais foram conduzidos em conformidade com as diretrizes de cuidados e uso de animais do NINDS.
1. Preparação pré-injeção
- Preparação da dose de AAV
- Determine o peso médio dos camundongos que serão injetados.
- Calcular o volume máximo permitido de injetar de acordo com as orientações da instituição em matéria de cuidados com os animais, conforme indicado na equação (1). O volume máximo injetado é normalmente um valor de volume (μL)/peso do rato (g) (por exemplo, 10 μL/g.).
Volume máximo de injeção (μL)/camundongo= [volume máximo de injeção (μL/g)) × [peso médio do camundongo (g)) (1)
NOTA: Cálculo de amostra: Volume máximo de injeção / camundongo = 10 μL / g × 20 g / mouse = 200 μL / mouse - Defina a dose do genoma do vetor AAV (vg) a ser administrada por camundongo.
NOTA: Este pode ser o mesmo valor absoluto em diferentes mouses (por exemplo, todos os mouses recebem 1,5 × 1012 vg, independentemente de quanto cada mouse pesa). Ou a dose pode ser em vg/kg, pelo que o vg total a injetar por ratinho deve ser calculado para cada ratinho de acordo com o peso desse ratinho no dia da injeção.- Se a dose for em vg/kg, pesar cada ratinho no dia da injeção antes da preparação da dose.
- Calcular os genomas vectoriais a entregar a cada ratinho de acordo com o seu peso, utilizando a equação (2):
Genomas vectoriais a serem entregues num ratinho específico (vg) = valor pré-especificado de vg/kg (vg/kg) ×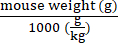 (2)
(2)
NOTA: Usar vg / kg como unidade de dose em vez de vg / camundongo pode ser mais apropriado em certos estudos pré-clínicos para garantir comparações válidas entre as doses injetadas. Isso se deve às diferenças de peso entre camundongos machos e fêmeas da mesma idade ou possivelmente entre camundongos do mesmo sexo. - Utilizar o volume máximo de injecção e a dose de AAV (vg) para calcular os volumes de AAV de reserva e de solução salina estéril tamponada com fosfato (PBS) necessários para preparar a dose necessária (ver equações (3-6)). Certifique-se de que o volume a ser injetado seja igual ou menor que o volume máximo de injeção permitido. Sempre prepare um volume injetado que seja pelo menos 15 μL maior que o volume que será injetado para levar em conta os erros de pipetagem e o espaço morto da seringa.
Concentração de injetado (vg/μL) =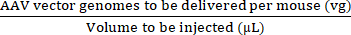 (3)
(3)
Total de genomas de vetores AAV a adicionar para preparar o injectado (vg) = Concentração de injectado (vg/μL) × volume a preparar (μL) (4)
Volume de estoque de AAV a ser adicionado para preparar o injetado) (μL) =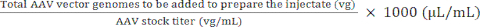 (5)
(5)
Volume de PBS a adicionar para preparar o injectado (μL) = Volume a preparar (μL) - Volume de stock de AAV a adicionar para preparar o injectado (μL) (6)
NOTA: Exemplo de cálculo:
6 × 1013 vg/kg (a dose) será administrada em 200 μL/camundongo (o volume a ser injetado) em um camundongo que pesa 25 g. O título de estoque de AAV é de 3,0 × 1013 (vg/mL)
Genomas vetoriais a serem entregues neste camundongo específico (vg) = 6 × 1013 (vg/kg) ×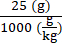 = 1,5 × 1012 vg para este camundongo
= 1,5 × 1012 vg para este camundongo
Concentração de injectado =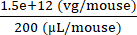 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Total de genomas vetoriais AAV a serem adicionados para preparar o injetado = 7,5 × 109 (vg/μL) × (200 (μL) + 15 (μL)) = 1,6125 × 1012 (vg)
Volume de estoque de AAV a ser adicionado para preparar o injetado =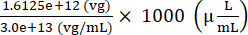 = 53,75 (μL)
= 53,75 (μL)
Volume de PBS a ser adicionado para preparar o injetado = 215 (μL) - 53,75 (μL) = 161,25 (μL)
- Procedimento de preparação da dose de AAV
NOTA: Seguindo as diretrizes de biossegurança e EPI da instituição para manuseio de AAV, em um tubo de microcentrífuga autoclavado estéril sem RNase e sem DNase de 1,7 mL, prepare o AAV injetado usando o estoque de AAV e PBS estéril de acordo com os cálculos da etapa 1.1.3.3. Sempre mantenha o estoque AAV e AAV injetado no gelo. Use micropipetas limpas e novas caixas de ponteiras de micropipeta para garantir a esterilidade. Descarte as pontas de micropipeta contaminadas com AAV de acordo com as diretrizes de gerenciamento de resíduos da instituição.- Descongele o estoque AAV no gelo.
NOTA: Evite descongelar e recongelar o estoque AAV. Encomende ou prepare o estoque de AAV em alíquotas de 100-200 μL para evitar excesso de AAV após a preparação da dose que precisará ser recongelada.
- Descongele o estoque AAV no gelo.
- Preparação da estação de injeção
- Limpeza
- Limpe a área de trabalho com etanol 70% (EtOH).
- Desinfete a área de trabalho usando um reagente bactericida, fungicida e virucida.
- Limpe o limitador do tubo do mouse com água e sabão.
- Configuração de ferramentas de estação
- Coloque um tubo cônico limpo e vazio de 15 mL em um suporte/rack de tubo.
- Configure uma plataforma elevada na qual o limitador do tubo do mouse será colocado (Figura 1A,B).
- Coloque o limitador do tubo do mouse limpo na área de trabalho.
- Se injetar camundongos muito menores do que o limitador de tubo de camundongo disponível, use um cone de cone de contenção de roedores de plástico para fazer uma luva de contenção. Consulte as etapas 2.1.3-4.
- Coloque as seringas que serão usadas para injeções na área de trabalho. Use seringas de insulina de 0,3 mL com agulhas de 29 G.
- Coloque o recipiente de resíduos o mais próximo possível da estação de injeção para permitir o descarte imediato de ferramentas contaminadas com AAV.
- Puxe e empurre o êmbolo de cada seringa várias vezes para garantir que o êmbolo se mova suavemente para que não haja resistência causada pela seringa durante a injeção. Se o êmbolo não se mover suavemente, descarte esta seringa e substitua-a por uma nova.
- Tenha uma balança de rato e uma mini centrífuga disponíveis ao lado da área de injeção.
- Tenha o AAV preparado no gelo pronto na área de injeção.
- Prepare água morna (38-40 °C). Tome cuidado para que a temperatura da água não exceda 40 °C para evitar queimaduras na cauda do rato.
- Limpeza
2. Procedimento de injeção
- Restrição de mouse
- Pesar cada ratinho para calcular a dose em vg/kg, se necessário.
- Certifique-se de que o mouse esteja totalmente contido e não possa se mover.
NOTA: Se o mouse não estiver totalmente contido, ele pode se mover durante a administração intravenosa, resultando no deslocamento da agulha. Isso pode fazer com que a agulha saia da veia e/ou machuque o mouse. - Para o limitador do tubo:
- Lave o aparelho de retenção com água morna e sabão entre os mouses para limpar e aquecer o suporte.
- Segure o mouse pela cauda. Insira a cauda do mouse na abertura superior do tubo; Em seguida, puxe lentamente o mouse para dentro do limitador de tubos. Se o tamanho do limitador do tubo for adequado para o tamanho do mouse, coloque o plugue à frente do mouse para evitar que o mouse escape.
NOTA: O plugue deve estar próximo o suficiente do mouse para evitar que o mouse se mova ou gire dentro do tubo, mas o plugue não deve obstruir o nariz do mouse para permitir que o mouse respire livremente. Se o mouse for menor que o tamanho do limitador do tubo, use um cone de retenção descartável flexível além do limitador do tubo, conforme descrito abaixo na etapa 2.1.4.
- Para os cones de retenção descartáveis flexíveis, se necessário (para fazer uma manga de contenção para ratos menores):
- Faça um corte na extremidade do nariz do cone para garantir que o nariz do mouse não esteja obstruído e que o mouse tenha espaço suficiente para respirar.
- Corte a parte de trás do cone para que o cone tenha quase o mesmo comprimento do mouse (para que o cone caiba dentro do tubo) (Figura 1A, B).
- Coloque o mouse no limitador de tubo conforme descrito acima nas etapas 2.1.3. Enquanto segura a cauda do mouse, insira o cone de retenção com o lado de abertura mais largo primeiro no tubo.
- Enquanto segura a cauda do rato, deixe o rato entrar no cone; Em seguida, deslize o resto do cone para dentro do tubo. Certifique-se de que a cauda do mouse esteja totalmente fora da parte de trás do tubo e que o mouse tenha espaço para respirar dentro do cone.
- Prenda o plugue do tubo imediatamente na frente da abertura do nariz do cone, certificando-se de que o mouse esteja totalmente preso e tenha espaço suficiente para respirar.
- Injetando o mouse
- Encha o tubo cônico de 15 mL com água morna.
- Coloque o limitador do tubo com o mouse dentro dele na plataforma elevada (Figura 1B).
- Mergulhe o máximo possível da cauda do camundongo contido na água morna por pelo menos 1 min até que as nervuras laterais estejam claramente dilatadas e visíveis (Figura 1B).
- Durante a etapa de aquecimento da cauda, carregue a dose de AAV na seringa.
- Coloque o tubo de microcentrífuga de 1.7 mL contendo AAV sem tampa em um suporte de tubos. Insira a agulha verticalmente no tubo com a mão dominante. Assim que a agulha estiver dentro do tubo, segure o tubo com a mão não dominante.
NOTA: A inserção vertical da agulha evita danos à agulha que podem ser causados pelo toque na parede do tubo. Outros métodos alternativos de carregamento de seringas podem ser usados, mas a segurança do experimentador e do camundongo injetado deve ser garantida. Segurar o tubo com a mão não dominante protege contra ferimentos acidentais por punção da agulha se a agulha for inserida enquanto segura o tubo. - Com a agulha dentro do tubo, levante o tubo e a seringa simultaneamente ao nível dos olhos, certificando-se de que a agulha não toque na parede do tubo. Descanse os dois braços sobre a mesa para estabilizá-los. Puxe lentamente a dose para a seringa.
NOTA: A aspiração lenta evita que bolhas de ar finas se fixem nas laterais do corpo da seringa. - Expulse as bolhas de ar da seringa. Se injetar AAV, certifique-se de que as bolhas de ar sejam expelidas da seringa sobre uma almofada absorvente descartável que será descartada em uma caixa de risco biológico.
- Segure o injetado por pelo menos 40 s para aquecê-lo.
NOTA: Certifique-se sempre de que o injetado está quente antes da injeção. Se for administrado injetado frio, a injeção pode não fluir através da veia, exceto os primeiros μL. - Verifique as veias da cauda a cada minuto.
NOTA: As veias devem estar MUITO visíveis até o local da injeção (adicione o tempo de aquecimento da cauda e substitua por água morna fresca conforme necessário até que a veia esteja claramente visível, mas não exceda o tempo de contenção do camundongo permitido pelo protocolo de manejo animal da instituição). - Depois de garantir que as veias estejam claramente visíveis, remova o limitador do tubo do topo da plataforma elevada e coloque o limitador do tubo diretamente sobre a mesa. Posicione o mouse no limitador com os pés para baixo e não para o lado para facilitar o manuseio da cauda.
NOTA: O mouse não deve ficar de lado ou de costas dentro do retentor. O mouse deve estar totalmente contido e incapaz de se mover ou girar dentro do limitador ou mover/puxar sua cauda. - Limpe rapidamente a cauda com uma gaze para secar a cauda; Limpe a cauda com um cotonete embebido em álcool e, em seguida, seque-a com uma gaze seca.
NOTA: Use gaze seca para deixar a cauda seca o suficiente para permitir uma pegada segura da cauda, mas não completamente seca. Pode ser mais difícil ver a veia quando a cauda está completamente seca. - Gire a cauda aproximadamente 90° para a esquerda ou para a direita para que uma das duas veias laterais fique voltada para cima. Localize um local de injeção adequado no terço médio da cauda. Inicie a injeção inicial distalmente (mais perto da ponta da cauda) e mova-se proximalmente se forem necessárias injeções adicionais devido a tentativas fracassadas ou exigidas pelo projeto experimental.
NOTA: Não tente injetar distal a um local de injeção anterior, pois o injetado pode vazar para fora desse local de injeção anterior. Opcional: use o polegar e o indicador da mão não dominante para aplicar pressão proximal (a montante/mais próximo do corpo do camundongo) ao local da injeção por 10 s. Os dedos atuam como torniquetes para dilatar ainda mais a veia no local da injeção. Imediatamente após o torniquete de 10 s, solte os dedos do torniquete e certifique-se de que uma das duas veias laterais esteja voltada para cima e claramente visível. - Segure a cauda com a mão não dominante usando o polegar e o indicador imediatamente distais ao local da injeção. Dobre a cauda sobre o dedo indicador para que o local da injeção fique plano no dedo indicador. Puxe a cauda para trás para que a cauda fique esticada e o local da injeção fique completamente horizontal (a 0°) (paralelo à mesa horizontal) (Figura 1C).
- Segure a seringa usando os dedos indicador e médio da mão dominante em ambos os lados do flange do cilindro da seringa, mantendo o polegar pronto no êmbolo.
NOTA: Isso tornará mais fácil não mover o polegar ou a agulha quando a agulha estiver dentro da veia (Figura 1C). - Descanse as duas mãos sobre a mesa para estabilizá-las e coloque a agulha diretamente sobre e paralelamente à cauda e à veia com o chanfro voltado para cima. Mantenha o local da injeção próximo ao dedo indicador segurando a cauda para melhorar o controle e a estabilidade do local da injeção.
NOTA: O limitador do tubo deve ser profundo o suficiente na mesa para que ambas as mãos fiquem apoiadas na mesa. - Enquanto mantém a agulha paralela à veia da cauda e aplica pressão para baixo na agulha, deslize a agulha para a frente na veia.
NOTA: A pressão para baixo deve ser suficiente para inserir a agulha no ângulo correto na veia. A veia é extremamente rasa, então a agulha deve ser o mais plana possível ao tentar entrar na veia. - Injete lentamente a solução na veia. Após a administração da dose, retire lentamente a agulha e aplique imediatamente pressão com uma gaze no local da injeção por pelo menos 10 s para parar o sangramento.
NOTA: Aplique a pressão pelo tempo necessário até que o sangramento pare completamente para evitar a perda potencial do reagente injetado. Uma gota de sangue geralmente aparece após a retirada da agulha, indicando que a agulha penetrou na veia. Ocasionalmente, a gota de sangue não aparece mesmo com uma injeção bem-sucedida. A gota de sangue não indica injeção bem-sucedida; indica apenas que a agulha penetrou na veia. O indicador confiável de injeção bem-sucedida é a completa ausência de resistência do êmbolo durante a injeção. Se a agulha estiver dentro da veia, não deve haver resistência no êmbolo da agulha durante a injeção do injetado, e a veia proximal ao local da injeção parecerá momentaneamente de cor ligeiramente mais clara (branqueados) (o branqueamento da veia pode não ser muito claro em algumas cepas de camundongos). Se houver resistência e/ou começar a aparecer uma protuberância no local da injeção, a agulha não está corretamente colocada dentro da veia. Se isso ocorrer, remova completamente a agulha da cauda e tente injetar a veia em um novo local de injeção próximo ao local da injeção com falha (mais próximo do corpo do camundongo). - Descarte as seringas e tubos contaminados com AAV de acordo com as diretrizes de gerenciamento de resíduos da instituição.
- Liberte o mouse das restrições e coloque-o de volta em uma nova gaiola separada dos camundongos não injetados. Monitore os camundongos por 10 minutos para garantir os níveis normais de atividade após a injeção.
NOTA: Isso evita a transmissão potencial de agentes injetados para camundongos não injetados se agentes transmissíveis forem administrados. - Desinfete a área de trabalho usando reagente(s) bactericida, fungicida e virucida e EtOH a 70%. Limpe o limitador do tubo do mouse com água e sabão.
- Coloque o tubo de microcentrífuga de 1.7 mL contendo AAV sem tampa em um suporte de tubos. Insira a agulha verticalmente no tubo com a mão dominante. Assim que a agulha estiver dentro do tubo, segure o tubo com a mão não dominante.
3. Dissecção e coleta e fixação de tecidos27
- Preparação da estação de coleta de tecidos
- Limpe a estação de trabalho com um reagente de degradação de DNA de acordo com as instruções do fabricante para degradar o DNA contaminante que possa estar presente na área de trabalho.
- Coloque o metilbutano em um recipiente de metal. Coloque o recipiente de metal de metilbutano dentro de uma caixa de isopor; Em seguida, envolva o recipiente de metal com gelo seco de modo que o nível de gelo seco ao redor do recipiente seja maior do que o nível de metilbutano dentro do recipiente.
- Rotule e coloque os tubos vazios de armazenamento de tecido de microcentrífuga de 2 mL no gelo seco. Deixe o metilbutano e os tubos de armazenamento de tecidos esfriarem em gelo seco por pelo menos 20 minutos antes de começar a congelar os tecidos. Coloque a pinça de transferência de tecido em gelo seco.
- Rotule e encha outro conjunto de tubos de armazenamento de tecido de microcentrífuga de 2 mL com paraformaldeído fresco a 4% (PFA) e mantenha-os em temperatura ambiente. Adicione 4% de PFA suficiente a cada tubo para submergir completamente os tecidos que serão colocados no tubo.
- Coleta e fixação de tecidos
- Eutanasiar o camundongo de acordo com as diretrizes de cuidados com os animais da instituição.
NOTA: Aqui, os camundongos foram sacrificados usando luxação cervical. - Pulverize totalmente o mouse com 70% de EtOH.
- Colete os tecidos necessários.
NOTA: O protocolo de coleta e fixação aqui descrito foi testado nos músculos esqueléticos e no fígado. - Para tecidos que serão usados para extração de DNA:
- Coloque o tecido em metilbutano pré-resfriado em gelo seco e deixe o tecido em metilbutano por pelo menos 1 min. Use a pinça de transferência pré-resfriada para transferir os tecidos congelados do metilbutano para os tubos vazios de armazenamento de tecido de microcentrífuga de 2 mL pré-resfriados. Conservar o tecido a -80 °C.
NOTA: Opcional: O tecido pode ser cortado em pedaços de 20 mg antes de cair em metilbutano para estar pronto para ser usado na etapa 4.1.4.
- Coloque o tecido em metilbutano pré-resfriado em gelo seco e deixe o tecido em metilbutano por pelo menos 1 min. Use a pinça de transferência pré-resfriada para transferir os tecidos congelados do metilbutano para os tubos vazios de armazenamento de tecido de microcentrífuga de 2 mL pré-resfriados. Conservar o tecido a -80 °C.
- Para tecidos que serão usados para análise histológica e para preservar a fluorescência das proteínas repórteres:
- Usando uma pinça designada por PFA mantida em temperatura ambiente, coloque os tecidos em seu respectivo tubo de microcentrífuga que contém 4% de PFA (mantido em temperatura ambiente), certificando-se de que o tecido esteja completamente submerso na solução de PFA a 4%.
NOTA: A contaminação por PFA pode afetar negativamente diferentes ensaios moleculares a jusante. Use apenas pinças designadas por PFA ao manusear PFA para evitar a contaminação por PFA de outros tecidos ou ferramentas. - Coloque os tubos da microcentrífuga em um rack e cubra o rack com papel alumínio para manter os tubos no escuro. Incube a grelha coberta a 4 °C em um shaker com agitação suave durante a noite.
- Após a incubação durante a noite, prepare 5% de sacarose (% p / v) em 1x PBS dissolvendo 5,0 g. de sacarose em 70 mL de 1x PBS por agitação vigorosa. Adicione 1x PBS suficiente a um volume total final de 100 mL para obter uma solução de sacarose a 5% (% p / v).
- Esterilize a solução de sacarose a 5% usando o filtro de seringa de 0,22 μm. Rotule e encha os tubos de microcentrífuga de 2,0 mL com sacarose a 5% recém-preparada.
- Transfira os tecidos de PFA a 4% para o respectivo tubo de microcentrífuga que contenha sacarose a 5% (mantido em temperatura ambiente), certificando-se de que o tecido esteja completamente submerso na solução de sacarose a 5%.
- Coloque os tubos da microcentrífuga em um rack e cubra o rack com papel alumínio para manter os tubos no escuro. Incube a grelha coberta a 4 °C em um shaker com agitação suave durante a noite.
- Após a incubação durante a noite, prepare 20% de sacarose (% p / v) em 1x PBS dissolvendo 20,0 g. de sacarose em 70 mL de 1x PBS por agitação vigorosa. Adicione 1x PBS suficiente a um volume total final de 100 mL para obter uma solução de sacarose a 20% (% p / v).
- Esterilize a solução de sacarose a 20% usando um filtro de seringa de 0,22 μm. Rotule e encha os tubos de microcentrífuga de 2,0 mL com sacarose a 20% recém-preparada.
- Transfira os tecidos de sacarose a 5% para seu respectivo tubo de microcentrífuga que contenha 20% de sacarose (mantido em temperatura ambiente), certificando-se de que o tecido esteja completamente submerso na solução de sacarose a 20%.
- Coloque os tubos da microcentrífuga em um rack e cubra o rack com papel alumínio para manter os tubos no escuro. Incube a grelha coberta a 4 °C em um shaker com agitação suave durante a noite.
- Após a incubação durante a noite, coloque o metilbutano em um recipiente de metal e coloque o recipiente de metal de metilbutano dentro de uma caixa de isopor. Cerque o recipiente de metal com gelo seco de forma que o nível de gelo seco ao redor do recipiente seja maior do que o nível de metilbutano dentro do recipiente.
- Rotule e coloque os tubos vazios de armazenamento de tecido de microcentrífuga de 2 mL em gelo seco. Deixe o metilbutano e os tubos de armazenamento de tecidos esfriarem em gelo seco por pelo menos 20 minutos antes de começar a congelar os tecidos. Coloque a pinça de transferência no gelo seco.
- Seque rapidamente os lenços usando lenços de precisão para remover qualquer excesso de sacarose a 20%. Coloque o tecido em metilbutano pré-resfriado em gelo seco. Deixe o tecido em metilbutano por pelo menos 1 min.
- Use a pinça de transferência pré-resfriada para transferir os tecidos congelados do metilbutano para os tubos vazios de armazenamento de tecido de microcentrífuga de 2 mL pré-resfriados. Conservar o tecido a -80 °C.
- Usando uma pinça designada por PFA mantida em temperatura ambiente, coloque os tecidos em seu respectivo tubo de microcentrífuga que contém 4% de PFA (mantido em temperatura ambiente), certificando-se de que o tecido esteja completamente submerso na solução de PFA a 4%.
- Eutanasiar o camundongo de acordo com as diretrizes de cuidados com os animais da instituição.
4. dPCR para quantificação de vg/dg
- Extração de DNA de tecidos e digestão inicial de RNA
NOTA: O manual do kit de extração de DNA listado na Tabela de Materiais foi usado para derivar este protocolo de extração de DNA. Sempre mantenha os tubos contendo os pedaços de tecido congelados em gelo seco.- Prepare um balde de gelo.
- Para cada amostra de DNA, rotule um tubo de grânulo de lise de 1,5 mL e dois tubos de microcentrífuga vazios de 1,7 mL sem RNase e sem DNase.
- Adicione 180 μL do primeiro tampão do kit de extração de DNA a cada tubo de esfera. Tara o primeiro tubo de cordão contendo tampão.
NOTA: Se os tecidos não foram pré-cortados na etapa 3.2.4.1, use uma lâmina de barbear pré-resfriada em gelo seco para cortar o tecido em pedaços de 20 mg. Esta etapa deve ser feita dentro de um criostato limpo mantido a -20 °C ou mais. - Adicione um pedaço de tecido no tubo; pesar e registrar o peso do tecido (para ser ~ 20 mg.).
- Coloque imediatamente o tubo do cordão de lise com o tecido no gelo. O tampão pode cristalizar.
- Repita as etapas anteriores para cada amostra de tecido.
- Transfira os tubos para o misturador de tubos de esferas de lise e deixe funcionar por 1 min na velocidade máxima (velocidade 10) a 4 °C.
- Coloque as amostras no gelo para transferi-las para a centrífuga. Centrifugue por 1 min a 20.000 × g a 4 °C.
- Durante a etapa de centrifugação, adicione 20 μL de proteinase K à primeira série de tubos de microcentrífuga de 1,7 mL. Após a etapa de centrifugação, transferir o sobrenadante dos homogeneizados para os tubos de 1,7 ml contendo a proteinase K e homogeneizar bem. Incubar a 56 °C durante 15 min, com mistura de 500 RPM.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Incube em temperatura ambiente por 2 min.
- Adicione 4 μL de RNase A e misture por vórtice de pulso breve. Incube em temperatura ambiente por 2 min. Vórtice de pulso por 15 s.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Adicione 200 μL do segundo tampão do kit de extração de DNA. Vórtice de pulso por 15 s.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Adicione 200 μL de 100% de EtOH. Vórtice de pulso por 15 s.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Transferir os lisados para a coluna de rotação de extracção de ADN. Gire a 6.000 × g por 1 min.
- Coloque a coluna giratória em um novo tubo de coleta. Adicione 500 μL do terceiro tampão do kit de extração de DNA à coluna de rotação. Gire a 6.000 × g por 1 min.
- Coloque a coluna giratória em um novo tubo de coleta. Adicione 500 μL do quarto tampão do kit de extração de DNA à coluna de rotação. Gire a 20.000 × g por 3 min.
- Coloque a coluna giratória em um novo tubo de microcentrífuga de 1,7 mL. Adicione 100 μL de água de grau molecular à coluna de rotação. Incube em temperatura ambiente por 1 min. Gire a 6.000 × g por 1 min em temperatura ambiente.
- Meça a concentração de DNA, se necessário. Armazene a 4 °C para armazenamento de curto prazo ou -20 °C para armazenamento de longo prazo.
- Extração de DNA de células classificadas por FACS
NOTA: O manual do kit de extração de DNA listado na Tabela de Materiais foi usado para derivar este protocolo de extração de DNA.- Depois de separar as células, centrifugue as amostras a 300 × g por 5 s para coletar todas as gotas nas laterais e na tampa. Certifique-se de que todos os drops sejam coletados.
NOTA: Se o volume da amostra for inferior a 1,5 mL, prossiga diretamente para a próxima etapa. Se o volume da amostra for superior a 1,5 mL, remova e descarte cuidadosamente a parte superior do sobrenadante usando uma micropipeta, deixando 1-1,5 mL da amostra. - Misture a amostra pipetando para cima e para baixo várias vezes e transfira a amostra para um tubo de microcentrífuga de 1,7 mL. Centrifugue a 515 × g por 1 min em temperatura ambiente.
- Rejeitar o sobrenadante, excepto os últimos 50 μl. Ressuspender o sedimento em 50 μl do primeiro tampão do kit de extracção de ADN para um volume final de 100 μl.
- Siga o protocolo do fabricante para o isolamento de DNA genômico de pequenos volumes de sangue (consulte a Tabela de Materiais).
- Adicione 10 μL de proteinase K e 100 μL de tampão do segundo kit de extração de DNA; misturar por vórtice de pulso por 15 s. Incubar as amostras a 56 °C durante 10 minutos com mistura de 300 RPM. Misturar as amostras duas vezes por inversão suave durante este período de incubação.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Adicione 50 μL de 100% de EtOH e misture por vórtice de pulso por 15 s. Incubar as amostras à temperatura ambiente durante 5 min.
- Colete as gotas das paredes e da tampa do tubo centrifugando o tubo por 1-2 s usando uma mini centrífuga. Transfira as amostras para a coluna de extração de DNA (a coluna está em um tubo de coleta de 2 mL) sem molhar a borda. Centrifugue a 6.000 × g por 1 min.
- Depois de colocar a coluna em um tubo de coleta limpo de 2 mL, descarte o tubo de coleta que contém o fluxo. Adicione 500 μL do terceiro tampão do kit de extração de DNA à coluna sem molhar a borda e centrifugue a 6.000 × g por 1 min.
- Novamente, depois de colocar a coluna em um tubo de coleta limpo de 2 mL, descarte o tubo de coleta que contém o fluxo. Adicione 500 μL do quarto tampão do kit de extração de DNA à coluna sem molhar a borda e centrifugue a 6.000 × g por 1 min.
- Coloque a coluna em um tubo de coleta limpo de 2 mL e descarte o tubo de coleta contendo fluxo. Centrifugue a 20.000 × g por 3 min.
- Coloque a coluna em um tubo de microcentrífuga limpo de 1.7 mL e descarte o tubo de coleta contendo fluxo. Adicionar 20 μL de água de grau molecular ao centro da membrana da coluna para eluição; Feche a tampa e incube as amostras com a água de grau molecular à temperatura ambiente por 5 min.
- Centrifugue a 20.000 × g por 1 min. Armazenar o ADN eluído a 4 °C para armazenamento a curto prazo ou a -20 °C para armazenamento a longo prazo.
- Depois de separar as células, centrifugue as amostras a 300 × g por 5 s para coletar todas as gotas nas laterais e na tampa. Certifique-se de que todos os drops sejam coletados.
- Digestão e limpeza de RNA
NOTA: O manual do kit de extração de DNA listado na Tabela de Materiais foi usado para derivar este protocolo de limpeza de DNA. Dependendo das condições de dPCR, reagentes e designs de primer e sonda, pode ser necessário garantir a ausência completa de RNA na amostra de DNA antes de prosseguir para a quantificação de dPCR vg/dg. A contaminação por RNA pode resultar em vários graus de valores vg/dg imprecisos sob certas condições de dPCR.- Em um tubo de PCR de 0,2 mL ou um tubo de microcentrífuga de 1,7 mL, adicione no máximo 20 μL da amostra de DNA extraída e 1,5 μL da RNase livre de DNase a cada amostra de DNA. Se o volume da mistura DNA/RNase for inferior a 21,5 μL, adicione água de grau molecular suficiente a um volume final de 21,5 μL e misture 25x invertendo os tubos. Incubar a 37 °C durante 30 min com mistura periódica de 10 em 10 min, invertendo os tubos.
NOTA: A quantidade total de ácidos nucléicos adicionados ao tubo deve estar entre 175 ng e 700 ng. Modificações podem ser necessárias se as amostras de DNA contiverem volumes ou quantidades de ácido nucleico fora dessa faixa ou se as amostras de DNA forem isoladas de forma diferente. - Coloque no gelo por 2 min. Adicione água de grau molecular suficiente a cada mistura de DNA / RNase até um volume final de 100 μL.
NOTA: A RNase listada aqui é recomendada, pois digere o RNA contaminante sem afetar negativamente o DNA alvo ou os ensaios de PCR a jusante. - Siga o protocolo do fabricante para limpeza de DNA genômico (consulte Tabela de Materiais).
- Adicione 10 μL do primeiro tampão do kit de extração de DNA e 250 μL do segundo tampão do kit de extração de DNA. Misture por vórtice de pulso por 10 s.
- Transferir as amostras para a coluna de extracção de ADN num tubo de recolha de 2 ml sem molhar a borda. Centrifugue a 6.000 × g por 1 min.
- Depois de colocar a coluna em um tubo de coleta limpo de 2 mL, descarte o tubo de coleta que contém o fluxo. Adicione 500 μL do segundo tampão do kit de extração de DNA à coluna sem molhar a borda. Centrifugue a 6.000 × g por 1 min.
- Coloque a coluna em um tubo de coleta limpo de 2 mL e descarte o tubo de coleta contendo fluxo. Centrifugue a 20.000 × g por 6 min.
- Coloque a coluna em um tubo de microcentrífuga limpo de 1,7 mL e descarte o tubo de coleta que contém o fluxo. Adicione 20 μL de água de grau molecular ao centro da membrana da coluna para eluição, feche a tampa e incube as amostras com a água de grau molecular à temperatura ambiente por 5 min.
- Centrifugue a 20.000 × g por 1 min. Armazene a 4 °C para armazenamento de curto prazo ou -20 °C para armazenamento de longo prazo.
- Confirme a ausência de contaminação por RNA na amostra digerida por RNase com PCR de endpoint ou dPCR ou PCR quantitativo (qPCR) usando um par de primers de PCR que amplificaria uma região de mRNA que abrange vários éxons e não apenas um único éxon.
NOTA: O alvo de mRNA deve ser de um gene altamente expresso no tipo de tecido/célula alvo para garantir que a contaminação por mRNA seja identificada corretamente, se presente. Amplicons que abrangem vários éxons diferenciam entre bandas resultantes da contaminação do mRNA versus DNA genômico. Sempre tenha uma amostra de DNA digerido não RNase como controle positivo para a reação de PCR para garantir que a contaminação por mRNA seja detectada, se presente.
- Em um tubo de PCR de 0,2 mL ou um tubo de microcentrífuga de 1,7 mL, adicione no máximo 20 μL da amostra de DNA extraída e 1,5 μL da RNase livre de DNase a cada amostra de DNA. Se o volume da mistura DNA/RNase for inferior a 21,5 μL, adicione água de grau molecular suficiente a um volume final de 21,5 μL e misture 25x invertendo os tubos. Incubar a 37 °C durante 30 min com mistura periódica de 10 em 10 min, invertendo os tubos.
- PCR digital (dPCR)
- PCR de ponto final para verificar a especificidade dos primers e as condições ideais de PCR (opcional)
- Projete pares de primers e sondas de dPCR para o genoma do vetor e pares de primers e sondas de dPCR para o gene de referência do camundongo que serão usados para quantificar os genomas diplóides na amostra.
NOTA: Apontar para o tamanho do amplicon entre 60 bp e 150 bp. O gene de referência do camundongo deve ser um gene que tenha um número constante de cópias do gene por genoma diplóide. Para os cálculos listados aqui, o gene de referência (Polr2a) tem duas cópias por genoma diplóide. - Para uma reação de PCR de ponto final de 10 μL, prepare a mistura de PCR usando os reagentes e as concentrações finais a serem usadas posteriormente para a reação de dPCR. Adicione a amostra de DNA modelo digerida por RNase (faixa de quantidade de ácidos nucleicos 56-223 ng) a uma concentração final de 1x master mix de dPCR que contém a DNA polimerase e dNTPs, 0,8 μM de cada primer direto, 0,8 μM de cada primer reverso, 0,4 μM de cada sonda e 0,025 U/μL de enzima de restrição (a concentração final da enzima de restrição depende da enzima de restrição e da marca usada). Adicione água de grau molecular para atingir um volume final de 10 μL.
NOTA: Deve haver pelo menos dois pares de primers e duas sondas na mistura de PCR: um par de primers e uma sonda para detectar o genoma do vetor e um par de primers e uma sonda para detectar o genoma do camundongo. - Condições de ciclagem térmica de PCR: Etapa inicial de ativação de calor a 95 °C por 2 min, seguida por 35-45 ciclos de uma etapa de desnaturação a 95 °C por 25 s e uma etapa combinada de recozimento/extensão a 58-62 °C por 1 min.
NOTA: A temperatura ideal de recozimento deve ser determinada para cada par de amplicon e primer. O número de ciclos pode ser ajustado de acordo com a quantidade de DNA molde na amostra. - Visualize o produto de PCR em um gel de agarose usando eletroforese em gel para determinar a presença das bandas de amplicon alvo e quaisquer possíveis bandas de amplificação não específicas.
- Prossiga para a próxima etapa de dPCR após confirmar que os pares de primers e as condições de ciclagem resultam em amplificação específica das sequências alvo.
- Projete pares de primers e sondas de dPCR para o genoma do vetor e pares de primers e sondas de dPCR para o gene de referência do camundongo que serão usados para quantificar os genomas diplóides na amostra.
- reação de dPCR
- Para uma reação de dPCR de 40 μL, adicione até 4 μL da amostra de DNA modelo digerida por RNase (faixa de quantidade de ácidos nucleicos de 50-330 ng) a uma concentração final de 1x mistura principal de dPCR que contém a DNA polimerase e dNTPs, 0,8 μM de cada primer direto, 0,8 μM de cada primer reverso, 0,4 μM de cada sonda, e 0,025 U/μL de enzima de restrição (a concentração final da enzima de restrição depende da enzima de restrição e da marca usada). Adicione água de grau molecular para atingir um volume final de 40 μL.
- Condições de ciclagem térmica de dPCR: Etapa inicial de ativação de calor a 95 °C por 2 min, seguida por 40-50 ciclos de uma etapa de desnaturação a 95 °C por 25 s e uma etapa combinada de recozimento/extensão a 58-62 °C por 1 min.
NOTA: A temperatura ideal de recozimento deve ser determinada para cada par de amplicon e primer. O número de ciclos pode ser ajustado de acordo com a quantidade do DNA molde na amostra. Os volumes, concentrações e condições listados aqui são otimizados para placas, reagentes e dispositivos de dPCR listados na Tabela de Materiais. Essas condições reduzem o efeito de quaisquer inibidores potenciais de dPCR que podem reduzir a precisão da reação. - Depois de executar a reação de dPCR e obter os valores absolutos para os genomas do vetor e o gene de referência do camundongo, calcule vg/dg na amostra usando equações (7-8).
Para genes de referência com duas cópias de genes/genoma diplóide:
Valor absoluto dos genomas diplóides (dg) =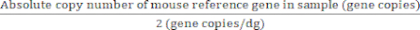 (7)
(7)
vg/dg =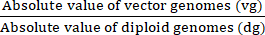 (8)
(8) - Verifique o gráfico de dispersão 1D da reação de dPCR para confirmar a validade do ensaio e quantificação (Figura 3A, C). Para que o ensaio seja válido, confirme se o gráfico de dispersão 1D satisfaz todos os seguintes critérios: presença de partições positivas e negativas; separação clara entre as partições positiva e negativa para permitir a determinação precisa do limiar; e a presença de gotículas entre as partições positiva e negativa (também conhecidas como chuva), o que pode reduzir a precisão da quantificação da dPCR.
- PCR de ponto final para verificar a especificidade dos primers e as condições ideais de PCR (opcional)
Resultados
Camundongos machos de sete a nove semanas de idade foram injetados com AAV por meio de injeção lateral na veia da cauda a 1,5 × 1012 vg / camundongo administrados em 150-200 μL de volume injetado. O ssDNA AAV usado aqui entregou o transgene Cre recombinase impulsionado pelo promotor do CMV. Os camundongos injetados eram homozigotos para o alelo Cre reporter Ai14. Quando expostas à Cre recombinase, as células contendo o alelo Ai14 expressam a proteína fluorescente tdTomato. Como a expressão de tdTomato é causada pela recombinação genômica induzida por Cre, as células que expressam tdTomato indicam células que foram transduzidas diretamente pelo AAV ou eram células de progênie de células transduzidas. Os dados mostrados aqui são de camundongos injetados com AAV9-CMV-Cre a 1,5 × 1012 vg / camundongo administrados em 160 μL (5,8-5,9 × 1013 vg / kg). Os camundongos foram sacrificados 28 dias após a injeção e os tecidos foram coletados conforme descrito acima. Alguns músculos esqueléticos e lobos hepáticos foram digeridos e suas células foram coletadas usando FACS. Alguns lobos do fígado foram congelados imediatamente usando metilbutano pré-resfriado para extração de ácido nucleico. Alguns músculos esqueléticos e lobos hepáticos foram congelados fixos para imagens histológicas de tdTomato fluorescente. O tdTomato foi expresso difusamente em todo o fígado (Figura 2A) e quadríceps (Figura 2C), indicando que o AAV9 atingiu e transduziu amplamente diferentes regiões de ambos os tecidos.
O DNA extraído do fígado fresco congelado e das células classificadas por FACS foi usado para quantificar vg/dg usando dPCR. A quantificação Vg/dg pode ser usada para avaliar a consistência da injeção e a eficiência de transdução do AAV na amostra analisada. Os gráficos de dispersão de gotículas 1D da amostra de tecido hepático recém-congelado e das células classificadas por FACS foram usados para garantir a validade do ensaio ( Figura 3A , C ). O gráfico de dispersão mostrou a presença de partições positivas e negativas, separação clara entre as partições positiva e negativa que permite a determinação precisa do limiar de detecção e a presença de gotículas entre as partições positivas e negativas, o que pode reduzir a precisão do ensaio de dPCR. O cumprimento de todos esses critérios indicou que os resultados do ensaio de dPCR eram válidos. O número de cópias do gene Polr2a em cada amostra foi quantificado para determinar o número de genomas diplóides de camundongo (2 cópias do gene Polr2a/genoma diplóide de camundongo), e primers/sonda contra a sequência do transgene Cre recombinase foram usados para quantificar o genoma viral (1 cópia do transgene/genoma viral, Tabela 1). O valor vg/dg foi quantificado para a amostra de tecido hepático fresco congelado e células classificadas por FACS e mostrou a presença de 187,7 vg/dg e 4,7 vg/dg em cada amostra, respectivamente (Figura 3B,D). Amostras de camundongos injetados com PBS e controles não molde sem ácidos nucléicos foram usados como controles negativos.

Figura 1: Visão geral da estação de injeção intravenosa. (A) Ferramentas necessárias para realizar a injeção intravenosa. Aqui é mostrado o (1) temporizador, (2) limitador de tubo de mouse, (3) cones de retenção de plástico não cortados e (4) cortados, (5) cotonete com álcool, (6) caixa de pontas de pipeta vazia usada como plataforma para elevar o limitador de tubo de mouse, (7) almofadas absorventes descartáveis, (8) tubo cônico de 15 mL com água morna, (9) suporte de tubo de 15 mL, (10) gaze e (11) seringa de insulina. (B) O mouse é colocado primeiro dentro do limitador do tubo. Em seguida, o cone de retenção cortado é inserido para criar uma luva de retenção ao redor do mouse, se o mouse for muito pequeno para ser restringido apenas pelo limitador de tubo. Certifique-se de que a respiração do mouse não seja obstruída pelos sistemas de contenção. O limitador de tubos é colocado no topo da plataforma elevada para permitir a colocação da cauda do rato em água morna. (C) Posicionamento da cauda do rato e ângulo de retenção da agulha imediatamente antes de realizar a injeção. Puxe a cauda para trás para que a cauda fique esticada e o local da injeção fique completamente horizontal. A agulha é paralela à cauda e à veia, e o chanfro está voltado para cima. Clique aqui para ver uma versão maior desta figura.
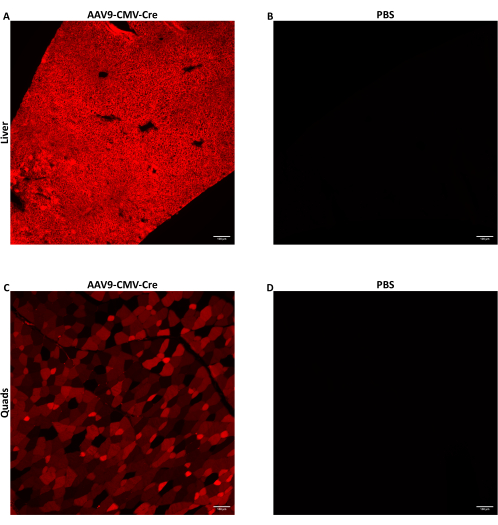
Figura 2: Detecção de proteína repórter fluorescente após injeção IV. Camundongos machos de sete a nove semanas de idade com o alelo Cre repórter Ai14 foram injetados por via intravenosa com AAV9-CMV-Cre a 1,5 × 1012 vg/camundongo entregues em 160 μL (5,8-5,9 × 1013 vg/kg) ou PBS. Imagens de fluorescência representativas de seções de fígado de camundongo (A) ou quadríceps (C) após AAV9 administrando injeção de Cre IV. (B) Seções de fígado ou (D) quadríceps de camundongos injetados com PBS foram fotografadas para servir como controles negativos. Os tecidos foram coletados e fixados em congelamento 28 dias após a injeção intravenosa. Pós-exposição a Cre, a proteína fluorescente tdTomato é expressa em células transduzidas e células de progênie de células transduzidas. Seções de 10 μm de espessura foram fotografadas com ampliação de 10x. Barras de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
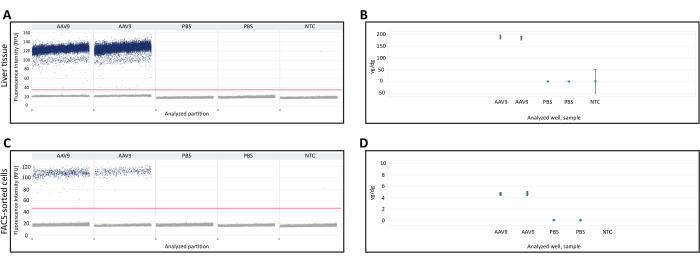
Figura 3: Quantificação do genoma vetorial por genoma diplóide (vg/dg). Gráfico de dispersão 1D da quantificação de genomas vetoriais de dPCR em (A) tecido hepático ou (C) células classificadas por FACS coletadas de camundongos injetados com AAV9-CMV-Cre ou PBS. Os gráficos de dispersão mostram as partições de dPCR positivas e negativas, bem como o limite de detecção indicado pela linha horizontal entre as amostras. (B,D) quantificação de vg/dg após quantificar os genomas diplóides de camundongo e genomas vetoriais no (B) tecido hepático ou (D) amostras de células classificadas por FACS. Os resultados mostrados aqui são de um único camundongo injetado com AAV9 e um único camundongo injetado com PBS com uma duplicata técnica de dPCR para cada camundongo. As barras de erro indicam o intervalo de confiança de 95% para cada amostra. Abreviaturas: NTC= Controle sem modelo; dPCR = PCR digital; FACS = classificação de células ativadas por fluorescência. Clique aqui para ver uma versão maior desta figura.
| Cartilha | Seqüenciar |
| Primer Cre para a frente | CTGACGGTGGGAGAATGTTAAT |
| Cre primer reverso | CATCGCTCGACCAGTTTAGTT |
| Sonda Cre | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Primer direto Polr2a | GACTCCTTCACTCACTGTCTTC |
| Primer reverso Polr2a | TCTTGCTAGGCAGTCCATTATC |
| Sonda Polr2a | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tabela 1: Sequências de primers e sondas usadas para quantificação de vg/dg. Primers e sonda Cre foram usados para quantificar o genoma do vetor. Primers e sonda Polr2a foram usados para quantificar o genoma diplóide de camundongo.
Discussão
As terapias baseadas em AAV têm grande potencial para distúrbios monogênicos devido à versatilidade do AAV como vetor de terapia gênica, o que torna possível personalizar os AAVs para atender às várias necessidades de entrega de diferentes distúrbios 4,5,7,9. Os AAVs são comumente administrados por injeção intravenosa em modelos de camundongos pré-clínicos para testar a segurança e a eficácia de possíveis terapias16. Como diferentes doses de AAV injetadas podem resultar em diferenças marcantes nos resultados experimentais, é fundamental que os experimentadores sejam capazes de injetar consistentemente a dose de AAV pretendida para garantir a validade e robustez dos dados in vivo gerados28. As injeções intravenosas são amplamente utilizadas, mas são tecnicamente desafiadoras, exigindo treinamento extensivo e prática contínua para desenvolver e manter um nível de habilidade que garanta injeções consistentemente bem-sucedidas 16,17,18,19. Além de injetar corretamente o AAV, geralmente é desejado usar ensaios para avaliar a biodistribuição do AAV injetado e a eficiência de entrega aos tecidos ou células-alvo29,30.
Este protocolo visa ajudar os experimentadores a realizar facilmente injeções IV com sucesso e consistência, descrevendo minuciosamente os detalhes de um protocolo de injeção IV otimizado para administrar AAV em camundongos não sedados de 7 a 9 semanas de idade. É importante notar que camundongos marcadamente menores ou maiores do que camundongos selvagens na faixa etária usada aqui podem apresentar um desafio maior devido a uma visibilidade reduzida das veias ou incompatibilidade com os contentores usados neste método. Foi relatado anteriormente que as injeções intravenosas de cauda não são apropriadas para administrar reagentes por via intravenosa em camundongos com menos de 6 semanas de idade devido ao pequeno tamanho do vaso31. Embora possível, pode ser difícil injetar consistentemente camundongos com peso inferior a 22,0 g. com sucesso. Os investigadores que usam camundongos de tamanho atípico podem precisar fazer adaptações no procedimento. Este protocolo também descreve vários ensaios que podem ser usados para avaliar a biodistribuição e a eficiência de transdução do AAV.
Alguns pontos críticos precisam ser lembrados ao seguir este protocolo. Durante a injeção, as agulhas 29 G proporcionam maior resistência se a agulha não estiver dentro da veia. Isso reduz o volume perdido pela injeção perivascular acidental da solução durante tentativas de injeção malsucedidas. As seringas de insulina têm volumes mortos menores do que as seringas comuns. Se estiver usando uma seringa e/ou agulha diferente das listadas aqui, pode ser necessário preparar um volume injetado adicional nas etapas 1.1.3.3 do protocolo para levar em conta um volume maior de espaço morto (por exemplo, adicionar 30 μL à dose pretendida em vez de 15 μL).
Se forem formadas bolhas de ar finas causadas por aspiração nas laterais da seringa durante a aspiração da dose de AAV para a seringa, puxe lentamente o injetado para cima na seringa. Isso removerá a maioria das pequenas bolhas de ar. Carregue pelo menos 10-15 μL adicionais de AAV no volume pretendido a ser injetado. Este volume adicional é para contabilizar qualquer volume que possa ser perdido durante a expulsão de bolhas de ar ou possíveis tentativas de injeção malsucedidas. (por exemplo, se o volume alvo a ser injetado for de 150 μL, carregue 165 μL na seringa (a meio caminho entre as marcas de 160 μL e 170 μL na escala da seringa). Se a agulha for colocada corretamente dentro da veia e o volume na seringa estiver em 165 μL imediatamente antes da tentativa de injeção bem-sucedida, administre o reagente até que restem 15 μL na seringa (a meio caminho entre as marcas de 10 μL e 20 μL), fornecendo assim 150 μL (165 μL - 150 μL = 15 μL)). O alinhamento do lúmen chanfrado (chanfro voltado para cima) com a escala da seringa permite rastrear o volume fornecido durante a injeção.
Alguns experimentadores podem preferir colocar o mouse de lado para que uma de suas veias fique reta e facilmente acessível em comparação com um mouse em pé. No entanto, a cauda de um rato de lado será inclinada em ângulos diferentes, dependendo do tamanho do rato, exigindo um ajuste do ângulo de injeção ao injetar ratos de tamanhos diferentes. Isso pode afetar negativamente a consistência do sucesso do procedimento. Durante as tentativas iniciais de prática, os experimentadores podem tentar ambas as orientações de restrição do mouse para determinar sua abordagem preferida. Ter o mouse nos pés permite acesso rápido e fácil a ambas as veias laterais da cauda. Isso reduz o tempo de restrição quando o acesso a ambas as veias é necessário no caso de várias tentativas de injeção malsucedidas.
Se injetar a veia lateral perto da base da cauda (mais perto do corpo do camundongo) (especialmente para camundongos pesando >30 g.), ajuste o ângulo de injeção de paralelo à veia para 5 ° -10 ° para a veia, pois a veia na base da cauda é ligeiramente mais profunda do que distalmente.
Os protocolos de digestão de RNase e verificação de contaminação por RNA listados aqui foram verificados em amostras de DNA isoladas de tecidos hepáticos frescos congelados contendo um total de 175-700 ng de ácidos nucléicos em 20 μL. O protocolo de digestão de RNase também foi testado em amostras de DNA isoladas de tecidos hepáticos recém-congelados e células classificadas por FACS para confirmar a presença do genoma do vetor e do genoma do camundongo após a digestão da RNase. Os resultados foram visualizados usando eletroforese em gel de agarose da amplificação por PCR dos amplicons alvo.
Seguir a metodologia descrita pode reduzir o tempo de treinamento e prática necessário para dominar as injeções IV e resultar em uma maior taxa de injeção bem-sucedida, o que economizaria reagentes. Este protocolo utiliza ferramentas simples e comumente usadas sem a necessidade de equipamentos ou configurações avançadas que podem não estar prontamente disponíveis. Além disso, as etapas de injeção IV listadas aqui podem ser aplicadas a uma ampla gama de injetados que precisam ser administrados por via intravenosa, como oligonucleotídeos antisense (ASOs), com as modificações apropriadas feitas nas etapas de preparação do injetado, dependendo do injetado.
Divulgações
Os autores não têm divulgações que sejam relevantes para o trabalho publicado neste artigo.
Agradecimentos
Os autores gostariam de agradecer à equipe da unidade de cuidados com animais do NINDS por seu apoio. Este trabalho foi apoiado pela Divisão de Pesquisa Intramural do NIH, NINDS (Relatório Anual Número 1ZIANS003129). O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Referências
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados