Method Article
Konsistente Verabreichung des Adeno-assoziierten Virus durch laterale Schwanzveneninjektion bei erwachsenen Mäusen
In diesem Artikel
Zusammenfassung
Im Folgenden stellen wir ein optimiertes Protokoll für die Injektion von seitlichen Schwanzvenen aus der Maus zur systemischen Verabreichung von Adeno-assoziierten Viren (AAV) bei adulten Mäusen vor. Darüber hinaus beschreiben wir Protokolle von häufig verwendeten Assays zur Beurteilung der AAV-Transduktion.
Zusammenfassung
Viele Erkrankungen betreffen mehrere Organe oder betreffen verschiedene Regionen des Körpers, daher ist es wichtig, Therapeutika systemisch zu verabreichen, um die betroffenen Zellen an verschiedenen Stellen zu bekämpfen. Die intravenöse Injektion ist ein weit verbreiteter systemischer Verabreichungsweg in präklinischen Studien, in denen Behandlungen untersucht werden, die für die körperweite Verabreichung vorgesehen sind. Bei erwachsenen Mäusen handelt es sich dabei um die intravenöse Verabreichung des Therapeutikums in die seitlichen Schwanzvenen der Maus. Wenn sie gemeistert werden, sind Schwanzveneninjektionen sicher und schnell und erfordern nur einfache und allgemein verfügbare Werkzeuge. Schwanzveneninjektionen sind jedoch technisch anspruchsvoll und erfordern umfangreiche Schulungen und kontinuierliches Üben, um die genaue Abgabe der beabsichtigten Dosis zu gewährleisten.
Hier beschreiben wir ein detailliertes, optimiertes, laterales Schwanzvenen-Injektionsprotokoll, das wir auf der Grundlage unserer Erfahrungen und auf Empfehlungen, die zuvor von anderen Gruppen berichtet wurden, entwickelt haben. Abgesehen von den Maus-Halterungen und Insulinspritzen werden für dieses Protokoll nur Reagenzien und Geräte benötigt, die in den meisten Labors leicht verfügbar sind. Wir fanden heraus, dass die Befolgung dieses Protokolls zu einer durchweg erfolgreichen intravenösen Verabreichung des Adeno-assoziierten Virus (AAV) in die Schwanzvenen von nicht edierten 7-9 Wochen alten Mäusen führt. Darüber hinaus beschreiben wir die optimierten Protokolle für den histologischen Nachweis von fluoreszierenden Reporterproteinen und die Quantifizierung des Vektorgenoms pro diploidem Genom (vg/dg), die zur Beurteilung der AAV-Transduktion und Biodistribution verwendet werden. Das Ziel dieses Protokolls ist es, den Experimentatoren dabei zu helfen, Schwanzveneninjektionen erfolgreich und konsistent durchzuführen, was die Übungszeit reduzieren kann, die zur Beherrschung der Technik erforderlich ist.
Einleitung
Monogene Erkrankungen machen 80 % der seltenen Erkrankungen aus, von denen weltweit insgesamt 300 Millionen Menschen betroffen sind 1,2. Für die meisten dieser stark beeinträchtigenden seltenen Erkrankungen gibt es derzeit keine zugelassenen kurativen Therapien 1,2,3. Monogene Störungen sind jedoch ideale Kandidaten für Gentherapien, die dysfunktionale Gene ersetzen, ergänzen, korrigieren oder zum Schweigen bringen können 4,5. Derzeit werden mehrere Vektoren entwickelt und verwendet, um Gentherapien für bestimmte Zelltypen zu verabreichen 4,6. Einer dieser Vektoren ist das Adeno-assoziierte Virus (AAV). AAV ist ein nicht-pathogenes Parvovirus, das zunehmend als Gentherapie-Vektor eingesetzt wird7. Im Vergleich zu anderen viralen Vektoren weist AAV eine geringere Immunogenität, ein geringeres Potenzial zur Integration in das Wirtsgenom und die Fähigkeit auf, sich teilende und nicht teilende Zellen in verschiedenen Geweben effizient zu transduzieren 7,8. Darüber hinaus wurden mehrere Ansätze entwickelt, um AAVs mit wünschenswerten Eigenschaften wie spezifischem Gewebetropismus oder weiter reduzierter Immunogenität zu entwickeln und zu identifizieren, was die Vielseitigkeit von AAV als viraler Vektor für verschiedene Indikationen erheblich erhöht9. Diese Faktoren haben AAV zu einem umfassend untersuchten Gentherapievektor gemacht und zur Entwicklung mehrerer von der FDA zugelassener AAV-basierter Gentherapien geführt10.
Mausmodelle werden häufig verwendet, um potenzielle Gentherapien in vivo zu testen und die Pathomechanismen monogener Erkrankungen besser zu verstehen. Dies ist auf die Rekapitulation der Pathologien verschiedener Erkrankungen durch die Mausmodelle, die Ähnlichkeit ihres Genoms mit dem menschlichen Genom und die relativ einfache Handhabung, Wartung und Generierung von Mäusen zurückzuführen 11,12,13. In-vivo-Tests sind besonders wichtig bei der Untersuchung von Erkrankungen, die mehrere Systeme oder Regionen des Körpers betreffen, wie z. B. Muskeldystrophien. Bei diesen Erkrankungen reichen In-vitro-Tests möglicherweise nicht aus, um die Sicherheit, Wirksamkeit, Pharmakokinetik und Pharmakodynamik von Therapeutika, die nach systemischer Verabreichung verschiedene Körperregionen erreichen sollen, umfassend zu beurteilen14.
Für die Verabreichung von Medikamenten können verschiedene systemische Verabreichungswege genutzt werden. Jeder Weg hat seine Vor- und Nachteile und seinen Grad der Kompatibilität mit dem untersuchten Tiermodell und dem untersuchten Medikament15. Die intravenöse (i.v.) laterale Schwanzveneninjektion ist ein häufig verwendeter Weg zur systemischen Verabreichung von AAV bei Mäusen16. Laterale Schwanzvenen-Injektionen ermöglichen eine schnelle und direkte Verabreichung des Injektats in den Blutkreislauf der Maus und gewährleisten so eine hohe Bioverfügbarkeit des Arzneimittels im systemischen Kreislauf17. Sie erfordern auch relativ einfache und allgemein verfügbare Werkzeuge, um ausgeführt zu werden. Vor allem aufgrund des kleinen Schwanzvenendurchmessers und der Schwierigkeit, die Vene zu lokalisieren, sind laterale Schwanzveneninjektionen jedoch technisch anspruchsvoll und erfordern ein hohes Maß an Geschicklichkeit und ständiger Übung, um fehlgeschlagene Injektionsversuche oder unvollständige Dosisabgabe zu vermeiden 16,17,18,19. Diese können zum Verlust teurer Reagenzien oder zu ungenauen Ergebnissen führen, insbesondere wenn die unvollständige Injektion bei der Durchführung der Injektion nicht erkannt wird. Unsere hier zusammengefassten Erfahrungen basieren auf Protokollen, die in gut dokumentierten Artikeln berichtet werden, die wir für unsere Verwendung angepasst haben, um verschiedene Schritte des lateralen Schwanzveneninjektionsverfahrens zu optimieren, um eine gleichbleibend erfolgreiche Injektion zu gewährleisten 20,21,22,23,24,25,26,27.
Hier beschreiben wir dieses detaillierte, optimierte laterale Schwanzvenen-Injektionsprotokoll zur Verabreichung von AAV an unedierte 7-9 Wochen alte Mäuse mit einfachen und allgemein verfügbaren Werkzeugen. Darüber hinaus stellen wir die Protokolle für Methoden zur Verfügung, die zur Bewertung der AAV-Verabreichung und Bioverteilung verwendet werden. Diese Protokolle umfassen die Gewebeentnahme nach der Injektion, die Gewebefixierung, die DNA-Extraktion und die Quantifizierung des Vektorgenoms pro diploidem Genom (vg/dg) der digitalen Polymerase-Kettenreaktion (dPCR). Das IV-Injektionsprotokoll und die hier bereitgestellten Hinweise zielen darauf ab, die erfolgreiche Durchführung von lateralen Schwanzveneninjektionen zu erleichtern. Dies wird möglicherweise dazu beitragen, die Zeit zu verkürzen, die für die Beherrschung der Injektionsfähigkeiten benötigt wird, und gleichzeitig die Genauigkeit und Konsistenz der Injektionen zu verbessern.
Protokoll
Alle Verfahren zum Umgang mit den Tieren und zur Injektion wurden vom Tierpflegeausschuss des NINDS genehmigt. Alle Tierbehandlungen wurden in Übereinstimmung mit den NINDS-Richtlinien für Tierpflege und -verwendung durchgeführt.
1. Vorbereitung vor der Injektion
- Vorbereitung der AAV-Dosis
- Bestimmen Sie das durchschnittliche Gewicht der Mäuse, die injiziert werden.
- Berechnen Sie das maximal zulässige Injektionsvolumen gemäß den Tierhaltungsrichtlinien der Einrichtung, wie in Gleichung (1) gezeigt. Das maximale Injektionsvolumen ist in der Regel ein Volumenwert (μL)/Mausgewicht (g) (z. B. 10 μL/g).
Maximales Injektvolumen (μL)/Maus= (maximales Injektatvolumen (μL/g)) × (durchschnittliches Gewicht der Maus (g)) (1)
HINWEIS: Beispielrechnung: Maximales Injektvolumen/Maus = 10 μL/g × 20 g/Maus = 200 μL/Maus - Stellen Sie die Dosis des AAV-Vektorgenoms (vg) ein, die pro Maus verabreicht werden soll.
HINWEIS: Dies kann für verschiedene Mäuse derselbe absolute Wert sein (z. B. erhalten alle Mäuse 1,5 × 1012 vg, unabhängig davon, wie viel jede Maus wiegt). Oder die Dosis könnte in vg/kg angegeben werden, so dass die Gesamtmenge an vg, die pro Maus injiziert werden muss, für jede Maus entsprechend dem Gewicht dieser Maus am Injektionstag berechnet werden muss.- Wenn die Dosis in vg/kg angegeben ist, wiegen Sie jede Maus am Injektionstag vor der Dosisvorbereitung.
- Berechnen Sie die Vektorgenome, die für jede Maus nach ihrem Gewicht mit Hilfe von Gleichung (2) abgegeben werden sollen:
Vektorgenome, die in einer bestimmten Maus (vg) verabreicht werden sollen = Vordefinierter vg/kg-Wert (vg/kg) ×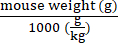 (2)
(2)
HINWEIS: Die Verwendung von vg/kg als Dosiseinheit anstelle von vg/Maus kann in bestimmten präklinischen Studien besser geeignet sein, um gültige Vergleiche zwischen injizierten Dosen zu gewährleisten. Dies ist auf die Gewichtsunterschiede zwischen männlichen und weiblichen Mäusen gleichen Alters oder möglicherweise zwischen Mäusen des gleichen Geschlechts zurückzuführen. - Verwenden Sie das maximale Injektionsvolumen und die AAV-Dosis (vg), um die Volumina von Stamm-AAV und steriler phosphatgepufferter Kochsalzlösung (PBS) zu berechnen, die zur Vorbereitung der erforderlichen Dosis erforderlich sind (siehe Gleichungen (3-6)). Stellen Sie sicher, dass das zu injizierende Volumen gleich oder kleiner als das zulässige maximale Injektvolumen ist. Bereiten Sie immer ein Injektionsvolumen vor, das mindestens 15 μl größer ist als das Volumen, das injiziert wird, um Pipettierfehler und den Totraum der Spritze zu berücksichtigen.
Konzentration des Injektats (vg/μL) =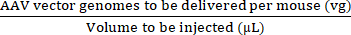 (3)
(3)
Gesamtanzahl der AAV-Vektorgenome, die zur Herstellung des Injektats hinzugefügt werden müssen (vg) = Konzentration des Injektats (vg/μl) × des aufzubereitenden Volumens (μl) (4)
Volumen des AAV-Rohlings, der zur Vorbereitung des Injektats zugegeben werden soll) (μL) =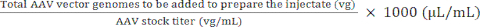 (5)
(5)
Volumen des zur Herstellung des Injektats hinzuzufügenden PBS (μL) = Volumen des herzustellenden Volumens (μL) - Volumen des AAV-Stammes, das zur Herstellung des Injektats zugegeben werden soll (μL) (6)
HINWEIS: Beispielhafte Berechnung:
6 × 1013 vg/kg (die Dosis) werden in 200 μl/Maus (das zu injizierende Volumen) in einer Maus mit einem Gewicht von 25 g verabreicht. Der AAV-Stammtiter beträgt 3,0 × 1013 (vg/ml)
Vektorgenome, die in dieser speziellen Maus (vg) abgegeben werden sollen = 6 × 1013 (vg/kg) ×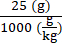 = 1,5 × 1012 vg für diese Maus
= 1,5 × 1012 vg für diese Maus
Konzentration des Injektats =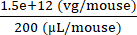 = 7,5 × 109 (vg/μL)
= 7,5 × 109 (vg/μL)
Gesamtzahl der AAV-Vektorgenome, die zur Vorbereitung des Injektats hinzugefügt werden müssen = 7,5 × 109 (vg/μl) × (200 (μl) + 15 (μl)) = 1,6125 × 1012 (vg)
Volumen des AAV-Rohlings, der zur Vorbereitung des Injektats zugegeben werden soll =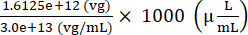 = 53,75 (μL)
= 53,75 (μL)
Volumen von PBS, das zur Herstellung des Injektats zugegeben werden soll = 215 (μL) - 53,75 (μL) = 161,25 (μL)
- Verfahren zur Vorbereitung der AAV-Dosis
HINWEIS: Bereiten Sie gemäß den Biosicherheits- und PSA-Richtlinien der Einrichtung für den Umgang mit AAV in einem autoklavierten sterilen RNase-freien und DNasefreien 1,7-ml-Mikrozentrifugenröhrchen das AAV-Injektat unter Verwendung des AAV-Stammes und sterilem PBS gemäß den Berechnungen in Schritt 1.1.3.3 vor. Bewahren Sie das serienmäßige AAV und AAV-Injektor immer auf Eis auf. Verwenden Sie saubere Mikropipetten und neue Mikropipettenspitzenboxen, um die Sterilität zu gewährleisten. Entsorgen Sie die AAV-kontaminierten Mikropipettenspitzen gemäß den Abfallentsorgungsrichtlinien der Institution.- Tauen Sie das serienmäßige AAV auf Eis auf.
HINWEIS: Vermeiden Sie es, den AAV-Vorrat aufzutauen und wieder einzufrieren. Bestellen oder bereiten Sie die AAV-Brühe in Aliquoten von 100-200 μl vor, um zu vermeiden, dass nach der Dosisvorbereitung überschüssiges AAV erneut eingefroren werden muss.
- Tauen Sie das serienmäßige AAV auf Eis auf.
- Vorbereitung der Injektionsstation
- Reinigung
- Reinigen Sie den Arbeitsbereich mit 70%igem Ethanol (EtOH).
- Desinfizieren Sie den Arbeitsbereich mit einem oder mehreren bakteriziden, fungiziden und viruziden Reagenzien.
- Reinigen Sie den Mausschlauch mit Wasser und Seife.
- Einrichtung der Stationswerkzeuge
- Legen Sie ein sauberes, leeres konisches 15-ml-Röhrchen in einen Röhrchenhalter/-gestell.
- Stellen Sie eine erhöhte Plattform auf, auf der der Mausschlauch platziert wird (Abbildung 1A, B).
- Platzieren Sie den sauberen Mausschlauch-Rückhalteapparat im Arbeitsbereich.
- Wenn Sie Mäuse injizieren, die viel kleiner sind als der verfügbare Mausschlauch-Rückhaltebehälter, verwenden Sie einen Nagetier-Rückhaltekegel aus Kunststoff, um eine Rückhaltehülle herzustellen. Siehe Schritte 2.1.3-4.
- Platzieren Sie die Spritzen, die für Injektionen verwendet werden sollen, im Arbeitsbereich. Verwenden Sie 0,3-ml-Insulinspritzen mit 29-g-Nadeln.
- Stellen Sie den Abfallbehälter so nah wie möglich an die Injektionsstation, um eine sofortige Entsorgung von AAV-kontaminierten Werkzeugen zu ermöglichen.
- Ziehen und drücken Sie mehrmals am Kolben jeder Spritze, um sicherzustellen, dass sich der Kolben reibungslos bewegt, damit während der Injektion kein durch die Spritze verursachter Widerstand entsteht. Wenn sich der Kolben nicht reibungslos bewegt, entsorgen Sie diese Spritze und ersetzen Sie sie durch eine neue.
- Halten Sie eine Mauswaage und eine Mini-Zentrifuge neben dem Injektionsbereich bereit.
- Halten Sie das vorbereitete AAV auf Eis im Injektionsbereich bereit.
- Bereiten Sie warmes Wasser (38-40 °C) vor. Achten Sie darauf, dass die Wassertemperatur 40 °C nicht überschreitet, um Verbrennungen am Mausschwanz zu vermeiden.
- Reinigung
2. Ablauf der Injektion
- Zurückhaltung von Mäusen
- Wiegen Sie jede Maus, um die Dosis bei Bedarf in vg/kg zu berechnen.
- Stellen Sie sicher, dass die Maus vollständig zurückgezogen ist und sich nicht bewegen kann.
HINWEIS: Wenn die Maus nicht vollständig fixiert ist, kann sie sich während der intravenösen Verabreichung bewegen, was zu einer Verschiebung der Nadel führt. Dies kann dazu führen, dass die Nadel aus der Vene kommt und/oder die Maus verletzt wird. - Für Schlauchrückhaltesysteme:
- Waschen Sie den Halter zwischen den Mäusen mit warmem Wasser und Seife, um den Halter zu reinigen und aufzuwärmen.
- Halten Sie die Maus am Schwanz fest. Führen Sie den Schwanz der Maus in die obere Öffnung des Schlauchs ein. Ziehen Sie dann die Maus langsam in den Röhrenrückhalteapparat. Wenn die Größe des Schlauchrückhaltesystems für die Größe der Maus geeignet ist, platzieren Sie den Stecker vor der Maus, um ein Entweichen der Maus zu verhindern.
HINWEIS: Der Stecker sollte nahe genug an der Maus sein, um zu verhindern, dass sich die Maus im Rohr bewegt oder dreht, aber der Stecker sollte die Nase der Maus nicht behindern, damit die Maus frei atmen kann. Wenn die Maus kleiner als die Größe des Schlauch-Rückhaltesystems ist, verwenden Sie zusätzlich zum Schlauch-Rückhaltekegel einen flexiblen Einweg-Rückhaltekegel, wie unten in Schritt 2.1.4 beschrieben.
- Für die flexiblen Einweg-Rückhaltekegel bei Bedarf (um eine Rückhaltehülle für kleinere Mäuse herzustellen):
- Mache einen Schnitt am Nasenende des Kegels, um sicherzustellen, dass die Nase der Maus nicht verstopft ist und die Maus genügend Platz zum Atmen hat.
- Schneiden Sie die Rückseite des Kegels so ab, dass der Kegel fast die gleiche Länge wie die Maus hat (damit der Kegel in das Rohr passt) (Abbildung 1A,B).
- Platzieren Sie die Maus in der Röhrenhalterung, wie oben in den Schritten 2.1.3 beschrieben. Halten Sie den Schwanz der Maus fest und führen Sie den Rückhaltekegel mit der breiteren Öffnungsseite zuerst in das Rohr ein.
- Während Sie den Schwanz der Maus halten, lassen Sie die Maus in den Kegel laufen; Schieben Sie dann den Rest des Kegels in das Rohr. Stellen Sie sicher, dass der Schwanz der Maus ganz aus der Rückseite des Schlauchs herausragt und die Maus im Kegel Platz zum Atmen hat.
- Befestigen Sie den Schlauchstopfen direkt vor der Nasenöffnung des Konus und stellen Sie sicher, dass die Maus vollständig zurückgehalten ist und genügend Platz zum Atmen hat.
- Injizieren der Maus
- Füllen Sie das konische 15-ml-Röhrchen mit warmem Wasser.
- Platzieren Sie den Schlauchhalter mit der Maus darin auf der erhöhten Plattform (Abbildung 1B).
- Tauchen Sie so viel wie möglich des Schwanzes der gefesselten Maus für mindestens 1 Minute in das warme Wasser, bis die Seitenvenen deutlich erweitert und sichtbar sind (Abbildung 1B).
- Laden Sie während des Schwanzerwärmungsschritts die AAV-Dosis in die Spritze.
- Legen Sie das unverschlossene AAV-haltige 1,7-ml-Mikrozentrifugenröhrchen in ein Röhrchengestell. Führen Sie die Nadel mit der dominanten Hand senkrecht in das Rohr ein. Sobald sich die Nadel in der Röhre befindet, halten Sie die Röhre mit der nicht dominanten Hand.
HINWEIS: Das vertikale Einstechen der Nadel verhindert Schäden an der Nadel, die durch Berühren der Rohrwand verursacht werden könnten. Andere alternative Methoden zum Laden von Spritzen können verwendet werden, aber die Sicherheit des Experimentators und der injizierten Maus sollte gewährleistet sein. Das Halten des Schlauchs mit der nicht dominanten Hand schützt vor versehentlichen Nadelstichverletzungen, wenn die Nadel eingeführt wird, während der Schlauch gehalten wird. - Heben Sie den Schlauch und die Spritze gleichzeitig auf Augenhöhe an, während Sie darauf achten, dass die Nadel die Schlauchwand nicht berührt. Legen Sie beide Arme auf den Tisch, um sie zu stabilisieren. Ziehen Sie die Dosis langsam in die Spritze.
HINWEIS: Durch langsames Absaugen wird verhindert, dass sich feine Luftblasen an den Seiten des Spritzenzylinders festsetzen. - Stoßen Sie Luftblasen aus der Spritze aus. Wenn Sie AAV injizieren, stellen Sie sicher, dass die Luftblasen aus der Spritze über ein absorbierendes Einwegkissen ausgestoßen werden, das in einer Biohazard-Box entsorgt wird.
- Halten Sie das Injektat mindestens 40 s lang, um es aufzuwärmen.
HINWEIS: Stellen Sie vor der Injektion immer sicher, dass das Injektat warm ist. Wenn kaltes Injektat verabreicht wird, fließt die Injektion möglicherweise nur in den ersten μl durch die Vene. - Kontrollieren Sie die Schwanzvenen jede Minute.
HINWEIS: Die Venen müssen bis zur Injektionsstelle SEHR gut sichtbar sein (fügen Sie die Schwanzerwärmungszeit hinzu und ersetzen Sie sie bei Bedarf durch frisches, warmes Wasser, bis die Vene deutlich sichtbar ist, darf jedoch die vom Tierbehandlungsprotokoll der Einrichtung zugelassene Rückhaltezeit für Mäuse nicht überschreiten). - Nachdem Sie sichergestellt haben, dass die Venen deutlich sichtbar sind, entfernen Sie den Schlauchhalter von der Oberseite der erhöhten Plattform und legen Sie den Schlauchhalter direkt auf den Tisch. Positionieren Sie die Maus mit den Füßen nach unten und nicht zur Seite in der Rückhaltemaschine, um die Handhabung des Schwanzes zu erleichtern.
HINWEIS: Die Maus sollte sich nicht auf der Seite oder mit dem Rücken im Rückhaltesystem befinden. Die Maus sollte vollständig fixiert sein und nicht in der Lage sein, sich innerhalb des Rückhaltesystems zu bewegen oder zu drehen oder ihren Schwanz zu bewegen/ziehen. - Wischen Sie den Schwanz schnell mit einer Gaze ab, um den Schwanz zu trocknen; Wischen Sie den Schwanz mit einem Alkoholtupfer ab und wischen Sie ihn dann mit einer trockenen Gaze trocken.
HINWEIS: Verwenden Sie trockene Gaze, um den Schwanz trocken genug zu machen, um einen sicheren Halt des Schwanzes zu ermöglichen, aber nicht vollständig trocken. Es kann schwieriger sein, die Vene zu sehen, wenn der Schwanz vollständig trocken ist. - Drehen Sie den Schwanz ca. 90° nach links oder rechts, so dass eine der beiden Seitenadern nach oben zeigt. Suchen Sie eine geeignete Injektionsstelle im mittleren Drittel des Schwanzes. Beginnen Sie die erste Injektion distal (näher an der Spitze des Schwanzes) und bewegen Sie sich proximal, wenn aufgrund fehlgeschlagener Versuche oder aufgrund des Versuchsdesigns zusätzliche Injektionen erforderlich sind.
HINWEIS: Versuchen Sie nicht, distal zu einer früheren Injektionsstelle zu injizieren, da das Injektionsat aus dieser vorherigen Injektionsstelle austreten könnte. Optional: Mit dem Daumen und Zeigefinger der nicht-dominanten Hand üben Sie 10 s lang proximal (stromaufwärts/näher am Mauskörper) Druck auf die Injektionsstelle aus. Die Finger fungieren als Tourniquets, um die Vene an der Injektionsstelle weiter zu erweitern. Unmittelbar nach dem 10 s Tourniquet lassen Sie die Tourniquet-Finger los und achten darauf, dass eine der beiden Seitenvenen nach oben zeigt und deutlich sichtbar ist. - Halten Sie den Schwanz mit der nicht dominanten Hand mit Daumen und Zeigefinger unmittelbar distal zur Injektionsstelle. Falten Sie den Schwanz über den Zeigefinger, so dass die Injektionsstelle flach auf dem Zeigefinger liegt. Ziehen Sie den Schwanz nach hinten, so dass der Schwanz gestreckt ist und die Injektionsstelle vollständig horizontal (bei 0°) (parallel zum horizontalen Tisch) ist (Abbildung 1C).
- Halten Sie die Spritze mit dem Zeige- und Mittelfinger der dominanten Hand auf beiden Seiten des Zylinderflansches der Spritze, während Sie den Daumen am Kolben halten.
HINWEIS: Dies macht es einfacher, den Daumen oder die Nadel nicht zu bewegen, sobald sich die Nadel in der Vene befindet (Abbildung 1C). - Legen Sie beide Hände auf den Tisch, um sie zu stabilisieren, und platzieren Sie die Nadel direkt auf und parallel zum Schwanz und zur Vene, wobei die Fase nach oben zeigt. Halten Sie die Injektionsstelle nahe am Zeigefinger und halten Sie den Schwanz, um die Kontrolle und Stabilität der Injektionsstelle zu verbessern.
HINWEIS: Der Schlauchhalter sollte tief genug im Tisch sitzen, damit beide Hände auf dem Tisch abgestützt sind. - Während Sie die Nadel parallel zur Schwanzvene halten und Druck nach unten auf die Nadel ausüben, schieben Sie die Nadel nach vorne in die Vene.
HINWEIS: Der Druck nach unten sollte ausreichen, um die Nadel im richtigen Winkel in die Vene einzuführen. Die Vene ist extrem flach, daher sollte die Nadel so flach wie möglich sein, wenn man versucht, in die Vene einzudringen. - Injiziere die Lösung langsam in die Vene. Ziehen Sie nach der Verabreichung der Dosis die Nadel langsam zurück und üben Sie sofort mindestens 10 s lang Druck mit einer Gaze auf die Injektionsstelle aus, um die Blutung zu stoppen.
HINWEIS: Üben Sie den Druck so lange wie nötig aus, bis die Blutung vollständig gestoppt ist, um einen möglichen Verlust des injizierten Reagenzes zu vermeiden. Nach dem Zurückziehen der Nadel tritt in der Regel ein Blutstropfen auf, der darauf hinweist, dass die Nadel in die Vene eingedrungen ist. Gelegentlich tritt der Blutstropfen auch bei erfolgreicher Injektion nicht auf. Der Blutstropfen zeigt keine erfolgreiche Injektion an; Es zeigt nur an, dass die Nadel in die Vene eingedrungen ist. Der zuverlässige Indikator für eine erfolgreiche Injektion ist das völlige Fehlen von Kolbenwiderstand während der Injektion. Wenn sich die Nadel in der Vene befindet, sollte während der Injektion des Injekts kein Widerstand am Nadelkolben vorhanden sein, und die Vene proximal der Injektionsstelle erscheint vorübergehend etwas heller (blanchiert) (das Blanchieren der Vene ist bei einigen Mausstämmen möglicherweise nicht sehr deutlich). Wenn es einen Widerstand gibt und/oder eine Ausbuchtung an der Injektionsstelle auftritt, wird die Nadel nicht richtig in der Vene platziert. In diesem Fall entfernen Sie die Nadel vollständig vom Schwanz und versuchen Sie, die Vene an einer neuen Injektionsstelle proximal der fehlgeschlagenen Injektionsstelle (näher am Mauskörper) zu injizieren. - Entsorgen Sie die mit AAV kontaminierten Spritzen und Schläuche gemäß den Abfallentsorgungsrichtlinien der Einrichtung.
- Befreien Sie die Maus von den Fixierungen und setzen Sie sie wieder in einen neuen Käfig, der von nicht injizierten Mäusen getrennt ist. Überwachen Sie die Mäuse 10 Minuten lang, um ein normales Aktivitätsniveau nach der Injektion sicherzustellen.
HINWEIS: Dadurch wird eine mögliche Übertragung von injizierten Erregern auf nicht injizierte Mäuse vermieden, wenn übertragbare Erreger verabreicht werden. - Desinfizieren Sie den Arbeitsbereich mit bakteriziden, fungiziden und viruziden Reagenzien und 70 % EtOH. Reinigen Sie den Mausschlauch mit Wasser und Seife.
- Legen Sie das unverschlossene AAV-haltige 1,7-ml-Mikrozentrifugenröhrchen in ein Röhrchengestell. Führen Sie die Nadel mit der dominanten Hand senkrecht in das Rohr ein. Sobald sich die Nadel in der Röhre befindet, halten Sie die Röhre mit der nicht dominanten Hand.
3. Dissektion und Gewebeentnahme und -fixierung27
- Vorbereitung der Gewebeentnahmestation
- Reinigen Sie den Arbeitsplatz mit einem DNA-Abbaureagenz gemäß den Anweisungen des Herstellers, um kontaminierende DNA, die sich möglicherweise im Arbeitsbereich befindet, abzubauen.
- Methylbutan in einen Metallbehälter geben. Stellen Sie den Methylbutan-Metallbehälter in eine Styroporbox. Umgeben Sie dann den Metallbehälter mit Trockeneis, so dass der Gehalt des Trockeneises, das den Behälter umgibt, höher ist als der Methylbutangehalt im Behälter.
- Beschriften Sie leere 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen und legen Sie sie auf das Trockeneis. Lassen Sie das Methylbutan und die Gewebeaufbewahrungsröhrchen mindestens 20 Minuten lang auf Trockeneis abkühlen, bevor Sie mit dem Einfrieren des Gewebes beginnen. Legen Sie die Gewebetransferzange auf Trockeneis.
- Beschriften und befüllen Sie einen weiteren Satz von 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen mit frischen 4 % Paraformaldehyd (PFA) und bewahren Sie sie bei Raumtemperatur auf. Geben Sie genügend 4% PFA in jedes Röhrchen, um das Gewebe, das in das Röhrchen gelegt wird, vollständig einzutauchen.
- Gewebeentnahme und -fixierung
- Euthanasieren Sie die Maus gemäß den Tierhaltungsrichtlinien der Einrichtung.
HINWEIS: Hier wurden die Mäuse mittels Zervixluxation euthanasiert. - Sprühen Sie die Maus vollständig mit 70% EtOH ein.
- Sammeln Sie die benötigten Taschentücher.
HINWEIS: Das hier beschriebene Entnahme- und Fixationsprotokoll wurde an der Skelettmuskulatur und der Leber getestet. - Für Gewebe, die für die DNA-Extraktion verwendet werden:
- Lassen Sie das Tuch in vorgekühltem Methylbutan auf Trockeneis fallen und lassen Sie das Tuch mindestens 1 Minute lang in Methylbutan. Verwenden Sie die vorgekühlte Transferzange, um das gefrorene Gewebe aus dem Methylbutan in die vorgekühlten leeren 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen zu übertragen. Lagern Sie das Gewebe bei -80 °C.
HINWEIS: Optional: Das Gewebe kann in 20 mg Stücke geschnitten werden, bevor es in Methylbutan gegeben wird, um in Schritt 4.1.4 verwendet zu werden.
- Lassen Sie das Tuch in vorgekühltem Methylbutan auf Trockeneis fallen und lassen Sie das Tuch mindestens 1 Minute lang in Methylbutan. Verwenden Sie die vorgekühlte Transferzange, um das gefrorene Gewebe aus dem Methylbutan in die vorgekühlten leeren 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen zu übertragen. Lagern Sie das Gewebe bei -80 °C.
- Für Gewebe, die für die histologische Analyse und zur Erhaltung der Fluoreszenz von Reporterproteinen verwendet werden:
- Lassen Sie das Gewebe mit einer PFA-gekennzeichneten Pinzette, die bei Raumtemperatur aufbewahrt wird, in das jeweilige Mikrozentrifugenröhrchen fallen, das 4 % PFA enthält (bei Raumtemperatur aufbewahrt), und stellen Sie sicher, dass das Gewebe vollständig in die 4 %ige PFA-Lösung eingetaucht ist.
HINWEIS: Eine PFA-Kontamination kann sich negativ auf verschiedene nachgeschaltete molekulare Assays auswirken. Verwenden Sie beim Umgang mit PFA nur eine PFA-gekennzeichnete Pinzette, um eine PFA-Kontamination anderer Gewebe oder Werkzeuge zu verhindern. - Legen Sie die Mikrozentrifugenröhrchen auf ein Gestell und decken Sie das Gestell mit Folienpapier ab, um die Röhrchen im Dunkeln zu halten. Inkubieren Sie das abgedeckte Gestell bei 4 °C auf einem Shaker unter leichtem Schütteln über Nacht.
- Nach der Inkubation über Nacht 5 % Saccharose (% w/v) in 1 x PBS herstellen, indem 5,0 g Saccharose in 70 ml 1 x PBS durch kräftiges Schütteln aufgelöst werden. Fügen Sie genügend 1x PBS zu einem endgültigen Gesamtvolumen von 100 mL hinzu, um eine 5%ige Saccharoselösung (% w/v) zu erhalten.
- Sterilisieren Sie die 5%ige Saccharoselösung mit dem 0,22 μm Spritzenfilter. Beschriften und befüllen Sie 2,0 mL Mikrozentrifugenröhrchen mit frisch zubereiteter 5% Saccharose.
- Übertragen Sie das Gewebe von 4 % PFA in das jeweilige Mikrozentrifugenröhrchen, das 5 % Saccharose enthält (bei Raumtemperatur aufbewahrt), und stellen Sie sicher, dass das Gewebe vollständig in die 5%ige Saccharoselösung eingetaucht ist.
- Legen Sie die Mikrozentrifugenröhrchen auf ein Gestell und decken Sie das Gestell mit Folienpapier ab, um die Röhrchen im Dunkeln zu halten. Inkubieren Sie das abgedeckte Gestell bei 4 °C auf einem Shaker unter leichtem Schütteln über Nacht.
- Nach der Inkubation über Nacht werden 20 % Saccharose (% w/v) in 1 x PBS hergestellt, indem 20,0 g Saccharose in 70 ml 1 x PBS durch kräftiges Schütteln aufgelöst werden. Fügen Sie genügend 1x PBS zu einem endgültigen Gesamtvolumen von 100 ml hinzu, um eine 20%ige Saccharoselösung (% w/v) zu erhalten.
- Sterilisieren Sie die 20%ige Saccharoselösung mit einem 0,22 μm Spritzenfilter. 2,0 mL Mikrozentrifugenröhrchen etikettieren und mit frisch vorbereiteter 20%iger Saccharose befüllen.
- Übertragen Sie das Gewebe von 5 % Saccharose in das entsprechende Mikrozentrifugenröhrchen, das 20 % Saccharose enthält (bei Raumtemperatur aufbewahrt), und stellen Sie sicher, dass das Gewebe vollständig in die 20%ige Saccharoselösung eingetaucht ist.
- Legen Sie die Mikrozentrifugenröhrchen auf ein Gestell und decken Sie das Gestell mit Folienpapier ab, um die Röhrchen im Dunkeln zu halten. Inkubieren Sie das abgedeckte Gestell bei 4 °C auf einem Shaker unter leichtem Schütteln über Nacht.
- Nach der Inkubation über Nacht wird Methylbutan in einen Metallbehälter gegeben und der Methylbutan-Metallbehälter in eine Styroporbox gestellt. Umgeben Sie den Metallbehälter mit Trockeneis, so dass der Gehalt des Trockeneises, das den Behälter umgibt, höher ist als der Methylbutangehalt im Behälter.
- Beschriften Sie leere 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen und legen Sie sie auf Trockeneis. Lassen Sie das Methylbutan und die Gewebeaufbewahrungsröhrchen mindestens 20 Minuten lang auf Trockeneis abkühlen, bevor Sie mit dem Einfrieren des Gewebes beginnen. Legen Sie die Transferzange auf Trockeneis.
- Tupfen Sie das Taschentuch schnell mit Präzisionstüchern ab, um überschüssige 20% Saccharose zu entfernen. Lassen Sie das Tuch in Methylbutan fallen, das auf Trockeneis vorgekühlt ist. Lassen Sie das Gewebe mindestens 1 Minute lang in Methylbutan.
- Verwenden Sie die vorgekühlte Transferzange, um das gefrorene Gewebe aus dem Methylbutan in die vorgekühlten leeren 2-ml-Mikrozentrifugen-Gewebeaufbewahrungsröhrchen zu übertragen. Lagern Sie das Gewebe bei -80 °C.
- Lassen Sie das Gewebe mit einer PFA-gekennzeichneten Pinzette, die bei Raumtemperatur aufbewahrt wird, in das jeweilige Mikrozentrifugenröhrchen fallen, das 4 % PFA enthält (bei Raumtemperatur aufbewahrt), und stellen Sie sicher, dass das Gewebe vollständig in die 4 %ige PFA-Lösung eingetaucht ist.
- Euthanasieren Sie die Maus gemäß den Tierhaltungsrichtlinien der Einrichtung.
4. dPCR zur vg/dg-Quantifizierung
- DNA-Extraktion aus Geweben und initialer RNA-Verdau
HINWEIS: Zur Ableitung dieses DNA-Extraktionsprotokolls wurde das Handbuch des DNA-Extraktionskits verwendet, das in der Materialtabelle aufgeführt ist. Bewahren Sie die Röhrchen mit den gefrorenen Gewebestücken immer auf Trockeneis auf.- Bereite einen Eimer Eis vor.
- Markieren Sie für jede DNA-Probe ein 1,5-ml-Lysebead-Röhrchen und zwei leere RNase-freie und DNase-freie 1,7-ml-Mikrozentrifugenröhrchen.
- Geben Sie 180 μl des Puffers des ersten DNA-Extraktionskits in jedes Bead-Röhrchen. Tarieren Sie das erste Bead-Rohr mit Puffer.
HINWEIS: Wenn die Taschentücher in Schritt 3.2.4.1 nicht vorgeschnitten wurden, verwenden Sie eine auf Trockeneis vorgekühlte Rasierklinge, um das Gewebe in 20 mg Stücke zu schneiden. Dieser Schritt muss in einem sauberen Kryostaten durchgeführt werden, der bei -20 °C oder kälter aufbewahrt wird. - Geben Sie ein Stück Gewebe in das Röhrchen; Wiegen und notieren Sie das Gewicht des Gewebes (~20 mg).
- Legen Sie das Lyseperlenröhrchen mit dem darin befindlichen Gewebe sofort auf Eis. Der Puffer kann kristallisieren.
- Wiederholen Sie die vorherigen Schritte für jede Gewebeprobe.
- Übertragen Sie die Röhrchen in den Lyseperlröhrchenmischer und lassen Sie sie 1 Minute lang bei maximaler Drehzahl (Stufe 10) bei 4 °C laufen.
- Legen Sie die Proben auf Eis, um sie in die Zentrifuge zu überführen. 1 min bei 20.000 × g bei 4 °C zentrifugieren.
- Geben Sie während des Zentrifugationsschritts 20 μl Proteinase K in die erste Serie von 1,7-ml-Mikrozentrifugenröhrchen. Nach dem Zentrifugationsschritt wird der Überstand der Homogenate in die 1,7-ml-Röhrchen mit der Proteinase K überführt und gut vermischt. 15 min bei 56 °C inkubieren, mit 500 U/min mischen.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. 2 min bei Raumtemperatur inkubieren.
- 4 μl RNase A zugeben und durch kurzes Impuls-Vortexen mischen. 2 min bei Raumtemperatur inkubieren. Pulswirbel für 15 s.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. Fügen Sie 200 μl des Puffers des zweiten DNA-Extraktionskits hinzu. Pulswirbel für 15 s.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. Fügen Sie 200 μl 100 % EtOH hinzu. Pulswirbel für 15 s.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. Übertragen Sie die Lysate in die Spin-Säule der DNA-Extraktion. Bei 6.000 × g 1 Min. schleudern.
- Setzen Sie die Schleudersäule in ein neues Auffangröhrchen ein. Geben Sie 500 μl des Puffers des dritten DNA-Extraktionskits in die Spin-Säule. Bei 6.000 × g 1 Min. schleudern.
- Setzen Sie die Schleudersäule in ein neues Auffangröhrchen ein. Geben Sie 500 μl des Puffers des vierten DNA-Extraktionskits in die Spin-Säule. Bei 20.000 × g 3 Min. schleudern.
- Setzen Sie die Spin-Säule in ein neues 1,7-ml-Mikrozentrifugenröhrchen ein. Geben Sie 100 μl Wasser in molekularer Qualität in die Spin-Säule. 1 min bei Raumtemperatur inkubieren. Bei 6.000 × g 1 min bei Raumtemperatur schleudern.
- Messen Sie bei Bedarf die DNA-Konzentration. Bei 4 °C für die kurzfristige Lagerung oder -20 °C für die langfristige Lagerung lagern.
- DNA-Extraktion aus FACS-sortierten Zellen
HINWEIS: Zur Ableitung dieses DNA-Extraktionsprotokolls wurde das Handbuch des DNA-Extraktionskits verwendet, das in der Materialtabelle aufgeführt ist.- Nach dem Sortieren der Zellen zentrifugieren Sie die Proben bei 300 × g für 5 s, um alle Tropfen an den Seiten und am Deckel aufzufangen. Stellen Sie sicher, dass alle Tropfen aufgefangen werden.
HINWEIS: Wenn das Probenvolumen weniger als 1,5 ml beträgt, fahren Sie direkt mit dem nächsten Schritt fort. Wenn das Probenvolumen mehr als 1,5 ml beträgt, entfernen und entsorgen Sie den oberen Teil des Überstands vorsichtig mit einer Mikropipette, wobei 1-1,5 ml der Probe übrig bleiben. - Mischen Sie die Probe, indem Sie mehrmals auf und ab pipettieren und die Probe in ein 1,7-ml-Mikrozentrifugenröhrchen überführen. Bei 515 × g 1 min bei Raumtemperatur zentrifugieren.
- Der Überstand mit Ausnahme der letzten 50 μl ist zu verwerfen. Das Pellet wird in 50 μl des Puffers des ersten DNA-Extraktionskits für ein Endvolumen von 100 μl resuspendiert.
- Befolgen Sie das Protokoll des Herstellers für die Isolierung genomischer DNA aus kleinen Blutmengen (siehe Materialtabelle).
- Fügen Sie 10 μl Proteinase K und 100 μl Puffer des zweiten DNA-Extraktionskits hinzu; 15 s lang durch Pulswirbeln mischen. Inkubieren Sie die Proben 10 Minuten lang bei 56 °C mit 300 U/min. Mischen Sie die Proben während dieser Inkubationszeit zweimal durch sanfte Inversion.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. 50 μl 100% EtOH zugeben und 15 s lang durch Pulswirbelwirbeln mischen. Inkubieren Sie die Proben 5 Minuten lang bei Raumtemperatur.
- Sammeln Sie die Tropfen von den Wänden und dem Deckel des Röhrchens, indem Sie das Röhrchen mit einer Minizentrifuge 1-2 s lang zentrifugieren. Übertragen Sie die Proben in die DNA-Extraktionssäule (die Säule befindet sich in einem 2-ml-Sammelröhrchen), ohne den Rand zu benetzen. Bei 6.000 × g 1 min zentrifugieren.
- Nachdem Sie die Säule in ein sauberes 2-ml-Entnahmeröhrchen gelegt haben, entsorgen Sie das Entnahmeröhrchen mit dem Durchfluss. Geben Sie 500 μl des Puffers des dritten DNA-Extraktionskits in die Säule, ohne den Rand zu benetzen, und zentrifugieren Sie 1 Minute lang bei 6.000 × g .
- Nachdem Sie die Säule in ein sauberes 2-ml-Sammelröhrchen gelegt haben, entsorgen Sie das Entnahmeröhrchen mit dem Durchfluss. Geben Sie 500 μl des Puffers des vierten DNA-Extraktionskits in die Säule, ohne den Rand zu benetzen, und zentrifugieren Sie 1 Minute lang bei 6.000 × g .
- Legen Sie die Säule in ein sauberes 2-ml-Sammelröhrchen und entsorgen Sie das Durchfluss-Sammelröhrchen. Bei 20.000 × g 3 min zentrifugieren.
- Stellen Sie die Säule in ein sauberes 1,7-ml-Mikrozentrifugenröhrchen und entsorgen Sie das Durchflusssammelröhrchen. Geben Sie 20 μl Wasser in molekularer Qualität in die Mitte der Säulenmembran für die Elution; Schließen Sie den Deckel und inkubieren Sie die Proben mit dem Wasser in molekularer Qualität bei Raumtemperatur für 5 Minuten.
- Bei 20.000 × g 1 min zentrifugieren. Lagern Sie die eluierte DNA bei 4 °C für die Kurzzeitlagerung oder -20 °C für die Langzeitlagerung.
- Nach dem Sortieren der Zellen zentrifugieren Sie die Proben bei 300 × g für 5 s, um alle Tropfen an den Seiten und am Deckel aufzufangen. Stellen Sie sicher, dass alle Tropfen aufgefangen werden.
- RNA-Verdau und -Reinigung
HINWEIS: Das Handbuch des DNA-Extraktionskits, das in der Materialtabelle aufgeführt ist, wurde verwendet, um dieses DNA-Aufreinigungsprotokoll abzuleiten. Abhängig von den dPCR-Bedingungen, den Reagenzien und dem Primer- und Sondendesign kann es erforderlich sein, sicherzustellen, dass die DNA-Probe vollständig frei von RNA ist, bevor mit der dPCR vg/dg-Quantifizierung fortgefahren wird. Eine RNA-Kontamination kann unter bestimmten dPCR-Bedingungen zu unterschiedlich hohen ungenauen vg/dg-Werten führen.- Geben Sie in einem 0,2-ml-PCR-Röhrchen oder einem 1,7-ml-Mikrozentrifugenröhrchen maximal 20 μl der extrahierten DNA-Probe und 1,5 μl der DNase-freien RNase zu jeder DNA-Probe. Wenn das DNA/RNase-Mischvolumen weniger als 21,5 μl beträgt, fügen Sie genügend Wasser in molekularer Qualität bis zu einem Endvolumen von 21,5 μl hinzu und mischen Sie 25x, indem Sie die Röhrchen umdrehen. 30 Minuten lang bei 37 °C inkubieren, alle 10 Minuten durch Umdrehen der Röhrchen mischen.
HINWEIS: Die Gesamtmenge der Nukleinsäuren, die dem Röhrchen zugesetzt werden, sollte zwischen 175 ng und 700 ng liegen. Modifikationen können erforderlich sein, wenn die DNA-Proben Volumina oder Nukleinsäuremengen enthalten, die außerhalb dieses Bereichs liegen, oder wenn DNA-Proben anders isoliert wurden. - 2 Min. auf Eis legen. Fügen Sie jedem DNA/RNase-Gemisch ausreichend Wasser in molekularer Qualität bis zu einem Endvolumen von 100 μl hinzu.
HINWEIS: Die hier aufgeführte RNase wird empfohlen, da sie die kontaminierende RNA verdaut, ohne die Ziel-DNA oder nachgeschaltete PCR-Assays negativ zu beeinflussen. - Befolgen Sie das Protokoll des Herstellers für die Reinigung der genomischen DNA (siehe Materialtabelle).
- Fügen Sie 10 μl des ersten Puffers des DNA-Extraktionskits und 250 μl des Puffers des zweiten DNA-Extraktionskits hinzu. 10 s lang durch Pulswirbeln mixen.
- Übertragen Sie die Proben in einem 2-ml-Sammelröhrchen in die DNA-Extraktionssäule, ohne den Rand zu benetzen. Bei 6.000 × g 1 min zentrifugieren.
- Nachdem Sie die Säule in ein sauberes 2-ml-Entnahmeröhrchen gelegt haben, entsorgen Sie das Entnahmeröhrchen mit dem Durchfluss. Geben Sie 500 μl des Puffers des zweiten DNA-Extraktionskits in die Säule, ohne den Rand zu benetzen. Bei 6.000 × g 1 min zentrifugieren.
- Legen Sie die Säule in ein sauberes 2-ml-Sammelröhrchen und entsorgen Sie das Durchfluss-Sammelröhrchen. Bei 20.000 × g für 6 min zentrifugieren.
- Legen Sie die Säule in ein sauberes 1,7-ml-Mikrozentrifugenröhrchen und entsorgen Sie das Sammelröhrchen mit dem Durchfluss. Geben Sie 20 μl Wasser in molekularer Qualität zur Elution in die Mitte der Säulenmembran, schließen Sie den Deckel und inkubieren Sie die Proben mit dem Wasser in molekularer Qualität bei Raumtemperatur für 5 Minuten.
- Bei 20.000 × g 1 min zentrifugieren. Bei 4 °C für die kurzfristige Lagerung oder -20 °C für die langfristige Lagerung lagern.
- Bestätigen Sie das Fehlen einer RNA-Kontamination in der RNase-verdauten Probe mit Endpunkt-PCR oder dPCR oder quantitativer PCR (qPCR) unter Verwendung eines PCR-Primerpaares, das eine mRNA-Region amplifiziert, die sich über mehrere Exons und nicht nur über ein einzelnes Exon erstreckt.
HINWEIS: Das mRNA-Ziel sollte von einem Gen stammen, das im Zielgewebe/-zelltyp stark exprimiert wird, um sicherzustellen, dass die mRNA-Kontamination, falls vorhanden, korrekt identifiziert wird. Amplikons, die sich über mehrere Exons erstrecken, unterscheiden zwischen Banden, die aus der Kontamination von mRNA resultieren, und genomischer DNA. Halten Sie immer eine nicht-RNase-verdaute DNA-Probe als Positivkontrolle für die PCR-Reaktion bereit, um sicherzustellen, dass eine mRNA-Kontamination nachgewiesen wird, falls vorhanden.
- Geben Sie in einem 0,2-ml-PCR-Röhrchen oder einem 1,7-ml-Mikrozentrifugenröhrchen maximal 20 μl der extrahierten DNA-Probe und 1,5 μl der DNase-freien RNase zu jeder DNA-Probe. Wenn das DNA/RNase-Mischvolumen weniger als 21,5 μl beträgt, fügen Sie genügend Wasser in molekularer Qualität bis zu einem Endvolumen von 21,5 μl hinzu und mischen Sie 25x, indem Sie die Röhrchen umdrehen. 30 Minuten lang bei 37 °C inkubieren, alle 10 Minuten durch Umdrehen der Röhrchen mischen.
- Digitale PCR (dPCR)
- Endpunkt-PCR zur Überprüfung der Spezifität der Primer und der optimalen PCR-Bedingungen (optional)
- Entwerfen Sie dPCR-Primerpaare und -Sonden für das Vektorgenom sowie dPCR-Primerpaare und -Sonden für das Maus-Referenzgen, die zur Quantifizierung der diploiden Genome in der Probe verwendet werden.
HINWEIS: Streben Sie eine Amplikongröße zwischen 60 bp und 150 bp an. Das Maus-Referenzgen sollte ein Gen sein, das eine konstante Genkopienzahl pro diploidem Genom hat. Für die hier aufgeführten Berechnungen hat das Referenzgen (Polr2a) zwei Kopien pro diploidem Genom. - Bereiten Sie für die 10-μl-Endpunkt-PCR-Reaktion die PCR-Mischung mit den Reagenzien und Endkonzentrationen vor, die später für die dPCR-Reaktion verwendet werden sollen. Geben Sie die RNase-verdaute Template-DNA-Probe (Nukleinsäuremengenbereich 56-223 ng) zu einer Endkonzentration von 1x dPCR-Mastermix, der die DNA-Polymerase und dNTPs, 0,8 μM jedes Forward-Primers, 0,8 μM jedes Reverse-Primers, 0,4 μM jeder Sonde und 0,025 U/μL Restriktionsenzym enthält (die endgültige Konzentration des Restriktionsenzyms hängt vom verwendeten Restriktionsenzym und der verwendeten Marke ab). Fügen Sie Wasser in molekularer Qualität hinzu, um ein Endvolumen von 10 μl zu erreichen.
HINWEIS: Der PCR-Mix sollte mindestens zwei Primerpaare und zwei Sonden enthalten: ein Primerpaar und eine Sonde zum Nachweis des Vektorgenoms und ein Primerpaar und eine Sonde zum Nachweis des Mausgenoms. - PCR-Temperaturwechselbedingungen: Erster Wärmeaktivierungsschritt bei 95 °C für 2 min, gefolgt von 35-45 Zyklen eines Denaturierungsschritts bei 95 °C für 25 s und eines kombinierten Glüh-/Verlängerungsschritts bei 58-62 °C für 1 min.
HINWEIS: Die optimale Glühtemperatur muss für jedes Amplikon- und Primerpaar bestimmt werden. Die Anzahl der Zyklen konnte entsprechend der Menge an Matrizen-DNA in der Probe angepasst werden. - Visualisieren Sie das PCR-Produkt auf einem Agarose-Gel unter Verwendung der Gelelektrophorese, um das Vorhandensein der Ziel-Amplikonbanden und möglicher unspezifischer Amplifikationsbanden zu bestimmen.
- Fahren Sie mit dem nächsten dPCR-Schritt fort, nachdem Sie bestätigt haben, dass die Primerpaare und die Zyklusbedingungen zu einer spezifischen Amplifikation der Zielsequenzen führen.
- Entwerfen Sie dPCR-Primerpaare und -Sonden für das Vektorgenom sowie dPCR-Primerpaare und -Sonden für das Maus-Referenzgen, die zur Quantifizierung der diploiden Genome in der Probe verwendet werden.
- dPCR-Reaktion
- Für eine 40 μl dPCR-Reaktion fügen Sie bis zu 4 μl der RNase-verdauten Template-DNA-Probe (Nukleinsäuremengenbereich 50-330 ng) zu einer Endkonzentration von 1x dPCR-Mastermix hinzu, der die DNA-Polymerase und dNTPs enthält, 0,8 μM jedes Forward-Primers, 0,8 μM jedes Reverse-Primers, 0,4 μM jeder Sonde, und 0,025 U/μl Restriktionsenzym (die endgültige Konzentration des Restriktionsenzyms hängt vom verwendeten Restriktionsenzym und der verwendeten Marke ab). Fügen Sie Wasser in molekularer Qualität hinzu, um ein Endvolumen von 40 μl zu erreichen.
- dPCR-Temperaturwechselbedingungen: Erster Wärmeaktivierungsschritt bei 95 °C für 2 min, gefolgt von 40-50 Zyklen eines Denaturierungsschritts bei 95 °C für 25 s und eines kombinierten Glüh-/Verlängerungsschritts bei 58-62 °C für 1 min.
HINWEIS: Die optimale Glühtemperatur muss für jedes Amplikon- und Primerpaar bestimmt werden. Die Anzahl der Zyklen konnte entsprechend der Menge der Matrizen-DNA in der Probe angepasst werden. Die hier aufgeführten Volumina, Konzentrationen und Bedingungen sind für dPCR-Platten, Reagenzien und Geräte optimiert, die in der Materialtabelle aufgeführt sind. Diese Bedingungen verringern die Wirkung potenzieller dPCR-Inhibitoren, die die Genauigkeit der Reaktion verringern können. - Nachdem Sie die dPCR-Reaktion durchgeführt und die absoluten Werte für die Vektorgenome und das Maus-Referenzgen erhalten haben, berechnen Sie vg/dg in der Probe unter Verwendung der Gleichungen (7-8).
Für Referenzgene mit zwei Genkopien/diploidem Genom:
Absoluter Wert diploider Genome (dg) =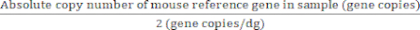 (7)
(7)
vg/dg =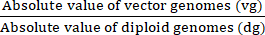 (8)
(8) - Überprüfen Sie das 1D-Scatterplot der dPCR-Reaktion, um die Gültigkeit des Assays und der Quantifizierung zu bestätigen (Abbildung 3A,C). Damit der Assay gültig ist, bestätigen Sie, dass das 1D-Streudiagramm alle folgenden Kriterien erfüllt: das Vorhandensein positiver und negativer Partitionen; klare Trennung zwischen positiver und negativer Trennwand, um eine genaue Bestimmung des Schwellenwerts zu ermöglichen; und das Vorhandensein von wenigen bis wenigen Tröpfchen zwischen der positiven und negativen Partition (auch bekannt als Regen), die die Genauigkeit der dPCR-Quantifizierung verringern können.
- Endpunkt-PCR zur Überprüfung der Spezifität der Primer und der optimalen PCR-Bedingungen (optional)
Ergebnisse
Sieben bis neun Wochen alten männlichen Mäusen wurde AAV durch laterale Schwanzveneninjektion in einer Dosis von 1,5 × 1012 vg/Maus injiziert, die in einem Injektionsvolumen von 150-200 μl verabreicht wurde. Das hier verwendete ssDNA-AAV lieferte ein Cre-Rekombinase-Transgen, das vom CMV-Promotor angetrieben wird. Die injizierten Mäuse waren homozygot für das Cre-Reporter-Allel Ai14. Wenn sie der Cre-Rekombinase ausgesetzt sind, exprimieren Ai14-Allel-haltige Zellen das fluoreszierende tdTomato-Protein. Da die tdTomato-Expression durch Cre-induzierte genomische Rekombination verursacht wird, weisen tdTomato-exprimierende Zellen auf Zellen hin, die entweder direkt durch das AAV transduziert wurden oder Nachkommenzellen von transduzierten Zellen waren. Die hier gezeigten Daten beziehen sich auf Mäuse, denen AAV9-CMV-Cre in einer Dosis von 1,5 × 1012 vg/Maus in 160 μl (5,8-5,9 × 1013 vg/kg) injiziert wurde. Die Mäuse wurden 28 Tage nach der Injektion getötet und das Gewebe wie oben beschrieben entnommen. Einige Skelettmuskeln und Leberlappen wurden verdaut und ihre Zellen mit Hilfe von FACS gesammelt. Einige Leberlappen wurden sofort mit vorgekühltem Methylbutan für die Nukleinsäureextraktion eingefroren. Einige Skelettmuskeln und Leberlappen wurden für die histologische Bildgebung der fluoreszierenden tdTomate fixiert. tdTomato wurde diffus in der Leber (Abbildung 2A) und im Quadrizeps (Abbildung 2C) exprimiert, was darauf hindeutet, dass AAV9 verschiedene Regionen beider Gewebe erreichte und transduzierte.
DNA, die aus frisch gefrorener Leber und FACS-sortierten Zellen extrahiert wurde, wurde verwendet, um vg/dg mittels dPCR zu quantifizieren. Die Vg/dg-Quantifizierung kann verwendet werden, um die Konsistenz der Injektion und die Transduktionseffizienz von AAV in der analysierten Probe zu beurteilen. Die 1D-Tröpfchen-Streudiagramme aus der frisch gefrorenen Lebergewebeprobe und den FACS-sortierten Zellen wurden verwendet, um die Validität des Assays sicherzustellen (Abbildung 3A,C). Das Streudiagramm zeigte das Vorhandensein positiver und negativer Partitionen, eine klare Trennung zwischen der positiven und der negativen Partition, die eine genaue Bestimmung der Nachweisschwelle ermöglicht, und das Vorhandensein von wenigen bis wenigen Tröpfchen zwischen der positiven und negativen Partition, die die Genauigkeit des dPCR-Assays verringern können. Die Erfüllung all dieser Kriterien deutete darauf hin, dass die Ergebnisse des dPCR-Assays gültig waren. Die Anzahl der Polr2a-Genkopien in jeder Probe wurde quantifiziert, um die Anzahl der diploiden Genome der Maus zu bestimmen (2 Polr2a-Genkopien/diploides Genom der Maus), und Primer/Sonden gegen die Cre-Rekombinase-Transgensequenz wurden verwendet, um das virale Genom zu quantifizieren (1 Transgenkopie/virales Genom, Tabelle 1). Der vg/dg-Wert wurde für die frisch gefrorene Lebergewebeprobe und die FACS-sortierten Zellen quantifiziert und zeigte das Vorhandensein von 187,7 vg/dg bzw. 4,7 vg/dg in jeder Probe (Abbildung 3B,D). Proben von PBS-injizierten Mäusen und Nicht-Template-Kontrollen, die keine Nukleinsäuren enthielten, wurden als Negativkontrollen verwendet.

Abbildung 1: Übersicht über die intravenöse Injektionsstation. (A) Erforderliche Werkzeuge für die Durchführung der IV-Injektion. Hier gezeigt sind der (1) Timer, (2) der Rückhalteapparat für Mausschläuche, (3) ungeschnittene und (4) geschnittene Kunststoff-Rückhaltekegel, (5) ein Alkoholtupfer, (6) eine leere Pipettenspitzenbox, die als Plattform zum Anheben des Mausschlauch-Rückhaltesystems verwendet wird, (7) Einweg-Absorptionspads, (8) ein konisches 15-ml-Röhrchen mit warmem Wasser, (9) ein 15-ml-Röhrchenhalter, (10) eine Gaze und (11) eine Insulinspritze. (B) Die Maus wird zuerst in den Schlauchrückhalter gelegt. Dann wird der geschnittene Rückhaltekegel eingeführt, um eine Rückhaltehülle um die Maus zu schaffen, wenn die Maus zu klein ist, um nur durch den Schlauchrückhalteapparat zurückgehalten zu werden. Stellen Sie sicher, dass die Atmung der Maus nicht durch die Fesseln behindert wird. Der Schlauch wird auf die erhöhte Plattform gelegt, um das Platzieren des Mausschwanzes in warmem Wasser zu ermöglichen. (C) Positionierung des Mausschwanzes und Haltewinkel der Nadel unmittelbar vor der Injektion. Ziehe den Schwanz nach hinten, so dass der Schwanz gestreckt ist und die Injektionsstelle vollständig horizontal ist. Die Nadel verläuft parallel zum Schwanz und zur Vene, und die Fase zeigt nach oben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
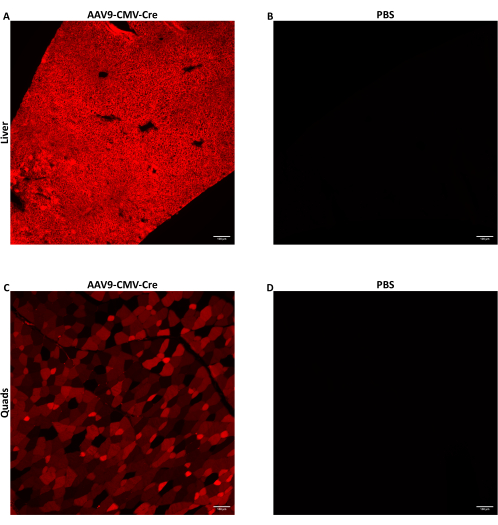
Abbildung 2: Nachweis des fluoreszierenden Reporterproteins nach der IV-Injektion. Sieben bis neun Wochen alte männliche Mäuse, die das Cre-Reporter-Allel Ai14 trugen, wurden entweder mit AAV9-CMV-Cre in einer Dosis von 1,5 × 10,12 vg/Maus in 160 μl (5,8-5,9 × 1013 vg/kg) oder PBS intravenös injiziert. Repräsentative Fluoreszenzbilder von Schnitten aus der Leber (A) oder (C) des Quadrizeps der Maus nach AAV9 nach der Injektion von Cre IV. (B) Leber- oder (D) Quadrizepsschnitte von PBS-injizierten Mäusen wurden als Negativkontrollen abgebildet. Das Gewebe wurde entnommen und 28 Tage nach der intravenösen Injektion fixiert. Nach der Cre-Exposition wird das fluoreszierende tdTomato-Protein in transduzierten Zellen und Nachkommenzellen transduzierter Zellen exprimiert. 10 μm dicke Schnitte wurden bei 10-facher Vergrößerung abgebildet. Maßstabsbalken = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
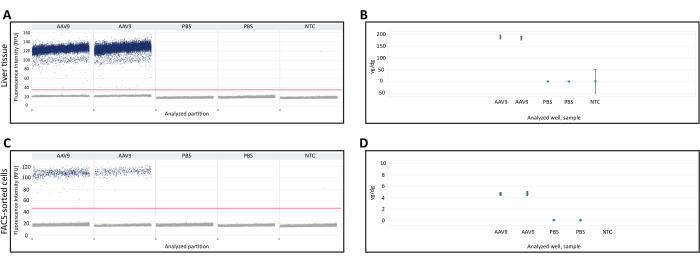
Abbildung 3: Quantifizierung des Vektorgenoms pro diploidem Genom (vg/dg). 1D-Scatterplot der Quantifizierung von dPCR-Vektorgenomen in (A) Lebergewebe oder (C) FACS-sortierten Zellen von Mäusen, die entweder mit AAV9-CMV-Cre oder PBS injiziert wurden. Die Streudiagramme zeigen die positiven und negativen dPCR-Partitionen sowie die Nachweisschwelle, die durch die horizontale Linie über den Proben angezeigt wird. (B,D) vg/dg-Quantifizierung nach Quantifizierung der diploiden Genome und Vektorgenome der Maus in den (B) Lebergewebe- oder (D) FACS-sortierten Zellproben. Die hier gezeigten Ergebnisse stammen von einer einzelnen AAV9-injizierten Maus und einer einzelnen PBS-injizierten Maus mit einem technischen dPCR-Duplikat für jede Maus. Fehlerbalken geben das Konfidenzintervall von 95 % für jede Stichprobe an. Abkürzungen: NTC= Nicht-Vorlagensteuerung; dPCR = digitale PCR; FACS = fluoreszenzaktivierte Zellsortierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Fibel | Reihenfolge |
| Cre Forward Grundierung | CTGACGGTGGGAGAATGTTAAT |
| Cre Reverse Grundierung | CATCGCTCGACCAGTTTAGTT |
| Cre-Sonde | /56-FAM/CGCAGGTGT/ZEN/AGAGAAGGCACTTAGC/3IABkFQ/ |
| Polr2a Vorwärts-Grundierung | GACTCCTTCACTCACTGTCTTC |
| Polr2a Rückseiten-Grundierung | TCTTGCTAGGCAGTCCATTATC |
| Polr2a-Sonde | /5HEX/ACGAGATGC/ZEN/TGAAAGAGCCAAGGT/3IABkFQ/ |
Tabelle 1: Sequenzen von Primern und Sonden, die für die vg/dg-Quantifizierung verwendet wurden. Cre-Primer und Sonde wurden verwendet, um das Vektorgenom zu quantifizieren. Polr2a-Primer und -Sonden wurden verwendet, um das diploide Genom der Maus zu quantifizieren.
Diskussion
AAV-basierte Therapien bergen aufgrund der Vielseitigkeit von AAV als Gentherapievektor ein großes Potenzial für monogene Erkrankungen, was es ermöglicht, AAVs an die unterschiedlichen Verabreichungsbedürfnisse verschiedener Erkrankungen anzupassen 4,5,7,9. AAVs werden in präklinischen Mausmodellen häufig per IV-Injektion verabreicht, um die Sicherheit und Wirksamkeit potenzieller Therapeutika zu testen16. Da unterschiedliche injizierte AAV-Dosen zu deutlichen Unterschieden in den experimentellen Ergebnissen führen können, ist es für die Experimentatoren von entscheidender Bedeutung, die beabsichtigte AAV-Dosis konsistent injizieren zu können, um die Gültigkeit und Robustheit der generierten In-vivo-Daten sicherzustellen28. IV-Injektionen sind weit verbreitet, aber sie sind technisch anspruchsvoll und erfordern umfangreiche Schulungen und kontinuierliches Üben, um ein Kompetenzniveau zu entwickeln und aufrechtzuerhalten, das eine gleichbleibend erfolgreiche Injektion gewährleistet 16,17,18,19. Zusätzlich zur korrekten Injektion von AAV ist es in der Regel wünschenswert, Assays zu verwenden, um die Bioverteilung und die Verabreichungseffizienz des injizierten AAV an die Zielgewebe oder -zellen zu beurteilen29,30.
Dieses Protokoll zielt darauf ab, Experimentatoren dabei zu unterstützen, IV-Injektionen erfolgreich und konsistent durchzuführen, indem es die Details eines optimierten IV-Injektionsprotokolls zur Verabreichung von AAV bei 7-9 Wochen alten, nicht edierten Mäusen ausführlich beschreibt. Es ist wichtig zu beachten, dass Mäuse, die deutlich kleiner oder größer als Wildtyp-Mäuse in der hier verwendeten Altersgruppe sind, aufgrund einer verminderten Sichtbarkeit der Venen oder einer Inkompatibilität mit den bei dieser Methode verwendeten Fesseln eine größere Herausforderung darstellen können. Es wurde bereits berichtet, dass Schwanz-IV-Injektionen aufgrund der kleinen Gefäßgröße31 nicht für die intravenöse Verabreichung von Reagenzien bei Mäusen unter 6 Wochen geeignet sind. Obwohl es möglich ist, könnte es schwierig sein, Mäuse mit einem Gewicht von weniger als 22,0 g erfolgreich zu injizieren. Forscher, die Mäuse untypischer Größe verwenden, müssen möglicherweise Anpassungen an das Verfahren vornehmen. Dieses Protokoll beschreibt auch mehrere Assays, die zur Beurteilung der AAV-Bioverteilung und der Transduktionseffizienz verwendet werden können.
Bei der Befolgung dieses Protokolls müssen einige kritische Punkte beachtet werden. Während der Injektion bieten 29-G-Nadeln einen höheren Widerstand, wenn sich die Nadel nicht in der Vene befindet. Dies reduziert den Volumenverlust, der durch versehentliche perivaskuläre Injektion der Lösung bei fehlgeschlagenen Injektionsversuchen verloren geht. Insulinspritzen haben ein geringeres Totvolumen als normale Spritzen. Wenn Sie eine andere Spritze und/oder Nadel als die hier aufgeführten verwenden, muss möglicherweise in den Protokollschritten 1.1.3.3 zusätzliches Injektionsvolumen vorbereitet werden, um ein größeres Totraumvolumen zu berücksichtigen (z. B. fügen Sie der vorgesehenen Dosis 30 μl anstelle von 15 μl hinzu).
Wenn sich beim Ansaugen der AAV-Dosis in die Spritze feine aspirationsbedingte Luftblasen an den Spritzenseiten bilden, ziehen Sie das Injektat langsam weiter nach oben auf der Spritze. Dadurch werden die meisten kleinen Luftblasen entfernt. Laden Sie mindestens weitere 10-15 μl AAV auf das vorgesehene Volumen, das injiziert werden soll. Dieses zusätzliche Volumen dient dazu, das Volumen zu berücksichtigen, das beim Ausstoßen von Luftblasen oder bei möglichen fehlgeschlagenen Injektionsversuchen verloren gehen könnte. (z. B. wenn das zu injizierende Zielvolumen 150 μl beträgt, laden Sie 165 μl in die Spritze (auf halbem Weg zwischen den 160 μl- und 170 μl-Markierungen auf der Spritzenskala). Wenn die Nadel korrekt in der Vene platziert ist und das Volumen in der Spritze unmittelbar vor dem erfolgreichen Injektionsversuch bei 165 μl liegt, geben Sie das Reagenz ab, bis 15 μl in der Spritze verbleiben (auf halbem Weg zwischen der 10 μl- und der 20-μl-Markierung), wodurch 150 μl (165 μl - 150 μl = 15 μl)) abgegeben werden. Die Ausrichtung des abgeschrägten Lumens (Abschrägung nach oben) mit der Spritzenskala ermöglicht die Verfolgung des abgegebenen Volumens während der Injektion.
Einige Experimentatoren ziehen es vielleicht vor, die Maus auf die Seite zu legen, so dass eine ihrer Venen gerade und leicht zugänglich ist, verglichen mit einer Maus auf ihren Füßen. Der Schwanz einer Maus auf der Seite ist jedoch je nach Mausgröße in unterschiedlichen Winkeln geneigt, was eine Anpassung des Injektionswinkels erfordert, wenn Mäuse unterschiedlicher Größe injiziert werden. Dies kann sich negativ auf die Konsistenz des Erfolgs des Eingriffs auswirken. Bei ersten Übungsversuchen können die Experimentatoren beide Ausrichtungen der Maus ausprobieren, um ihren bevorzugten Ansatz zu bestimmen. Wenn Sie die Maus an den Füßen haben, können Sie schnell und einfach auf beide seitlichen Schwanzvenen zugreifen. Dies reduziert die Rückhaltezeit, wenn bei mehreren fehlgeschlagenen Injektionsversuchen ein Zugang zu beiden Venen erforderlich ist.
Wenn Sie die Seitenvene in der Nähe der Schwanzbasis (näher am Mauskörper) injizieren (insbesondere bei Mäusen mit einem Gewicht von >30 g), stellen Sie den Injektionswinkel von parallel zur Vene bis 5°-10° zur Vene ein, da die Vene an der Schwanzbasis etwas tiefer ist als distal.
Die hier aufgeführten Protokolle zur Überprüfung des RNase-Verdaus und der RNA-Kontamination wurden an DNA-Proben verifiziert, die aus frisch gefrorenem Lebergewebe isoliert wurden und insgesamt 175-700 ng Nukleinsäuren in 20 μl enthielten. Das RNase-Verdauprotokoll wurde auch an DNA-Proben getestet, die aus frisch gefrorenem Lebergewebe und FACS-sortierten Zellen isoliert wurden, um das Vorhandensein des Vektorgenoms und des Mausgenoms nach dem RNase-Verdau zu bestätigen. Die Ergebnisse wurden mittels Agarose-Gelelektrophorese der Endpunkt-PCR-Amplifikation der Zielamplikone visualisiert.
Das Befolgen der beschriebenen Methodik kann die Schulungs- und Übungszeit reduzieren, die erforderlich ist, um intravenöse Injektionen zu beherrschen, und zu einer höheren erfolgreichen Injektionsrate führen, wodurch Reagenzien eingespart werden. Dieses Protokoll verwendet einfache und häufig verwendete Tools, ohne dass fortschrittliche Geräte oder Setups erforderlich sind, die möglicherweise nicht ohne weiteres verfügbar sind. Darüber hinaus können die hier aufgeführten IV-Injektionsschritte auf eine Vielzahl von Injektaten angewendet werden, die intravenös verabreicht werden müssen, wie z. B. Antisense-Oligonukleotide (ASOs), wobei die entsprechenden Modifikationen an den Schritten der Injektvorbereitung je nach Injektat vorgenommen werden.
Offenlegungen
Die Autoren haben keine Offenlegungen, die für die in diesem Artikel veröffentlichte Arbeit relevant sind.
Danksagungen
Die Autoren danken den Mitarbeitern der NINDS-Tierpflegeeinrichtung für ihre Unterstützung. Diese Arbeit wurde von der Abteilung für Intramurale Forschung des NIH, NINDS, unterstützt (Jahresberichtsnummer 1ZIANS003129). Der Inhalt liegt ausschließlich in der Verantwortung der Autoren und gibt nicht unbedingt die offizielle Meinung der National Institutes of Health wieder.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Millipore | SLGVM33RS | |
| 0.3 mL insulin syringes with 29G needle | BD Biosciences | 324702 | |
| 1.7 mL microcentrifuge tube | Crystalgen | 23-2051 | |
| 10 mL syringe | BD Biosciences | 302995 | |
| 100% EtOH | The Warner Graham Company | 201096 | |
| 10x phosphate-buffered saline (PBS) | Corning | 46-013-CM | Used to prepare 1x PBS for tissue fixation |
| 15 mL conical tube | Corning | 430766 | |
| 15 mL conical tube holder | Multiple sources | N/A | |
| 190 proof ethyl alcohol | The Warner Graham Company | 6810-01-113-7320 | Used to prepare 70% ethanol |
| 1x sterile PBS | Gibco | 10010023 | |
| 2 mL microcentrifuge tissue storage tubes | Eppendorf | 022363344 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Sciences | 157-4 | |
| Adeno-associated virus (AAV) | Charles River | N/A | Single-stranded DNA (ssDNA) AAV was packaged to deliver Cre recombinase as the transgene driven by CMV promoter |
| Alcohol swab | BD Biosciences | 326895 | |
| Bead lysis tube | Next Advance | GREENE5 | |
| BsuRI (HaeIII) restriction enzyme | Thermo Fisher Scientific | ER0151 | |
| Bullet blender | Next Advance | BBX24B | |
| Ai14-derived mice from JAX 007914 strain (genetic background: C57BL/6J) | N/A | N/A | Mice containing Ai14 Cre-reporter allele were purchased from JAX (catalog number: 007914) |
| Disposable absorbent pads | Fisherbrand | 1420662 | |
| Dissection forceps | Fine Science Tools (F.S.T) | 11251-35 | |
| Dissection scissors | Fine Science Tools (F.S.T) | 14085-08 | |
| DNA degradation reagent (DNAZap) | Invitrogen | AM9890 | |
| DNA-Extraction RNase A | Qiagen | 19101 | For RNA digestion during nucleic acid extraction |
| DNase-free RNase for DNA cleanup | F. Hoffmann-La Roche | 11119915001 | For RNA digestion after nucleic acid extraction |
| dPCR Probe PCR Kit | Qiagen | 250102 | |
| dPCR software | Qiagen | N/A | QIAcuity Software Suite |
| Elevated platform | Multiple sources | N/A | An empty pipette tips box was used to elevate the mouse restrainer during tail warming up |
| Fluorescence microscope | Multiple sources | N/A | Model used here: Nikon Eclipse Ti |
| Fluorescence microscope software | Multiple sources | N/A | Software used here: NIS-Elements |
| Gauze | Covidien | 9022 | |
| Heat block | Eppendorf | Thermomixer 5350 | |
| High-speed centrifuge | Eppendorf | 22620689 | |
| Metal container | Vollrath | 80125 | |
| Methylbutane | J.T. Baker | Q223-08 | |
| Molecular grade water | Quality Biological | 351-029-131 | |
| Mouse tube restrainer | Braintree Scientific | TV-RED-150-STD | |
| Myfuge mini centrifuge | Benchmark Scientific | C1012 | |
| Polymerase chain reaction thermal cycler | Bio-Rad Laboratories | 1851148 | Model: C1000 Touch |
| Precision wipes | Kimberly-Clark Professional | 7552 | |
| Proteinase K | Qiagen | 19131 | |
| QIAcuity dPCR Nanoplate 26k 24-well | Qiagen | 250001 | |
| QIAcuity One dPCR system | Qiagen | 911020 | |
| Qiagen DNeasy Blood & Tissue Kit | Qiagen | 69504 | Used for DNA extraction from tissues |
| Qiagen QIAamp DNA Micro Kit | Qiagen | 56304 | Used for cleanup of genomic DNA, and the isolation of DNA from small volumes of blood prtocotol was used for DNA extraction from FACS-sorted cells |
| Rodent restrainer cone | Braintree Scientific | MDC-200 | |
| Scale | Ohaus | 72212663 | |
| Styrofoam box | Multiple sources | N/A | |
| Sucrose | Sigma-Aldrich | S9378-1kg | |
| Surface cleaner and disinfectant | Peroxigard | 29101 | |
| Timer | Multiple sources | N/A | |
| Transfer forceps | Fine Science Tools (F.S.T) | 91113-10 | |
| Vortex | Daigger & Company | 22220A | Model: Daigger Vortex Genie 2 |
Referenzen
- Tisdale, A., et al. The ideas initiative: Pilot study to assess the impact of rare diseases on patients and healthcare systems. Orphanet J Rare Dis. 16 (1), 429 (2021).
- Condo, I. Rare monogenic diseases: Molecular pathophysiology and novel therapies. Int J Mol Sci. 23 (12), 6525 (2022).
- Vaisitti, T., et al. The frequency of rare and monogenic diseases in pediatric organ transplant recipients in italy. Orphanet J Rare Dis. 16 (1), 374 (2021).
- Bulcha, J. T., Wang, Y., Ma, H., Tai, P. W. L., Gao, G. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 6 (1), 53 (2021).
- Lundstrom, K. Viral vectors in gene therapy: Where do we stand in 2023. Viruses. 15 (3), 698 (2023).
- Wang, C., et al. Emerging non-viral vectors for gene delivery. J Nanobiotechnology. 21 (1), 272 (2023).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (aav) as a vector for gene therapy. BioDrugs. 31 (4), 317-334 (2017).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: A comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 25 (1), 7-18 (2020).
- Wang, D., Tai, P. W. L., Gao, G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 18 (5), 358-378 (2019).
- Srivastava, A. Rationale and strategies for the development of safe and effective optimized aav vectors for human gene therapy. Mol Ther Nucleic Acids. 32, 949-959 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Jucker, M. The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat Med. 16 (11), 1210-1214 (2010).
- Vandamme, T. F. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 6 (1), 2-9 (2014).
- Anders, H. J., Vielhauer, V. Identifying and validating novel targets with in vivo disease models: Guidelines for study design. Drug Discov Today. 12 (11-12), 446-451 (2007).
- Turner, P. V., Brabb, T., Pekow, C., Vasbinder, M. A. Administration of substances to laboratory animals: Routes of administration and factors to consider. J Am Assoc Lab Anim Sci. 50 (5), 600-613 (2011).
- Prabhakar, S., Lule, S., Da Hora, C. C., Breakefield, X. O., Cheah, P. S. Aav9 transduction mediated by systemic delivery of vector via retro-orbital injection in newborn, neonatal and juvenile mice. Exp Anim. 70 (4), 450-458 (2021).
- Hauff, P., Nebendahl, K., Kiessling, F., Pichler, B. J., Hauff, P. Drug administration. Small Animal Imaging: Basics and Practical. , 127-152 (2017).
- Saleem, M., et al. A new best practice for validating tail vein injections in rat with near-infrared-labeled agents. J Vis Exp. (146), (2019).
- Resch, M., Neels, T., Tichy, A., Palme, R., Rulicke, T. Impact assessment of tail-vein injection in mice using a modified anaesthesia induction chamber versus a common restrainer without anaesthesia. Lab Anim. 53 (2), 190-201 (2019).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (icv) and intravenous (iv) injection in mice. J Vis Exp. (56), 2968 (2011).
- Grames, M. S., Jackson, K. L., Dayton, R. D., Stanford, J. A., Klein, R. L. Methods and tips for intravenous administration of adeno-associated virus to rats and evaluation of central nervous system transduction. J Vis Exp. (126), 55994 (2017).
- Yano, J., Lilly, E. A., Noverr, M. C., Fidel, P. L. A contemporary warming/restraining device for efficient tail vein injections in a murine fungal sepsis model. J Vis Exp. (165), 61961 (2020).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined use of tail vein metastasis assays and real-time in vivo imaging to quantify breast cancer metastatic colonization and burden in the lungs. J Vis Exp. (154), 60687 (2019).
- JoVE Science Education Database. . Lab Animal Research. Compound administration I. , (2023).
- UCSF Office of Research, Institutional Animal Care and Use Program. Lateral tail vein injection in mice and rats (preferred technique for vascular access in mice Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/STD%20PROCEDURE%20-%20Misc%20Rodent%20Procedures%20-%20Lateral%20Tail%20Vein%20Injection%20in%20Mice%20and%20Rats.pdf (2023)
- Jones, K. Tail vein injections in the mouse and rat sop. UBC Animal Care Guidelines SOP: ACC-2012-Tech03. , (2012).
- Liadaki, K., Luth, E. S., Kunkell, L. M. Co-detection of gfp and dystrophin in skeletal muscle tissue sections. Biotechniques. 42 (6), 699-700 (2007).
- Burr, A., et al. Allometric-like scaling of aav gene therapy for systemic protein delivery. Mol Ther Methods Clin Dev. 27, 368-379 (2022).
- Lang, J. F., Toulmin, S. A., Brida, K. L., Eisenlohr, L. C., Davidson, B. L. Standard screening methods underreport aav-mediated transduction and gene editing. Nat Commun. 10 (1), 3415 (2019).
- Rodriguez-Estevez, L., Asokan, P., Borras, T. Transduction optimization of aav vectors for human gene therapy of glaucoma and their reversed cell entry characteristics. Gene Ther. 27 (3-4), 127-142 (2020).
- Hatakeyama, S., Yamamoto, H., Ohyama, C. Tumor formation assays. Methods Enzymol. 479, 397-411 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten