Method Article
Inducción de embolia gaseosa arterial cerebral en rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo proporciona una descripción detallada de la inducción de émbolos gaseosos cerebrales en ratas. Compara la inyección directa en la arteria carótida común y la introducción a través de la arteria carótida externa. Proporciona una descripción técnica del generador de burbujas de aire, el efecto de diferentes volúmenes de aire y los desafíos de procedimiento.
Resumen
Presentamos un enfoque metodológico para la investigación preclínica de la embolia gaseosa arterial cerebral (CAGE), una condición caracterizada por burbujas de gas dentro de la circulación cerebral que causan isquemia multifocal. El presente trabajo describe dos métodos quirúrgicos para inducir CAGE en la rata: uno con inyección de aire a través de la arteria carótida externa (ECA), sacrificando así el vaso, y otro mediante inyección directa en la arteria carótida común (CCA). Se utilizaron ratas Wistar macho y se dividieron en grupos (n = 5) para someterse al método de entrada ECA o CCA con inyección de diferentes volúmenes de émbolos aéreos (6000, 7000 y 8000 nL) o cirugía simulada. Se utilizó un generador de burbujas hecho a medida para producir émbolos de gas con un tamaño constante, y se desarrolló un software de código abierto para el análisis de burbujas en tiempo real. La comparación entre los dos métodos reveló que el enfoque de CCA es superior en términos de producción constante de burbujas dentro del generador de burbujas, menor tiempo de embolización y menos complicaciones.
Introducción
La embolia gaseosa arterial cerebral (CAGE) se caracteriza por la formación de burbujas de gas dentro de la circulación arterial cerebral, lo que conduce a un espectro de deficiencias neurológicas. Esta afección se conoce predominantemente como una complicación en el buceo, donde la expansión excesiva de los pulmones durante el ascenso resulta en barotrauma y entrada de aire en las venas pulmonares, que luego fluyen hacia las arterias cerebrales1. Además de esta ocurrencia bien conocida en el buceo, los profesionales médicos están reconociendo cada vez más la CAGE como una complicación de los procedimientos médicos invasivos. La embolia gaseosa iatrogénica puede ocurrir durante la colocación, manipulación o extracción de catéteres venosos centrales y drenajes torácicos, así como durante el curso de procedimientos abiertos y endovasculares, incluidas las intervenciones de válvulas cardíacas, las reparaciones aórticas endovasculares torácicas y la trombectomía endovascular en el accidente cerebrovascular isquémico 2,3. A pesar de su importancia clínica, la investigación sobre CAGE, en particular con modelos animales, sigue siendo escasa y fragmentada4.
Desde el estudio pionero de Rosengren et al. en 1977 con ratas, los modelos animales para CAGE han experimentado un refinamiento significativo5. El enfoque empleado por Rosengren consistió en la canulación de la arteria carótida común (CCA) para introducir un volumen total de 10 μL de aire. Esta técnica no estuvo exenta de limitaciones, incluyendo la hemodinámica alterada debido a la ligadura arterial y el tamaño descontrolado y el volumen excesivo del émbolo aéreo6. El método de Furlow, descrito en 1982, mejoró la precisión de la embolización aérea mediante el avance de un catéter en la arteria carótida interna y la administración de un volumen total de aire de 5 μL. Sin embargo, aunque su importancia se reconoció pronto, el concepto de tamaño de burbuja uniforme solo se implementó décadas después. Gerriets et al. fueron capaces de producir un número constante de burbujas con un diámetro uniforme, inicialmente de 160 μm, posteriormente reducido a 45 μm 7,8. El método quirúrgico utilizado en este caso requirió el sacrificio de la arteria carótida externa (ECA). Recientemente, Schaefer et al. introdujeron un método menos invasivo al insertar un microcatéter en el CCA a través de la arteria femoral, imitando con mayor precisión los escenarios de embolia gaseosa observados durante los procedimientos endovasculares9. Su método tenía la limitación de no ligar las ramas arteriales de la CCA (por ejemplo, ECA y arteria pterigopalatina (PPA)), lo que permitía que las burbujas no solo fluyeran a las arterias cerebrales deseadas, sino también a territorios no cerebrales. Esto puede resultar en daño isquémico cerebral inconsistente, lo que complica la reproducibilidad de los experimentos.
A pesar de los avances en los modelos preclínicos de CAGE, persisten desafíos para replicar las técnicas de generación de burbujas, estandarizar los métodos quirúrgicos y adquirir lesiones cerebrales consistentes. El presente estudio introduce tanto un abordaje quirúrgico convencional que requiere sacrificar el ACE como un método alternativo en el que las burbujas de aire se inyectan directamente en el ACC. Informamos sobre procedimientos detallados, desafíos y software de código abierto para el análisis de burbujas en tiempo real. También incluimos los detalles técnicos necesarios para construir un generador de burbujas.
Protocolo
Todos los procedimientos con animales se llevaron a cabo de acuerdo con la Guía para el uso y cuidado de animales de laboratorio. Obtuvimos la aprobación total del Comité Central de Experimentos con Animales de los Países Bajos (AVD11800202114839). Se utilizaron ratas Wistar macho con un rango de peso de 300 a 350 g. Los animales se alojaron en parejas con comida y agua ad libitum y ciclos de luz-oscuridad de 12 h. A su llegada, los animales se sometieron a un período de aclimatación de 7 días antes de iniciar cualquier procedimiento experimental.
NOTA: Se utilizaron dos métodos quirúrgicos, el método de entrada ECA y el método de entrada CCA. Para ambas técnicas, las ratas se aleatorizaron en grupos Vehicle o CAGE de 8000 nL utilizando una herramienta de análisis estadístico. El tratamiento del vehículo incluyó solo inyección de solución salina; El tratamiento CAGE utilizó burbujas de aire en solución salina a un volumen de 8000 nL, con cada burbuja con un diámetro objetivo de 160 μm. Después de la finalización de esta serie, el refinamiento adicional del modelo con 6000 nL y 7000 nL (ambos con un diámetro de burbuja de 160 μm) se realizó solo a través del método de entrada CCA. En caso de falla del procedimiento, se agregaron ratas de reemplazo para obtener tamaños de grupo finales de n=5.
1. Generador de burbujas de aire
NOTA: El generador de burbujas de aire (Figura 1, Figura 2 y Figura complementaria 1A-C) consta de varios componentes hechos a medida que generan y detectan burbujas de gas del mismo tamaño.
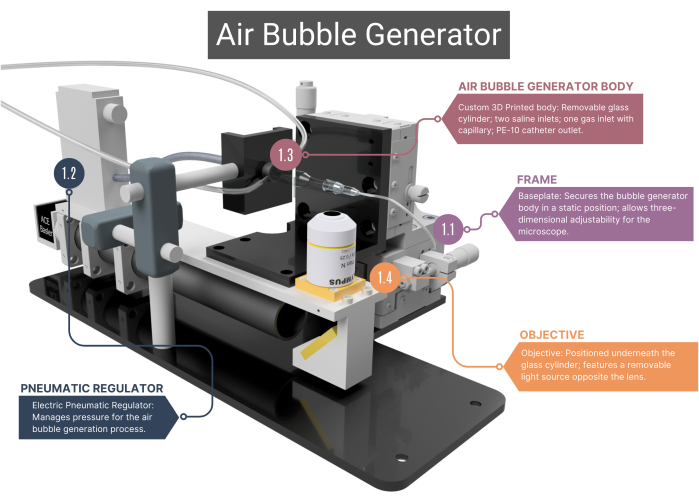
Figura 1: Vista general del generador de burbujas de aire. El generador de burbujas consta de un bastidor de soporte (1.1) y un regulador neumático para la gestión del flujo de aire (1.2). Incluye un cuerpo principal impreso en 3D que alberga un capilar de vidrio (1.3), vinculado a un objetivo y una cámara de alta velocidad (1.4). Consulte la Figura complementaria 1A-C para obtener más imágenes. Los números corresponden a los pasos metodológicos del texto principal. Haga clic aquí para ver una versión más grande de esta figura.
- Marco
- Utilice un marco con una placa base de acero inoxidable hecha a medida que garantiza el posicionamiento estático del cuerpo principal del generador de burbujas, mientras que el objetivo del microscopio colocado debajo de él se puede mover en tres dimensiones. Esta capacidad de ajuste se ve facilitada por los ensamblajes XYZ que permiten alteraciones en el campo de visión y permiten enfocar la punta del microcanal y las burbujas de aire.
- Regulador neumático
- Para el suministro de aire comprimido, utilice un regulador neumático eléctrico, que tiene un rango de presión de 0,001 a 0,1 MPa. Asegúrese de que el regulador esté conectado al capilar de vidrio a través de un tubo intravenoso (IV), sellado al aire con funda termorretráctil. Regule la presión cambiando el voltaje del regulador.
- Cuerpo del generador de burbujas de aire
NOTA: El cuerpo principal del generador de burbujas consta de una cámara de vidrio, una carcasa interior de plástico y un capilar de vidrio. Todos los componentes del cuerpo deben ser herméticos, lo que garantiza que no sea posible la fuga de aire o solución salina.- Asegúrese de que la cámara de vidrio cilíndrica hecha a medida tenga un diámetro interior (ID) de 1000 μm que se fusione en un microcanal con un ID de 400 μm. Aplana la parte superior de este microcanal de forma cilíndrica para obtener una vista óptima a través del objetivo.
- Coloque el extremo exterior del cilindro de vidrio en una aguja de 21 G sin la punta. Dentro de esta aguja, pegue una segunda aguja (27G, ID 210 μm). Coloque esta aguja de menor diámetro en el microcanal y conéctela a un catéter de polietileno (PE-10) (ID 280 μm, longitud 125 mm).
- Coloque un cuerpo de plástico en la parte posterior de la cámara de vidrio, que cuenta con dos entradas de acero inoxidable; aquí, se puede conectar el tubo intravenoso para la entrada de solución salina. La parte trasera de este cuerpo tiene una entrada para el gas a través de un capilar de vidrio personalizado que se coloca con gomas de junta tórica y se bloquea en su lugar atornillando una tapa.
- Para el método de entrada CCA, fije el extremo del catéter a una aguja (30 G, ID 159 μm) con la carcasa Luer-lock de plástico retirada y dóblela con cuidado en un ángulo de 45°.
- Ajuste del microscopio
- Coloque el objetivo (4x) debajo del cuerpo del generador de burbujas y conéctelo a una cámara de alta velocidad. Frente a la lente, coloque una fuente de luz LED ajustable.
- Antes del inicio de cada experimento, asegúrese de que la lente del objetivo esté limpia. La suciedad dará lugar a análisis de burbujas incorrectos.
- Creación del capilar de vidrio
NOTA: El proceso de creación de capilares implica una cantidad significativa de ajuste. Si bien los ajustes proporcionados sirven como referencia, es posible que sea necesario realizar ajustes para lograr el diámetro de burbuja deseado.- Haga el capilar de vidrio con un extractor de micropipetas (Figura complementaria 1A-C). Para crear las pipetas, configure los calentadores de extracción de micropipetas: ajuste el calentador izquierdo (n.º 1) en ajuste = 70 y el calentador derecho (n.º 2) en ajuste = 980.
- Coloque el capilar de vidrio en el extractor y agregue dos bloques de 100 g de peso para asegurar la forma correcta después del proceso de tracción. Presione Inicio. Una vez completado el proceso de extracción, se forman dos capilares.
- Corte o rompa cada capilar en diagonal en la punta con un microscopio de campo claro. La forma y el diámetro de la punta son críticos, ya que influyen en el diámetro de las burbujas de gas. Para garantizar la consistencia en el tamaño de la burbuja en todos los experimentos, utilice el mismo capilar para el diámetro de burbuja deseado.
- Inserte la punta capilar de vidrio en el canal cilíndrico (ID 400 μm) del cuerpo del generador de burbujas.
- Configuración del generador de microburbujas
- Conecte el generador de burbujas a una bomba de jeringa con solución salina estéril (50 mL) e inicie un flujo continuo a 20 mL/h. Asegúrese de que no haya aire atrapado en el sistema. En caso de que haya aire atrapado en el sistema, sostenga el generador de burbujas verticalmente para que el aire pueda escapar a través del catéter.
- Encienda la fuente de luz, la cámara y el software.
- Cuando el sistema esté a la presión correcta (después de aproximadamente 2 minutos), verifique que el sistema no tenga fugas de gas o fluido.
- Para crear burbujas, aumente lentamente la presión aumentando el voltaje, comenzando desde 2,1 V y continuando hasta que el gas llene el capilar de vidrio. Esto puede llevar algún tiempo, pero es importante no apresurar esta parte. Cuando la presión en el capilar de vidrio es igual a la del canal, puede comenzar la producción de burbujas de gas. Simplemente aumentando el voltaje hasta 2,6 V, se producirán burbujas.
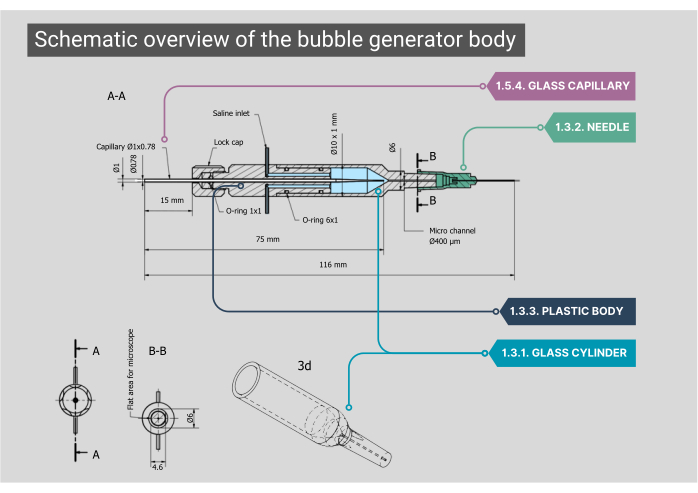
Figura 2: Vista general esquemática del cuerpo del generador de burbujas. Un plano detallado del cuerpo del generador de burbujas, incluidas las dimensiones y anotaciones de cada componente. Los números corresponden a los pasos metodológicos del texto principal. Haga clic aquí para ver una versión más grande de esta figura.
2. Detección y análisis de burbujas de gas
NOTA: El código Python (Archivo complementario 1) está diseñado para rastrear y calcular el número, el diámetro y el volumen de cada burbuja de gas en tiempo real. Durante la producción de burbujas de gas, el código procesa cada burbuja detectada a medida que se mueve a través del campo de visión. Estos datos se muestran continuamente como el recuento de burbujas, el volumen acumulado de aire, el diámetro medio de las burbujas y la duración total de la grabación. Después de cada grabación, los datos se exportan a una hoja de cálculo y .mp4 archivo de vídeo.
- Ajustes de la cámara (Figura complementaria 2)
- Cuando el generador de microburbujas esté configurado correctamente, encienda la cámara en el Pylon Viewer. Seleccione la ganancia y el umbral correctos.
- Encuentre la región de interés correcta moviendo los ejes X e Y del generador de burbujas y mejore la nitidez moviendo el eje Z.
- Para optimizar la velocidad de fotogramas (171 fps), ajuste la cámara a 2480 x 400 píxeles (ancho x alto). Cuando finalice la configuración de la cámara, asegúrese de apagarla en Pylon Viewer.
- Análisis de burbujas en tiempo real (Figura complementaria 2)
- Antes de iniciar un experimento, realice una ejecución de prueba del script mientras produce burbujas de gas. Compruebe la grabación y ajuste el umbral y la ganancia cuando sea necesario.
- Para iniciar el análisis de las burbujas, ejecute el código Python. El código mostrará automáticamente el video en vivo, el recuento de burbujas, el diámetro y el volumen.
3. Cirugía de jaula
- Preparación para la cirugía
- Prepare el área quirúrgica con un paño estéril debajo de la rata y coloque todos los instrumentos quirúrgicos y las suturas en un segundo paño estéril. Prepare los medicamentos necesarios.
- Asegúrese de que la almohadilla térmica, con sistema de retroalimentación, esté configurada a 37 °C. Ajuste el microscopio a la altura correcta.
- Saca a la rata de su jaula y prepárate para la anestesia.
- Anestesia y cuidados prequirúrgicos
- Administrar 0,05 mg/kg de buprenorfina por vía subcutánea 30 min antes de la cirugía.
- Anestesiar a la rata con una mezcla de isoflurano al 4% y aire de 1 L/min (30% de oxígeno y 70% de aire) en la cámara de inducción. Una vez que esté completamente anestesiada, pesa la rata y afeita el área del cuello quirúrgico con una maquinilla de afeitar eléctrica.
- Traslade la rata a la mesa quirúrgica y cambie el isoflurano por la mascarilla facial para mantener la anestesia con isoflurano al 2%-2,5% en una mezcla de aire al 70%/30%.
- Aplica lágrimas artificiales en los ojos para evitar que se sequen. Lubrique la sonda de temperatura e insértela rectalmente.
- Coloque la rata en posición supina y coloque una jeringa de 10 ml debajo del cuello para facilitar el acceso al área quirúrgica.
- Asegure las patas delanteras a la mesa de cirugía con cinta adhesiva. Desinfecte el área quirúrgica con un exfoliante a base de yodo o clorhexidina y alcohol varias veces con movimientos circulares para garantizar la esterilidad. Confirme la profundidad de la anestesia mediante un pellizco en los dedos de los pies.
- Incisión
- Haga una incisión en la línea media con un bisturí desde la muesca esternal hasta debajo de la mandíbula (aproximadamente 1,5 cm).
- Use dos pinzas para diseccionar el tejido conectivo (fascia cervical superficial), exponiendo los músculos subyacentes.
- Separe los músculos esternohioideos izquierdo y derecho desgarrando suavemente el tejido conectivo que se encuentra entre ellos.
- Identifique y retraiga los siguientes músculos por debajo: músculo esternomastoideo derecho (retracción con un gancho de tejido lateralmente) y músculo omohioideo derecho (retracción con un gancho de tejido caudal-medial). El triángulo carotídeo del lado derecho (CCA, ECA, arteria carótida interna (ACI)) debe ser visible.
- Preparación quirúrgica de la ACC
- Prepare el CCA eliminando la fascia suprayacente y el tejido adiposo. Separe cuidadosamente el CCA del nervio vago sin dañar el nervio. No agarre ni pellizque el nervio ni sus ramas. Solo empújelo suavemente lejos del CCA. No toque ni presione contra la tráquea mientras prepara los vasos.
- Coloque una sutura 3-0 alrededor del CCA con pinzas curvas y asegure el hilo con hemostáticos. Esto servirá más adelante para elevar el CCA.
- Ligadura temporal de la ECA, ICA y sus ramas
- Localice y exponga la bifurcación de ECA e ICA. Limpie la fascia circundante y el tejido adiposo si es necesario. Ligar temporalmente el ECA con sutura 3-0.
- Localice la arteria occipital (OA, que se ramifica principalmente desde la ACI, en el medio entre la bifurcación en forma de Y de origen ICA y ECA) y la arteria tiroidea superior (que se ramifica desde el lado medial de la ECA). Estas pequeñas ramas se rompen con facilidad. Ligar temporalmente la artrosis con una sutura 3-0 proximalmente.
- Después de la ACI distalmente, la siguiente rama que se mueve lateralmente es la arteria pterigopalatina. Limpie la fascia circundante y el tejido adiposo teniendo mucho cuidado de no dañar el nervio vago. Ligar temporalmente el PPA con una sutura 3-0.
NOTA: Se recomienda acercarse al PPA desde una dirección craneal; Inclinar la rata ligeramente hacia los lados puede facilitar el acceso y la visualización durante la cirugía.
- Método de entrada ECA (Figura 3A)
- Ligue las arterias de la siguiente manera: utilice la sutura del paso 3.4.2. para ligar suave y temporalmente el CCA, asegurando que el flujo se detenga pero minimizando el riesgo de crear coágulos trombóticos. Luego, use una sutura 3-0 o un clip vascular para ligar temporalmente la ICA y la OA.
- Aplicar dos suturas alrededor del ECA: una proximal y otra distal. Asegúrese de que la sutura distal incluya la arteria tiroidea superior y se apriete para detener el flujo sanguíneo de forma permanente, mientras que la sutura proximal se ata sin apretar después del uso posterior.
- Cree una arteriotomía entre las dos suturas del ECA con tijeras vasculares. No debería haber sangrado en esta etapa.
- Inserte el catéter desaireado del generador de burbujas hasta que la punta alcance la bifurcación del CCA. Estuerce la sutura proximal y luego ligar y extirpar el ECA distal al sitio de la arteriotomía.
- Afloje las ligaduras del CCA y el ICA para restaurar el flujo sanguíneo y, al mismo tiempo, iniciar el flujo de solución salina a través del generador de burbujas hacia el catéter (paso 1.6.3.). Confirmar la estabilidad de la colocación del catéter y la ausencia de fugas de sangre o solución salina. Gire el muñón de ECA con el catéter insertado unos 90° en sentido contrario a las agujas del reloj para que el flujo del catéter vaya en la dirección del ICA.
- Inicie el proceso de embolización. Inicie el código Python e inicie la creación de burbujas de aire como se describe en el paso 1.6.4.
- Una vez finalizada la embolización, detenga temporalmente el flujo sanguíneo apretando la sutura ICA/pinza vascular.
- Retire el catéter con cuidado y cierre permanentemente el extremo proximal del AEC atando firmemente la sutura existente.
- Retire suavemente las suturas 3-0 y/o la pinza de la PPA, OA, ICA y CCA para permitir la reperfusión. Limpie cualquier resto de sangre alrededor del área de la cirugía.
- Método de entrada CCA (Figura 3B)
- Continúe después del paso 3.5.3; ligar temporalmente el ECA proximal de la rama tiroidea superior, cerca de la bifurcación.
- Inicie el recorrido de solución salina a través del generador de burbujas de aire hacia el catéter, pero sin iniciar aún la producción de burbujas de aire.
- Eleve suavemente el CCA utilizando los hemostáticos del paso 3.4.2. y proceda a insertar la aguja conectada al catéter del generador de burbujas en el lumen del CCA en la dirección del flujo. Asegúrese de que la abertura de la aguja esté orientada hacia arriba y que la aguja no perfore a través de la pared del vaso opuesto al CCA.
- Después de la inserción, vuelva a bajar lentamente los hemostáticos y el CCA acompañante para permitir la reperfusión del CCA. Asegúrese de que no haya fugas de sangre o solución salina alrededor del sitio de inserción.
- Inicie el proceso de embolización iniciando el código Python y la creación de burbujas de aire como se describe en el paso 1.6.4.
- Después de completar la embolización, vuelva a elevar el CCA y retraiga con cuidado la aguja. Aplique presión con una punta de algodón en el sitio de inserción mientras mantiene la elevación del CCA para detener el sangrado.
- Continúe aplicando presión en el sitio de la punción. Retire suavemente la punta de algodón enrollándola distalmente a lo largo del CCA, ejerciendo una presión mínima para asegurarse de que el coágulo permanezca inalterado y en su lugar. Puede tomar entre 30 s y 5 min lograr la hemostasia.
NOTA: En las ratas hembras, cerrar el sitio de punción puede llevar unos minutos más que en las ratas macho. - Recupere cuidadosamente las suturas 3-0 de la ECA, ICA y CCA para permitir la reperfusión. Una vez más, confirme que el sangrado se haya detenido permanentemente y limpie cualquier resto de sangre alrededor del área de la cirugía si es necesario.
- Cierre y cuidados postquirúrgicos
- Separar la piel del tejido subcutáneo del cuello para facilitar la sutura. Suturar la piel con una aguja curva y sutura 4-0.
- Administre bupivacaína subcutánea 2,5 mg/mL (0,01 - 0,02 mL/kg) alrededor del sitio de la incisión.
- Transfiera con cuidado al animal a una jaula de recuperación (33 - 35 °C) durante 30-120 min. Durante el período de recuperación, el animal no se deja desatendido hasta que haya recuperado la conciencia suficiente para mantener una posición de decúbito esternal. Cuando el animal esté completamente recuperado, transfiéralo de nuevo a la jaula de la casa. Coloque la comida húmeda al alcance de la mano dentro de la jaula.
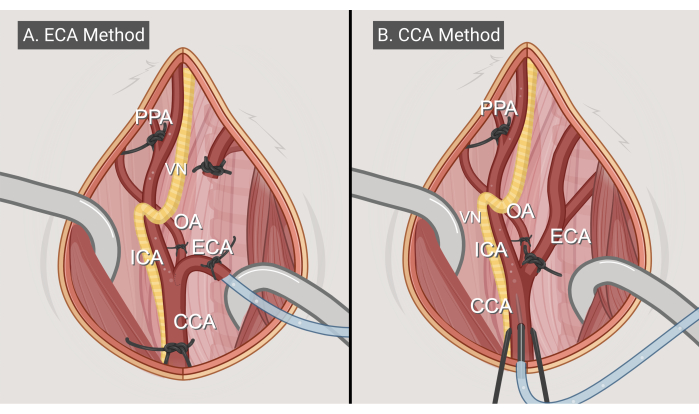
Figura 3: Métodos quirúrgicos. Ilustraciones de los dos abordajes quirúrgicos, (A) el método de entrada en ECA y (B) el método de entrada en CCA. Abreviaturas: CCA = arteria carótida común; ECA = arteria carótida externa; ICA = arteria carótida interna; OA = arteria occipital; PPA = pterigopalatino; VN = nervio vago. Figura realizada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
4. Seguimiento
- Supervisión y puntos de conexión humanitarios
- Monitorizar a los animales durante un postoperatorio de 7 días. Proporcionar analgesia postoperatoria con buprenorfina subcutánea a 0,05 mg/kg al final del día de la cirugía y de nuevo a la mañana siguiente. Continúe monitoreando a los animales diariamente y administre analgésicos adicionales según sea necesario en función de la evaluación clínica del dolor o la angustia. Aplicar la eutanasia a las ratas antes si se alcanza un objetivo humanitario de acuerdo con la directiva 2010/63/UE del Parlamento Europeo.
- Déficits neurológicos clínicos
- Evaluar los déficits clínicos neurológicos (CND) en los días postoperatorios (por ejemplo, días 1, 3 y 7). Nuestra definición de CND incluye la disminución de la flexión de la extremidad anterior izquierda (por ejemplo, la inhibición de la extensión de la extremidad delantera mientras se eleva la rata), la incapacidad de caminar en línea recta o el comportamiento de dar vueltas, similar a la puntuación de Bederson10. Usar cualquier puntuación o prueba neurológica estandarizada para evaluar la función motora y el estado neurológico.
- Resonancia magnética
- Realizar imágenes de resonancia magnética (RMN) postoperatorias (por ejemplo, en los días 1, 3, 5 y 7) en un sistema de resonancia magnética de animales pequeños de 7 T con la rata anestesiada con isoflurano al 1,2% - 2,5% en una mezcla de 0,5 L/min de aire medicinal y 0,5 L/min de oxígeno. Controle la respiración y la temperatura continuamente.
- Obtenga escaneos ponderados en T2 utilizando los siguientes parámetros de secuencia: tiempo de repetición 2500 ms, tiempo de eco 9 ms, espaciado de eco 9 ms y 10 ecos. Ajuste el campo de visión a 35 x 35 mm con una matriz de adquisición de 128 x 128. El grosor de la loncha es de 1,1 mm con un total de 15 lonchas adquiridas, manteniendo una relación de aspecto de 1,00 y utilizando una sola adquisición dinámica.
- Análisis histológico
- Después de completar la resonancia magnética en el7º día (o cuando se alcance el criterio de valoración experimental), mantener a la rata bajo anestesia para la eutanasia mediante perfusión cardíaca con 30 mL de solución salina tamponada con fosfato 0,1 M seguida de 30 mL de paraformaldehído al 4%.
- Extraer el cerebro y postfijarlo durante la noche en paraformaldehído al 4%. Después de un período de fijación de 24 h, incrustar el cerebro en parafina, cortar en secciones coronales y teñir con hematoxilina y eosina (H&E) utilizando el método estándar11.
Resultados
Resultado neurológico
La Tabla 1 ofrece una visión general de todas las inclusiones y exclusiones en los diferentes grupos experimentales. Ninguna de las ratas operadas simuladamente mostró ningún tipo de CND. En el grupo ECA-CAGE (8000 nL), dos de cada cinco ratas no presentaron CND, mientras que las tres ratas restantes experimentaron CND, de las cuales dos murieron dentro de las 24 h. En el grupo CCA-CAGE (8000 nL) todos los animales presentaron CND, tres de cinco no sobrevivieron hasta las 48 h. En los grupos CCA-CAGE con menores volúmenes de aire, todas las ratas sobrevivieron en el postoperatorio. Las cinco ratas en el grupo de 7000 nL mostraron CND, mientras que en el grupo de 6000 nL, dos de cada cinco ratas mostraron CND.
| CEPA | CCA | |||||||
| fingir | 8000 nL | fingir | 8000 nL | 7000 nL | 6000 nL | |||
| Incluido | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Presentaban déficits neurológicos clínicos | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Mortalidad < 24 h | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Mortalidad 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Total excluido | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Excluido por complicación hemorrágica | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Excluido por complicación trombótica | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Muerte intraoperatoria por compresión del nervio vago | 1 | 0 | 1 | 0 | 2 | 0 | ||
Tabla 1: Inclusiones y exclusión de grupos de animales. El número de ratas en cada grupo, inclusiones y exclusiones, muertes y supervivencia con déficits neurológicos clínicos.
MRI
La Figura 4 muestra una imagen representativa ponderada en T2 de una rata que recibió 7000 nL de burbujas de aire a través del método de entrada CCA, mostrando hiperintensidades corticales. Se observaron anomalías similares en todos los animales del grupo CCA-CAGE que recibieron 7000 u 8000 nL, y en menor medida en el grupo de 6000 nL y en el grupo ECA-CAGE. En particular, mientras que ninguno de los animales de los grupos simulados mostró ningún CND, una rata simulada de ECA exhibió un área de hiperintensidad en la resonancia magnética; en el grupo simulado de CCA, ninguna rata mostró anomalías en la resonancia magnética.
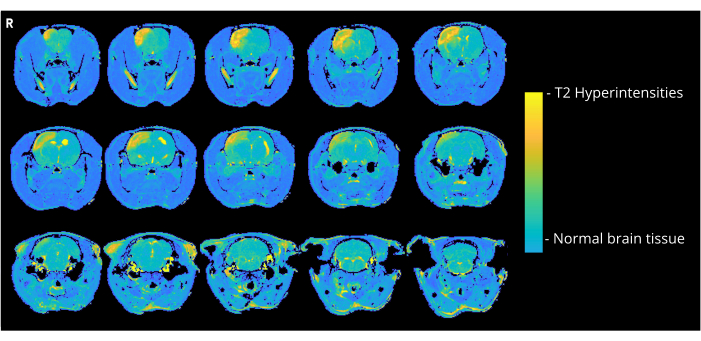
Figura 4: Imágenes de ejemplo de resonancia magnética. Imágenes representativas de resonancia magnética ponderadas en T2 (3 días después de la cirugía CAGE) que muestran hiperintensidades corticales debidas a CAGE en una rata del grupo CCA-CAGE 7000 nL. Haga clic aquí para ver una versión más grande de esta figura.
Histología
La Figura 5 muestra una sección representativa del cerebro teñida con H&E de la rata CCA-CAGE de 7000 nL de la Figura 4, que demuestra daño cerebral isquémico cortical con pérdida de células neuronales y gliosis reactiva, incluida la astrogliosis reactiva y la activación microglial.
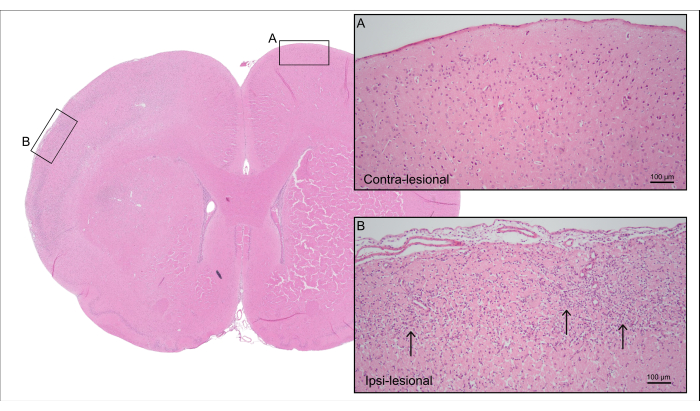
Figura 5: Histología post-mortem. Tinción representativa de H&E de la rata de la Figura 4 que muestra tejido cortical del lado contralesional con (A) neuronas intactas y (B) el lado ipsi-lesional con tejido cortical isquémico con pérdida de células neuronales y gliosis reactiva (flechas). Haga clic aquí para ver una versión más grande de esta figura.
Desafíos técnicos
Debido a los desafíos técnicos, el método de entrada en el ECA tuvo una tasa de éxito sustancialmente menor en comparación con el método de entrada en el CCA (Tabla 1). Esto se debió principalmente a la corta longitud del catéter requerida en el método de entrada al ECA, que con frecuencia resultó en dislocación y sangrado del catéter. Además, el método de entrada de ECA también resultó en un tiempo de cirugía aproximadamente 20 minutos más largo, así como una mayor variación en el diámetro de la burbuja.
Figura complementaria 1: Detalles del generador de burbujas de aire. (A) Las imágenes del cuerpo del generador de burbujas y el extractor capilar resaltan sus aspectos funcionales y de montaje. (B) Vista lateral del generador de burbujas, mostrando su diseño y características estructurales desde una perspectiva lateral. (C) Vista frontal del generador de burbujas, que ilustra los aspectos y características frontales clave. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Pasos para ejecutar el software. Este archivo proporciona una guía detallada sobre los procedimientos y pasos a seguir para ejecutar y utilizar de manera efectiva el software asociado con el generador de burbujas de aire. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Código Python. El código consta de los dos scripts (A y B) que deben guardarse en la misma carpeta. Haga clic aquí para descargar este archivo.
Discusión
Hemos descrito cómo introducir émbolos aéreos en las arterias cerebrales de rata utilizando dos métodos y hemos demostrado que la introducción a través de una aguja insertada en el ACC tiene múltiples ventajas sobre un método que implica la embolización a través de un catéter en el ACE. En concreto, observamos menos complicaciones con el método de entrada en CCA, así como un diámetro de burbuja más consistente y un menor tiempo quirúrgico. El método de entrada de CCA da lugar a una CND dependiente de la dosis y anomalías en la RM indicativas de infarto cerebral, confirmadas con histología.
La elección inicial del método de entrada en el ECA se inspiró en Gerriets et al.7. Sin embargo, identificamos varias dificultades con este enfoque, incluidas variaciones sustanciales en el tamaño de la burbuja y una tasa de complicaciones quirúrgicas más alta en comparación con el método de entrada CCA. Una fuente primaria de estas complicaciones está relacionada con la longitud del catéter. En nuestro modelo, el uso de un catéter corto (125 mm) ayudó a mantener la estabilidad de las burbujas, ya que cuanto más largo es el catéter, mayor es la probabilidad de que las burbujas se fusionen mientras fluyen a través del catéter9. Sin embargo, en el método de entrada ECA, un catéter más largo facilita la colocación y el apalancamiento para el movimiento. El uso de un catéter corto en el método de entrada al ECA da como resultado una dislocación y deterioro frecuentes del muñón del ECA debido a la manipulación excesiva.
Una segunda dificultad encontrada en el método de entrada de ECA se refiere a la creación de burbujas de tamaño consistente (Figura 6). En el método de entrada de ECA, el flujo de solución salina a través del catéter debe detenerse temporalmente mientras el catéter se inserta en el ECA. Cuando se restablece el flujo arterial y se puede iniciar la embolización, el catéter se somete repentinamente a la presión arterial de la rata. Como resultado, esto conduce a que la sangre ingrese retrógradamente al catéter y al generador de burbujas. El efecto de la presión arterial fluctuante sobre la presión dentro del generador de burbujas conduce a una mayor variación en el tamaño de la burbuja, lo que a veces conduce a burbujas de forma cilíndrica que llenan el canal (Figura 6B). Esto se puede evitar aumentando la presión dentro del sistema antes de colocar el catéter en el ECA. Lo mejor es hacerlo una segunda persona para una sincronización precisa. Además, dado que este método requiere más tiempo, conduce a una mayor cantidad de solución salina que se infunde en la rata que el método de entrada CCA. En el método de entrada CCA, la solución salina fluye continuamente a través del catéter y la aguja se inserta en la dirección del flujo sanguíneo a través del CCA, resolviendo así el problema del gradiente de presión descrito anteriormente. Esto da como resultado la ausencia de reflujo en el catéter y un tamaño de burbuja más uniforme.
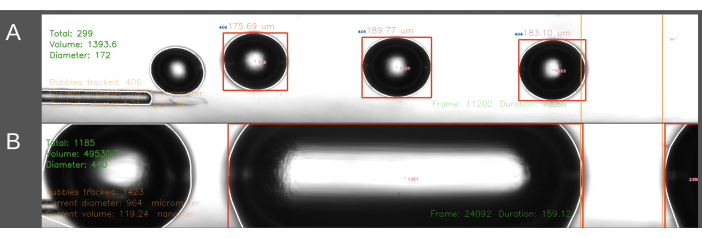
Figura 6: Ejemplo de registro y análisis de la producción de burbujas. Las imágenes muestran capturas de pantalla que muestran el análisis en tiempo real del número total de burbujas, el volumen total y el diámetro promedio en el área de medición (verde, esquina superior izquierda). El área de medición se resalta entre las líneas naranjas de la derecha. El diámetro y el volumen de la burbuja se calculan en función del diámetro horizontal. Las imágenes incluyen la formación de (A) burbujas de aire generadas con éxito y (B) burbujas cilíndricas generadas sin éxito. Haga clic aquí para ver una versión más grande de esta figura.
A pesar de que el método de entrada CCA es uno de los favoritos, todavía encontramos varias dificultades técnicas. En primer lugar, la preparación del PPA es un desafío, ya que la compresión accidental del nervio vago puede resultar en una depresión de la respiración y la posterior muerte del animal12. Para reducir este riesgo, se debe inclinar la rata ligeramente hacia los lados y acercarse al PPA desde la dirección craneal. Además, debido a la difícil anatomía de la bifurcación de la ICA y la PPA, existe el riesgo de daño vascular y hemorragia incontrolable. Esto solo se puede evitar mejorando las habilidades quirúrgicas. Estos desafíos ponen de manifiesto que el dominio del modelo CAGE en ratas es complejo y requiere una gran práctica y precisión13.
La configuración técnica propuesta del generador de burbujas de aire tiene sus limitaciones, particularmente relacionadas con los capilares de vidrio hechos a medida, debido a su fragilidad. El tubo que conecta el regulador neumático al capilar es propenso a romperse al ajustar la válvula de tres vías para la liberación de presión después de la embolización. Además, la sustitución de un capilar requiere la destrucción del capilar existente debido a que el caucho termorretráctil está permanentemente unido a él. Además, cada capilar tiene características de burbuja únicas debido a pequeñas diferencias en el diámetro y la forma de la punta. Por último, el manejo manual de la generación de burbujas a través del regulador neumático requería una gran experiencia. Una manipulación inexperta puede dar lugar a la producción de burbujas excesivamente grandes. La regulación automatizada de la presión con un bucle de retroalimentación del código Python podría mejorar la precisión automatizada en estudios futuros.
Nuestra exhaustiva documentación, que abarca tanto las especificaciones técnicas del generador de burbujas, como un protocolo quirúrgico detallado y el suministro del software, supone una importante contribución a este campo de investigación. Nuestra técnica de ACC garantiza una interrupción mínima de la perfusión cerebral fisiológica, manteniendo el flujo de CCA durante todo el procedimiento y aboliendo la necesidad de sacrificar la ECA. Nuestro estudio proporciona un modelo experimental fiable y reproducible para investigar CAGE y sus posibles tratamientos.
Divulgaciones
Ninguno
Agradecimientos
Esta investigación fue financiada por la Fundación del Seguro de Salud Militar de los Países Bajos (Stichting Ziektekosten Verzekering Krijgsmacht) bajo el número de subvención 20-0232 y la Fundación Holandesa del Corazón 2021 E. Dekker Grant (03-006-2021-T019 a IAM). También agradecemos a Lindy Alles, Paul Bloemen y Ed van Bavel por su excelente asistencia.
Materiales
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Referencias
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados