Method Article
Induction de l’embolie gazeuse artérielle cérébrale chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole fournit une description détaillée de l’induction d’embolies gazeuses cérébrales chez le rat. Il compare l’injection directe dans l’artère carotide commune et l’introduction par l’artère carotide externe. Il fournit une description technique du générateur de bulles d’air, de l’effet des différents volumes d’air et des défis procéduraux.
Résumé
Nous présentons une approche méthodologique pour la recherche préclinique de l’embolie gazeuse artérielle cérébrale (CAGE), une condition caractérisée par des bulles de gaz dans la circulation cérébrale provoquant une ischémie multifocale. Les travaux actuels décrivent deux méthodes chirurgicales pour induire CAGE chez le rat : l’une par injection d’air via l’artère carotide externe (ECA), sacrifiant ainsi le vaisseau, et l’autre par injection directe dans l’artère carotide commune (CCA). Des rats Wistar mâles ont été utilisés et divisés en groupes (n = 5) pour subir soit la méthode d’entrée ECA- ou CCA avec injection de différents volumes d’embolie gazeuse (6000, 7000 et 8000 nL) ou une chirurgie simulée. Un générateur de bulles sur mesure a été utilisé pour produire des embolies gazeuses de taille constante, et un logiciel open source a été développé pour l’analyse des bulles en temps réel. La comparaison entre les deux méthodes a révélé que l’approche CCA était supérieure en termes de production constante de bulles dans le générateur de bulles, de réduction du temps d’embolisation et de réduction des complications.
Introduction
L’embolie gazeuse artérielle cérébrale (CAGE) se caractérise par la formation de bulles de gaz dans la circulation artérielle cérébrale, entraînant un spectre de déficiences neurologiques. Cette condition est principalement connue sous le nom de complication de la plongée, où une expansion excessive des poumons lors de la remontée entraîne un barotraumatisme et une entrée d’air dans les veines pulmonaires, qui s’écoulent ensuite vers les artères cérébrales1. En plus de cet événement bien connu en plongée, les professionnels de la santé reconnaissent de plus en plus la CAGE comme une complication des procédures médicales invasives. L’embolie gazeuse iatrogène peut survenir lors de la mise en place, de la manipulation ou du retrait des cathéters veineux centraux et des drains thoraciques, ainsi que tout au long des procédures ouvertes et endovasculaires, y compris les interventions valvulaires cardiaques, les réparations endovasculaires de l’aorte thoracique et la thrombectomie endovasculaire dans l’AVC ischémique 2,3. Malgré son importance clinique, la recherche sur CAGE, en particulier sur des modèles animaux, reste rare et fragmentée4.
Depuis l’étude pionnière de Rosengren et al. en 1977 sur des rats, les modèles animaux de CAGE ont fait l’objet d’un raffinement significatif5. L’approche employée par Rosengren impliquait la canulation de l’artère carotide commune (ACC) pour introduire un volume total de 10 μL d’air. Cette technique n’était pas sans limites, notamment une hémodynamique altérée due à la ligature artérielle et à la taille incontrôlée et au volume excessif de l’embolie gazeuse6. La méthode de Furlow, décrite en 1982, a amélioré la précision de l’embolisation à l’air en avançant un cathéter dans l’artère carotide interne et en administrant un volume d’air total de 5 μL. Cependant, bien que son importance ait été reconnue très tôt, le concept de taille de bulle uniforme n’a été mis en œuvre que des décennies plus tard. Gerriets et al. ont pu produire un nombre constant de bulles de diamètre uniforme, initialement de 160 μm, puis réduit à 45 μm 7,8. La méthode chirurgicale utilisée ici nécessitait de sacrifier l’artère carotide externe (ECA). Récemment, Schaefer et al. ont introduit une méthode moins invasive en insérant un microcathéter dans l’ACC à travers l’artère fémorale, imitant plus précisément les scénarios d’embolie gazeuse observés lors de procédures endovasculaires9. Leur méthode avait la limitation de ne pas ligaturer les branches artérielles de l’ACC (par exemple, l’ECA et l’artère ptérygo-palatine (PPA)), permettant ainsi aux bulles de s’écouler non seulement vers les artères cérébrales souhaitées, mais aussi vers les territoires non cérébraux. Cela peut entraîner des lésions ischémiques cérébrales incohérentes, ce qui complique la reproductibilité des expériences.
Malgré les progrès réalisés dans les modèles CAGE précliniques, il reste des défis à relever pour reproduire les techniques de génération de bulles, normaliser les méthodes chirurgicales et acquérir des lésions cérébrales cohérentes. La présente étude introduit à la fois une approche chirurgicale conventionnelle qui nécessite de sacrifier l’ECA et une méthode alternative dans laquelle des bulles d’air sont injectées directement dans l’ACC. Nous rapportons des procédures détaillées, des défis et des logiciels open source pour l’analyse des bulles en temps réel. Nous incluons également les détails techniques nécessaires à la construction d’un générateur de bulles.
Protocole
Toutes les procédures impliquant des animaux ont été effectuées conformément au Guide d’utilisation et de soins des animaux de laboratoire. Nous avons obtenu l’approbation complète du Comité central de l’expérimentation animale des Pays-Bas (AVD11800202114839). Des rats Wistar mâles d’un poids compris entre 300 et 350 g ont été utilisés. Les animaux ont été logés par paires avec de la nourriture et de l’eau à volonté et des cycles lumière-obscurité de 12 heures. À leur arrivée, les animaux ont subi une période d’acclimatation de 7 jours avant que toute procédure expérimentale ne soit initiée.
REMARQUE : Nous avons utilisé deux méthodes chirurgicales, la méthode d’entrée ECA et la méthode d’entrée CCA. Pour les deux techniques, les rats ont été randomisés dans des groupes CAGE Vehicle ou 8000 nL à l’aide d’un outil d’analyse statistique. Le traitement du véhicule comprenait uniquement l’injection de solution saline ; Le traitement CAGE a utilisé des bulles d’air dans une solution saline d’un volume de 8000 nL, chaque bulle ayant un diamètre cible de 160 μm. Après l’achèvement de cette série, le modèle a été perfectionné avec 6000 nL et 7000 nL (tous deux avec un diamètre de bulle de 160 μm) uniquement par la méthode d’entrée CCA. En cas d’échec de la procédure, des rats de remplacement ont été ajoutés pour obtenir des tailles de groupe finales de n = 5.
1. Générateur de bulles d’air
REMARQUE : Le générateur de bulles d’air (Figure 1, Figure 2 et Figure supplémentaire 1A-C) se compose de plusieurs composants fabriqués sur mesure qui génèrent et détectent des bulles de gaz de taille égale.
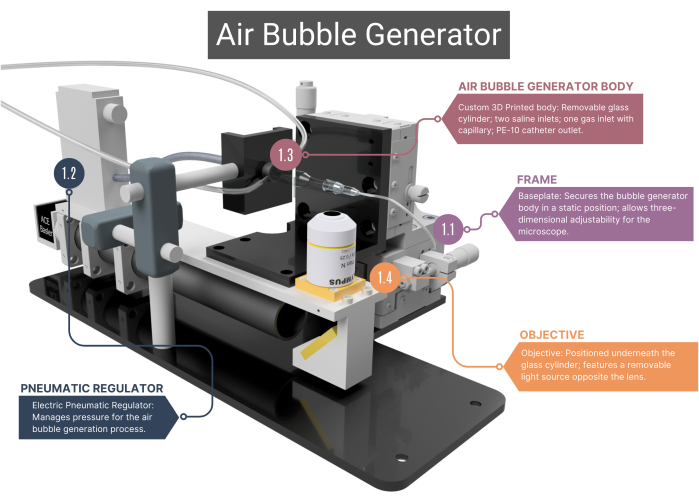
Figure 1 : Vue d’ensemble du générateur de bulles d’air. Le générateur de bulles comprend un cadre de support (1.1) et un régulateur pneumatique pour la gestion du flux d’air (1.2). Il comprend un corps principal imprimé en 3D abritant un capillaire en verre (1.3), relié à un objectif et une caméra haute vitesse (1.4). Voir la figure supplémentaire 1A-C pour plus d’images. Les chiffres correspondent aux étapes méthodologiques du texte principal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Cadre
- Utilisez un cadre avec une plaque de base en acier inoxydable sur mesure qui assure le positionnement statique du corps principal du générateur de bulles, tandis que l’objectif du microscope positionné en dessous peut être déplacé en trois dimensions. Cette capacité de réglage est facilitée par les assemblages XYZ qui permettent de modifier le champ de vision et de faire la mise au point sur l’extrémité du microcanal et les bulles d’air.
- Régulateur pneumatique
- Pour l’alimentation en air comprimé, utilisez un régulateur pneumatique électrique, qui a une plage de pression de 0,001 à 0,1 MPa. Assurez-vous que le régulateur est connecté au capillaire en verre par une tubulure intraveineuse (IV), scellée à l’air avec une gaine thermorétractable. Régulez la pression en modifiant la tension du régulateur.
- Corps du générateur de bulles d’air
REMARQUE : Le corps principal du générateur de bulles se compose d’une chambre en verre, d’un boîtier intérieur en plastique et d’un capillaire en verre. Tous les composants du corps doivent être étanches à l’air, ce qui garantit qu’aucune fuite d’air ou de solution saline n’est possible.- Assurez-vous que la chambre cylindrique en verre sur mesure a un diamètre intérieur (ID) de 1000 μm qui se fond dans un microcanal d’un ID de 400 μm. Aplatissez la face supérieure de ce microcanal de forme cylindrique pour obtenir une vue optimale à travers l’objectif.
- Montez l’extrémité extérieure du cylindre en verre sur une aiguille 21G avec la pointe retirée. À l’intérieur de cette aiguille, collez une deuxième aiguille (27G, ID 210 μm). Insérez cette aiguille de plus petit diamètre dans le microcanal et fixez-la à un cathéter en polyéthylène (PE-10) (ID 280 μm, longueur 125 mm).
- Installez un corps en plastique à l’arrière de la chambre en verre, qui comporte deux entrées en acier inoxydable ; ici, le tube IV pour l’entrée de solution saline peut être fixé. L’arrière de ce corps a une entrée pour le gaz à travers un capillaire en verre personnalisé qui est positionné avec des caoutchoucs à joint torique et verrouillé en place en vissant un capuchon.
- Pour la méthode d’entrée CCA, fixez l’extrémité du cathéter à une aiguille (30G, ID 159 μm) avec le boîtier Luer-lock en plastique retiré et pliez-le soigneusement à un angle de 45°.
- Réglage du microscope
- Positionnez l’objectif (4x) sous le corps du générateur de bulles et connectez-le à une caméra à grande vitesse. À l’opposé de la lentille, placez une source lumineuse LED réglable.
- Avant le début de chaque expérience, assurez-vous que la lentille de l’objectif est propre. La saleté entraînera des analyses de bulles incorrectes.
- Création du capillaire en verre
REMARQUE : Le processus de création de capillaires implique une quantité importante de mise au point. Bien que les paramètres fournis servent de référence, des ajustements peuvent être nécessaires pour obtenir le diamètre de bulle souhaité.- Fabriquer le capillaire en verre à l’aide d’un extracteur de micro-pipette (figure supplémentaire 1A-C). Pour créer les pipettes, installez les réchauffeurs d’extraction de micropipettes : réglez le réchauffeur gauche (n° 1) sur réglage = 70 et le chauffage droit (n° 2) sur réglage = 980.
- Placez le capillaire en verre dans l’extracteur et ajoutez deux blocs de 100 g de poids pour assurer la forme correcte après le processus de traction. Appuyez sur Démarrer. Une fois le processus de traction terminé, deux capillaires se forment.
- Coupez ou cassez chaque capillaire en diagonale à l’extrémité à l’aide d’un microscope à champ clair. La forme et le diamètre de la pointe sont critiques car ils influencent le diamètre des bulles de gaz. Pour assurer l’uniformité de la taille des bulles d’une expérience à l’autre, utilisez le même capillaire pour le diamètre de bulle souhaité.
- Insérez l’embout capillaire en verre dans le canal cylindrique (ID 400 μm) du corps du générateur de bulles.
- Configuration du générateur de microbulles
- Raccordez le générateur de bulles à un pousse-seringue avec une solution saline stérile (50 ml) et démarrez un débit continu à 20 ml/h. Assurez-vous qu’il n’y a pas d’air emprisonné dans le système. Si de l’air est piégé dans le système, tenez le générateur de bulles verticalement afin que l’air puisse s’échapper par le cathéter.
- Allumez la source lumineuse, l’appareil photo et le logiciel.
- Lorsque le système est à la bonne pression (après environ 2 min), vérifiez qu’il n’y a pas de fuite de gaz ou de liquide.
- Pour créer des bulles, augmentez lentement la pression en augmentant la tension, à partir de 2,1 V et en continuant jusqu’à ce que le gaz remplisse le capillaire en verre. Cela peut prendre un certain temps, mais il est important de ne pas précipiter cette partie. Lorsque la pression dans le capillaire en verre est égale à celle dans le canal, la production de bulles de gaz peut commencer. En augmentant simplement la tension jusqu’à 2,6 V, des bulles seront produites.
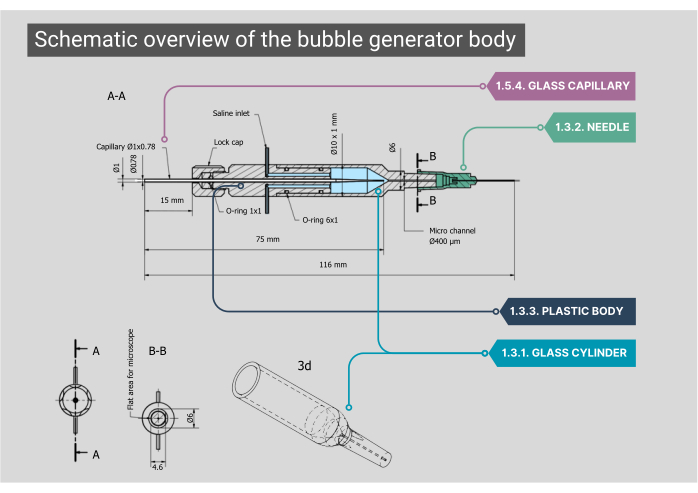
Figure 2 : Vue d’ensemble schématique du corps du générateur de bulles. Un plan détaillé du corps du générateur de bulles, y compris les dimensions et les annotations de chaque composant. Les chiffres correspondent aux étapes méthodologiques du texte principal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Détection et analyse des bulles de gaz
REMARQUE : Le code Python (Fichier supplémentaire 1) est conçu pour suivre et calculer le nombre, le diamètre et le volume de chaque bulle de gaz en temps réel. Lors de la production de bulles de gaz, le code traite chaque bulle détectée lorsqu’elle se déplace dans le champ de vision. Ces données sont affichées en permanence sous la forme du nombre de bulles, du volume d’air cumulé, du diamètre moyen des bulles et de la durée totale de l’enregistrement. Après chaque enregistrement, les données sont exportées dans une feuille de calcul et .mp4 fichier vidéo.
- Paramètres de l’appareil photo (Figure supplémentaire 2)
- Lorsque le générateur de microbulles est correctement configuré, allumez l’appareil photo dans le visualiseur de pylônes. Sélectionnez le gain et le seuil corrects.
- Trouvez la bonne région d’intérêt en déplaçant les axes X et Y du générateur de bulles et améliorez la netteté en déplaçant l’axe Z.
- Pour optimiser la fréquence d’images (171 ips), réglez l’appareil photo sur 2480 x 400 pixels (largeur x hauteur). Une fois la configuration de l’appareil photo terminée, assurez-vous de désactiver l’appareil photo dans Pylon Viewer.
- Analyse des bulles en temps réel (figure supplémentaire 2)
- Avant de commencer une expérience, effectuez un test du script tout en produisant des bulles de gaz. Vérifiez l’enregistrement et ajustez le seuil et le gain si nécessaire.
- Pour lancer l’analyse des bulles, exécutez le code Python. Le code affichera automatiquement la vidéo en direct, le nombre de bulles, le diamètre et le volume.
3. Chirurgie en cage
- Préparation à l’opération
- Préparez la zone chirurgicale avec un chiffon stérile sous le rat et disposez tous les instruments chirurgicaux et les sutures sur un deuxième chiffon stérile. Préparez les médicaments nécessaires.
- Assurez-vous que le coussin chauffant, avec système de rétroaction, est réglé à 37 °C. Réglez le microscope à la bonne hauteur.
- Retirez le rat de sa cage d’origine et préparez-vous à l’anesthésie.
- Anesthésie et soins préopératoires
- Administrer 0,05 mg/kg de buprénorphine par voie sous-cutanée 30 minutes avant la chirurgie.
- Anesthésier le rat à l’aide de 4 % d’isoflurane et d’un mélange d’air de 1 L/min (30 % d’oxygène et 70 % d’air) dans la chambre d’induction. Une fois complètement anesthésié, pesez le rat et rasez la zone chirurgicale du cou à l’aide d’un rasoir électrique.
- Déplacez le rat sur la table d’opération et placez l’isoflurane sur le masque facial pour maintenir l’anesthésie avec 2 % à 2,5 % d’isoflurane dans un mélange d’air à 70 %/30 %.
- Appliquez des larmes artificielles sur les yeux pour éviter le dessèchement. Lubrifiez la sonde de température et insérez-la par voie rectale.
- Placez le rat en position couchée et placez une seringue de 10 ml sous le cou pour faciliter l’accès à la zone chirurgicale.
- Fixez les pattes avant à la table d’opération à l’aide de ruban adhésif. Désinfectez la zone chirurgicale avec un gommage à base d’iode ou de chlorhexidine et d’alcool plusieurs fois en mouvements circulaires pour assurer la stérilité. Confirmez la profondeur de l’anesthésie par pincement des orteils.
- Incision
- Faites une incision médiane avec un scalpel de l’encoche sternale jusqu’en dessous de la mandibule (environ 1,5 cm).
- Utilisez deux pinces à épiler pour disséquer le tissu conjonctif (fascia cervical superficiel), exposant les muscles sous-jacents.
- Séparez les muscles sterno-hyoïdiens gauche et droit en déchirant doucement le tissu conjonctif entre les deux.
- Identifiez et rétractez les muscles suivants en dessous : muscle sterno-mastoïdien droit (se rétracter à l’aide d’un crochet tissulaire latéralement) et muscle omohyoïdien droit (se rétracter à l’aide d’un crochet tissulaire-médial). Le triangle carotidien droit (ACC, ECA, artère carotide interne (ICA)) doit être visible.
- Préparation chirurgicale de l’ACC
- Préparez l’ACC en enlevant le fascia sus-jacent et le tissu adipeux. Séparez soigneusement l’ACC du nerf vague sans endommager le nerf. Ne saisissez pas ou ne pincez pas le nerf ou ses branches. Poussez-le seulement doucement pour l’éloigner de l’ACC. Ne touchez pas ou n’appuyez pas contre la trachée pendant la préparation des vaisseaux.
- Placez une suture 3-0 autour de l’ACC à l’aide d’une pince à épiler incurvée et fixez le fil avec des hémostats. Cela servira plus tard à élever le CAC.
- Ligature temporaire de la Cour des comptes, de l’ICA et de leurs branches
- Localiser et exposer l’ECA et la bifurcation de l’ICA. Nettoyez le fascia environnant et le tissu adipeux si nécessaire. Ligaturer temporairement l’ECA avec une suture 3-0.
- Localisez l’artère occipitale (OA, principalement ramifiée à partir de l’ICA, au milieu entre la bifurcation en forme de Y de l’origine ICA et ECA) et l’artère thyroïdienne supérieure (ramification à partir de la face médiale de l’ECA). Ces petites branches se cassent facilement. Ligaturer temporairement l’arthrose avec une suture 3-0 proximalement.
- Après l’ICA distalement, la branche suivante se déplaçant latéralement est l’artère ptérygo-palatine (PPA). Nettoyez son fascia et son tissu adipeux environnants tout en faisant très attention à ne pas endommager le nerf vague. Ligaturer temporairement le PPA avec une suture 3-0.
REMARQUE : Il est recommandé d’approcher le PPA d’une direction crânienne ; L’inclinaison légère du rat sur le côté peut faciliter l’accès et la visualisation pendant la chirurgie.
- Méthode d’entrée ECA (Figure 3A)
- Lister les artères comme suit : utilisez la suture de l’étape 3.4.2. ligaturer doucement et temporairement l’ACC, en s’assurant que le flux est arrêté mais en minimisant le risque de créer des caillots thrombotiques. Ensuite, utilisez une suture 3-0 ou un clip vasculaire pour ligaturer temporairement l’ICA et l’OA.
- Appliquez deux sutures autour de l’ECA : une proximale et une distale. Assurez-vous que la suture distale inclut l’artère thyroïde supérieure et qu’elle est resserrée pour arrêter définitivement la circulation sanguine, tandis que la suture proximale est lâchement attachée lors d’une utilisation ultérieure.
- Créez une artériotomie entre les deux sutures de l’ECA à l’aide de ciseaux vasculaires. Il ne devrait pas y avoir de saignement à ce stade.
- Insérez le cathéter désaéré du générateur de bulles jusqu’à ce que l’extrémité atteigne la bifurcation de l’ACC. Resserrez la suture proximale, puis ligaturez et excisez l’ECA distale au site de l’artériotomie.
- Desserrez les ligatures de l’ACC et de l’ICA pour rétablir la circulation sanguine et, en même temps, commencez l’écoulement de la solution saline à travers le générateur de bulles dans le cathéter (étape 1.6.3.). Confirmez la stabilité de l’emplacement du cathéter et l’absence de fuite de sang ou de solution saline. Faites pivoter le moignon ECA avec le cathéter inséré d’environ 90° dans le sens inverse des aiguilles d’une montre afin que le flux du cathéter aille dans la direction de l’ICA.
- Démarrez le processus d’embolisation. Démarrez le code Python et lancez la création de bulles d’air comme décrit à l’étape 1.6.4.
- Une fois l’embolisation terminée, arrêtez temporairement le flux sanguin en resserrant la suture/pince vasculaire ICA.
- Retirez le cathéter avec précaution et fermez définitivement l’extrémité proximale de l’ECA en attachant fermement la suture existante.
- Retirez délicatement les sutures 3-0 et/ou la pince de l’APA, de l’OA, de l’ICA et de l’ACC pour permettre la reperfusion. Nettoyez tout sang résiduel autour de la zone de chirurgie.
- Méthode de saisie de l’ECA (figure 3B)
- Continuez après l’étape 3.5.3 ; ligaturer temporairement l’ECA proximale de la branche thyroïdienne supérieure, près de la bifurcation.
- Démarrez l’écoulement de la solution saline à travers le générateur de bulles d’air dans le cathéter, mais sans encore commencer la production de bulles d’air.
- Élevez doucement l’ACC à l’aide des hémostats de l’étape 3.4.2. et procédez à l’insertion de l’aiguille fixée au cathéter du générateur de bulles dans la lumière du CCA dans le sens de l’écoulement. Assurez-vous que l’ouverture de l’aiguille est tournée vers le haut et que l’aiguille ne perce pas la paroi du récipient opposé de l’ACC.
- Après l’insertion, abaissez lentement les hémostats et l’ACC qui l’accompagne à nouveau pour permettre la reperfusion de l’ACC. Assurez-vous qu’il n’y a pas de fuite de sang ou de solution saline autour du site d’insertion.
- Démarrez le processus d’embolisation en démarrant le code Python et la création de bulles d’air comme décrit à l’étape 1.6.4.
- Une fois l’embolisation terminée, soulevez à nouveau le CCA et rétractez soigneusement l’aiguille. Appliquez une pression avec un coton-tige sur le site d’insertion tout en maintenant l’élévation de l’ACC pour arrêter le saignement.
- Continuez à appliquer une pression sur le site de ponction. Retirez délicatement l’embout en coton en le faisant rouler distalement le long de l’ACC, en utilisant une pression minimale pour vous assurer que le caillot reste intact et en place. L’hémostase peut prendre entre 30 s et 5 minutes.
REMARQUE : Chez les rats femelles, la fermeture du site de ponction peut prendre quelques minutes de plus que chez les rats mâles. - Récupérez soigneusement les sutures 3-0 de l’ECA, de l’ICA et de l’ACC pour permettre la reperfusion. Encore une fois, confirmez que le saignement a cessé de façon permanente et nettoyez tout sang résiduel autour de la zone chirurgicale si nécessaire.
- Fermeture et soins postopératoires
- Séparez la peau du tissu sous-cutané du cou pour faciliter la suture. Suturez la peau avec une aiguille incurvée et une suture 4-0.
- Administrer de la bupivacaïne sous-cutanée à raison de 2,5 mg/mL (0,01 à 0,02 mL/kg) autour du site d’incision.
- Transférez soigneusement l’animal dans une cage de récupération (33 à 35 °C) pendant 30 à 120 minutes. Pendant la période de récupération, l’animal n’est pas laissé sans surveillance jusqu’à ce qu’il ait repris une conscience suffisante pour maintenir une position couchée sternale. Lorsque l’animal est complètement rétabli, transférez-le dans la cage familiale. Placez la nourriture humide à portée de main à l’intérieur de la cage.
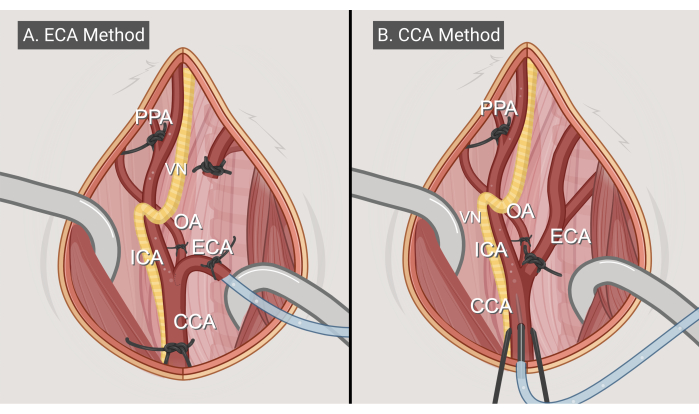
Figure 3 : Méthodes chirurgicales. Illustrations des deux approches chirurgicales, (A) la méthode d’entrée ECA et (B) la méthode d’entrée CCA. Abréviations : CCA = artère carotide commune ; ECA = artère carotide externe ; ICA = artère carotide interne ; OA = artère occipitale ; PPA = ptérygopalatine ; VN = nerf vague. Figurine réalisée avec BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Suivi
- Surveillance et critères d’évaluation sans cruauté
- Surveiller les animaux pendant une période postopératoire de 7 jours. Fournir une analgésie postopératoire avec de la buprénorphine sous-cutanée à 0,05 mg/kg à la fin de la journée de l’intervention et à nouveau le lendemain matin. Continuer de surveiller les animaux quotidiennement et d’administrer des analgésiques supplémentaires au besoin en fonction de l’évaluation clinique de la douleur ou de la détresse. Euthanasier le rat plus tôt si le critère d’évaluation sans cruauté est atteint conformément à la directive 2010/63/UE du Parlement européen.
- Déficits neurologiques cliniques
- Évaluer les déficits neurologiques cliniques (CND) les jours postopératoires (par exemple, les jours 1, 3 et 7). Notre définition de la CND comprend une diminution de la flexion du membre antérieur gauche (par exemple, l’inhibition de l’extension du membre antérieur lors de l’élévation du rat), l’incapacité de marcher droit ou un comportement circulaire, similaire au score de Bedersonde 10. Utilisez un score ou des tests neurologiques standardisés pour évaluer la fonction motrice et l’état neurologique.
- Imagerie par résonance magnétique
- Effectuez une imagerie par résonance magnétique (IRM) postopératoire (par exemple, les jours 1, 3, 5 et 7) sur un système d’IRM de petits animaux de 7 T avec le rat anesthésié avec 1,2 % à 2,5 % d’isoflurane dans un mélange de 0,5 L/min d’air médical et de 0,5 L/min d’oxygène. Surveillez en permanence la respiration et la température.
- Obtenez des balayages pondérés T2 à l’aide des paramètres de séquence suivants : temps de répétition 2500 ms, temps d’écho 9 ms, espacement des échos 9 ms et 10 échos. Réglez le champ de vision sur 35 x 35 mm avec une matrice d’acquisition de 128 x 128. L’épaisseur de la tranche est de 1,1 mm avec un total de 15 tranches acquises, en maintenant un rapport d’aspect de 1,00 et en utilisant une seule acquisition dynamique.
- Analyse histologique
- Après l’IRM le 7e jour (ou lorsque le point final expérimental est atteint), maintenez le rat sous anesthésie pour l’euthanasie en utilisant une perfusion cardiaque avec 30 ml de solution saline tamponnée au phosphate 0,1 M suivie de 30 ml de paraformaldéhyde à 4 %.
- Extrayez le cerveau et post-fixez-le pendant la nuit dans du paraformaldéhyde à 4 %. Après une période de fixation de 24 heures, incorporer le cerveau dans de la paraffine, trancher dans des coupes coronales et colorer avec de l’hématoxyline et de l’éosine (H&E) en utilisant la méthode standard11.
Résultats
Résultat neurologique
Le tableau 1 donne un aperçu de toutes les inclusions et exclusions dans les différents groupes expérimentaux. Aucun des rats opérés fictivement n’a montré de CND. Dans le groupe ECA-CAGE (8000 nL), deux rats sur cinq n’ont pas présenté de CND, tandis que les trois autres rats ont présenté une CND, dont deux sont morts dans les 24 heures. Dans le groupe CCA-CAGE (8000 nL), tous les animaux ont présenté une CND, trois sur cinq n’ont pas survécu jusqu’à 48 h. Dans les groupes CCA-CAGE avec des volumes d’air plus faibles, tous les rats ont survécu en postopératoire. Les cinq rats du groupe 7000 nL ont présenté une CND, tandis que dans le groupe 6000 nL, deux rats sur cinq ont présenté une CND.
| ECA | CCA | |||||||
| feinte | 8000 nL | feinte | 8000 nL | 7000 nL | 6000 nL | |||
| Inclus | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Présentait des déficits neurologiques cliniques | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Mortalité < 24 h | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Mortalité 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Total exclu | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Exclu en raison d’une complication hémorragique | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Exclu en raison d’une complication thrombotique | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Mort peropératoire due à la compression du nerf vague | 1 | 0 | 1 | 0 | 2 | 0 | ||
Tableau 1 : Inclusions et exclusions de groupes d’animaux. Le nombre de rats dans chaque groupe, les inclusions et les exclusions, les décès et la survie avec des déficits neurologiques cliniques.
IRM
La figure 4 montre une image représentative pondérée en T2 d’un rat qui a reçu des bulles d’air de 7000 nL par la méthode d’entrée CCA, montrant des hyperintensités corticales. Des anomalies similaires ont été observées chez tous les animaux du groupe CCA-CAGE qui ont reçu 7000 ou 8000 nL, et dans une moindre mesure dans le groupe 6000 nL et le groupe ECA-CAGE. Notamment, alors qu’aucun des animaux des groupes fictifs n’a montré de CND, un rat ECA-sham a montré une zone d’hyperintensité à l’IRM ; dans le groupe CCA-simulé, aucun rat n’a présenté d’anomalies à l’IRM.
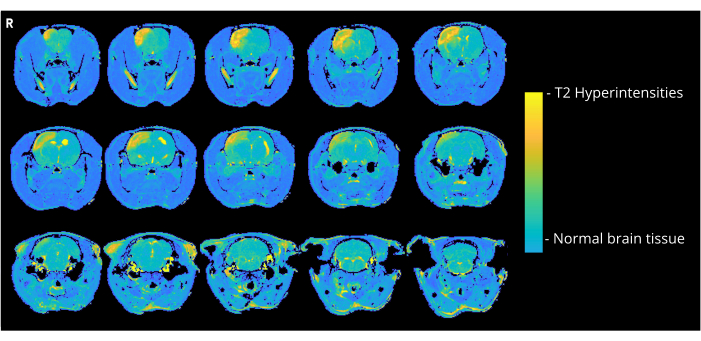
Figure 4 : Exemples d’images IRM. Images IRM représentatives pondérées en T2 (3 jours après la chirurgie CAGE) montrant des hyperintensités corticales dues à CAGE chez un rat du groupe CCA-CAGE 7000 nL. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Histologie
La figure 5 montre une coupe cérébrale représentative du rat 7000 nL CCA-CAGE de la figure 4, démontrant des lésions cérébrales ischémiques corticales avec perte de cellules neuronales et gliose réactive, y compris l’astrogliose réactive et l’activation microgliale.
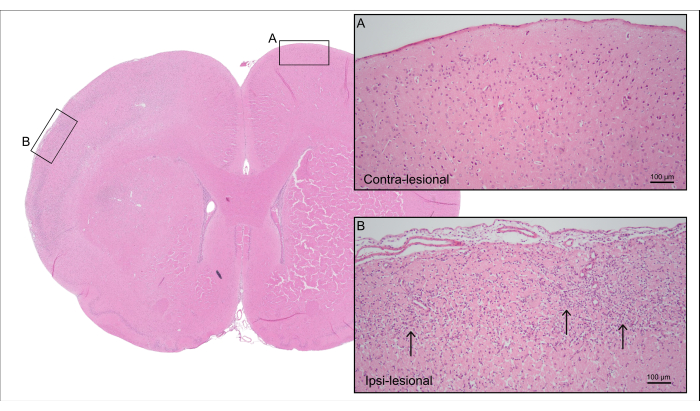
Figure 5 : Histologie post-mortem. Coloration H&E représentative du rat de la figure 4 montrant le tissu cortical du côté contra-lésionnel avec (A) des neurones intacts et (B) le côté ipsi-lésionnel avec du tissu cortical ischémique avec perte de cellules neuronales et gliose réactive (flèches). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Défis techniques
En raison de défis techniques, la méthode d’entrée dans la ZCE a eu un taux de réussite considérablement inférieur à celui de la méthode d’entrée dans la ZCD (tableau 1). Cela provenait principalement de la courte longueur du cathéter requise dans la méthode d’entrée ECA, qui entraînait fréquemment une luxation du cathéter et des saignements. De plus, la méthode d’entrée ECA a également entraîné une durée de chirurgie plus longue d’environ 20 minutes, ainsi qu’une plus grande variation du diamètre de la bulle.
Figure supplémentaire 1 : Détails du générateur de bulles d’air. (A) Des images du corps du générateur de bulles et de l’extracteur capillaire mettent en évidence leur assemblage et leurs aspects fonctionnels. (B) Vue latérale du générateur de bulles, montrant sa conception et ses caractéristiques structurelles d’un point de vue latéral. (C) Vue frontale du générateur de bulles, illustrant les principaux aspects et caractéristiques frontaux. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Étapes d’exécution du logiciel. Ce fichier fournit un guide détaillé sur les procédures et les étapes à suivre pour faire fonctionner et utiliser efficacement le logiciel associé au générateur de bulles d’air. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Code Python. Le code se compose des deux scripts (A et B) qui doivent être enregistrés dans le même dossier. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Nous avons décrit comment introduire des embolies gazeuses dans les artères cérébrales du rat à l’aide de deux méthodes et avons montré que l’introduction par une aiguille insérée dans l’ACC présente de multiples avantages par rapport à une méthode qui implique l’embolisation par cathéter dans l’ECA. Plus précisément, nous avons observé moins de complications avec la méthode d’entrée en ACC, ainsi qu’un diamètre de bulle plus constant et une réduction du temps chirurgical. La méthode d’entrée en ACC entraîne une CND dose-dépendante et des anomalies à l’IRM indiquant un infarctus cérébral, comme confirmé par l’histologie.
Le choix initial de la méthode d’entrée ECA a été inspiré par Gerriets et al.7. Cependant, nous avons identifié plusieurs difficultés avec cette approche, notamment des variations substantielles de la taille des bulles et un taux de complications chirurgicales plus élevé par rapport à la méthode d’entrée CCA. L’une des principales sources de ces complications est liée à la longueur du cathéter. Dans notre modèle, l’utilisation d’un cathéter court (125 mm) a permis de maintenir la stabilité des bulles, car plus le cathéter est long, plus la probabilité que les bulles fusionnent en passant dans le cathéter9 est élevée. Cependant, dans la méthode d’entrée ECA, un cathéter plus long facilite le placement et l’effet de levier pour le mouvement. L’utilisation d’un cathéter court dans la méthode d’entrée ECA entraîne une luxation et une détérioration fréquentes du moignon ECA en raison d’une manipulation excessive.
Une deuxième difficulté rencontrée dans la méthode d’entrée ECA concerne la création de bulles de taille constante (Figure 6). Dans la méthode d’entrée ECA, l’écoulement de solution saline à travers le cathéter doit être temporairement interrompu pendant que le cathéter est inséré dans l’ECA. Lorsque le flux artériel est rétabli et que l’embolisation peut commencer, le cathéter est soudainement soumis à la pression artérielle du rat. En conséquence, cela conduit à ce que le sang pénètre rétrogradément dans le cathéter et le générateur de bulles. L’effet de la fluctuation de la pression artérielle sur la pression à l’intérieur du générateur de bulles entraîne une variation plus importante de la taille des bulles, conduisant parfois à des bulles de forme cylindrique remplissant le canal (Figure 6B). Cela peut être évité en augmentant la pression à l’intérieur du système avant de positionner le cathéter dans l’ECA. Il est préférable qu’une deuxième personne le fasse pour un timing précis. De plus, comme cette méthode prend plus de temps, elle permet d’injecter une plus grande quantité de solution saline dans le rat que la méthode d’entrée en ACC. Dans la méthode d’entrée en ACC, la solution saline s’écoule continuellement à travers le cathéter et l’aiguille est insérée dans la direction du flux sanguin à travers l’ACC, résolvant ainsi le problème de gradient de pression décrit ci-dessus. Il en résulte l’absence de reflux dans le cathéter et une taille de bulle plus uniforme.
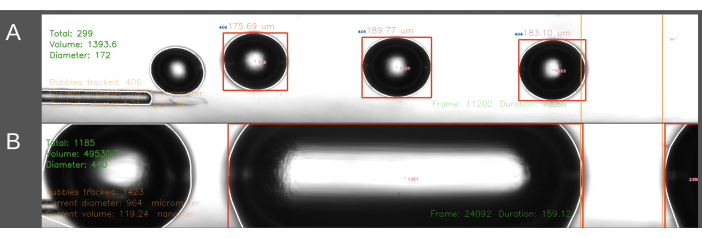
Figure 6 : Exemple d’enregistrement et d’analyse de la production de bulles. Les images affichent des captures d’écran montrant l’analyse en temps réel du nombre total de bulles, du volume total et du diamètre moyen dans la zone de mesure (vert, coin supérieur gauche). La zone de mesure est mise en évidence entre les lignes orange sur la droite. Le diamètre et le volume de la bulle sont calculés en fonction du diamètre horizontal. Les images comprennent la formation (A) de bulles d’air générées avec succès et (B) de bulles cylindriques générées sans succès. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Bien que la méthode d’entrée CCA soit très appréciée, nous avons tout de même rencontré diverses difficultés techniques. Tout d’abord, la préparation de l’APP est difficile, car la compression accidentelle du nerf vague peut entraîner une dépression respiratoire et la mort ultérieure de l’animal12. Pour réduire ce risque, il faut incliner légèrement le rat sur le côté et s’approcher du PPA par la direction crânienne. De plus, en raison de l’anatomie difficile de la bifurcation de l’ICA et de la PPA, il existe un risque de lésions vasculaires et de saignements incontrôlables. Cela ne peut être contourné qu’en améliorant les compétences chirurgicales. Ces défis mettent en évidence que la maîtrise du modèle CAGE chez le rat est complexe et nécessite beaucoup de pratique et de précision13.
La configuration technique proposée du générateur de bulles d’air a ses limites, notamment liées aux capillaires en verre fabriqués sur mesure, en raison de leur fragilité. Le tube qui relie le régulateur pneumatique au capillaire est sujet à la rupture lors du réglage de la vanne à trois voies pour la libération de la pression après l’embolisation. De plus, le remplacement d’un capillaire nécessite la destruction du capillaire existant en raison du caoutchouc thermorétractable qui y est fixé en permanence. De plus, chaque capillaire présente des caractéristiques de bulles uniques en raison de différences mineures de diamètre et de forme de la pointe. Enfin, le fonctionnement manuel de la génération de bulles via le régulateur pneumatique nécessitait une expérience considérable. Une manipulation inexpérimentée peut entraîner la production de bulles excessivement grosses. La régulation automatisée de la pression avec une boucle de rétroaction à partir du code Python pourrait améliorer la précision automatisée dans les études futures.
Notre documentation complète, qui comprend à la fois les spécifications techniques du générateur de bulles, un protocole chirurgical détaillé et la fourniture du logiciel, apporte une contribution importante à ce domaine de recherche. Notre technique CCA garantit une perturbation minimale de la perfusion cérébrale physiologique, en maintenant le flux CCA tout au long de la procédure et en éliminant la nécessité de sacrifier l’ECA. Notre étude fournit un modèle expérimental fiable et reproductible pour étudier CAGE et ses traitements potentiels.
Déclarations de divulgation
Aucun
Remerciements
Cette recherche a été financée par la Fondation néerlandaise pour l’assurance maladie militaire (Stichting Ziektekosten Verzekering Krijgsmacht) sous le numéro de subvention 20-0232 et la subvention E. Dekker 2021 de la Fondation néerlandaise du cœur (03-006-2021-T019 à IAM). Nous remercions également Lindy Alles, Paul Bloemen et Ed van Bavel pour leur aide exceptionnelle.
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Références
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon