Method Article
Indução de embolia gasosa arterial cerebral em ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo fornece uma descrição detalhada da indução de êmbolos aéreos cerebrais em ratos. Ele compara a injeção direta na artéria carótida comum e a introdução através da artéria carótida externa. Ele fornece uma descrição técnica do gerador de bolhas de ar, o efeito de diferentes volumes de ar e os desafios processuais.
Resumo
Apresentamos uma abordagem metodológica para a pesquisa pré-clínica da embolia gasosa arterial cerebral (CAGE), uma condição caracterizada por bolhas de gás dentro da circulação cerebral causando isquemia multifocal. O presente trabalho descreve dois métodos cirúrgicos para induzir CAGE no rato: um com injeção de ar através da artéria carótida externa (ECA), sacrificando assim o vaso, e outro via injeção direta na artéria carótida comum (CCA). Ratos Wistar machos foram usados e divididos em grupos (n=5) para serem submetidos ao método de entrada ECA ou CCA com injeção de diferentes volumes de êmbolos aéreos (6000, 7000 e 8000 nL) ou cirurgia simulada. Um gerador de bolhas feito sob medida foi usado para produzir êmbolos de gás com tamanho consistente, e um software de código aberto foi desenvolvido para análise de bolhas em tempo real. A comparação entre os dois métodos revelou que a abordagem CCA é superior em termos de produção consistente de bolhas dentro do gerador de bolhas, tempo de embolização reduzido e menos complicações.
Introdução
A embolia gasosa arterial cerebral (CAGE) é caracterizada pelo alojamento de bolhas de gás na circulação arterial cerebral, levando a um espectro de comprometimentos neurológicos. Essa condição é predominantemente conhecida como uma complicação no mergulho, onde a expansão excessiva dos pulmões durante a subida resulta em barotrauma e entrada de ar nas veias pulmonares, que então fluem para as artérias cerebrais1. Além dessa ocorrência bem conhecida no mergulho, os profissionais médicos estão reconhecendo cada vez mais o CAGE como uma complicação de procedimentos médicos invasivos. A embolia gasosa iatrogênica pode ocorrer durante a colocação, manuseio ou remoção de cateteres venosos centrais e drenos torácicos, bem como durante o curso de procedimentos abertos e endovasculares, incluindo intervenções valvares cardíacas, reparos endovasculares da aorta torácica e trombectomia endovascular no AVC isquêmico 2,3. Apesar de sua importância clínica, a pesquisa sobre CAGE, particularmente usando modelos animais, permanece esparsa e fragmentada4.
Desde o estudo pioneiro de Rosengren et al. em 1977 com ratos, os modelos animais para CAGE passaram por um refinamento significativo5. A abordagem empregada por Rosengren envolveu a canulação da artéria carótida comum (ACC) para introduzir um volume total de 10 μL de ar. Essa técnica não foi isenta de limitações, incluindo hemodinâmica alterada devido à ligadura arterial e ao tamanho descontrolado e volume excessivo do êmbolo aéreo6. O método de Furlow, descrito em 1982, melhorou a precisão da embolização de ar avançando um cateter na artéria carótida interna e administrando um volume total de ar de 5 μL. No entanto, embora sua importância tenha sido reconhecida cedo, o conceito de tamanho uniforme da bolha só foi implementado décadas depois. Gerriets et al. foram capazes de produzir um número consistente de bolhas com diâmetro uniforme, inicialmente de 160 μm, posteriormente reduzido para 45 μm 7,8. O método cirúrgico aqui utilizado exigiu o sacrifício da artéria carótida externa (ACE). Recentemente, Schaefer et al. introduziram um método menos invasivo ao inserir um microcateter na ACC através da artéria femoral, mimetizando com mais precisão os cenários de embolia gasosa observados durante procedimentos endovasculares9. Seu método tinha a limitação de não ligar os ramos arteriais da ACC (por exemplo, ECA e artéria pterigopalatina (PPA)), permitindo assim que as bolhas fluíssem não apenas para as artérias cerebrais desejadas, mas também para territórios não cerebrais. Isso pode resultar em danos isquêmicos cerebrais inconsistentes, complicando a reprodutibilidade dos experimentos.
Apesar dos avanços nos modelos pré-clínicos de CAGE, os desafios permanecem na replicação de técnicas de geração de bolhas, padronização de métodos cirúrgicos e aquisição de lesões cerebrais consistentes. O presente estudo apresenta uma abordagem cirúrgica convencional que requer o sacrifício da ECA e um método alternativo no qual as bolhas de ar são injetadas diretamente na CCA. Relatamos procedimentos detalhados, desafios e software de código aberto para análise de bolhas em tempo real. Também incluímos os detalhes técnicos necessários para construir um gerador de bolhas.
Protocolo
Todos os procedimentos envolvendo animais foram conduzidos de acordo com o Guia de Uso e Cuidados com Animais de Laboratório. Obtivemos a aprovação total do Comitê Central de Experimentos Animais da Holanda (AVD11800202114839). Foram utilizados ratos Wistar machos com faixa de peso de 300 a 350 g. Os animais foram alojados em pares com comida e água ad libitum e ciclos claro-escuro de 12 h. Na chegada, os animais foram submetidos a um período de aclimatação de 7 dias antes de qualquer procedimento experimental ser iniciado.
NOTA: Foram utilizados dois métodos cirúrgicos, o método de entrada ECA e o método de entrada CCA. Para ambas as técnicas, os ratos foram randomizados em grupos Veículo ou CAGE de 8000 nL usando uma ferramenta de análise estatística. O tratamento veicular incluiu apenas injeção salina; O tratamento CAGE utilizou bolhas de ar em solução salina até um volume de 8000 nL, com cada bolha tendo um diâmetro alvo de 160 μm. Após a conclusão desta série, o refinamento adicional do modelo com 6000 nL e 7000 nL (ambos com diâmetro de bolha de 160 μm) foi feito apenas através do método de entrada CCA. Em caso de falha do procedimento, ratos de substituição foram adicionados para obter tamanhos finais de grupo de n=5.
1. Gerador de bolhas de ar
NOTA: O gerador de bolhas de ar (Figura 1, Figura 2 e Figura Suplementar 1A-C) consiste em vários componentes personalizados que geram e detectam bolhas de gás de tamanhos iguais.
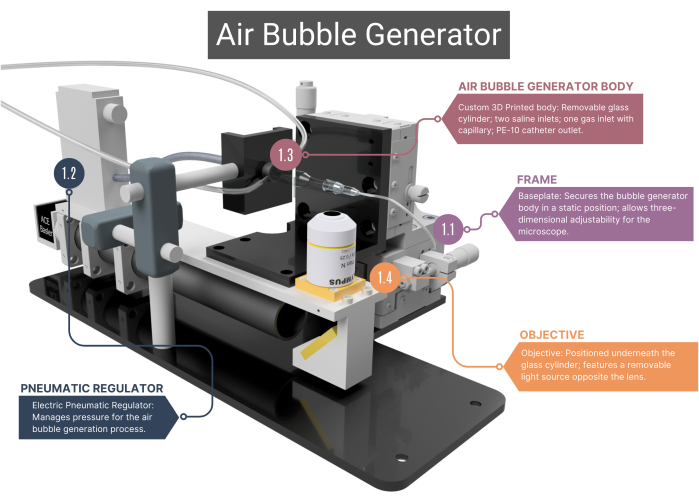
Figura 1: Visão geral do gerador de bolhas de ar. O gerador de bolhas compreende uma estrutura de suporte (1.1) e um regulador pneumático para gerenciamento do fluxo de ar (1.2). Inclui um corpo principal impresso em 3D que abriga um capilar de vidro (1.3), ligado a uma objetiva e câmera de alta velocidade (1.4). Veja a Figura Suplementar 1A-C para mais imagens. Os números correspondem às etapas metodológicas do texto principal. Clique aqui para ver uma versão maior desta figura.
- Moldura
- Use uma estrutura com uma placa de base de aço inoxidável feita sob medida que garanta o posicionamento estático do corpo principal do gerador de bolhas, enquanto a objetiva do microscópio posicionada embaixo dela pode ser movida em três dimensões. Essa capacidade de ajuste é facilitada por montagens XYZ que permitem alterações no campo de visão e permitem o foco na ponta do microcanal e nas bolhas de ar.
- Regulador pneumático
- Para fornecimento de ar comprimido, use um regulador pneumático elétrico, que tenha uma faixa de pressão de 0,001 a 0,1 MPa. Certifique-se de que o regulador esteja conectado ao capilar de vidro por meio de tubos intravenosos (IV), selados a ar com mangas termoencolhíveis. Regule a pressão alterando a tensão do regulador.
- Corpo do gerador de bolhas de ar
NOTA: O corpo principal do gerador de bolhas consiste em uma câmara de vidro, caixa interna de plástico e um capilar de vidro. Todos os componentes do corpo precisam ser herméticos, garantindo que nenhum vazamento de ar ou solução salina seja possível.- Certifique-se de que a câmara de vidro cilíndrica feita sob medida tenha um diâmetro interno (ID) de 1000 μm que se funde em um microcanal com um ID de 400 μm. Achate o lado superior deste microcanal de forma cilíndrica para obter uma visão ideal através da objetiva.
- Encaixe a extremidade externa do cilindro de vidro em uma agulha 21G com a ponta removida. Dentro desta agulha, cole uma segunda agulha (27G, ID 210 μm). Encaixe esta agulha de menor diâmetro no microcanal e conecte-a a um cateter de polietileno (PE-10) (ID 280 μm, comprimento 125 mm).
- Encaixe um corpo de plástico na parte de trás da câmara de vidro, que possui duas entradas de aço inoxidável; aqui, o tubo IV para a entrada de solução salina pode ser conectado. A parte traseira deste corpo tem uma entrada de gás através de um capilar de vidro personalizado que é posicionado com borrachas O-ring e travado no lugar aparafusando uma tampa.
- Para o método de entrada CCA, prenda a extremidade do cateter a uma agulha (30G, ID 159 μm) com o invólucro de Luer-lock de plástico removido e dobre-o cuidadosamente em um ângulo de 45°.
- Ajuste do microscópio
- Posicione a objetiva (4x) embaixo do corpo do gerador de bolhas e conecte-a a uma câmera de alta velocidade. Em frente à lente, coloque uma fonte de luz LED ajustável.
- Antes do início de cada experimento, certifique-se de que a lente objetiva esteja limpa. A sujeira resultará em análises incorretas de bolhas.
- Criação do capilar de vidro
NOTA: O processo de criação de capilares envolve uma quantidade significativa de ajuste fino. Embora as configurações fornecidas sirvam como linha de base, podem ser necessários ajustes para atingir o diâmetro de bolha desejado.- Faça o capilar de vidro usando um extrator de micropipeta (Figura Suplementar 1A-C). Para criar as pipetas, configure os aquecedores extratores de micropipetas: ajuste o aquecedor esquerdo (nº 1) para ajuste = 70 e o aquecedor direito (nº 2) para ajuste = 980.
- Coloque o capilar de vidro no extrator e adicione dois blocos de peso de 100 g para garantir a forma correta após o processo de puxamento. Pressione Iniciar. Uma vez concluído o processo de tração, dois capilares são formados.
- Corte ou quebre cada capilar diagonalmente na ponta usando um microscópio de campo claro. A forma e o diâmetro da ponta são críticos, pois influenciam o diâmetro das bolhas de gás. Para garantir a consistência no tamanho da bolha entre os experimentos, use o mesmo capilar para o diâmetro desejado da bolha.
- Insira a ponta capilar de vidro no canal cilíndrico (ID 400 μm) do corpo do gerador de bolhas.
- Configurando o gerador de microbolhas
- Conecte o gerador de bolhas a uma bomba de seringa com solução salina estéril (50 mL) e inicie um fluxo contínuo a 20 mL/h. Certifique-se de que não haja ar preso no sistema. Caso o ar fique preso no sistema, segure o gerador de bolhas verticalmente para que o ar possa escapar pelo cateter.
- Ligue a fonte de luz, a câmera e o software.
- Quando o sistema estiver na pressão correta (após aproximadamente 2 min), verifique se há vazamento de gás ou fluido no sistema.
- Para criar bolhas, aumente lentamente a pressão aumentando a tensão, começando em 2,1 V e continuando até que o gás encha o capilar do vidro. Isso pode levar algum tempo, mas é importante não apressar essa parte. Quando a pressão no capilar de vidro é igual à do canal, a produção de bolhas de gás pode começar. Simplesmente aumentando a tensão até 2,6 V, as bolhas serão produzidas.
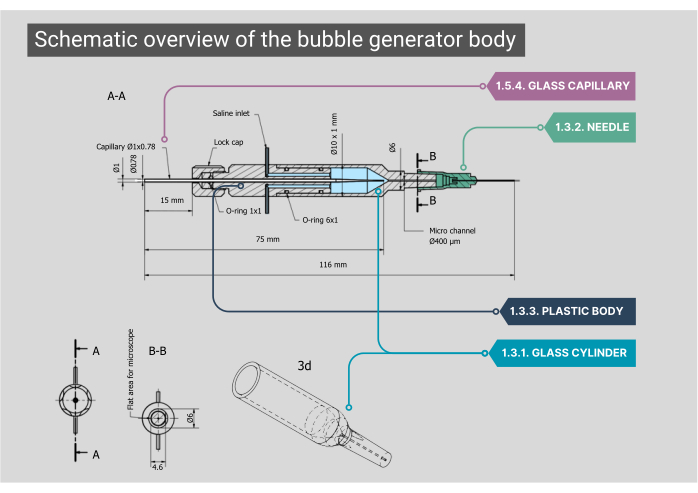
Figura 2: Visão geral esquemática do corpo do gerador de bolhas. Um projeto detalhado do corpo do gerador de bolhas, incluindo dimensões e anotações para cada componente. Os números correspondem às etapas metodológicas do texto principal. Clique aqui para ver uma versão maior desta figura.
2. Detecção e análise de bolhas de gás
NOTA: O código Python (Arquivo Suplementar 1) foi projetado para rastrear e calcular o número, diâmetro e volume de cada bolha de gás em tempo real. Durante a produção de bolhas de gás, o código processa cada bolha detectada à medida que ela se move pelo campo de visão. Esses dados são exibidos continuamente como contagem de bolhas, volume cumulativo de ar, diâmetro médio da bolha e duração total da gravação. Após cada gravação, os dados são exportados para uma planilha e .mp4 arquivo de vídeo.
- Configurações da câmera (Figura 2 suplementar)
- Quando o gerador de microbolhas estiver configurado corretamente, ligue a câmera no Pylon Viewer. Selecione o ganho e o limite corretos.
- Encontre a região de interesse correta movendo os eixos X e Y do gerador de bolhas e aumente a nitidez movendo o eixo Z.
- Para otimizar a taxa de quadros (171 fps), defina a câmera para 2480 x 400 pixels (largura x altura). Quando a configuração da câmera estiver concluída, certifique-se de desligar a câmera no Pylon Viewer.
- Análise de bolhas em tempo real (Figura 2 suplementar)
- Antes de iniciar um experimento, execute um teste do script enquanto produz bolhas de gás. Verifique a gravação e ajuste o limite e o ganho quando necessário.
- Para iniciar a análise das bolhas, execute o código Python. O código exibirá automaticamente o vídeo ao vivo, contagem de bolhas, diâmetro e volume.
3. Cirurgia CAGE
- Preparação para a cirurgia
- Prepare a área cirúrgica com um pano estéril sob o rato e coloque todos os instrumentos cirúrgicos e suturas em um segundo pano estéril. Prepare a medicação necessária.
- Certifique-se de que a almofada de aquecimento, com sistema de feedback, esteja ajustada para 37 °C. Ajuste o microscópio para a altura correta.
- Remova o rato de sua gaiola doméstica e prepare-se para a anestesia.
- Anestesia e cuidados pré-cirúrgicos
- Administre 0,05 mg/kg de buprenorfina por via subcutânea 30 minutos antes da cirurgia.
- Anestesiar o rato com isoflurano a 4% e mistura de ar a 1 L/min (oxigênio a 30% e ar a 70%) na câmara de indução. Depois de totalmente anestesiado, pese o rato e raspe a área cirúrgica do pescoço usando um barbeador elétrico.
- Mova o rato para a mesa cirúrgica e troque o isoflurano pela máscara facial para manter a anestesia com 2%-2,5% de isoflurano em 70%/30% de mistura de ar.
- Aplique lágrimas artificiais nos olhos para evitar o ressecamento. Lubrifique a sonda de temperatura e insira-a por via retal.
- Posicione o rato em decúbito dorsal e coloque uma seringa de 10 mL sob o pescoço para facilitar o acesso à área cirúrgica.
- Prenda as patas dianteiras à mesa de cirurgia usando fita adesiva. Desinfete a área cirúrgica com esfoliante à base de iodo ou clorexidina e álcool várias vezes em movimentos circulares para garantir a esterilidade. Confirme a profundidade da anestesia beliscando o dedo do pé.
- Incisão
- Faça uma incisão na linha média com um bisturi da incisura esternal até abaixo da mandíbula (aproximadamente 1,5 cm).
- Use duas pinças para dissecar o tecido conjuntivo (fáscia cervical superficial), expondo os músculos subjacentes.
- Separe os músculos esterno-hióideos esquerdo e direito, rasgando suavemente o tecido conjuntivo entre eles.
- Identifique e retraia os seguintes músculos abaixo: músculo esternomastóideo direito (retrair usando um gancho de tecido lateralmente) e músculo omo-hióideo direito (retrair usando um gancho de tecido caudal-medialmente). O triângulo carotídeo do lado direito (CCA, ECA, artéria carótida interna (ACI)) deve estar visível.
- Preparação cirúrgica do CCA
- Prepare o CCA removendo a fáscia sobrejacente e o tecido adiposo. Separe cuidadosamente o CCA do nervo vago sem danificar o nervo. Não agarre ou aperte o nervo ou seus galhos. Apenas empurre-o suavemente para longe do CCA. Não toque ou pressione contra a traqueia enquanto prepara os vasos.
- Coloque uma sutura 3-0 ao redor do CCA usando uma pinça curva e prenda o fio com hemostáticos. Mais tarde, isso servirá para elevar o CCA.
- Ligadura temporária do TCE, ICA e suas filiais
- Localize e exponha a ECA e a bifurcação da ICA. Limpe a fáscia circundante e o tecido adiposo, se necessário. Ligue temporariamente o ECA com sutura 3-0.
- Localize a artéria occipital (OA, principalmente ramificando-se da ACI, no meio entre a bifurcação em forma de Y da origem da ACI e da ACE) e a artéria tireóidea superior (ramificando-se do lado medial da ACE). Esses pequenos galhos se rompem facilmente. Ligue temporariamente o OA com uma sutura 3-0 proximalmente.
- Seguindo a ACI distalmente, o próximo ramo que se move lateralmente é a artéria pterigopalatina (APP). Limpe a fáscia circundante e o tecido adiposo, tomando muito cuidado para não danificar o nervo vago. Ligue temporariamente o PPA com uma sutura 3-0.
NOTA: Recomenda-se abordar o PPA no sentido cranial; Inclinar o rato ligeiramente para o lado pode facilitar o acesso e a visualização durante a cirurgia.
- Método de entrada ECA (figura 3A)
- Ligue as artérias da seguinte forma: use a sutura da etapa 3.4.2. para ligar suave e temporariamente o CCA, garantindo que o fluxo seja interrompido, mas minimizando o risco de criar coágulos trombóticos. Em seguida, use uma sutura 3-0 ou clipe vascular para ligar temporariamente a ACI e a OA.
- Aplique duas suturas ao redor do ECA: uma proximal e outra distal. Certifique-se de que a sutura distal inclua a artéria tireoidiana superior e seja apertada para interromper o fluxo sanguíneo permanentemente, enquanto a sutura proximal é frouxamente amarrada após o uso posterior.
- Crie uma arteriotomia entre as duas suturas da ECA usando uma tesoura vascular. Não deve haver sangramento nesta fase.
- Insira o cateter desventilado do gerador de bolhas até que a ponta atinja a bifurcação do CCA. Aperte a sutura proximal e, em seguida, ligue e excise a ECA distal ao local da arteriotomia.
- Afrouxe as ligaduras no CCA e na ACI para restaurar o fluxo sanguíneo e, ao mesmo tempo, inicie o fluxo de solução salina através do gerador de bolhas para o cateter (etapa 1.6.3.). Confirme a estabilidade da colocação do cateter e a ausência de vazamento de sangue ou solução salina. Gire o coto ECA com o cateter inserido cerca de 90° no sentido anti-horário para que o fluxo do cateter vá na direção da ACI.
- Inicie o processo de embolização. Inicie o código Python e inicie a criação de bolhas de ar conforme descrito na etapa 1.6.4.
- Após o término da embolização, interrompa temporariamente o fluxo sanguíneo apertando a sutura da ACI/pinça vascular.
- Remova o cateter com cuidado e feche permanentemente a extremidade proximal da ECA amarrando firmemente a sutura existente.
- Remova suavemente as suturas 3-0 e/ou pinça do PPA, OA, ICA e CCA para permitir a reperfusão. Limpe qualquer sangue residual ao redor da área de cirurgia.
- Método de entrada CCA (Figura 3B)
- Continue após a etapa 3.5.3; ligam temporariamente a ECA proximal do ramo tireoidiano superior, próximo à bifurcação.
- Inicie a corrida de solução salina através do gerador de bolhas de ar para o cateter, mas sem iniciar a produção de bolhas de ar ainda.
- Eleve suavemente o CCA usando os hemostáticos da etapa 3.4.2. e prossiga para inserir a agulha presa ao cateter do gerador de bolhas no lúmen do CCA na direção do fluxo. Certifique-se de que a abertura da agulha esteja voltada para cima e que a agulha não perfure a parede oposta do vaso do CCA.
- Após a inserção, abaixe lentamente os hemostáticos e a ACC que a acompanha novamente para permitir a reperfusão da ACC. Certifique-se de que não haja vazamento de sangue ou solução salina ao redor do local de inserção.
- Inicie o processo de embolização iniciando o código Python e a criação de bolhas de ar, conforme descrito na etapa 1.6.4.
- Após completar a embolização, eleve novamente o CCA e retraia cuidadosamente a agulha. Aplique pressão com uma ponta de algodão no local de inserção, mantendo a elevação do CCA para estancar o sangramento.
- Continue aplicando pressão no local da punção. Remova suavemente a ponta de algodão rolando-a distalmente ao longo do CCA, usando pressão mínima para garantir que o coágulo permaneça intacto e no lugar. Pode levar entre 30 s a 5 min para atingir a hemostasia.
NOTA: Em ratos fêmeas, o fechamento do local da punção pode demorar alguns minutos a mais do que em ratos machos. - Recupere cuidadosamente as suturas 3-0 do ECA, ICA e CCA para permitir a reperfusão. Novamente, confirme se o sangramento parou permanentemente e limpe qualquer sangue residual ao redor da área da cirurgia, se necessário.
- Fechamento e cuidados pós-cirúrgicos
- Separe a pele do tecido subcutâneo do pescoço para facilitar a sutura. Suturar a pele com uma agulha curva e sutura 4-0.
- Administre bupivacaína subcutânea 2,5 mg / mL (0,01 - 0,02 mL / kg) ao redor do local da incisão.
- Transfira cuidadosamente o animal para uma gaiola de recuperação (33 - 35 °C) por 30-120 min. Durante o período de recuperação, o animal não é deixado sozinho até que tenha recuperado a consciência suficiente para manter uma posição de decúbito esternal. Quando o animal estiver totalmente recuperado, transfira-o de volta para a gaiola de origem. Coloque a ração úmida de fácil acesso dentro da gaiola.
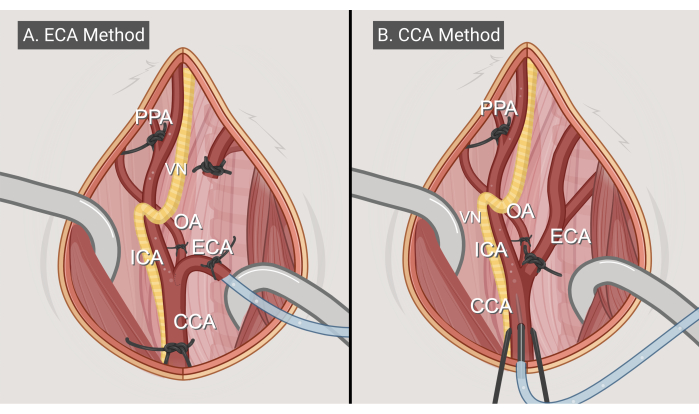
Figura 3: Métodos cirúrgicos. Ilustrações das duas abordagens cirúrgicas, (A) o método de entrada ECA e (B) o método de entrada CCA. Abreviaturas: CCA = artéria carótida comum; ECA = artéria carótida externa; ACI = artéria carótida interna; OA = artéria occipital; PPA = pterigopalatino; VN = nervo vago. Figura feita com BioRender.com. Clique aqui para ver uma versão maior desta figura.
4. Acompanhamento
- Monitoramento e endpoints humanos
- Monitore os animais por um período de pós-operatório de 7 dias. Forneça analgesia pós-operatória com buprenorfina subcutânea a 0,05 mg / kg no final do dia da cirurgia e novamente na manhã seguinte. Continue a monitorar os animais diariamente e administre analgésicos adicionais conforme necessário com base na avaliação clínica da dor ou angústia. Eutanasiar o rato mais cedo se o ponto final humano for atingido de acordo com a diretiva 2010/63/UE do Parlamento Europeu.
- Déficits neurológicos clínicos
- Avalie os déficits neurológicos clínicos (DCN) nos dias pós-operatórios (por exemplo, dias 1, 3 e 7). Nossa definição de DCN inclui diminuição da flexão do membro anterior esquerdo (por exemplo, a inibição da extensão do membro anterior ao levantar o rato), a incapacidade de andar em linha reta ou comportamento circular, semelhante ao escore de Bederson10. Use qualquer pontuação ou teste neurológico padronizado para avaliar a função motora e o estado neurológico.
- Ressonância magnética
- Realize ressonância magnética (MRI) pós-operatória (por exemplo, nos dias 1, 3, 5 e 7) em um sistema de ressonância magnética de pequenos animais de 7 T com o rato anestesiado com isoflurano a 1,2% - 2,5% em uma mistura de 0,5 L / min de ar medicinal e 0,5 L / min de oxigênio. Monitore a respiração e a temperatura continuamente.
- Obtenha varreduras ponderadas em T2 usando os seguintes parâmetros de sequência: tempo de repetição de 2500 ms, tempo de eco de 9 ms, espaçamento de eco de 9 ms e 10 ecos. Defina o campo de visão para 35 x 35 mm com uma matriz de aquisição de 128 x 128. A espessura do corte é de 1,1 mm com um total de 15 cortes adquiridos, mantendo uma proporção de 1,00 e usando uma única aquisição dinâmica.
- Análise histológica
- Após a conclusão da ressonância magnética no7º dia (ou quando o desfecho experimental for atingido), manter o rato sob anestesia para eutanásia usando perfusão cardíaca com 30 mL de solução salina tamponada com fosfato 0,1 M seguida de 30 mL de paraformaldeído 4%.
- Extraia o cérebro e pós-fixe-o durante a noite em paraformaldeído a 4%. Após um período de fixação de 24 horas, embutir o cérebro em parafina, cortar em cortes coronais e corar com hematoxilina e eosina (H&E) usando o método padrão11.
Resultados
Desfecho neurológico
A Tabela 1 fornece uma visão geral de todas as inclusões e exclusões nos diferentes grupos experimentais. Nenhum dos ratos operados simuladamente apresentou qualquer DCN. No grupo ECA-CAGE (8000 nL), dois dos cinco ratos não apresentaram DCN, enquanto os três ratos restantes apresentaram DCN, dos quais dois morreram em 24 horas. No grupo CCA-CAGE (8000 nL) todos os animais apresentaram CND, três dos cinco não sobreviveram até 48 h. Nos grupos CCA-CAGE com menores volumes de ar, todos os ratos sobreviveram no pós-operatório. Todos os cinco ratos do grupo de 7000 nL demonstraram CND, enquanto no grupo de 6000 nL, dois em cada cinco ratos apresentaram CND.
| ECA | CCA | |||||||
| Farsa | 8000 nL | Farsa | 8000 nL | 7000 nL | 6000 nL | |||
| Incluso | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Exibiu déficits neurológicos clínicos | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Mortalidade < 24 h | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Mortalidade 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Total excluído | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Excluído devido a complicação hemorrágica | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Excluído devido a complicação trombótica | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Morte intraoperatória devido à compressão do nervo vago | 1 | 0 | 1 | 0 | 2 | 0 | ||
Tabela 1: Inclusões e exclusões de grupos de animais. O número de ratos em cada grupo, inclusões e exclusões, mortes e sobrevida com déficits neurológicos clínicos.
RESSONÂNCIA
A Figura 4 mostra uma imagem representativa ponderada em T2 de um rato que recebeu bolhas de ar de 7000 nL pelo método de entrada CCA, mostrando hiperintensidades corticais. Anormalidades semelhantes foram observadas em todos os animais do grupo CCA-CAGE que receberam 7000 ou 8000 nL e, em menor grau, no grupo 6000 nL e no grupo ECA-CAGE. Notavelmente, enquanto nenhum dos animais dos grupos simulados apresentou qualquer DCN, um rato ECA-sham exibiu uma área de hiperintensidade na ressonância magnética; no grupo CCA-sham, nenhum rato apresentou anormalidades na ressonância magnética.
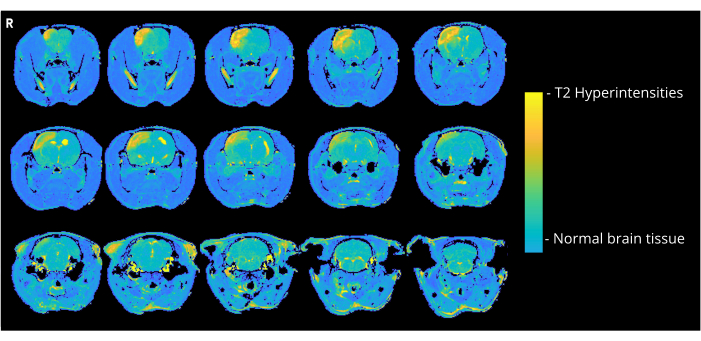
Figura 4: Imagens de exemplo de ressonância magnética. Imagens representativas de ressonância magnética ponderadas em T2 (3 dias após a cirurgia de CAGE) mostrando hiperintensidades corticais devido a CAGE em um rato do grupo CCA-CAGE 7000 nL. Clique aqui para ver uma versão maior desta figura.
Histologia
A Figura 5 mostra uma seção cerebral corada com H & E representativa do rato CCA-CAGE de 7000 nL da Figura 4, demonstrando dano cerebral isquêmico cortical com perda de células neuronais e gliose reativa, incluindo astrogliose reativa e ativação microglial.
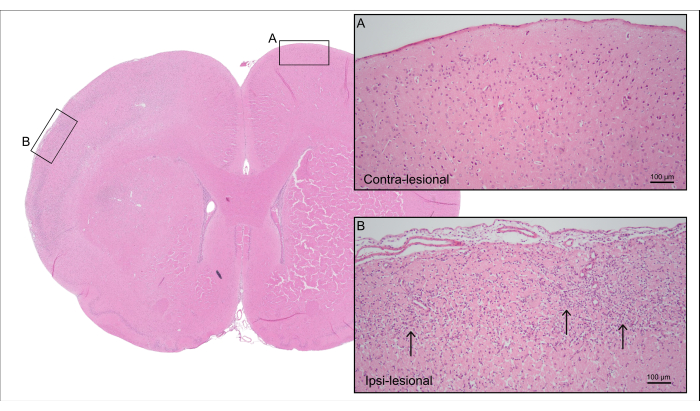
Figura 5: Histologia post-mortem. Coloração H&E representativa do rato da Figura 4 mostrando tecido cortical do lado contralesional com (A) neurônios intactos e (B) o lado ipsi-lesional com tecido cortical isquêmico com perda de células neuronais e gliose reativa (setas). Clique aqui para ver uma versão maior desta figura.
Desafios técnicos
Devido a desafios técnicos, o método de entrada ECA teve uma taxa de sucesso substancialmente menor em comparação com o método de entrada CCA (Tabela 1). Isso resultou predominantemente do curto comprimento do cateter exigido no método de entrada ECA, que frequentemente resultava em luxação e sangramento do cateter. Além disso, o método de entrada ECA também resultou em um tempo cirúrgico aproximadamente 20 minutos maior, bem como uma maior variação no diâmetro da bolha.
Figura suplementar 1: Detalhes do gerador de bolhas de ar. (A) Imagens do corpo do gerador de bolhas e do extrator capilar destacam sua montagem e aspectos funcionais. (B) Vista lateral do gerador de bolhas, mostrando seu design e características estruturais de uma perspectiva lateral. (C) Vista frontal do gerador de bolhas, ilustrando os principais aspectos e características frontais. Clique aqui para baixar este arquivo.
Figura suplementar 2: Etapas para executar o software. Este arquivo fornece um guia detalhado sobre os procedimentos e etapas a serem seguidos para executar e utilizar efetivamente o software associado ao gerador de bolhas de ar. Clique aqui para baixar este arquivo.
Arquivo suplementar 1: código Python. O código consiste nos dois scripts (A e B) que devem ser salvos na mesma pasta. Clique aqui para baixar este arquivo.
Discussão
Descrevemos como introduzir êmbolos aéreos nas artérias cerebrais de ratos usando dois métodos e mostramos que a introdução por meio de uma agulha inserida no CCA tem múltiplas vantagens sobre um método que envolve embolização através de um cateter no ECA. Especificamente, observamos menos complicações com o método de entrada em CCA, bem como um diâmetro de bolha mais consistente e tempo cirúrgico reduzido. O método de entrada CCA resulta em DCN dose-dependente e anormalidades na RNM indicativas de infarto cerebral, conforme confirmado com histologia.
A escolha inicial do método de entrada ECA foi inspirada em Gerriets et al.7. No entanto, identificamos várias dificuldades com essa abordagem, incluindo variações substanciais no tamanho da bolha e uma maior taxa de complicações cirúrgicas em comparação com o método de entrada em CCA. Uma fonte primária dessas complicações está relacionada ao comprimento do cateter. Em nosso modelo, o uso de cateter curto (125 mm) ajudou a manter a estabilidade das bolhas, pois quanto mais longo o cateter, maior a probabilidade de as bolhas se fundirem durante o fluxo através do cateter9. No entanto, no método de entrada ECA, um cateter mais longo facilita a colocação e o aproveitamento do movimento. O uso de um cateter curto no método de entrada de ECA resulta em luxação frequente e deterioração do coto de ECA devido à manipulação excessiva.
Uma segunda dificuldade encontrada no método de entrada ECA dizia respeito à criação de bolhas de tamanho consistente (Figura 6). No método de entrada ECA, o fluxo de solução salina através do cateter deve ser temporariamente interrompido enquanto o cateter é inserido no ECA. Quando o fluxo arterial é restaurado e a embolização pode começar, o cateter é subitamente submetido à pressão arterial do rato. Como resultado, isso leva o sangue a entrar retrógradamente no cateter e no gerador de bolhas. O efeito da pressão arterial flutuante na pressão dentro do gerador de bolhas leva a uma maior variação no tamanho da bolha, às vezes levando a bolhas cilíndricas preenchendo o canal (Figura 6B). Isso pode ser evitado aumentando a pressão dentro do sistema antes de posicionar o cateter no ECA. Isso é melhor feito por uma segunda pessoa para um tempo preciso. Além disso, como esse método é mais demorado, ele leva a uma quantidade maior de solução salina sendo infundida no rato do que o método de entrada CCA. No método de entrada CCA, a solução salina flui continuamente através do cateter e a agulha é inserida na direção do fluxo sanguíneo através do CCA, resolvendo assim o problema do gradiente de pressão descrito acima. Isso resulta na ausência de refluxo para o cateter e em um tamanho de bolha mais uniforme.
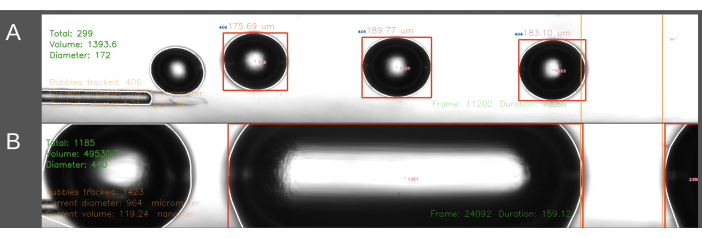
Figura 6: Exemplo de registro e análise da produção de bolhas. As imagens exibem capturas de tela mostrando a análise em tempo real do número total de bolhas, volume total e diâmetro médio na área de medição (verde, canto superior esquerdo). A área de medição é destacada entre as linhas laranja à direita. O diâmetro e o volume da bolha são calculados com base no diâmetro horizontal. As imagens incluem a formação de (A) bolhas de ar geradas com sucesso e (B) bolhas cilíndricas geradas sem sucesso. Clique aqui para ver uma versão maior desta figura.
Apesar do método de entrada CCA ser um dos favoritos, ainda encontramos várias dificuldades técnicas. Em primeiro lugar, a preparação do PPA é desafiadora, uma vez que a compressão acidental do nervo vago pode resultar em depressão da respiração e subsequente morte do animal12. Para reduzir esse risco, deve-se inclinar o rato ligeiramente para o lado e aproximar-se do PPA na direção cranial. Além disso, devido à anatomia desafiadora da bifurcação da ACI e do PPA, existe o risco de dano vascular e sangramento incontrolável. Isso só pode ser contornado melhorando as habilidades cirúrgicas. Esses desafios destacam que o domínio do modelo CAGE em ratos é complexo e requer prática e precisão significativas13.
A configuração técnica proposta do gerador de bolhas de ar tem suas limitações, particularmente relacionadas aos capilares de vidro feitos sob medida, devido à sua fragilidade. A tubulação que conecta o regulador pneumático ao capilar é propensa a quebrar ao ajustar a válvula de três vias para liberação de pressão após a embolização. Além disso, a substituição de um capilar requer a destruição do capilar existente devido à borracha termorretrátil estar permanentemente presa a ele. Além disso, cada capilar tem características únicas de bolha devido a pequenas diferenças no diâmetro e formato da ponta. Por fim, a operação manual da geração de bolhas por meio do regulador pneumático exigia uma experiência significativa. O manuseio inexperiente pode resultar na produção de bolhas excessivamente grandes. A regulação automatizada da pressão com um loop de feedback do código Python pode aumentar a precisão automatizada em estudos futuros.
Nossa documentação completa, abrangendo tanto a especificação técnica do gerador de bolhas, um protocolo cirúrgico detalhado quanto o fornecimento do software, dá uma contribuição importante para esse campo de pesquisa. Nossa técnica de CCA garante uma interrupção mínima da perfusão cerebral fisiológica, mantendo o fluxo de CCA durante todo o procedimento e abolindo a necessidade de sacrificar a ECA. Nosso estudo fornece um modelo experimental confiável e reprodutível para investigar o CAGE e seus possíveis tratamentos.
Divulgações
Nenhum
Agradecimentos
Esta pesquisa foi financiada pela Fundação de Seguro de Saúde Militar da Holanda (Stichting Ziektekosten Verzekering Krijgsmacht) sob o número de concessão 20-0232 e pela Fundação Holandesa do Coração 2021 E. Dekker Grant (03-006-2021-T019 para IAM). Também agradecemos a Lindy Alles, Paul Bloemen e Ed van Bavel por sua excelente assistência.
Materiais
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Referências
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados