Method Article
쥐에서 대뇌 동맥 가스 색전증의 유도
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 쥐에서 대뇌 공기 색전을 유도하는 방법에 대한 자세한 설명을 제공합니다. 그것은 일반적인 경동맥으로 직접 주입하는 것과 외부 경동맥을 통한 도입을 비교합니다. 기포 발생기에 대한 기술적 설명, 다양한 공기량의 영향 및 절차상의 문제를 제공합니다.
초록
우리는 다발성 허혈을 유발하는 대뇌 순환 내 가스 기포를 특징으로 하는 상태인 대뇌 동맥 가스 색전증(CAGE)의 전임상 연구를 위한 방법론적 접근 방식을 제시합니다. 현재 연구에서는 쥐에게 CAGE를 유도하는 두 가지 수술 방법을 설명하고 있는데, 하나는 외부 경동맥(ECA)을 통해 공기를 주입하여 혈관을 희생하는 방법이고, 다른 하나는 총경동맥(CCA)에 직접 주입하는 방법입니다. 수컷 Wistar 쥐를 사용하여 그룹(n=5)으로 나누어 다른 공기 색전 부피(6000, 7000 및 8000nL)를 주입하는 ECA 또는 CCA 진입 방법 또는 가짜 수술을 받았습니다. 맞춤형 기포 발생기를 사용하여 일정한 크기의 가스 색전을 생성하고, 실시간 기포 분석을 위해 오픈 소스 소프트웨어를 개발했습니다. 두 방법을 비교한 결과, CCA 접근법이 버블 발생기 내에서 일관된 기포 생성, 색전술 시간 단축 및 합병증 감소 측면에서 우수한 것으로 나타났습니다.
서문
대뇌 동맥 가스 색전증(CAGE)은 대뇌 동맥 순환 내에 가스 거품이 머무르는 것이 특징이며, 이로 인해 다양한 신경학적 손상이 발생합니다. 이 질환은 주로 다이빙 시 합병증으로 알려져 있으며, 상승 중 폐가 과도하게 팽창하면 기압 외상과 공기가 폐정맥으로 유입된 후 대뇌 동맥으로 흘러 들어가게 됩니다1. 다이빙에서 잘 알려진 이러한 현상 외에도 의료 전문가들은 CAGE를 침습적 의료 절차의 합병증으로 점점 더 많이 인식하고 있습니다. 의인성 공기색전증은 허혈성 뇌졸중 심장 판막 중재술, 흉혈관 내 대동맥 복원술 및 혈관내 혈전제거술을 포함한 개복 및 혈관 내 시술 과정뿐만 아니라 중심 정맥 카테터 및 흉부 배액관의 배치, 취급 또는 제거 과정에서 발생할 수 있습니다 2,3. CAGE의 임상적 중요성에도 불구하고, 특히 동물 모델을 사용한 CAGE에 대한 연구는 여전히 부족하고 단편적이다4.
1977년 Rosengren et al.이 쥐를 대상으로 한 선구적인 연구 이후, CAGE의 동물 모델은 상당한 개선을 거쳤다5. Rosengren이 채택한 접근 방식은 총경동맥(CCA)을 캐뉼레이션하여 총 10μL의 공기를 주입하는 것이었습니다. 이 기법은 동맥 결찰로 인한 혈류역학적 변화, 조절되지 않은 공기 색전의 크기 및 과도한 부피 6 등 한계가 없는 것은 아니었다. 1982년에 기술된 Furlow의 방법은 카테터를 내부 경동맥으로 전진시키고 총 공기량을 5μL로 투여하여 공기 색전술의 정밀도를 향상시켰습니다. 그러나 그 중요성은 초기에 인식되었지만 균일한 버블 크기의 개념은 수십 년 후에야 구현되었습니다. Gerriets 등은 처음에는 160 μm의 균일 한 직경으로 일관된 수의 기포를 생성 할 수 있었고 나중에는 45 μm로 감소했습니다 7,8. 여기에 사용된 수술 방법은 외부 경동맥(ECA)을 희생하는 것이었습니다. 최근 Schaefer 등은 대퇴 동맥을 통해 CCA에 마이크로 카테터를 삽입하여 혈관 내 시술에서 볼 수 있는 공기 색전증 시나리오를 보다 정확하게 모방하는 덜 침습적인 방법을 도입했습니다9. 그들의 방법은 CCA의 동맥 분지(예: ECA 및 익상구개 동맥(PPA))를 결찰하지 않는다는 한계가 있어 기포가 원하는 대뇌 동맥뿐만 아니라 비대뇌 영역으로도 흐를 수 있습니다. 이로 인해 일관되지 않은 뇌 허혈 손상이 발생하여 실험의 재현성을 복잡하게 만들 수 있습니다.
전임상 CAGE 모델의 발전에도 불구하고 기포 생성 기술을 복제하고, 수술 방법을 표준화하고, 일관된 뇌 병변을 확보하는 데는 여전히 과제가 남아 있습니다. 현재 연구에서는 ECA를 희생해야 하는 기존의 수술 방법과 기포를 CCA에 직접 주입하는 대체 방법을 모두 소개합니다. 실시간 버블 분석을 위한 자세한 절차, 과제 및 오픈 소스 소프트웨어를 보고합니다. 또한 버블 생성기를 구축하는 데 필요한 기술적 세부 정보도 포함되어 있습니다.
프로토콜
동물과 관련된 모든 절차는 실험 동물의 사용 및 관리 가이드에 따라 수행되었습니다. 우리는 네덜란드 동물 실험 중앙위원회 (AVD11800202114839)로부터 완전한 승인을 받았습니다. 300 - 350 g의 체중 범위를 가진 수컷 Wistar 쥐가 사용되었습니다. 동물들은 음식과 물과 함께 쌍을 이루어 수용되었으며 12시간의 명암 주기가 있었습니다. 도착하자마자 동물들은 실험 절차가 시작되기 전에 7일의 순응 기간을 거쳤습니다.
참고: ECA 진입 방법과 CCA 진입 방법의 두 가지 수술 방법을 사용했습니다. 두 기술 모두 통계 분석 도구를 사용하여 쥐를 Vehicle 또는 8000 nL CAGE 그룹으로 무작위 배정했습니다. 차량 치료에는 식염수 주사만 포함되었습니다. 케이지 처리는 식염수 내 기포를 8000nL 부피로 사용했으며, 각 기포의 목표 직경은 160μm였습니다. 이 시리즈가 완료된 후 6000nL 및 7000nL(둘 다 160μm 기포 직경)의 모델에 대한 추가 개선은 CCA 입력 방법을 통해서만 수행되었습니다. 절차적 실패의 경우, n=5의 최종 그룹 크기를 얻기 위해 교체 랫드를 추가했습니다.
1. 기포 발생기
알림: 기포 발생기(그림 1, 그림 2 및 보충 그림 1A-C)는 동일한 크기의 가스 기포를 생성하고 감지하는 여러 맞춤형 구성 요소로 구성됩니다.
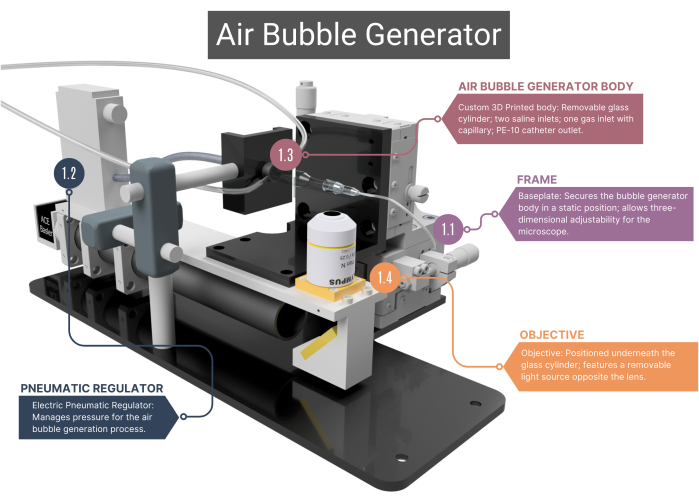
그림 1: 기포 발생기 개요. 버블 발생기는 지지 프레임(1.1)과 공기 흐름 관리를 위한 공압 조절기(1.2)로 구성됩니다. 여기에는 대물렌즈 및 고속 카메라(1.4)에 연결된 유리 모세관(1.3)이 있는 3D 프린팅 본체가 포함됩니다. 자세한 이미지는 보충 그림 1A-C 를 참조하십시오. 숫자는 본문의 방법론적 단계에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 프레임
- 버블 제너레이터 본체의 정적 위치를 보장하는 맞춤형 스테인리스 스틸 베이스 플레이트가 있는 프레임을 사용하고, 그 아래에 배치된 현미경 대물렌즈는 3차원으로 이동할 수 있습니다. 이 조정 기능은 시야를 변경하고 마이크로 채널 및 기포의 팁에 초점을 맞출 수 있는 XYZ 어셈블리에 의해 촉진됩니다.
- 공압 레귤레이터
- 압축 공기 공급의 경우 압력 범위가 0.001 - 0.1MPa인 전기 공압 조절기를 사용하십시오. 레귤레이터가 열 수축 슬리브로 공기 밀봉된 정맥(IV) 튜브를 통해 유리 모세관에 연결되어 있는지 확인합니다. 레귤레이터의 전압을 변경하여 압력을 조절합니다.
- 기포 발생기 본체
알림: 버블 발생기의 본체는 유리 챔버, 플라스틱 내부 하우징 및 유리 모세관으로 구성됩니다. 신체의 모든 구성 요소는 밀폐되어 공기나 식염수가 누출되지 않도록 해야 합니다.- 맞춤형 원통형 유리 챔버의 내경(ID)이 1000μm이고 ID가 400μm인 마이크로 채널로 병합되는지 확인합니다. 이 원통형 마이크로채널의 상단을 평평하게 하여 대물렌즈를 통해 최적의 시야를 확보합니다.
- 팁을 제거한 상태에서 유리 실린더의 바깥쪽 끝을 21G 바늘에 맞춥니다. 이 바늘 안에 두 번째 바늘 (27G, ID 210 μm)을 붙입니다. 이 작은 직경의 바늘을 마이크로 채널에 끼우고 폴리에틸렌(PE-10) 카테터(ID 280μm, 길이 125mm)에 부착합니다.
- 두 개의 스테인리스 스틸 입구가 있는 유리 챔버 뒷면에 플라스틱 몸체를 끼웁니다. 여기에, 식염수 유입을 위한 IV 튜브를 부착할 수 있습니다. 이 본체의 후면에는 O-링 고무로 배치되고 캡을 조여 제자리에 고정되는 맞춤형 유리 모세관을 통한 가스 흡입구가 있습니다.
- CCA 진입 방법의 경우 플라스틱 Luer-lock 하우징을 제거한 상태에서 카테터 끝을 바늘(30G, ID 159μm)에 부착하고 45° 각도로 조심스럽게 구부립니다.
- 현미경 조정
- 버블 제너레이터 본체 아래에 대물렌즈(4x)를 배치하고 고속 카메라에 연결합니다. 렌즈 반대편에 조정 가능한 LED 광원을 배치합니다.
- 각 실험을 시작하기 전에 대물 렌즈가 깨끗한지 확인하십시오. 먼지로 인해 잘못된 버블 해석이 발생합니다.
- 유리 모세관의 생성
참고: 모세혈관을 만드는 과정에는 상당한 양의 미세 조정이 필요합니다. 제공된 설정이 기준선으로 사용되지만 원하는 버블 지름을 얻기 위해 조정이 필요할 수 있습니다.- 마이크로 피펫 풀러를 사용하여 유리 모세관을 만듭니다(보충 그림 1A-C). 피펫을 만들려면 마이크로피펫 풀러 히터를 설정하십시오: 왼쪽 히터(1번)를 조정 = 70으로, 오른쪽 히터(2번)를 조정 = 980으로 설정합니다.
- 유리 모세관을 풀러에 넣고 100g 무게의 두 블록을 추가하여 당기는 과정 후에 올바른 모양을 확인합니다. 시작을 누릅니다. 당기는 과정이 완료되면 두 개의 모세관이 형성됩니다.
- 명시야 현미경을 사용하여 끝에서 대각선으로 각 모세관을 절단하거나 끊습니다. 팁의 모양과 직경은 가스 기포의 직경에 영향을 미치기 때문에 매우 중요합니다. 실험 전반에 걸쳐 기포 크기의 일관성을 보장하려면 원하는 기포 직경에 대해 동일한 모세관을 사용하십시오.
- 유리 모세관 팁을 기포 발생기 본체의 원통형 채널(ID 400μm)에 삽입합니다.
- 마이크로버블 발생기 설정
- 버블 발생기를 멸균 식염수(50mL)가 있는 주사기 펌프에 연결하고 20mL/h로 연속 흐름을 시작합니다. 시스템에 공기가 갇히지 않았는지 확인하십시오. 공기가 시스템에 갇힌 경우 공기가 카테터를 통해 빠져나갈 수 있도록 기포 발생기를 수직으로 잡으십시오.
- 광원, 카메라 및 소프트웨어를 켭니다.
- 시스템이 올바른 압력에 도달하면(약 2분 후) 시스템에 가스 또는 유체 누출이 있는지 확인하십시오.
- 기포를 만들려면 2.1V부터 시작하여 가스가 유리 모세관을 채울 때까지 전압을 높여 천천히 압력을 높입니다. 시간이 좀 걸릴 수 있지만 이 부분을 서두르지 않는 것이 중요합니다. 유리 모세관의 압력이 채널의 압력과 같을 때 기포 생성이 시작될 수 있습니다. 전압을 최대 2.6V까지 높이기만 하면 기포가 생성됩니다.
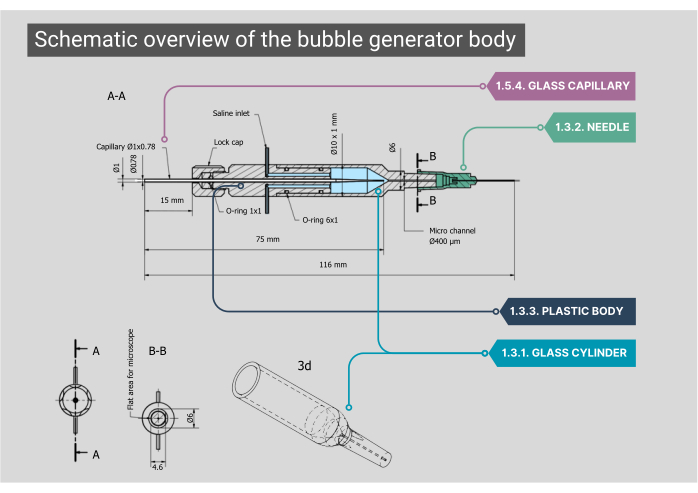
그림 2: 버블 생성기 본체의 개략도. 버블 생성기 본체의 자세한 청사진으로, 각 구성 요소에 대한 치수 및 주석이 포함되어 있습니다. 숫자는 본문의 방법론적 단계에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 가스 기포 감지 및 분석
참고: Python 코드(보충 파일 1)는 각 가스 버블의 수, 직경 및 부피를 실시간으로 추적하고 계산하도록 설계되었습니다. 가스 기포가 생성되는 동안 코드는 시야를 통해 이동할 때 감지된 각 기포를 처리합니다. 이 데이터는 기포 수, 누적 공기량, 평균 기포 직경 및 총 기록 기간으로 지속적으로 표시됩니다. 모든 녹화 후 데이터는 스프레드시트 및 .mp4 비디오 파일로 내보내집니다.
- 카메라 설정(보충 그림 2)
- 마이크로버블 발생기가 올바르게 설정되면 Pylon Viewer에서 카메라를 켭니다. 올바른 게인과 임계값을 선택합니다.
- 버블 생성기의 X축과 Y축을 이동하여 올바른 관심 영역을 찾고 Z축을 이동하여 선명도를 향상시킵니다.
- 프레임 속도(171fps)를 최적화하려면 카메라를 2480 x 400픽셀(너비 x 높이)로 설정합니다. 카메라 설정이 완료되면 Pylon 뷰어에서 카메라를 끄십시오.
- 실시간 버블 분석(보충 그림 2)
- 실험을 시작하기 전에 가스 거품을 생성하는 동안 스크립트의 테스트 실행을 수행합니다. 녹음을 확인하고 필요한 경우 임계값과 게인을 조정합니다.
- 거품 분석을 시작하려면 Python 코드를 실행합니다. 코드는 라이브 비디오, 버블 수, 직경 및 볼륨을 자동으로 표시합니다.
3. 케이지 수술
- 수술 준비
- 쥐 아래에 멸균 천으로 수술 부위를 준비하고 두 번째 멸균 천에 모든 수술 기구와 봉합사를 놓습니다. 필요한 약을 준비하십시오.
- 피드백 시스템이 있는 가열 패드가 37°C로 설정되어 있는지 확인하십시오. 현미경을 올바른 높이로 조정하십시오.
- 집 새장에서 쥐를 꺼내고 마취를 준비하십시오.
- 마취 및 수술 전 관리
- 수술 30분 전에 0.05mg/kg 부프레노르핀을 피하투여합니다.
- 유도 챔버에서 4% 이소플루란과 1L/min 공기 혼합물(30% 산소 및 70% 공기)을 사용하여 쥐를 마취합니다. 완전히 마취되면 쥐의 무게를 측정하고 전기 면도기를 사용하여 수술 목 부위를 면도합니다.
- 쥐를 수술대로 옮기고 이소플루란을 안면 마스크로 전환하여 70%/30% 공기 혼합에서 2%-2.5% 이소플루란으로 마취를 유지합니다.
- 건조를 방지하기 위해 눈에 인공 눈물을 바르십시오. 온도 프로브에 윤활유를 바르고 직장에 삽입합니다.
- 쥐를 누운 자세로 놓고 수술 부위에 쉽게 접근할 수 있도록 목 아래에 10mL 주사기를 놓습니다.
- 테이프를 사용하여 앞발을 수술대에 고정합니다. 요오드 또는 클로르헥시딘 기반 스크럽과 알코올로 수술 부위를 원을 그리며 여러 번 소독하여 무균 상태를 보장합니다. 발가락 꼬집음으로 마취 깊이를 확인합니다.
- 베기
- 메스로 흉골 노치에서 하악 아래(약 1.5cm)까지 정중선을 절개합니다.
- 핀셋 두 개를 사용하여 결합 조직(표재성 경추 근막)을 절개하여 밑에 있는 근육을 노출시킵니다.
- 왼쪽과 오른쪽 흉골 근육 사이에 있는 결합 조직을 부드럽게 찢어 분리합니다.
- 아래에 있는 다음 근육을 식별하고 수축시킵니다: 오른쪽 흉골유방근(조직 후크를 사용하여 측면으로 수축) 및 오른쪽 오모히이드근(조직 후크 꼬리-내측을 사용하여 수축). 오른쪽 경동맥 삼각형(CCA, ECA, 내부 경동맥(ICA))이 보여야 합니다.
- CCA의 외과적 준비
- 위에 있는 근막과 지방 조직을 제거하여 CCA를 준비합니다. 신경을 손상시키지 않고 CCA를 미주신경에서 조심스럽게 분리하십시오. 신경이나 가지를 잡거나 꼬집지 마십시오. CCA에서 부드럽게 밀어내기만 하면 됩니다. 혈관을 준비하는 동안 기관을 만지거나 누르지 마십시오.
- 곡선형 핀셋을 사용하여 CCA 주위에 3-0 봉합사를 놓고 지혈기로 실을 고정합니다. 이것은 나중에 CCA를 향상시키는 데 도움이 될 것입니다.
- ECA, ICA 및 그 분지의 임시 결찰
- ECA와 ICA 분기점을 찾아 표시합니다. 필요한 경우 주변 근막과 지방 조직을 청소합니다. 3-0 봉합사로 ECA를 임시로 합자합니다.
- 후두 동맥(OA, 주로 ICA에서 분기, ICA와 ECA 기원의 Y자형 분기점 사이의 중간에 있음)과 상갑상선 동맥(ECA의 내측에서 분기)을 찾습니다. 이 작은 가지는 쉽게 파열됩니다. 인근에서 3-0 봉합사로 골관절염을 임시로 접합합니다.
- ICA를 따라 원위부로 이동한 다음 가지는 익상구개동맥(PPA)입니다. 주변의 근막과 지방 조직을 청소하면서 미주 신경이 손상되지 않도록 각별히 주의합니다. 3-0 봉합사로 PPA를 임시로 합자합니다.
알림: 두개골 방향에서 PPA에 접근하는 것이 좋습니다. 쥐를 약간 옆으로 기울이면 수술 중에 더 쉽게 접근하고 시각화할 수 있습니다.
- ECA 입력 방법(그림 3A)
- 다음과 같이 동맥을 접합합니다: 3.4.2단계의 봉합사를 사용합니다. CCA를 부드럽고 일시적으로 결찰하여 흐름을 중단시키지만 혈전성 혈전 생성 위험을 최소화합니다. 그런 다음 3-0 봉합사 또는 혈관 클립을 사용하여 ICA 및 골관절염을 임시로 접합합니다.
- ECA 주위에 두 개의 봉합사를 적용합니다: 하나는 근위부, 다른 하나는 원위부입니다. 원위 봉합사에 상갑상선 동맥이 포함되어 있고 혈류를 영구적으로 중단할 수 있도록 조여져 있는지 확인하고, 근위 봉합사는 추가 사용 시 느슨하게 묶여 있는지 확인합니다.
- 혈관 가위를 사용하여 ECA의 두 봉합사 사이에 동맥 절개술을 만듭니다. 이 단계에서는 출혈이 없어야 합니다.
- 팁이 CCA의 분기점에 도달할 때까지 기포 발생기에서 공기가 제거된 카테터를 삽입합니다. 근위 봉합사를 조인 다음 동맥 절개술 부위의 원위부에 ECA를 접합하고 절제합니다.
- CCA 및 ICA의 결찰을 풀어 혈류를 회복시키는 동시에 버블 발생기를 통해 카테터로 식염수의 흐름을 시작합니다(단계 1.6.3.). 카테터 배치의 안정성과 혈액 또는 식염수 누출이 없는지 확인합니다. 카테터가 삽입된 ECA 그루터기를 시계 반대 방향으로 약 90° 회전하여 카테터의 흐름이 ICA 방향으로 흐르도록 합니다.
- 색전술 과정을 시작합니다. Python 코드를 시작하고 1.6.4단계에 설명된 대로 기포 만들기를 시작합니다.
- 색전술이 완료된 후 ICA 봉합사/혈관 클램프를 조여 혈류를 일시적으로 멈춥니다.
- 카테터를 조심스럽게 제거하고 기존 봉합사를 단단히 묶어 ECA의 근위부 끝을 영구적으로 닫습니다.
- 3-0 봉합사 및/또는 cl을 부드럽게 제거합니다.amp 재관류를 허용하기 위해 PPA, OA, ICA 및 CCA에서 제거합니다. 수술 부위 주변에 남아 있는 혈액을 청소합니다.
- CCA 입력 방법(그림 3B)
- 3.5.3 단계 후에 계속하십시오. 분기점에 가까운 상갑상선 가지에서 근위부에 있는 ECA를 임시로 결찰합니다.
- 기포 발생기를 통해 카테터로 식염수 실행을 시작하지만 아직 기포 생성을 시작하지 않습니다.
- 3.4.2단계의 지혈기를 사용하여 CCA를 부드럽게 들어 올립니다. 그리고 버블 제너레이터의 카테터에 부착된 바늘을 흐름 방향으로 CCA의 내강에 삽입하는 것을 진행한다. 바늘 구멍이 위쪽을 향하고 바늘이 CCA의 반대쪽 혈관 벽을 통해 구멍이 나지 않는지 확인합니다.
- 삽입 후 지혈과 동반 CCA를 천천히 내려 CCA가 재관류될 수 있도록 합니다. 삽입 부위 주변에 혈액이나 식염수가 누출되지 않았는지 확인하십시오.
- 1.6.4단계에 설명된 대로 Python 코드를 시작하고 기포를 만들어 색전술 프로세스를 시작합니다.
- 색전술이 완료된 후 CCA를 다시 올리고 바늘을 조심스럽게 집어넣습니다. 출혈을 멈추기 위해 CCA의 고도를 유지하면서 면 끝으로 삽입 부위에 압력을 가합니다.
- 펑크 부위에 계속 압력을 가하십시오. CCA를 따라 말단 방향으로 면 팁을 굴려 부드럽게 제거하되 최소한의 압력으로 혈전이 방해받지 않고 제자리에 유지되도록 합니다. 지혈이 이루어지는 데 30초에서 5분 정도 걸릴 수 있습니다.
참고: 암컷 쥐의 경우 펑크 부위를 닫는 데 수컷 쥐보다 몇 분 더 걸릴 수 있습니다. - 재관류를 허용하기 위해 ECA, ICA 및 CCA에서 3-0 봉합사를 조심스럽게 회수합니다. 다시 한 번, 출혈이 영구적으로 멈췄는지 확인하고 필요한 경우 수술 부위 주변에 남아 있는 혈액을 청소합니다.
- 봉합 및 수술 후 관리
- 봉합을 용이하게 하기 위해 목의 피하 조직에서 피부를 분리합니다. 구부러진 바늘과 4-0 봉합사로 피부를 봉합합니다.
- 절개 부위 주변에 피하 부피바카인 2.5 mg/mL (0.01 - 0.02 mL/kg)를 투여합니다.
- 동물을 회복 케이지 (33-35 ° C)로 30-120 분 동안 조심스럽게 옮깁니다. 회복 기간 동안, 동물은 흉골 누운 자세를 유지할 수 있을 만큼 충분한 의식을 회복할 때까지 방치되지 않습니다. 동물이 완전히 회복되면 집 우리로 다시 옮깁니다. 젖은 차우를 케이지 내부의 손이 닿기 쉬운 곳에 두십시오.
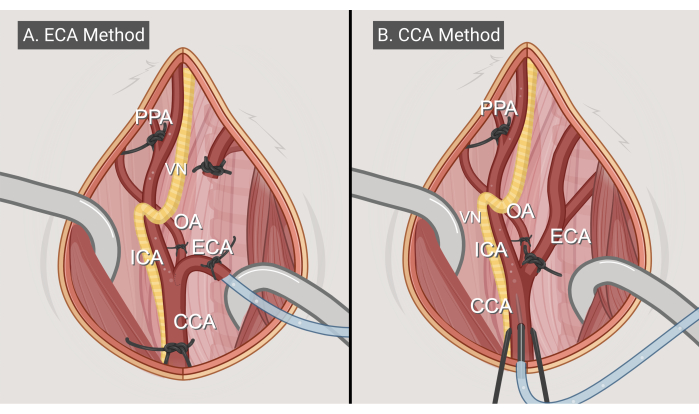
그림 3: 수술 방법. 두 가지 수술 접근법, (A) ECA 진입 방법 및 (B) CCA 진입 방법의 그림. 약어: CCA = 총경동맥; ECA = 외부 경동맥; ICA = 내부 경동맥; OA = 후두 동맥; PPA = 익상구개; VN = 미주신경. BioRender.com 로 만든 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 후속 조치
- 모니터링 및 인간적 엔드포인트
- 수술 후 7일 동안 동물을 모니터링합니다. 수술 당일 종료 시 0.05mg/kg의 피하 부프레노르핀을 투여하고 다음 날 아침에 다시 수술 후 진통제를 제공합니다. 매일 동물을 계속 모니터링하고 통증이나 고통에 대한 임상적 평가에 따라 필요에 따라 추가 진통제를 투여합니다. 유럽 의회의 지침 2010/63/EU에 따라 인도적인 종점에 도달하면 쥐를 더 일찍 안락사시킵니다.
- 임상적 신경학적 결손
- 수술 후 며칠(예: 1일, 3일, 7일)에 임상적 신경학적 결손(CND)을 평가합니다. CND에 대한 우리의 정의에는 왼쪽 앞다리 굴곡 감소(예: 쥐를 들어올리는 동안 앞다리 신전 억제), 똑바로 걸을 수 없는 상태 또는 Bederson 점수10과 유사한 빙빙 도는 동작이 포함됩니다. 표준화된 신경학적 점수 또는 테스트를 사용하여 운동 기능과 신경학적 상태를 평가합니다.
- 자기공명영상(MRI)
- 0.5 L/min 의료용 공기와 0.5 L/min 산소의 혼합물에서 1.2% - 2.5% 이소플루란으로 마취된 쥐와 함께 7 T 소동물 MRI 시스템에서 수술 후 자기 공명 영상(MRI)을 수행합니다(예: 1, 3, 5, 7일). 호흡과 온도를 지속적으로 모니터링하십시오.
- 반복 시간 2500ms, 에코 시간 9ms, 에코 간격 9ms 및 10 에코 시퀀스 매개변수를 사용하여 T2 가중치 스캔을 얻습니다. 시야각을 35 x 35mm로 설정하고 획득 매트릭스를 128 x 128mm로 설정합니다. 슬라이스 두께는 1.1mm이며 총 15개의 슬라이스가 획득되었으며 종횡비는 1.00을 유지하고 단일 동적 획득을 사용합니다.
- 조직학적 분석
- 7일 째 MRI 완료 후(또는 실험 종말점에 도달했을 때) 0.1M 인산염 완충 식염수 30mL와 파라포름알데히드 4% 30mL를 함께 심장 관류하여 안락사를 위해 쥐를 마취 상태로 유지합니다.
- 뇌를 추출하여 4% 파라포름알데히드에 하룻밤 동안 고정시킵니다. 24시간 고정 기간 후, 뇌에 파라핀을 삽입하고, 관상 절편을 절편화하고, 표준 방법11을 사용하여 헤마톡실린과 에오신(H&E)으로 염색합니다.
결과
신경학적 결과
표 1 은 서로 다른 실험 그룹에 걸친 모든 포함 및 제외에 대한 개요를 제공합니다. 가짜 수술을 받은 쥐 중 어느 누구도 CND를 보이지 않았습니다. ECA-CAGE 그룹(8000nL)에서 5마리 중 2마리는 CND를 나타내지 않은 반면, 나머지 3마리의 쥐는 CND를 경험했으며 그 중 2마리는 24시간 이내에 사망했습니다. CCA-CAGE 그룹(8000nL)에서 모든 동물이 CND를 보였으며 5마리 중 3마리는 최대 48시간까지 생존하지 못했습니다. 공기량이 적은 CCA-CAGE 그룹에서는 모든 쥐가 수술 후 생존했습니다. 7000 nL 그룹의 쥐 5마리 모두 CND를 보인 반면, 6000 nL 그룹의 쥐 5마리 중 2마리는 CND를 보였다.
| 증권 시세 표시기 | CCA는 | |||||||
| 가짜 | 8000 nL | 가짜 | 8000 nL | 7000 nL | 6000 nL | |||
| 포함 | 5 | 5 | 5 | 5 | 5 | 5 | ||
| 임상적 신경학적 결손을 보임 | 0 | 3 | 0 | 5 | 5 | 2 | ||
| 사망률 < 24시간 | 0 | 2 | 0 | 2 | 0 | 0 | ||
| 사망률 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| 제외된 합계 | 3 | 4 | 1 | 0 | 2 | 1 | ||
| 출혈 합병증으로 인한 제외 | 2 | 3 | 0 | 0 | 0 | 0 | ||
| 혈전성 합병증으로 인한 제외 | 0 | 1 | 0 | 0 | 0 | 1 | ||
| 미주신경 압박으로 인한 수술 중 사망 | 1 | 0 | 1 | 0 | 2 | 0 | ||
표 1: 동물 그룹 포함 및 제외. 각 그룹의 쥐 수, 포함 및 제외, 사망 및 임상 신경학적 결손이 있는 생존.
MRI 촬영
그림 4는 CCA 진입 방법을 통해 7000nL 기포를 받은 쥐의 대표적인 T2 가중치 이미지를 보여주며, 피질 고강도를 보여줍니다. 7000 또는 8000 nL을 투여받은 CCA-CAGE 그룹의 모든 동물에서 유사한 이상이 관찰되었으며, 6000 nL 그룹과 ECA-CAGE 그룹에서는 그 정도가 덜했습니다. 특히, 가짜 그룹의 동물 중 어느 동물도 CND를 보이지 않았지만 ECA 가짜 쥐 한 마리는 MRI에서 과강도 영역을 보였습니다. CCA-sham 그룹에서는 MRI에서 이상을 보인 쥐가 없었다.
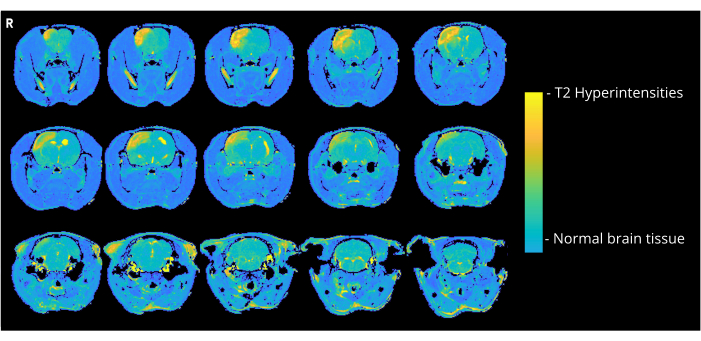
그림 4: MRI 예시 이미지. 대표적인 T2 가중 MRI 영상(CAGE 수술 후 3일)은 CCA-CAGE 7000 nL 그룹의 쥐에서 CAGE로 인한 대뇌피질 고강도를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
조직학
그림 5는 그림 4의 7000 nL CCA-CAGE 랫트의 대표적인 H&E 염색 뇌 단면을 보여주며, 반응성 성상아교세포 및 미세아교세포 활성화를 포함한 신경 세포 손실 및 반응성 신경교세포증을 동반한 피질 허혈성 뇌 손상을 보여줍니다.
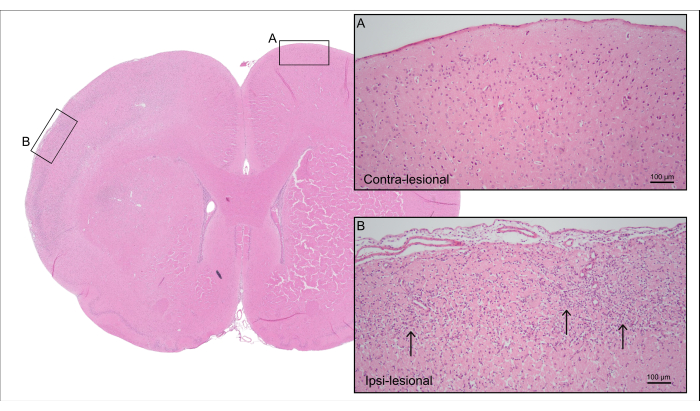
그림 5: 사후 조직학. 그림 4 의 쥐를 염색한 대표적인 H&E 염색은 (A) 온전한 뉴런이 있는 반대 병변 쪽의 피질 조직과 (B) 신경 세포 손실 및 반응성 신경교세포증(화살표)이 있는 허혈성 피질 조직이 있는 동파 병변 쪽을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
기술적 과제
기술적 문제로 인해 ECA 입력 방법은 CCA 입력 방법에 비해 성공률이 상당히 낮았습니다(표 1). 이는 주로 ECA 진입 방법에 필요한 카테터 길이가 짧기 때문에 발생했으며, 이로 인해 카테터 탈구와 출혈이 자주 발생했습니다. 또한 ECA 진입 방법은 수술 시간이 약 20분 더 길어지고 기포 직경의 편차가 더 커졌습니다.
보충 그림 1: 기포 발전기의 세부사항. (A) 버블 제너레이터와 모세관 풀러의 본체 이미지는 조립 및 기능적 측면을 강조합니다. (B) 버블 생성기의 측면도, 측면 관점에서 설계 및 구조적 특징을 보여줍니다. (C) 버블 생성기의 정면도, 주요 정면 측면 및 기능을 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 소프트웨어 실행 단계. 이 파일은 기포 발생기와 관련된 소프트웨어를 효과적으로 실행하고 활용하기 위해 따라야 할 절차 및 단계에 대한 자세한 가이드를 제공합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1 : 파이썬 코드. 코드는 동일한 폴더 내에 저장해야 하는 두 개의 스크립트(A와 B)로 구성됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
우리는 두 가지 방법을 사용하여 쥐의 대뇌 동맥에 공기 색전을 도입하는 방법을 설명했으며, CCA에 삽입된 바늘을 통해 공기 색전을 도입하는 것이 카테터를 통해 ECA로 색전술을 포함하는 방법에 비해 여러 가지 이점이 있음을 보여주었습니다. 구체적으로 CCA 진입 방법에서 합병증이 적고 기포 직경이 더 일관되고 수술 시간이 단축되는 것을 관찰했습니다. CCA 진입 방법은 용량 의존적 CND를 초래하며, MRI에서 이상은 조직학적으로 확인된 바와 같이 뇌경색을 나타냅니다.
ECA 입력 방법의 초기 선택은 Gerriets et al.7에서 영감을 받았습니다. 그러나 이 접근법에서는 기포 크기의 상당한 변화와 CCA 진입 방법에 비해 더 높은 수술 합병증 발생률을 포함하여 몇 가지 어려움을 확인했습니다. 이러한 합병증의 주요 원인은 카테터 길이와 관련이 있습니다. 본 모델에서는 짧은 카테터(125mm)를 사용하면 카테터가 길수록 카테터를 통해 흐르는 동안 기포가 병합될 확률이 높아지기 때문에 기포의 안정성을 유지하는 데 도움이 되었습니다9. 그러나 ECA 진입 방법에서는 카테터가 길수록 카테터를 더 쉽게 배치하고 움직임을 지렛대 삼을 수 있습니다. ECA 진입 방법에서 짧은 카테터를 사용하면 과도한 조작으로 인해 ECA 그루터기가 자주 탈구되고 악화됩니다.
ECA 진입 방법에서 직면한 두 번째 어려움은 일관된 크기의 기포를 생성하는 것이었습니다(그림 6). ECA 진입 방법에서는 카테터가 ECA에 삽입되는 동안 카테터를 통한 식염수의 흐름을 일시적으로 중단해야 합니다. 동맥 흐름이 회복되고 색전술이 시작될 수 있게 되면, 카테터는 갑자기 쥐의 혈압에 영향을 받습니다. 그 결과, 이로 인해 혈액이 카테터와 버블 생성기로 역행적으로 유입됩니다. 기포 발생기 내부의 압력에 대한 변동하는 혈압의 영향으로 기포 크기가 더 많이 변하고 때로는 원통형 기포가 채널을 채우게 됩니다(그림 6B). 이는 ECA에 카테터를 배치하기 전에 시스템 내의 압력을 높이면 피할 수 있습니다. 이것은 정확한 타이밍을 위해 두 번째 사람이 수행하는 것이 가장 좋습니다. 더욱이, 이 방법은 시간이 더 많이 걸리기 때문에 CCA 진입 방법보다 쥐에 더 많은 양의 식염수가 주입됩니다. CCA 진입 방법에서는 식염수가 카테터를 통해 지속적으로 흐르고 CCA를 통한 혈류 방향으로 바늘을 삽입하여 위에서 설명한 압력 구배 문제를 해결합니다. 그 결과 카테터로의 역류가 없고 기포 크기가 더 균일해집니다.
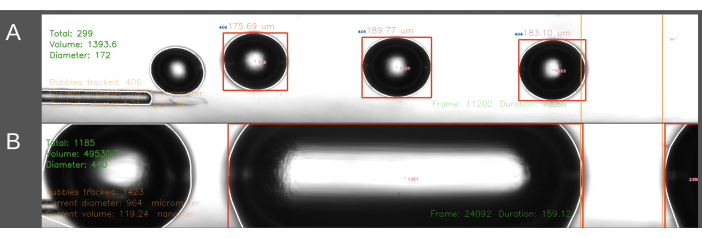
그림 6: 기포 생성의 기록 및 분석 예. 이미지는 측정 영역(녹색, 왼쪽 상단 모서리)에서 총 기포 수, 총 부피 및 평균 직경에 대한 실시간 분석을 보여주는 화면 캡처를 표시합니다. 측정 영역은 오른쪽의 주황색 선 사이에 강조 표시됩니다. 버블 지름과 부피는 수평 지름을 기준으로 계산됩니다. 이미지에는 (A) 성공적으로 생성된 기포 및 (B) 성공적으로 생성된 원통형 기포의 형성이 포함됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CCA 진입 방식이 가장 선호되었음에도 불구하고 여전히 여러 가지 기술적 어려움에 직면했습니다. 첫째, PPA의 준비는 미주신경의 우발적인 압박으로 인해 호흡 곤란이 일어나고 동물이 사망할 수 있기 때문에 어렵습니다12. 이 위험을 줄이려면 쥐를 약간 옆으로 기울이고 두개골 방향에서 PPA에 접근해야 합니다. 또한 ICA와 PPA 분기점의 까다로운 해부학적 구조로 인해 혈관 손상 및 제어할 수 없는 출혈의 위험이 있습니다. 이것은 수술 기술을 향상시킴으로써만 우회할 수 있습니다. 이러한 과제는 쥐에서 CAGE 모델을 마스터하는 것이 복잡하고 상당한 연습과 정밀도가 필요하다는 점을 강조합니다13.
기포 발생기의 제안된 기술 설정은 취약성으로 인해 특히 맞춤형 유리 모세관과 관련된 한계가 있습니다. 공압 조절기를 모세관에 연결하는 튜브는 색전술 후 압력 해제를 위해 3방향 밸브를 조정할 때 파손되기 쉽습니다. 또한 모세관을 교체하려면 열수축 고무가 영구적으로 부착되어 있기 때문에 기존 모세관을 파괴해야 합니다. 또한 각 모세관은 팁 직경과 모양의 사소한 차이로 인해 고유한 기포 특성을 가지고 있습니다. 마지막으로, 공압 레귤레이터를 통한 기포 생성의 수동 작동에는 상당한 경험이 필요했습니다. 경험이 부족한 취급으로 인해 과도하게 큰 기포가 생성될 수 있습니다. Python 코드의 피드백 루프를 사용한 자동화된 압력 조절은 향후 연구에서 자동화된 정밀도를 향상시킬 수 있습니다.
버블 제너레이터의 기술 사양, 상세한 수술 프로토콜 및 소프트웨어 제공을 모두 포함하는 당사의 철저한 문서화는 이 연구 분야에 중요한 기여를 합니다. 당사의 CCA 기법은 시술 전반에 걸쳐 CCA 흐름을 유지하고 ECA를 희생할 필요성을 없애 생리학적 대뇌 관류에 대한 중단을 최소화합니다. 본 연구는 CAGE와 그 잠재적 치료법을 조사하기 위한 신뢰할 수 있고 재현 가능한 실험 모델을 제공합니다.
공개
없음
감사의 말
이 연구는 보조금 번호 20-0232에 따라 네덜란드 군 의료 보험 재단(Stichting Ziektekosten Verzekering Krijgsmacht)과 네덜란드 심장 재단 2021 E. Dekker 보조금(03-006-2021-T019 IAM으로)의 자금 지원을 받았습니다. 또한 Lindy Alles, Paul Bloemen 및 Ed van Bavel의 탁월한 도움에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
참고문헌
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유