Method Article
Sıçanlarda Serebral Arteriyel Gaz Embolisi İndüksiyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, sıçanlarda serebral hava embolisinin indüklenmesinin ayrıntılı bir tanımını sağlar. Ortak karotis artere doğrudan enjeksiyon ile dış karotis arterden girişi karşılaştırır. Hava kabarcığı üretecinin teknik bir açıklamasını, farklı hava hacimlerinin etkisini ve prosedürel zorlukları sağlar.
Özet
Serebral dolaşım içinde multifokal iskemiye neden olan gaz kabarcıkları ile karakterize bir durum olan serebral arteriyel gaz embolisinin (CAGE) klinik öncesi araştırması için metodolojik bir yaklaşım sunuyoruz. Mevcut çalışma, sıçanlarda CAGE'yi indüklemek için iki cerrahi yöntemi tanımlamaktadır: biri dış karotis arter (ECA) yoluyla hava enjeksiyonu ile damarı feda etmek ve diğeri ortak karotis artere (CCA) doğrudan enjeksiyon yoluyla. Erkek Wistar sıçanları, farklı hava emboli hacimlerinin enjeksiyonu (6000, 7000 ve 8000 nL) veya sahte cerrahi ile ECA veya CCA giriş yöntemine tabi tutulmak üzere kullanıldı ve gruplara (n = 5) ayrıldı. Tutarlı boyutta gaz embolisi üretmek için özel yapım bir kabarcık üreteci kullanıldı ve gerçek zamanlı kabarcık analizi için açık kaynaklı yazılım geliştirildi. İki yöntem arasındaki karşılaştırma, CCA yaklaşımının kabarcık jeneratörü içinde tutarlı kabarcık üretimi, azaltılmış embolizasyon süresi ve daha az komplikasyon açısından üstün olduğunu ortaya koymuştur.
Giriş
Serebral arteriyel gaz embolisi (CAGE), serebral arteriyel dolaşım içinde gaz kabarcıklarının yerleşmesi ile karakterize edilir ve bir dizi nörolojik bozukluğa yol açar. Bu durum ağırlıklı olarak dalışta bir komplikasyon olarak bilinir, burada yükseliş sırasında akciğerlerin aşırı genişlemesi barotravma ve pulmoner venlere hava girişi ile sonuçlanır ve bu daha sonra serebral arterlere akar1. Dalışta bu iyi bilinen olaya ek olarak, tıp uzmanları CAGE'i invaziv tıbbi prosedürlerin bir komplikasyonu olarak giderek daha fazla kabul etmektedir. İyatrojenik hava embolisi, merkezi venöz kateterlerin ve göğüs drenlerinin yerleştirilmesi, taşınması veya çıkarılması sırasında ve ayrıca kalp kapakçığı girişimleri, torasik endovasküler aort onarımları ve iskemik inmede endovasküler trombektomi dahil olmak üzere açık ve endovasküler prosedürler boyunca ortaya çıkabilir 2,3. Klinik önemine rağmen, özellikle hayvan modelleri kullanılarak CAGE üzerine yapılan araştırmalar seyrek ve parçalanmış kalmaktadır4.
Rosengren ve ark. 1977'de farelerle yapılan öncü çalışmadan bu yana, CAGE için hayvan modelleri önemli bir iyileştirme geçirmiştir5. Rosengren tarafından kullanılan yaklaşım, toplam 10 μL hava hacmini sağlamak için ortak karotis arterin (CCA) kanülasyonunu içeriyordu. Bu teknik, arteriyel ligasyona bağlı hemodinamik değişiklikler ve hava embolisinin kontrolsüz boyutu ve aşırı hacmi dahil olmak üzere sınırlamasız değildi6. Furlow'un 1982'de açıklanan yöntemi, bir kateteri iç karotis artere ilerleterek ve toplam 5 μL'lik bir hava hacmi uygulayarak hava embolizasyonunun hassasiyetini geliştirdi. Bununla birlikte, önemi erken fark edilmesine rağmen, tek tip kabarcık boyutu kavramı ancak on yıllar sonra uygulandı. Gerriets ve ark. başlangıçta 160 μm, daha sonra 45 μm 7,8'e düşürülen düzgün bir çapa sahip tutarlı sayıda kabarcık üretebildiler. Burada kullanılan cerrahi yöntemde eksternal karotis arterin (ECA) feda edilmesi gerekiyordu. Son zamanlarda, Schaefer ve ark. femoral arter yoluyla CCA'ya bir mikrokateter yerleştirerek, endovasküler prosedürler sırasında görülen hava embolisi senaryolarını daha doğru bir şekilde taklit ederek daha az invaziv bir yöntem tanıttı9. Yöntemleri, CCA'nın arteriyel dallarını (örneğin, ECA ve pterygopalatine arter (PPA)) bağlamama sınırlamasına sahipti, böylece kabarcıkların sadece istenen serebral arterlere değil, aynı zamanda serebral olmayan bölgelere de akmasına izin verdi. Bu, deneylerin tekrarlanabilirliğini zorlaştıran tutarsız serebral iskemik hasara neden olabilir.
Klinik öncesi CAGE modellerindeki gelişmelere rağmen, kabarcık oluşturma tekniklerinin tekrarlanmasında, cerrahi yöntemlerin standardize edilmesinde ve tutarlı serebral lezyonların elde edilmesinde zorluklar devam etmektedir. Bu çalışma, hem ECA'dan fedakarlık gerektiren geleneksel bir cerrahi yaklaşımı hem de hava kabarcıklarının doğrudan CCA'ya enjekte edildiği alternatif bir yöntemi ortaya koymaktadır. Gerçek zamanlı kabarcık analizi için ayrıntılı prosedürleri, zorlukları ve açık kaynaklı yazılımları rapor ediyoruz. Ayrıca bir baloncuk üreteci oluşturmak için gereken teknik detayları da dahil ediyoruz.
Protokol
Hayvanlarla ilgili tüm işlemler, Laboratuvar Hayvanlarının Kullanım ve Bakım Kılavuzu'na uygun olarak gerçekleştirilmiştir. Hollanda Hayvan Deneyleri Merkez Komitesi'nden (AVD11800202114839) tam onay aldık. Ağırlık aralığı 300 - 350 g arasında olan erkek Wistar cinsi sıçanlar kullanıldı. Hayvanlar, yiyecek ve su ad libitum ve 12 saatlik aydınlık-karanlık döngüleri ile çiftler halinde barındırıldı. Varışta, hayvanlara herhangi bir deneysel prosedür başlatılmadan önce 7 günlük bir iklimlendirme periyodu uygulandı.
NOT: ECA-giriş yöntemi ve CCA-giriş yöntemi olmak üzere iki cerrahi yöntem kullandık. Her iki teknik için de sıçanlar, istatistiksel bir analiz aracı kullanılarak Araç veya 8000 nL CAGE gruplarına randomize edildi. Araç tedavisi sadece salin enjeksiyonunu içeriyordu; CAGE tedavisi, tuzlu suda 8000 nL'lik bir hacme kadar hava kabarcıkları kullandı ve her bir baloncuk 160 μm'lik bir hedef çapa sahipti. Bu serinin tamamlanmasından sonra, modelin 6000 nL ve 7000 nL (her ikisi de 160 μm kabarcık çapına sahip) ile daha da rafine edilmesi yalnızca CCA giriş yöntemiyle yapıldı. Prosedürel başarısızlık durumunda, n = 5 nihai grup boyutlarını elde etmek için yedek sıçanlar eklendi.
1. Hava kabarcığı jeneratörü
NOT: Hava kabarcığı jeneratörü (Şekil 1, Şekil 2 ve Ek Şekil 1A-C), eşit büyüklükte gaz kabarcıkları üreten ve algılayan birkaç özel yapım bileşenden oluşur.
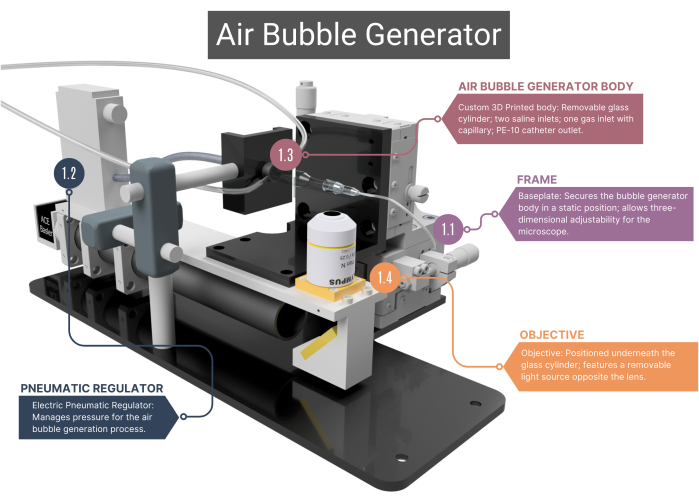
Şekil 1: Hava kabarcığı jeneratörüne genel bakış. Kabarcık üreteci, bir destek çerçevesi (1.1) ve hava akışı yönetimi için bir pnömatik regülatör (1.2) içerir. Bir objektif ve yüksek hızlı kameraya (1.4) bağlı bir cam kılcal damar (1.3) barındıran 3D baskılı bir ana gövde içerir. Daha fazla resim için Ek Şekil 1A-C'ye bakın. Sayılar, ana metindeki metodolojik adımlara karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Çerçeve
- Kabarcık üretecinin ana gövdesinin statik olarak konumlandırılmasını sağlayan özel yapım paslanmaz çelik taban plakasına sahip bir çerçeve kullanın, altına yerleştirilen mikroskop objektifi ise üç boyutlu olarak hareket ettirilebilir. Bu ayarlama yeteneği, görüş alanında değişikliklere olanak tanıyan ve mikro kanalın ucuna ve hava kabarcıklarına odaklanmaya izin veren XYZ düzenekleri tarafından kolaylaştırılır.
- Pnömatik regülatör
- Basınçlı hava beslemesi için, 0,001 ila 0,1 MPa basınç aralığına sahip bir elektrikli pnömatik regülatör kullanın. Regülatörün, ısıyla daralan kılıf ile hava sızdırmaz hale getirilmiş intravenöz (IV) boru yoluyla cam kılcal damara bağlandığından emin olun. Regülatörün voltajını değiştirerek basıncı düzenleyin.
- Hava kabarcığı jeneratör gövdesi
NOT: Kabarcık üretecinin ana gövdesi bir cam hazne, plastik iç muhafaza ve bir cam kılcal damardan oluşur. Vücudun tüm bileşenlerinin hava geçirmez olması gerekir, bu da hava veya tuzlu su sızıntısının mümkün olmamasını sağlar.- Özel yapım silindirik cam haznenin, 400 μm iç çapa sahip bir mikro kanala birleşen 1000 μm'lik bir iç çapa (ID) sahip olduğundan emin olun. Objektif boyunca en iyi görüntüyü elde etmek için bu silindirik şekilli mikro kanalın üst tarafını düzleştirin.
- Cam silindirin dış ucunu, ucu çıkarılmış olarak 21G'lik bir iğneye takın. Bu iğnenin içine ikinci bir iğne yapıştırın (27G, ID 210 μm). Bu daha küçük çaplı iğneyi mikrokanala yerleştirin ve bir polietilen (PE-10) katetere (ID 280 μm, uzunluk 125 mm) takın.
- İki paslanmaz çelik girişe sahip cam haznenin arkasına plastik bir gövde yerleştirin; burada, salin girişi için IV tüpü takılabilir. Bu gövdenin arkasında, O-ring kauçuklarla konumlandırılmış ve bir kapağa vidalanarak yerine kilitlenmiş özel bir cam kılcal damar aracılığıyla gaz girişi vardır.
- CCA giriş yöntemi için, kateterin ucunu plastik Luer kilit muhafazası çıkarılmış olarak bir iğneye (30G, ID 159 μm) takın ve dikkatlice 45°'lik bir açıyla bükün.
- Mikroskop ayarı
- Objektifi (4x) kabarcık üreteci gövdesinin altına yerleştirin ve yüksek hızlı bir kameraya bağlayın. Lensin karşısına ayarlanabilir bir LED ışık kaynağı yerleştirin.
- Her deneye başlamadan önce, objektif merceğin temiz olduğundan emin olun. Kir, yanlış kabarcık analizlerine neden olur.
- Cam kılcal damarın oluşturulması
NOT: Kılcal damar oluşturma işlemi önemli miktarda ince ayar içerir. Sağlanan ayarlar bir temel görevi görse de, istenen kabarcık çapını elde etmek için ayarlamalar gerekebilir.- Bir mikro pipet çektirmesi kullanarak cam kılcal damarı yapın (Ek Şekil 1A-C). Pipetleri oluşturmak için mikropipet çektirme ısıtıcılarını ayarlayın: sol ısıtıcıyı (no. 1) ayar = 70'e ve sağ ısıtıcıyı (no 2) ayar = 980'e ayarlayın.
- Cam kılcal damarı çektirmeye yerleştirin ve çekme işleminden sonra doğru şekli sağlamak için 100 g ağırlığında iki blok ekleyin. Başlat'a basın. Çekme işlemi tamamlandıktan sonra iki kılcal damar oluşur.
- Parlak bir alan mikroskobu kullanarak her kılcal damarı uçtan çapraz olarak kesin veya kırın. Ucun şekli ve çapı, gaz kabarcıklarının çapını etkilediği için kritik öneme sahiptir. Deneyler arasında kabarcık boyutunda tutarlılık sağlamak için, istenen kabarcık çapı için aynı kılcal damarı kullanın.
- Cam kılcal ucu, kabarcık jeneratörü gövdesinin silindirik kanalına (ID 400 μm) yerleştirin.
- Mikro kabarcık üretecinin kurulması
- Kabarcık jeneratörünü steril tuzlu su (50 mL) içeren bir şırınga pompasına bağlayın ve 20 mL/s'de sürekli bir akış başlatın. Sistemde hava sıkışmadığından emin olun. Sistemde hava sıkışması durumunda, havanın kateterden kaçabilmesi için kabarcık jeneratörünü dikey olarak tutun.
- Işık kaynağını, kamerayı ve yazılımı açın.
- Sistem doğru basınçta olduğunda (yaklaşık 2 dakika sonra), sistemde gaz veya sıvı sızıntısı olup olmadığını kontrol edin.
- Kabarcıklar oluşturmak için, voltajı artırarak, 2,1 V'tan başlayarak ve gaz cam kılcal damarı doldurana kadar devam ederek basıncı yavaşça artırın. Bu biraz zaman alabilir, ancak bu kısmı aceleye getirmemek önemlidir. Cam kılcal damardaki basınç kanaldakine eşit olduğunda, gaz kabarcıklarının üretimi başlayabilir. Voltajı basitçe 2,6 V'a yükselterek kabarcıklar üretilecektir.
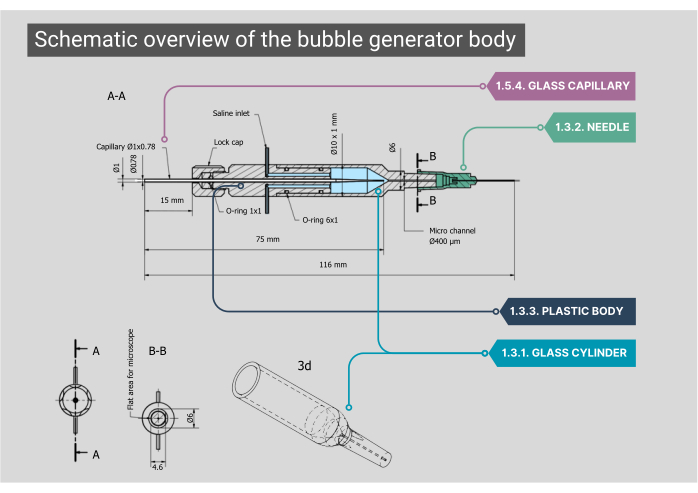
Şekil 2: Kabarcık jeneratörü gövdesine şematik genel bakış. Her bileşen için boyutlar ve ek açıklamalar dahil olmak üzere kabarcık üreteci gövdesinin ayrıntılı bir planı. Sayılar, ana metindeki metodolojik adımlara karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Gaz kabarcığı tespiti ve analizi
NOT: Python kodu (Ek Dosya 1), her bir gaz balonunun sayısını, çapını ve hacmini gerçek zamanlı olarak izlemek ve hesaplamak için tasarlanmıştır. Gaz kabarcıklarının üretimi sırasında, kod, görüş alanı boyunca hareket ederken algılanan her kabarcığı işler. Bu veriler sürekli olarak kabarcık sayısı, kümülatif hava hacmi, ortalama kabarcık çapı ve kaydın toplam süresi olarak görüntülenir. Her kayıttan sonra, veriler bir elektronik tabloya ve .mp4 video dosyasına aktarılır.
- Kamera ayarları (Ek Şekil 2)
- Mikro kabarcık üreteci doğru şekilde kurulduğunda, Pilon Görüntüleyici'de kamerayı açın. Doğru kazancı ve eşiği seçin.
- Kabarcık üretecinin X ve Y eksenini hareket ettirerek doğru ilgi alanını bulun ve Z eksenini hareket ettirerek keskinliği artırın.
- Kare hızını (171 fps) optimize etmek için kamerayı 2480 x 400 piksele (genişlik x yükseklik) ayarlayın. Kamera kurulumu tamamlandığında, Pylon Viewer'da kamerayı kapattığınızdan emin olun.
- Gerçek zamanlı kabarcık analizi (Ek Şekil 2)
- Bir deneye başlamadan önce, gaz kabarcıkları üretirken komut dosyası üzerinde bir test çalıştırması gerçekleştirin. Kaydı kontrol edin ve gerektiğinde eşiği ve kazancı ayarlayın.
- Kabarcıkların analizini başlatmak için Python kodunu çalıştırın. Kod, canlı videoyu, kabarcık sayısını, çapı ve hacmi otomatik olarak görüntüler.
3. KAFES ameliyatı
- Ameliyat için hazırlık
- Cerrahi alanı farenin altına steril bir bezle hazırlayın ve tüm cerrahi aletleri ve dikişleri ikinci bir steril bez üzerine yerleştirin. Gerekli ilaçları hazırlayın.
- Geri besleme sistemli ısıtma yastığının 37 °C'ye ayarlandığından emin olun. Mikroskobu doğru yüksekliğe ayarlayın.
- Fareyi ev kafesinden çıkarın ve anestezi için hazırlanın.
- Anestezi ve cerrahi öncesi bakım
- Ameliyattan 30 dakika önce deri altına 0.05 mg / kg buprenorfin uygulayın.
- İndüksiyon odasında %4 izofluran ve 1 L / dk hava karışımı (%30 oksijen ve %70 hava) kullanarak sıçanı uyuşturun. Tamamen uyuşturulduktan sonra, fareyi tartın ve elektrikli bir tıraş bıçağı kullanarak cerrahi boyun bölgesini tıraş edin.
- Fareyi ameliyat masasına taşıyın ve %70 / %30 hava karışımında %2-2.5 izofluran ile anesteziyi sürdürmek için izofluranı yüz maskesine geçirin.
- Kurumayı önlemek için gözlere suni gözyaşı uygulayın. Sıcaklık probunu yağlayın ve rektal olarak yerleştirin.
- Fareyi sırtüstü pozisyonda konumlandırın ve cerrahi alana kolay erişim için boynun altına 10 mL'lik bir şırınga yerleştirin.
- Ön pençeleri bant kullanarak ameliyat masasına sabitleyin. Steriliteyi sağlamak için cerrahi alanı iyot veya klorheksidin bazlı ovma ve alkol ile dairesel hareketlerle birkaç kez dezenfekte edin. Anestezi derinliğini ayak parmağınızı sıkıştırarak onaylayın.
- Kesi
- Sternal çentikten mandibulanın altına (yaklaşık 1,5 cm) neşter ile orta hat kesisi yapın.
- Bağ dokusunu (yüzeysel servikal fasya) incelemek için iki cımbız kullanın ve altta yatan kasları açığa çıkarın.
- Aradaki bağ dokusunu nazikçe yırtarak sol ve sağ sternohyoid kasları ayırın.
- Aşağıdaki kasları tanımlayın ve geri çekin: sağ sternomastoid kas (lateral olarak bir doku kancası kullanarak geri çekilin) ve sağ omohyoid kas (kaudal-medial olarak bir doku kancası kullanarak geri çekin). Sağ taraflı karotis üçgeni (CCA, ECA, internal karotis arter (ICA)) görünür olmalıdır.
- CCA'nın cerrahi hazırlığı
- Üstteki fasya ve yağ dokusunu çıkararak CCA'yı hazırlayın. Sinire zarar vermeden CCA'yı vagus sinirinden dikkatlice ayırın. Siniri veya dallarını tutmayın veya sıkıştırmayın. Sadece yavaşça CCA'dan uzağa itin. Damarları hazırlarken soluk borusuna dokunmayın veya bastırmayın.
- Kavisli cımbız kullanarak CCA'nın etrafına 3-0 sütür yerleştirin ve ipliği kanama durdurucularla sabitleyin. Bu daha sonra CCA'yı yükseltmeye hizmet edecektir.
- ECA, ICA ve dallarının geçici ligasyonu
- ECA'yı ve ICA çatallanmasını bulun ve ortaya çıkarın. Gerekirse çevredeki fasya ve yağ dokusunu temizleyin. ECA'yı geçici olarak 3-0 sütür ile bağlayın.
- Oksipital arteri (OA, esas olarak ICA'dan dallanan, ICA ve ECA kökenli Y şeklindeki bifurkasyon arasında ortada) ve superior tiroid arterini (ECA'nın medial tarafından dallanan) bulun. Bu küçük dallar kolayca yırtılır. OA'yı proksimal olarak 3-0 sütür ile geçici olarak bağlayın.
- IKA'yı distal olarak takiben, lateral olarak hareket eden bir sonraki dal pterygopalatin arterdir (PPA). Vagus sinirine zarar vermemeye çok dikkat ederken çevresindeki fasya ve yağ dokusunu temizleyin. PPA'yı geçici olarak 3-0 sütürle bağlayın.
NOT: PPA'ya kraniyal yönden yaklaşılması önerilir; Fareyi hafifçe yana doğru eğmek, ameliyat sırasında daha kolay erişim ve görselleştirmeyi kolaylaştırabilir.
- ECA giriş yöntemi (Şekil 3A)
- Arterleri aşağıdaki gibi bağlayın: 3.4.2 adımındaki dikişi kullanın. CCA'yı nazikçe ve geçici olarak bağlamak, akışın durdurulmasını sağlamak, ancak trombotik pıhtı oluşturma riskini en aza indirmek. Ardından, ICA ve OA'yı geçici olarak bağlamak için 3-0 sütür veya vasküler klips kullanın.
- ECA'nın etrafına iki dikiş uygulayın: biri proksimal diğeri distal. Distal sütürün superior tiroid arterini içerdiğinden ve kan akışını kalıcı olarak durdurmak için sıkıldığından, proksimal sütürün daha fazla kullanımda gevşek bir şekilde bağlandığından emin olun.
- Vasküler makas kullanarak ECA'nın iki sütürü arasında bir arteriyotomi oluşturun. Bu aşamada kanama olmaması gerekir.
- Havası alınmış kateteri, uç CCA'nın çatallanmasına ulaşana kadar kabarcık üretecinden yerleştirin. Proksimal sütürü sıkın ve ardından ECA'nın distalini arteriyotomi bölgesine bağlayın ve eksize edin.
- Kan akışını yeniden sağlamak için CCA ve ICA üzerindeki bağları gevşetin ve aynı zamanda kabarcık jeneratöründen katetere salin akışını başlatın (adım 1.6.3.). Kateter yerleşiminin stabilitesini ve kan veya salin sızıntısı olmadığını onaylayın. ECA kütüğünü, takılan kateter ile saat yönünün tersine yaklaşık 90° döndürün, böylece kateterden gelen akış ICA yönüne gider.
- Embolizasyon işlemini başlatın. Python kodunu başlatın ve adım 1.6.4'te açıklandığı gibi hava kabarcıkları oluşturmaya başlayın.
- Embolizasyon bittikten sonra, ICA sütürünü / vasküler klempi sıkarak kan akışını geçici olarak durdurun.
- Kateteri dikkatlice çıkarın ve mevcut dikişi sıkıca bağlayarak ECA'nın proksimal ucunu kalıcı olarak kapatın.
- Reperfüzyona izin vermek için 3-0 dikişleri ve/veya kelepçeyi PPA, OA, ICA ve CCA'dan nazikçe çıkarın. Ameliyat alanının etrafındaki kalan kanı temizleyin.
- CCA giriş yöntemi (Şekil 3B)
- Adım 3.5.3'ten sonra devam edin; ECA'yı geçici olarak priksimal, bifurkasyona yakın superior tiroid dalından ligate eder.
- Salin akışını hava kabarcığı jeneratöründen katetere başlatın, ancak henüz hava kabarcıkları üretimine başlamadan.
- Adım 3.4.2'deki kanama durdurucuları kullanarak CCA'yı yavaşça yükseltin. ve kabarcık üretecinin kateterine bağlı iğneyi akış yönünde CCA'nın lümenine sokmaya devam edin. İğne açıklığının yukarı baktığından ve iğnenin CCA'nın karşı damar duvarından delinmediğinden emin olun.
- Yerleştirildikten sonra, CCA'nın reperfüzyonuna izin vermek için hemostatları ve eşlik eden CCA'yı tekrar yavaşça indirin. Yerleştirme yerinin çevresinde kan veya salin sızıntısı olmadığından emin olun.
- Python kodunu başlatarak ve adım 1.6.4'te açıklandığı gibi hava kabarcıkları oluşturarak embolizasyon işlemini başlatın.
- Embolizasyonu tamamladıktan sonra, CCA'yı tekrar yükseltin ve iğneyi dikkatlice geri çekin. Kanamayı durdurmak için CCA'nın yüksekliğini korurken yerleştirme bölgesine pamuklu bir uçla baskı uygulayın.
- Delinme bölgesine baskı uygulamaya devam edin. Pıhtının rahatsız edilmeden ve yerinde kalmasını sağlamak için minimum basınç uygulayarak pamuk ucunu CCA boyunca distal olarak yuvarlayarak nazikçe çıkarın. Hemostaz elde etmek 30 saniye ila 5 dakika sürebilir.
NOT: Dişi sıçanlarda, delinme bölgesinin kapatılması erkek sıçanlara göre birkaç dakika daha uzun sürebilir. - Reperfüzyona izin vermek için ECA, ICA ve CCA'dan 3-0 sütürleri dikkatlice alın. Yine, kanamanın kalıcı olarak durduğunu onaylayın ve gerekirse ameliyat alanının etrafındaki kalıntı kanı temizleyin.
- Kapanış ve ameliyat sonrası bakım
- Dikiş atmayı kolaylaştırmak için cildi boynun deri altı dokusundan ayırın. Cildi kavisli bir iğne ve 4-0 dikiş ile dikin.
- İnsizyon bölgesi çevresinde deri altı bupivakain 2.5 mg / mL (0.01 - 0.02 mL / kg) uygulayın.
- Hayvanı 30-120 dakika boyunca dikkatlice bir kurtarma kafesine (33 - 35 ° C) aktarın. İyileşme süresi boyunca, hayvan, sternal yaslanma pozisyonunu sürdürmek için yeterli bilinci yeniden kazanana kadar gözetimsiz bırakılmaz. Hayvan tamamen iyileştiğinde, onu ev kafesine geri aktarın. Islak yemi kafesin içine kolayca ulaşılabilecek bir yere yerleştirin.
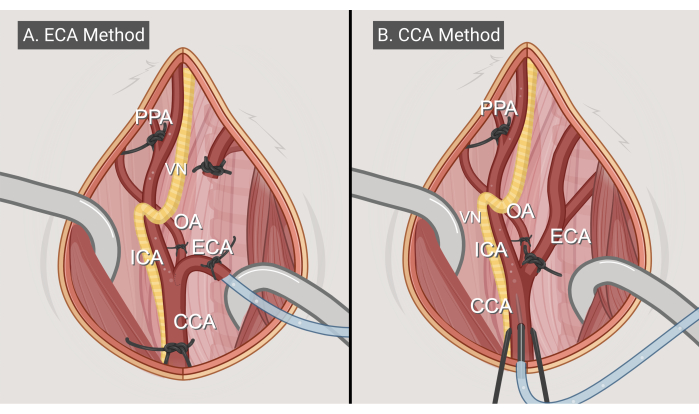
Şekil 3: Ameliyat yöntemleri. İki cerrahi yaklaşımın çizimleri, (A) ECA giriş yöntemi ve (B) CCA giriş yöntemi. Kısaltmalar: CCA = ortak karotis arter; ECA = dış karotis arter; ICA = iç karotis arter; OA = oksipital arter; PPA = pterygopalatin; VN = vagus siniri. BioRender.com ile yapılan figür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Takip
- İzleme ve insani uç noktalar
- Ameliyat sonrası 7 günlük bir süre boyunca hayvanları izleyin. Ameliyat gününün sonunda ve ertesi sabah tekrar 0.05 mg / kg'da deri altı buprenorfin ile postoperatif analjezi sağlayın. Hayvanları günlük olarak izlemeye devam edin ve ağrı veya sıkıntının klinik değerlendirmesine dayanarak gerektiğinde ek analjezikler uygulayın. Avrupa Parlamentosu'nun 2010/63/EU direktifine göre insancıl son noktaya ulaşılırsa fareyi daha erken ötenazi yapın.
- Klinik nörolojik defisitler
- Postoperatif günlerde (örneğin, 1, 3 ve 7. günler) klinik nörolojik defisitleri (CND) değerlendirin. CND tanımımız, sol ön bacak fleksiyonunun azalmasını (örneğin, sıçanı kaldırırken ön ekstremitenin uzamasının engellenmesi), Bederson skoru10'a benzer şekilde düz yürüyememe veya daire çizme davranışını içerir. Motor fonksiyonu ve nörolojik durumu değerlendirmek için herhangi bir standart nörolojik skorlama veya test kullanın.
- Manyetik rezonans görüntüleme
- Postoperatif manyetik rezonans görüntüleme (MRG) (örneğin, 1, 3, 5 ve 7. günlerde) 7 T'lik küçük bir hayvan MRI sisteminde% 1.2 -% 2.5 izofluran ile 0.5 L / dk tıbbi hava ve 0.5 L / dk oksijen karışımında sıçan anestezi ile gerçekleştirin. Solunumu ve sıcaklığı sürekli olarak izleyin.
- Aşağıdaki dizi parametrelerini kullanarak T2 ağırlıklı taramalar elde edin: tekrarlama süresi 2500 ms, yankı süresi 9 ms, yankı aralığı 9 ms ve 10 yankı. 128 x 128 çekim matrisi ile görüş alanını 35 x 35 mm olarak ayarlayın. Dilim kalınlığı 1,1 mm'dir ve toplam 15 dilim elde edilir, en boy oranı 1,00'dir ve tek bir dinamik çekim kullanılır.
- Histolojik analiz
- 7. günde MRG'nin tamamlanmasından sonra (veya deneysel son noktaya ulaşıldığında), sıçanı 30 mL 0.1 M fosfat tamponlu salin ve ardından 30 mL paraformaldehit% 4 ile kardiyak perfüzyon kullanarak ötenazi için anestezi altında tutun.
- Beyni çıkarın ve gece boyunca% 4 paraformaldehit içinde sabitleyin. 24 saatlik bir fiksasyon süresinden sonra, beyni parafine gömün, koronal bölümlerde dilimleyin ve standart yöntem11'i kullanarak hematoksilen ve eozin (H & E) ile boyayın.
Sonuçlar
Nörolojik sonuç
Tablo 1 , farklı deney gruplarındaki tüm dahil etme ve dışlamalara genel bir bakış sunmaktadır. Sahte olarak ameliyat edilen farelerin hiçbiri herhangi bir CND göstermedi. ECA-CAGE grubunda (8000 nL), beş sıçandan ikisi CND göstermezken, kalan üç sıçan CND yaşadı ve bunlardan ikisi 24 saat içinde öldü. CCA-CAGE grubunda (8000 nL) tüm hayvanlar CND gösterdi, beşte üçü 48 saate kadar hayatta kalamadı. Daha düşük hava hacmine sahip CCA-CAGE gruplarında, tüm sıçanlar postoperatif dönemde hayatta kaldı. 7000 nL grubundaki beş sıçanın tümü CND gösterirken, 6000 nL grubunda, beş sıçandan ikisi CND gösterdi.
| ECA | CCA | |||||||
| sahte | 8000 nL | sahte | 8000 nL | 7000 nL | 6000 nL | |||
| Dahil | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Sergilenen klinik nörolojik defisitler | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Ölüm oranı < 24 saat | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Ölüm oranı 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Hariç tutulan toplam | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Kanama komplikasyonu nedeniyle dışlandı | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Trombotik komplikasyon nedeniyle dışlandı | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Vagal sinir sıkışmasına bağlı intraoperatif ölüm | 1 | 0 | 1 | 0 | 2 | 0 | ||
Tablo 1: Hayvan grubu dahil etme ve dışlama. Her gruptaki sıçan sayısı, inklüzyonlar ve dışlamalar, ölümler ve klinik nörolojik defisitlerle sağkalım.
MRG
Şekil 4, CCA giriş yöntemiyle 7000 nL hava kabarcığı alan ve kortikal hiperintensiteleri gösteren bir sıçanın temsili bir T2 ağırlıklı görüntüsünü göstermektedir. 7000 veya 8000 nL alan CCA-CAGE grubundaki tüm hayvanlarda ve daha az ölçüde 6000 nL grubunda ve ECA-CAGE grubunda benzer anormallikler görülmüştür. Özellikle, sahte gruplardaki hayvanların hiçbiri herhangi bir CND göstermezken, bir ECA-sahte sıçan MRG'de bir hiperyoğunluk alanı sergiledi; CCA-sham grubunda, hiçbir sıçan MRG'de anormallik göstermedi.
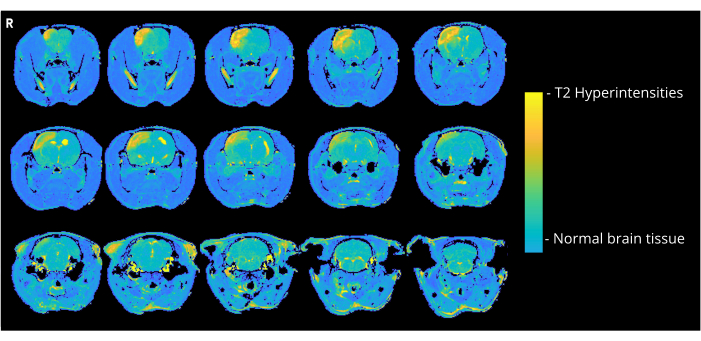
Şekil 4: MRG örnek görüntüleri. CCA-CAGE 7000 nL grubundaki bir sıçanda CAGE'ye bağlı kortikal hiperintensiteleri gösteren temsili T2 ağırlıklı MRG görüntüleri (CAGE ameliyatından 3 gün sonra). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Histoloji
Şekil 5, Şekil 4'ten 7000 nL CCA-CAGE sıçanın temsili bir H & E lekeli beyin bölümünü göstermektedir ve reaktif astrogliozis ve mikroglial aktivasyon dahil olmak üzere nöronal hücre kaybı ve reaktif gliozis ile kortikal iskemik beyin hasarını göstermektedir.
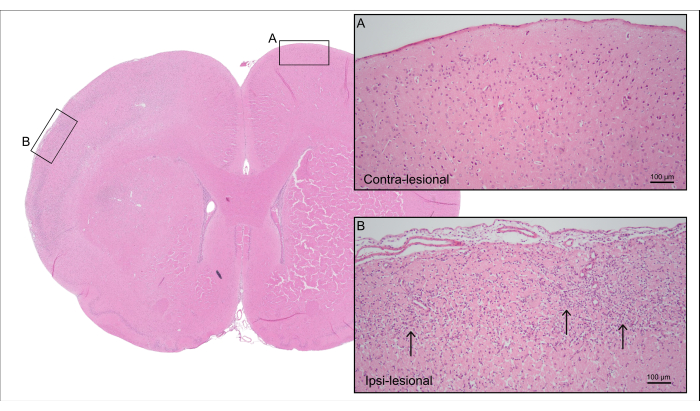
Şekil 5: Ölüm sonrası histoloji. Şekil 4'ten sıçanın temsili H&E boyaması, (A) sağlam nöronlar ile kontra-lezyonel tarafın kortikal dokusunu ve (B) nöronal hücre kaybı ve reaktif gliozis ile iskemik kortikal doku ile ipsi-lezyonel tarafı gösterir (oklar). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Teknik zorluklar
Teknik zorluklar nedeniyle, ECA'ya giriş yöntemi, CCA'ya giriş yöntemine kıyasla önemli ölçüde daha düşük bir başarı oranına sahipti (Tablo 1). Bu durum ağırlıklı olarak ECA giriş yönteminde gerekli olan ve sıklıkla kateter çıkığı ve kanama ile sonuçlanan kısa kateter uzunluğundan kaynaklanıyordu. Ek olarak, ECA giriş yöntemi ayrıca yaklaşık 20 dakika daha uzun bir ameliyat süresinin yanı sıra kabarcık çapında daha büyük bir varyasyon ile sonuçlandı.
Ek Şekil 1: Hava kabarcığı jeneratörünün detayları. (A) Kabarcık üretecinin gövdesinin ve kılcal çektirmenin görüntüleri, montajlarını ve işlevsel yönlerini vurgular. (B) Kabarcık üretecinin tasarımını ve yapısal özelliklerini yandan perspektiften gösteren yandan görünümü. (C) Kabarcık üretecinin önden görünümü, temel ön yönleri ve özellikleri gösterir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Yazılımı çalıştırma adımları. Bu dosya, hava kabarcığı jeneratörü ile ilişkili yazılımı etkin bir şekilde çalıştırmak ve kullanmak için izlenecek prosedürler ve adımlar hakkında ayrıntılı bir kılavuz sağlar. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 1: Python kodu. Kod, aynı klasöre kaydedilmesi gereken iki komut dosyasından (A ve B) oluşur. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Sıçan serebral arterlerine hava embolisinin nasıl sokulacağını iki yöntem kullanarak tanımladık ve CCA'ya yerleştirilen bir iğne ile girişin, ECA'ya bir kateter yoluyla embolizasyonu içeren bir yönteme göre birçok avantajı olduğunu gösterdik. Spesifik olarak, CCA giriş yöntemiyle daha az komplikasyonun yanı sıra daha tutarlı bir kabarcık çapı ve daha kısa cerrahi süre gözlemledik. CCA giriş yöntemi, doza bağımlı CND ve histoloji ile doğrulandığı gibi serebral enfarktüsü gösteren MRG'de anormallikler ile sonuçlanır.
ECA-giriş yönteminin ilk seçimi Gerriets ve ark.7'den esinlenmiştir. Bununla birlikte, bu yaklaşımla, kabarcık boyutunda önemli farklılıklar ve CCA giriş yöntemine kıyasla daha yüksek bir cerrahi komplikasyon oranı dahil olmak üzere çeşitli zorluklar belirledik. Bu komplikasyonların birincil kaynağı kateter uzunluğu ile ilgilidir. Modelimizde, kısa bir kateter (125 mm) kullanmak, baloncukların stabilitesinin korunmasına yardımcı olmuştur çünkü kateter ne kadar uzun olursa, baloncukların kateterdenakarken birleşme olasılığı o kadar yüksek olur 9. Bununla birlikte, ECA giriş yönteminde, daha uzun bir kateter, hareket için daha kolay yerleştirme ve kaldıraç sağlar. ECA giriş yönteminde kısa bir kateter kullanılması, aşırı manipülasyon nedeniyle ECA güdüğünün sık sık yerinden çıkmasına ve bozulmasına neden olur.
ECA giriş yönteminde karşılaşılan ikinci bir zorluk, tutarlı bir şekilde boyutlandırılmış kabarcıkların oluşturulmasıyla ilgiliydi (Şekil 6). ECA giriş yönteminde, kateter ECA'ya yerleştirilirken kateterden salin akışının geçici olarak durdurulması gerekir. Arteriyel akış geri yüklendiğinde ve embolizasyon başlayabildiğinde, kateter aniden farenin kan basıncına maruz kalır. Sonuç olarak, bu, kanın geriye dönük olarak kateter ve kabarcık jeneratörüne girmesine yol açar. Dalgalanan kan basıncının kabarcık üreteci içindeki basınç üzerindeki etkisi, kabarcık boyutunda daha yüksek bir varyasyona yol açar ve bazen kanalı dolduran silindirik şekilli kabarcıklara yol açar (Şekil 6B). Bu, kateteri ECA'ya yerleştirmeden önce sistem içindeki basıncı artırarak önlenebilir. Bu, hassas zamanlama için en iyi şekilde ikinci bir kişi tarafından yapılır. Ayrıca, bu yöntem daha fazla zaman alıcı olduğundan, sıçana CCA giriş yönteminden daha fazla miktarda salin infüze edilmesine yol açar. CCA giriş yönteminde, salin sürekli olarak kateterden akar ve iğne, CCA'dan geçen kan akışı yönünde sokulur, böylece yukarıda açıklanan basınç gradyanı sorunu çözülür. Bu, katetere geri akış olmamasına ve daha düzgün bir kabarcık boyutuna neden olur.
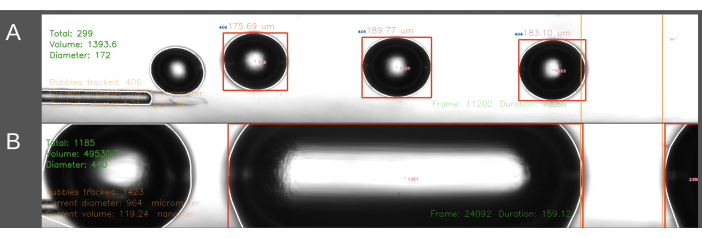
Şekil 6: Kabarcık üretiminin örnek kaydı ve analizi. Görüntüler, ölçüm alanındaki toplam kabarcık sayısının, toplam hacmin ve ortalama çapın gerçek zamanlı analizini gösteren ekran görüntülerini görüntüler (yeşil, sol üst köşe). Ölçüm alanı sağdaki turuncu çizgiler arasında vurgulanır. Kabarcık çapı ve hacmi yatay çapa göre hesaplanır. Görüntüler, (A) başarıyla oluşturulmuş hava kabarcıklarının ve (B) başarısız şekilde oluşturulmuş silindirik kabarcıkların oluşumunu içerir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
CCA'ya giriş yönteminin favori olmasına rağmen, yine de çeşitli teknik zorluklarla karşılaştık. İlk olarak, PPA'nın hazırlanması zordur, çünkü vagus sinirinin kazara sıkışması solunumun depresyonuna ve ardından hayvanın ölümüne neden olabilir12. Bu riski azaltmak için, sıçan hafifçe yana doğru eğilmeli ve PPA'ya kraniyal yönden yaklaşılmalıdır. Ek olarak, İKA'nın zorlu anatomisi ve PPA bifurkasyonu nedeniyle, vasküler hasar ve kontrol edilemeyen kanama riski vardır. Bu ancak cerrahi becerilerin geliştirilmesiyle atlatılabilir. Bu zorluklar, sıçanlarda CAGE modeline hakim olmanın karmaşık olduğunu ve önemli pratik ve hassasiyet gerektirdiğini vurgulamaktadır13.
Hava kabarcığı jeneratörünün önerilen teknik kurulumunun, kırılganlıkları nedeniyle, özellikle ısmarlama cam kılcal damarlarla ilgili sınırlamaları vardır. Pnömatik regülatörü kılcal damara bağlayan boru, embolizasyondan sonra basınç tahliyesi için üç vanayı ayarlarken kırılmaya eğilimlidir. Ayrıca, bir kılcal damarın değiştirilmesi, ısıyla daralan kauçuğun kalıcı olarak bağlı olması nedeniyle mevcut kılcal damarın yok edilmesini gerektirir. Ek olarak, her kılcal, uç çapı ve şeklindeki küçük farklılıklar nedeniyle benzersiz kabarcık özelliklerine sahiptir. Son olarak, kabarcık üretiminin pnömatik regülatör aracılığıyla manuel olarak çalıştırılması önemli bir deneyim gerektiriyordu. Deneyimsiz kullanım, aşırı büyük baloncukların üretilmesine neden olabilir. Python kodundan bir geri bildirim döngüsü ile otomatik basınç regülasyonu, gelecekteki çalışmalarda otomatik hassasiyeti artırabilir.
Hem kabarcık jeneratörünün teknik özelliklerini, hem de ayrıntılı bir cerrahi protokolü ve yazılımı sağlayan kapsamlı dokümantasyonumuz, bu araştırma alanına önemli bir katkı sağlamaktadır. CCA tekniğimiz, prosedür boyunca CCA akışını koruyarak ve ECA'yı feda etme ihtiyacını ortadan kaldırarak fizyolojik serebral perfüzyonda minimum kesinti sağlar. Çalışmamız, CAGE ve potansiyel tedavilerini araştırmak için güvenilir ve tekrarlanabilir bir deneysel model sunmaktadır.
Açıklamalar
Hiç kimse
Teşekkürler
Bu araştırma, Hollanda Askeri Sağlık Sigortası Vakfı (Stichting Ziektekosten Verzekering Krijgsmacht) tarafından 20-0232 hibe numarası ve Hollanda Kalp Vakfı 2021 E. Dekker Hibesi (03-006-2021-T019 - IAM) tarafından finanse edilmiştir. Ayrıca olağanüstü yardımları için Lindy Alles, Paul Bloemen ve Ed van Bavel'e teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Referanslar
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır