Method Article
大鼠脑动脉气体栓塞的诱导
* 这些作者具有相同的贡献
摘要
该方案提供了在大鼠中诱导脑空气栓塞的详细描述。它比较了直接注射到颈总动脉和通过颈外动脉引入。它提供了气泡发生器的技术描述、不同空气体积的效果和程序挑战。
摘要
我们提出了一种用于脑动脉气体栓塞 (CAGE) 临床前研究的方法学方法,脑动脉气体栓塞是一种以脑循环内气泡引起多灶性缺血为特征的疾病。目前的工作描述了两种在大鼠体内诱导 CAGE 的手术方法:一种通过颈外动脉 (ECA) 注射空气,从而牺牲血管,另一种通过直接注射到颈总动脉 (CCA) 中。使用雄性 Wistar 大鼠并分成组 (n=5) 进行 ECA 或 CCA 进入方法,注射不同的空气栓塞体积 (6000、7000 和 8000 nL) 或假手术。使用定制的气泡发生器来生产大小一致的气体栓子,并开发了用于实时气泡分析的开源软件。两种方法之间的比较表明,CCA 方法在气泡发生器内一致地产生气泡、减少栓塞时间和减少并发症方面具有优势。
引言
脑动脉气体栓塞 (CAGE) 的特征是气泡在脑动脉循环内停留,导致一系列神经功能障碍。这种情况主要被称为潜水并发症,其中肺部在上升过程中过度扩张导致气压伤和空气进入肺静脉,然后流向脑动脉1。除了潜水中这一众所周知的事件外,医疗专业人员也越来越认识到 CAGE 是侵入性医疗程序的并发症。医源性空气栓塞可能发生在中心静脉导管和胸腔引流管的放置、处理或移除过程中,以及整个开放和血管内手术过程中,包括心脏瓣膜介入治疗、胸主动脉腔内修复和缺血性中风的血管内血栓切除术 2,3。尽管具有临床意义,但对 CAGE 的研究,特别是使用动物模型的研究,仍然稀疏且碎片化4。
自 Rosengren 等人于 1977 年对大鼠进行开创性研究以来,CAGE 的动物模型经历了重大改进5。Rosengren 采用的方法包括颈总动脉 (CCA) 插管,以引入总体积为 10 μL 的空气。这项技术并非没有限制,包括由于动脉结扎和空气栓塞不受控制的大小和体积而改变的血流动力学6。Furlow 的方法于 1982 年描述,通过将导管推进到颈内动脉并施用 5 μL 的总空气量,提高了空气栓塞的精度。然而,尽管它的重要性很早就得到了认可,但均匀气泡大小的概念直到几十年后才得到实施。Gerriets 等人能够产生一致数量的均匀直径气泡,最初为 160 μm,后来减少到 45 μm 7,8。这里使用的手术方法需要牺牲颈外动脉 (ECA)。最近,Schaefer 等人引入了一种侵入性较小的方法,通过股动脉将微导管插入 CCA,更准确地模拟了血管内手术中观察到的空气栓塞情况9。他们的方法存在不结扎 CCA 动脉分支(例如 ECA 和翼腭动脉 (PPA))的局限性,因此气泡不仅可以流向所需的脑动脉,还可以流向非脑区域。这可能导致不一致的脑缺血损伤,使实验的可重复性复杂化。
尽管临床前 CAGE 模型取得了进步,但在复制气泡生成技术、标准化手术方法和获得一致的脑损伤方面仍然存在挑战。目前的研究引入了一种需要牺牲 ECA 的传统手术方法和一种将气泡直接注入 CCA 的替代方法。我们报告了详细的程序、挑战和用于实时气泡分析的开源软件。我们还包括构建气泡生成器所需的技术细节。
研究方案
所有涉及动物的程序均按照《实验动物使用和护理指南》进行。我们获得了荷兰中央动物实验委员会 (AVD11800202114839) 的完全批准。使用体重范围为 300 - 350 g 的雄性 Wistar 大鼠。将动物与 食物 和水成对饲养,随意饲养 12 小时的光暗循环。到达后,动物在开始任何实验程序之前经历了 7 天的适应期。
注意:我们使用了两种手术方法,即 ECA 进入法和 CCA 进入法。对于这两种技术,使用统计分析工具将大鼠随机分配到 Vehicle 组或 8000 nL CAGE 组。载体治疗仅包括生理盐水注射;CAGE 处理使用体积为 8000 nL 的盐水气泡,每个气泡的目标直径为 160 μm。完成本系列后,仅通过 CCA 进入方法对 6000 nL 和 7000 nL(均具有 160 μm 气泡直径)的模型进行进一步细化。在程序失败的情况下,加入替代大鼠以获得 n=5 的最终组大小。
1. 气泡发生器
注:气泡发生器(图 1、 图 2 和 补充图 1A-C)由几个定制组件组成,可产生和检测大小相等的气泡。
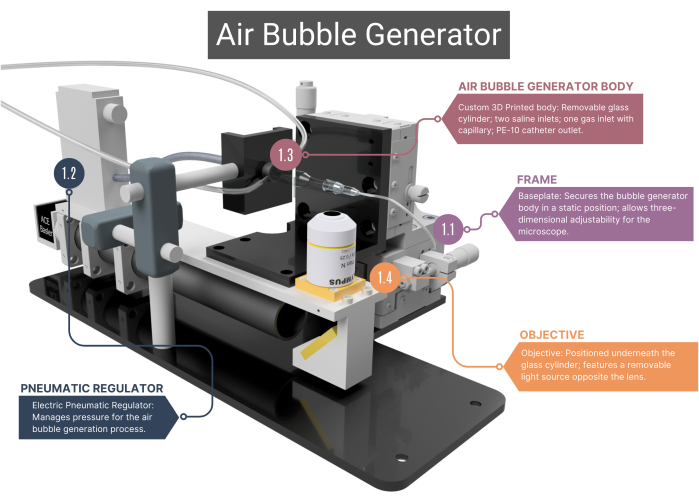
图 1:气泡发生器概述。 气泡发生器包括一个支撑框架 (1.1) 和一个用于气流管理的气动调节器 (1.2)。它包括一个 3D 打印的主体,里面装有玻璃毛细管 (1.3),与物镜和高速相机 (1.4) 相连。有关更多图像,请参阅 补充图 1A-C 。数字与正文中的方法步骤相对应。 请单击此处查看此图的较大版本。
- 框架
- 使用带有定制不锈钢底板的框架,确保气泡发生器主体的静态定位,而位于其下方的显微镜物镜可以在三个维度上移动。XYZ 组件有助于实现这种调整功能,这些组件可以改变视野并允许聚焦于微通道和气泡的尖端。
- 气动调节器
- 对于压缩空气供应,请使用压力范围为 0.001 至 0.1 MPa 的电动气动调节器。确保调节器通过静脉注射 (IV) 管连接到玻璃毛细管,并使用热缩套管进行空气密封。通过改变调节器的电压来调节压力。
- 气泡发生器本体
注:气泡发生器的主体由玻璃室、塑料内壳和玻璃毛细管组成。车身的所有组件都需要密封,确保不会泄漏空气或盐水。- 确保定制的圆柱形玻璃腔室的内径 (ID) 为 1000 μm,并合并成 ID 为 400 μm 的微通道。压平这个圆柱形微通道的顶部,以获得通过物镜的最佳视图。
- 将玻璃圆筒的外端安装到 21G 针头上,并取下尖端。在该针头内,粘上第二根针头(27G,ID 210 μm)。将这种较小直径的针头安装到微通道中,并将其连接到聚乙烯 (PE-10) 导管(ID 280 μm,长度 125 mm)上。
- 将塑料体安装在玻璃室的背面,玻璃室具有两个不锈钢入口;在这里,可以连接用于进入盐水的 IV 管。该机身的后部有一个通过定制玻璃毛细管的气体入口,该毛细管用 O 形环橡胶定位,并通过拧上盖子锁定到位。
- 对于 CCA 进入方法,将导管末端连接到针头(30G,ID 159 μm)上,取下塑料鲁尔锁外壳,然后小心地将其弯曲成 45° 角。
- 显微镜调整
- 将物镜 (4x) 放置在气泡发生器主体下方,并将其连接到高速相机。在镜头对面,放置一个可调节的 LED 光源。
- 在每次实验开始之前,请确保物镜清洁。污垢会导致气泡分析不正确。
- 玻璃毛细管的创建
注意:创建毛细管的过程涉及大量的微调。虽然提供的设置用作基准,但可能需要进行调整才能获得所需的气泡直径。- 使用微量移液器拉拔器制作玻璃毛细管(补充图 1A-C)。要创建移液器,请设置微量移液器拉取器加热器:将左侧加热器(1 号)设置为调节 = 70,将右侧加热器(2 号)设置为调节 = 980。
- 将玻璃毛细管放入拉取器中,并添加两块 100 g 的砝码,以确保拉出过程后的形状正确。按 Start(开始)。拉动过程完成后,会形成两个毛细血管。
- 使用明场显微镜在尖端对角线切割或折断每个毛细管。尖端的形状和直径至关重要,因为它们会影响气泡的直径。为确保整个实验中气泡大小的一致性,请对所需的气泡直径使用相同的毛细管。
- 将玻璃毛细管尖端插入气泡发生器主体的圆柱形通道 (ID 400 μm)。
- 设置微气泡生成器
- 将气泡发生器连接到装有无菌盐水 (50 mL) 的注射泵,并以 20 mL/h 的速度开始连续流速。确保系统中没有空气滞留。如果空气滞留在系统中,请垂直握住气泡发生器,以便空气可以通过导管逸出。
- 打开光源、相机和软件。
- 当系统处于正确的压力时(大约 2 分钟后),检查系统是否有气体或液体泄漏。
- 要产生气泡,请通过增加电压来缓慢增加压力,从 2.1 V 开始,一直持续到气体充满玻璃毛细管。这可能需要一些时间,但重要的是不要急于完成这部分。当玻璃毛细管中的压力等于通道中的压力时,气泡的产生就会开始。只需将电压提高到 2.6 V,就会产生气泡。
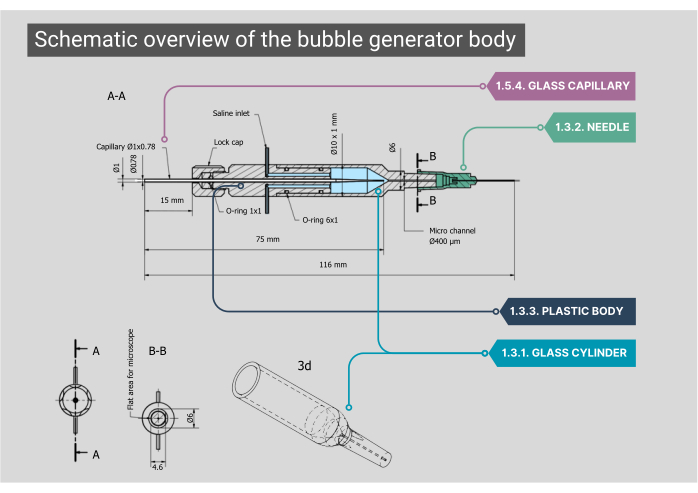
图 2:气泡发生器主体的示意图。 气泡生成器主体的详细蓝图,包括每个组件的尺寸和注释。数字与正文中的方法步骤相对应。 请单击此处查看此图的较大版本。
2. 气泡检测和分析
注意:Python 代码(补充文件 1)旨在实时跟踪和计算每个气泡的数量、直径和体积。在气泡的产生过程中,该代码会在每个检测到的气泡穿过视场时对其进行处理。此数据以气泡计数、累积空气量、平均气泡直径和记录的总持续时间的形式连续显示。每次录制后,数据都会导出到电子表格和 .mp4 视频文件中。
- 相机设置(补充图 2)
- 正确设置微气泡发生器后,在 Pylon Viewer 中打开相机。选择正确的增益和阈值。
- 通过移动气泡发生器的 X 轴和 Y 轴找到正确的感兴趣区域,并通过移动 Z 轴来增强清晰度。
- 要优化帧速率 (171 fps),请将摄像机设置为 2480 x 400 像素(宽 x 高)。相机设置完成后,请确保在 Pylon Viewer 中关闭相机。
- 实时气泡分析(补充图 2)
- 在开始实验之前,请在生成气泡时执行脚本的试运行。检查录音并根据需要调整阈值和增益。
- 要开始分析气泡,请运行 Python 代码。该代码将自动显示实时视频、气泡计数、直径和体积。
3. CAGE 手术
- 手术准备
- 在大鼠下方用无菌布准备手术区域,并将所有手术器械和缝合线铺在第二块无菌布上。准备必要的药物。
- 确保带有反馈系统的加热垫设置为 37 °C。 将显微镜调整到正确的高度。
- 将大鼠从家笼中取出并准备麻醉。
- 麻醉和术前护理
- 手术前 30 分钟皮下注射 0.05 mg/kg 丁丙诺啡。
- 在诱导室中使用 4% 异氟醚和 1 L/min 空气混合物(30% 氧气和 70% 空气)麻醉大鼠。完全麻醉后,称量大鼠并使用电动剃须刀剃除手术颈部区域。
- 将大鼠移至手术台上,将异氟醚换成面罩,用 2%-2.5% 异氟醚在 70%/30% 空气混合物中维持麻醉。
- 将人工泪液涂抹在眼睛上以防止干燥。润滑温度探头并将其插入直肠。
- 将大鼠置于仰卧位,并在颈部下方放置一个 10 mL 注射器,以便于进入手术区域。
- 使用胶带将前爪固定在手术台上。用碘或洗必泰基磨砂膏和酒精以圆周运动对手术区域进行数次消毒,以确保无菌。通过捏住脚趾确认麻醉深度。
- 切口
- 用手术刀从胸骨切迹到下颌骨下方(约 1.5 厘米)做一个中线切口。
- 用两把镊子解剖结缔组织(颈浅筋膜),露出下面的肌肉。
- 通过轻轻撕裂左右胸骨舌骨肌之间的结缔组织来分离两者。
- 识别并缩回下面的以下肌肉:右胸骨突肌(使用组织钩横向缩回)和右侧舌骨肌(使用组织钩尾内侧缩回)。右侧颈动脉三角(CCA、ECA、颈内动脉 (ICA))应该是可见的。
- CCA 的手术准备
- 通过去除覆盖的筋膜和脂肪组织来准备 CCA。小心地将 CCA 与迷走神经分开,不要损伤神经。不要抓住或挤压神经或其分支。只需轻轻地将其从 CCA 上推开。准备血管时,请勿触摸或压迫气管。
- 使用弯曲的镊子在 CCA 周围放置 3-0 缝合线,并用止血钳固定线。这将在以后用于提升 CCA。
- ECA、ICA 及其分支的临时结扎
- 找到并暴露 ECA 和 ICA 分叉。如果需要,清除周围的筋膜和脂肪组织。用 3-0 缝合线暂时结扎 ECA。
- 找到枕动脉(OA,主要从 ICA 分支,在 ICA 和 ECA 起点的 Y 形分叉之间的中间)和甲状腺上动脉(从 ECA 的内侧分支)。这些小树枝很容易破裂。用 3-0 缝合线在近端临时结扎 OA。
- 在 ICA 向远端移动之后,下一个横向移动的分支是翼腭动脉 (PPA)。清除周围的筋膜和脂肪组织,同时非常小心不要损伤迷走神经。用 3-0 缝合线暂时结扎 PPA。
注意:建议从颅方向接近 PPA;将大鼠稍微向侧面倾斜可以促进手术过程中更容易进入和观察。
- ECA 输入方法(图 3A)
- 按如下方式结扎动脉:使用步骤 3.4.2 中的缝合线。轻柔而暂时地结扎 CCA,确保血流停止,但将产生血栓形成的风险降至最低。然后,使用 3-0 缝合线或血管夹暂时结扎 ICA 和 OA。
- 在 ECA 周围缝合两根:一根近端缝合,一条远端缝合。确保远端缝合线包括甲状腺上动脉并收紧以永久阻止血液流动,同时在进一步使用时将近端缝线松散地系好。
- 使用血管剪刀在 ECA 的两条缝合线之间创建动脉切开术。这个阶段应该没有出血。
- 从气泡发生器插入脱气的导管,直到尖端到达 CCA 的分叉处。收紧近端缝合线,然后结扎并切除动脉切开部位远端的 ECA。
- 松开 CCA 和 ICA 上的结扎线以恢复血流,同时开始盐水通过气泡发生器流入导管(步骤 1.6.3.)。确认导管放置的稳定性以及是否有血液或盐水泄漏。将插入的导管的 ECA 残端逆时针旋转约 90°,使来自导管的血流进入 ICA 的方向。
- 开始栓塞过程。启动 Python 代码并开始创建气泡,如步骤 1.6.4 中所述。
- 栓塞完成后,通过拧紧 ICA 缝合线/血管夹暂时停止血流。
- 小心地取下导管,并通过牢固地系好现有缝合线来永久关闭 ECA 的近端。
- 轻轻地从 PPA、OA、ICA 和 CCA 上取下 3-0 缝合线和/或夹子,以便再灌注。清洁手术区域周围的残留血液。
- CCA 输入方法(图 3B)
- 在步骤 3.5.3 之后继续;暂时连接甲状腺上支近端的 ECA,靠近分叉处。
- 开始将盐水通过气泡发生器流入导管,但尚未开始产生气泡。
- 使用步骤 3.4.2 中的止血钳轻轻升高 CCA。然后继续将连接到气泡发生器导管的针头沿流动方向插入 CCA 的管腔。确保针头开口朝上,并且针头不会穿过 CCA 的对面血管壁。
- 插入后,缓慢降低止血钳并再次伴随 CCA,以允许 CCA 再灌注。确保插入部位周围没有血液或盐水泄漏。
- 通过启动 Python 代码并创建气泡来开始栓塞过程,如步骤 1.6.4 中所述。
- 完成栓塞后,再次抬高 CCA 并小心地缩回针头。用棉签对插入部位施加压力,同时保持 CCA 升高以止血。
- 继续对穿刺部位施加压力。沿着 CCA 向远端滚动,轻轻地取下棉签,使用最小的压力确保血凝块保持不受干扰并就位。可能需要 30 秒到 5 分钟才能实现止血。
注意:在雌性大鼠中,关闭穿刺部位可能比雄性大鼠多花几分钟。 - 小心地从 ECA、ICA 和 CCA 中取出 3-0 缝合线,以便进行再灌注。同样,确认出血已永久停止,并在必要时清洁手术区域周围的任何残留血液。
- 闭合和术后护理
- 将皮肤与颈部皮下组织分开,以便缝合。用弯曲的针和 4-0 缝合线缝合皮肤。
- 在切口部位周围皮下注射 2.5 mg/mL (0.01 - 0.02 mL/kg) 的布比卡因。
- 小心地将动物转移到恢复笼 (33 - 35 °C) 中 30-120 分钟。在恢复期间,动物不会无人看管,直到它恢复足够的意识以维持胸骨斜躺姿势。当动物完全康复后,将其转移回家笼。将湿食物放在笼子内触手可及的地方。
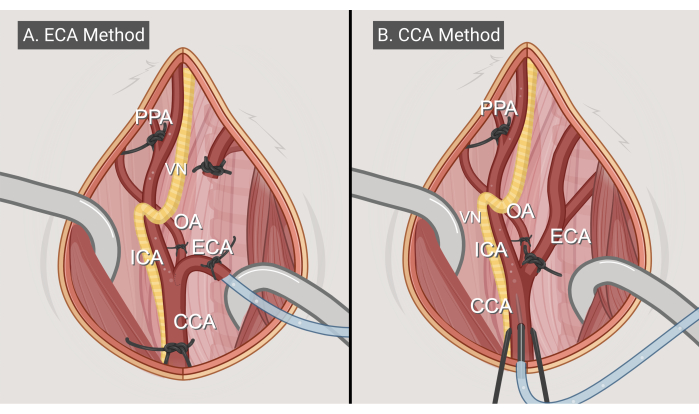
图 3:手术方法。 两种手术方法的插图,(A) ECA 进入法和 (B) CCA 进入法。缩写: CCA = 颈总动脉;ECA = 颈外动脉;ICA = 颈内动脉;OA = 枕动脉;PPA = 翼腭;VN = 迷走神经。用 BioRender.com 制作的手办。请单击此处查看此图的较大版本。
4. 随访
- 监控和人性化端点
- 术后 7 天监测动物。在手术当天结束时和第二天早上再次使用0.05 mg/kg的皮下注射丁丙诺啡进行术后镇痛。继续每天监测动物,并根据对疼痛或痛苦的临床评估根据需要给予额外的镇痛药。如果根据欧洲议会指令 2010/63/EU 达到人道终点,请尽早对大鼠实施安乐死。
- 临床神经功能缺损
- 评估术后几天(例如,第 1 、 3 和 7 天)的临床神经功能缺损 (CND)。我们对 CND 的定义包括左前肢屈曲减少(例如,在饲养大鼠时抑制前肢伸展)、无法笔直行走或盘旋行为,类似于 Bederson 评分10。使用任何标准化的神经学评分或测试来评估运动功能和神经功能状态。
- 磁共振成像
- 在 7 T 小动物 MRI 系统上进行术后磁共振成像 (MRI)(例如,第 1、3、5 和 7 天),大鼠在 0.5 L/min 医用空气和 0.5 L/min 氧气的混合物中用 1.2% - 2.5% 异氟醚麻醉。持续监测呼吸和温度。
- 使用以下序列参数获取 T2 加权扫描:重复时间 2500 ms、回波时间 9 ms、回波间距 9 ms 和 10 个回波。将视野设置为 35 x 35 mm,采集矩阵为 128 x 128。切片厚度为 1.1 mm,总共采集了 15 个切片,保持 1.00 的纵横比并使用单次动态采集。
- 组织学分析
- 第7 天 ( 或达到实验终点) MRI 完成后,使用 30 mL 0.1 M 磷酸盐缓冲盐水的心脏灌注,然后用 30 mL 多聚甲醛 4% 维持大鼠麻醉安乐死。
- 提取大脑并在 4% 多聚甲醛中后固定过夜。固定期 24 小时后,将大脑包埋在石蜡中,切成冠状切片,并使用标准方法11 用苏木精和伊红 (H&E) 染色。
结果
神经系统结局
表 1 概述了不同实验组的所有包含和排除。所有假手术大鼠均未显示任何 CND。在 ECA-CAGE 组 (8000 nL) 中,5 只大鼠中有 2 只没有表现出 CND,而其余 3 只大鼠出现 CND,其中 2 只在 24 小时内死亡。在 CCA-CAGE 组 (8000 nL) 中,所有动物都显示 CND,5 只动物中有 3 只存活时间不超过 48 小时。在空气量较低的 CCA-CAGE 组中,所有大鼠术后均存活。7000 nL 组的所有 5 只大鼠均表现出 CND,而在 6000 nL 组中,5 只大鼠中有 2 只表现出 CND。
| 出口委员会 | CCA | |||||||
| 假 | 8000 纳升 | 假 | 8000 纳升 | 7000 纳升 | 6000 纳升 | |||
| 包括 | 5 | 5 | 5 | 5 | 5 | 5 | ||
| 表现出临床神经功能缺损 | 0 | 3 | 0 | 5 | 5 | 2 | ||
| 24 <死亡率 | 0 | 2 | 0 | 2 | 0 | 0 | ||
| 死亡率 24-48 小时 | 0 | 0 | 0 | 1 | 0 | 0 | ||
| 排除的总数 | 3 | 4 | 1 | 0 | 2 | 1 | ||
| 因出血并发症而被排除 | 2 | 3 | 0 | 0 | 0 | 0 | ||
| 因血栓并发症而被排除 | 0 | 1 | 0 | 0 | 0 | 1 | ||
| 迷走神经压迫导致术中死亡 | 1 | 0 | 1 | 0 | 2 | 0 | ||
表 1:动物组包含和排除。 每组中的大鼠数量、包含和排除、死亡和临床神经功能缺损的存活率。
核磁共振成像
图 4 显示了通过 CCA 进入方法接受 7000 nL 气泡的大鼠的代表性 T2 加权图像,显示皮质高信号。在接受 7000 或 8000 nL 的 CCA-CAGE 组的所有动物中均观察到类似的异常,在 6000 nL 组和 ECA-CAGE 组中观察到的程度较小。值得注意的是,虽然假手术组中的动物均未显示任何 CND,但一只 ECA 假大鼠在 MRI 上表现出高信号区域;在 CCA-sham 组中,大鼠 MRI 上无异常。
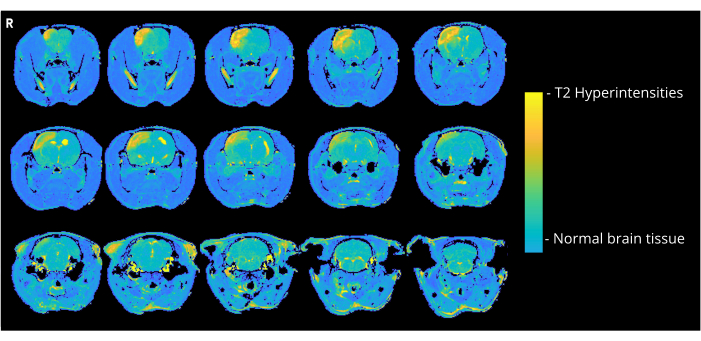
图 4:MRI 示例图像。 代表性的 T2 加权 MRI 图像 (CAGE 手术后 3 天) 显示 CCA-CAGE 7000 nL 组大鼠因 CAGE 引起的皮质高信号。 请单击此处查看此图的较大版本。
组织学
图 5 显示了 图 4 中 7000 nL CCA-CAGE 大鼠的代表性 H&E 染色脑切片,显示皮质缺血性脑损伤伴神经元细胞丢失和反应性神经胶质细胞增生,包括反应性星形胶质细胞增生和小胶质细胞活化。
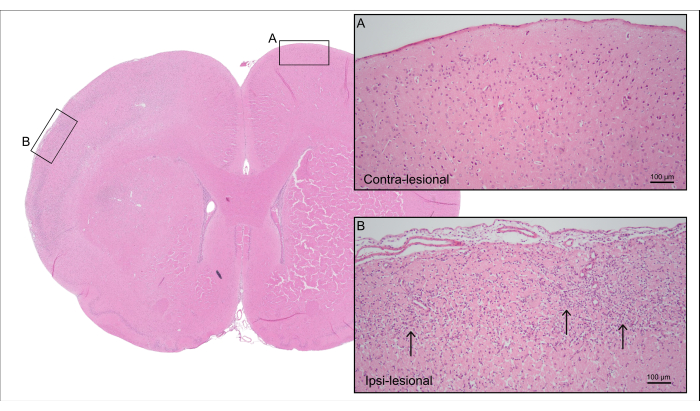
图 5:死后组织学。图 4 中大鼠的代表性 H&E 染色显示对侧皮质组织具有 (A) 完整神经元和 (B) 同侧病变侧具有缺血性皮质组织,伴有神经元细胞丢失和反应性神经胶质增生(箭头)。请单击此处查看此图的较大版本。
技术挑战
由于技术挑战,与 CCA 进入方法相比,ECA 进入方法的成功率要低得多(表 1)。这主要是由于 ECA 进入方法所需的导管长度较短,这经常导致导管脱位和出血。此外,ECA 进入方法还导致手术时间延长了大约 20 分钟,并且气泡直径的变化更大。
补充图 1:气泡发生器的详细信息。(A) 气泡发生器和毛细管拉拔器主体的图像突出了它们的组装和功能方面。(B) 气泡发生器的侧视图,从侧面显示其设计和结构特征。(C) 气泡发生器的正面视图,说明了关键的正面和特征。 请点击此处下载此文件。
补充图 2:运行软件的步骤。 该文件提供了有关有效运行和使用与气泡发生器相关的软件所要遵循的程序和步骤的详细指南。 请点击此处下载此文件。
补充文件 1:Python 代码。 代码由两个脚本(A 和 B)组成,这两个脚本应该保存在同一个文件夹中。 请点击此处下载此文件。
讨论
我们已经描述了如何使用两种方法将空气栓塞引入大鼠大脑动脉,并表明通过插入 CCA 的针头引入比通过导管栓塞到 ECA 的方法具有多种优势。具体来说,我们观察到 CCA 进入方法的并发症更少,气泡直径更一致,手术时间更短。CCA 进入方法导致剂量依赖性 CND,MRI 异常提示脑梗死,经组织学证实。
ECA 入门方法的最初选择受到 Gerriets 等人的启发7。然而,我们发现了这种方法的几个困难,包括与 CCA 进入方法相比气泡大小的巨大变化和更高的手术并发症发生率。这些并发症的主要来源与导管长度有关。在我们的模型中,使用短导管 (125 mm) 有助于保持气泡的稳定性,因为导管越长,气泡在流经导管时合并的可能性就越高9。然而,在 ECA 进入方法中,较长的导管有助于更容易放置和利用移动。在 ECA 进入方法中使用短导管会导致由于过度作而导致的 ECA 残端频繁脱位和恶化。
ECA 进入方法遇到的第二个困难是产生大小一致的气泡(图 6)。在 ECA 进入方法中,当导管插入 ECA 时,必须暂时停止盐水流经导管。当动脉血流恢复并且可以开始栓塞时,导管突然受到大鼠的血压。结果,这会导致血液逆行进入导管和气泡发生器。波动的血压对气泡发生器内部压力的影响导致气泡大小的变化更大,有时会导致圆柱形气泡充满通道(图 6B)。这可以通过在将导管定位到 ECA 之前增加系统内的压力来避免。这最好由第二个人完成,以便精确计时。此外,由于这种方法更耗时,因此与 CCA 进入方法相比,它会导致更多的盐水注入大鼠体内。在 CCA 进入法中,生理盐水连续流过导管,针头沿流经 CCA 的血流方向插入,从而解决了上述压力梯度问题。这导致没有回流到导管中,并且气泡大小更均匀。
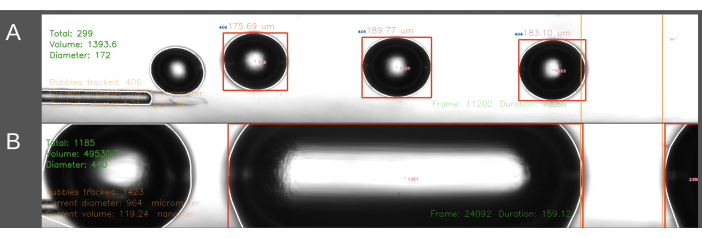
图 6:气泡产生的示例记录和分析。 图像显示屏幕截图,显示测量区域(绿色,左上角)中气泡总数、总体积和平均直径的实时分析。测量区域在右侧的橙色线条之间突出显示。气泡直径和体积是根据水平直径计算的。图像包括 (A) 成功生成的气泡和 (B) 未成功生成的圆柱形气泡的形成。 请单击此处查看此图的较大版本。
尽管 CCA 入场法是最受欢迎的,但我们仍然遇到了各种技术困难。首先,PPA 的制备具有挑战性,因为意外压迫迷走神经会导致呼吸抑制和随后的动物死亡12。为了降低这种风险,应该将大鼠稍微向侧面倾斜并从颅方向接近 PPA。此外,由于 ICA 和 PPA 分叉的解剖结构具有挑战性,存在血管损伤和无法控制的出血风险。这只能通过提高手术技能来规避。这些挑战凸显出,掌握大鼠的 CAGE 模型很复杂,需要大量的练习和精确度13。
拟议的气泡发生器技术设置有其局限性,特别是与定制的玻璃毛细管有关,因为它们很脆弱。在栓塞后调节三通阀以释放压力时,将气动调节器连接到毛细管的管道容易破裂。此外,更换毛细管需要破坏现有的毛细管,因为热缩橡胶会永久附着在毛细管上。此外,由于针尖直径和形状的微小差异,每个毛细管都具有独特的气泡特性。最后,通过气动调节器手动作气泡生成需要丰富的经验。不熟悉的处理会导致产生过大的气泡。使用 Python 代码的反馈回路进行自动压力调节可以提高未来研究的自动化精度。
我们详尽的文档,包括气泡发生器的技术规格、详细的手术方案和提供的软件,为这一研究领域做出了重要贡献。我们的 CCA 技术通过在整个手术过程中保持 CCA 流动并消除牺牲 ECA 的需要,确保对生理性脑灌注的干扰最小。我们的研究提供了一种可靠且可重复的实验模型来研究 CAGE 及其潜在的治疗方法。
披露声明
没有
致谢
这项研究由荷兰军事医疗保险基金会 (Stichting Ziektekosten Verzekering Krijgsmacht) 资助,资助号为 20-0232 和荷兰心脏基金会 2021 年 E. Dekker 资助(03-006-2021-T019 至 IAM)。我们还要感谢 Lindy Alles、Paul Bloemen 和 Ed van Bavel 的出色帮助。
材料
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
参考文献
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。