Method Article
Индукция газовой эмболии сосудов головного мозга у крыс
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол содержит подробное описание индуцирования эмболов мозгового воздуха у крыс. В нем сравнивают прямое введение в общую сонную артерию и введение через наружную сонную артерию. В нем содержится техническое описание генератора пузырьков воздуха, влияние различных объемов воздуха и процедурные проблемы.
Аннотация
Представлен методологический подход к доклиническим исследованиям церебральной артериальной газовой эмболии (КЕЙДЖ) – состояния, характеризующегося образованием пузырьков газа в мозговом кровообращении, вызывающим мультифокальную ишемию. В данной работе описаны два хирургических метода индуцирования CAGE у крысы: один с впрыском воздуха через наружную сонную артерию (ECA), тем самым жертвуя сосудом, и другой через прямую инъекцию в общую сонную артерию (CCA). Самцов крыс линии Wistar разделили на группы (n=5) для проведения либо ЭХА- или ССА-входа методом с введением различных объемов воздушных эмболов (6000, 7000 и 8000 нл), либо фиктивной хирургической операции. Для производства газовых эмболов одинакового размера был использован специально изготовленный генератор пузырьков, а для анализа пузырьков в режиме реального времени было разработано программное обеспечение с открытым исходным кодом. Сравнение двух методов показало, что подход CCA превосходит его с точки зрения последовательного образования пузырьков в генераторе пузырьков, сокращения времени эмболизации и меньшего количества осложнений.
Введение
Церебральная артериальная газовая эмболия (КЕЙДЖ) характеризуется размещением пузырьков газа в мозговом артериальном кровообращении, что приводит к спектру неврологических нарушений. Это состояние преимущественно известно как осложнение в дайвинге, когда чрезмерное расширение легких во время всплытия приводит к баротравме и попаданию воздуха в легочные вены, которые затем поступают в мозговые артерии1. В дополнение к этому хорошо известному явлению в дайвинге, медицинские работники все чаще признают CAGE как осложнение инвазивных медицинских процедур. Ятрогенная воздушная эмболия может возникать во время установки, обработки или удаления центральных венозных катетеров и дренажей грудной клетки, а также на протяжении всего курса открытых и эндоваскулярных процедур, включая вмешательства на сердечных клапанах, эндоваскулярные операции на грудной аорте и эндоваскулярную тромбэктомию при ишемическом инсульте 2,3. Несмотря на клиническую значимость, исследования CAGE, особенно с использованием животных моделей, остаются скудными ифрагментарными.
Со времени новаторского исследования Rosengren et al. в 1977 году на крысах, животные модели для CAGE претерпели значительныеусовершенствования. Подход, использованный Розенгреном, включал канюляцию общей сонной артерии (ОСА) для введения общего объема 10 мкл воздуха. Эта методика не обошлась без ограничений, в том числе из-за изменения гемодинамики вследствие перевязки артерий и неконтролируемого размера и чрезмерного объема воздушной эмболии. Метод Ферлоу, описанный в 1982 году, повысил точность воздушной эмболизации путем введения катетера во внутреннюю сонную артерию и введения общего объема воздуха 5 мкл. Однако, несмотря на то, что его важность была признана рано, концепция равномерного размера пузыря была реализована только десятилетия спустя. Gerriets et al. смогли получить постоянное количество пузырьков с одинаковым диаметром, первоначально 160 мкм, позже уменьшенным до 45 мкм 7,8. Хирургический метод, использованный здесь, требовал принесения в жертву наружной сонной артерии (ЭКА). Недавно Schaefer et al. представили менее инвазивный метод, вводя микрокатетер в ОСА через бедренную артерию, более точно имитируя сценарии воздушной эмболии, наблюдаемые во время эндоваскулярных процедур9. Их метод имел ограничение, заключающееся в том, что они не лигировали артериальные ветви ОСА (например, ЭКА и крыловидную артерию (ППА)), что позволяло пузырькам течь не только к нужным церебральным артериям, но и к нецеребральным территориям. Это может привести к непоследовательному ишемическому повреждению головного мозга, что осложняет воспроизводимость экспериментов.
Несмотря на достижения в области доклинических моделей CAGE, остаются проблемы в воспроизведении методов генерации пузырьков, стандартизации хирургических методов и приобретении устойчивых поражений головного мозга. В текущем исследовании представлен как традиционный хирургический подход, требующий отказа от ОСА, так и альтернативный метод, при котором пузырьки воздуха впрыскиваются непосредственно в ОСА. Мы сообщаем о подробных процедурах, проблемах и программном обеспечении с открытым исходным кодом для анализа пузырьков в режиме реального времени. Мы также включили технические детали, необходимые для создания генератора пузырьков.
протокол
Все процедуры с участием животных проводились в соответствии с Руководством по использованию и уходу за лабораторными животными. Мы получили полное одобрение Центрального комитета по экспериментам на животных Нидерландов (AVD11800202114839). Использовали самцов крыс Вистар с диапазоном массы 300 - 350 г. Животные размещались парами с пищей и водой в неограниченном количестве и 12-часовыми циклами света и темноты. По прибытии животные прошли 7-дневный период акклиматизации, прежде чем была начата какая-либо экспериментальная процедура.
ПРИМЕЧАНИЕ: Мы использовали два хирургических метода: метод ECA-entry и метод CCA-entry. Для обоих методов крысы были рандомизированы в группы Vehicle или 8000 нл CAGE с использованием инструмента статистического анализа. Лечение носителем включало только инъекцию физиологического раствора; При обработке CAGE использовались пузырьки воздуха в физиологическом растворе до объема 8000 нл, при этом каждый пузырь имел целевой диаметр 160 мкм. После завершения этой серии дальнейшая доработка модели с 6000 нл и 7000 нл (обе с диаметром пузырька 160 мкм) была произведена только с помощью метода CCA-entry. В случае неудачи процедуры замещающие крысы добавлялись для получения итоговых размеров групп n=5.
1. Генератор пузырьков воздуха
ПРИМЕЧАНИЕ: Генератор пузырьков воздуха (Рисунок 1, Рисунок 2 и Дополнительный рисунок 1A-C) состоит из нескольких специально изготовленных компонентов, которые генерируют и обнаруживают пузырьки газа одинакового размера.
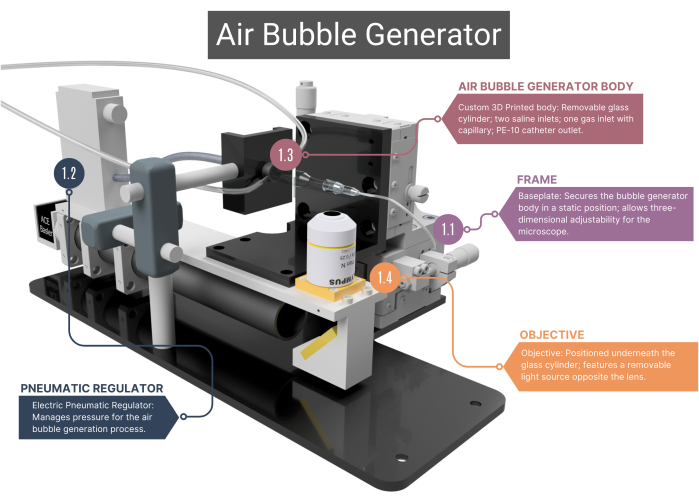
Рисунок 1: Обзор генератора пузырьков воздуха. Пузырьковый генератор состоит из опорной рамы (1.1) и пневматического регулятора для управления воздушным потоком (1.2). Он включает в себя напечатанный на 3D-принтере основной корпус со стеклянным капилляром (1.3), соединенным с объективом и высокоскоростной камерой (1.4). Дополнительные изображения см. на дополнительном рисунке 1A-C . Цифры соответствуют методологическим шагам в основном тексте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Рамка
- Используйте раму с изготовленной на заказ опорной пластиной из нержавеющей стали, которая обеспечивает статическое расположение основного корпуса генератора пузырей, в то время как объектив микроскопа, расположенный под ним, можно перемещать в трех измерениях. Эта возможность регулировки облегчается узлами XYZ, которые позволяют изменять поле зрения и фокусироваться на кончике микроканала и пузырьках воздуха.
- Пневматический регулятор
- Для подачи сжатого воздуха используйте электрический пневматический регулятор, который имеет диапазон давления от 0,001 до 0,1 МПа. Убедитесь, что регулятор подключен к стеклянному капилляру через внутривенную (IV) трубку, герметичную с помощью термоусадочной оплетки. Регулируйте давление, изменяя напряжение регулятора.
- Корпус генератора воздушных пузырьков
ПРИМЕЧАНИЕ: Основной корпус пузырькового генератора состоит из стеклянной камеры, пластикового внутреннего корпуса и стеклянного капилляра. Все компоненты тела должны быть герметичными, что исключает невозможность утечки воздуха или физиологического раствора.- Убедитесь, что изготовленная на заказ цилиндрическая стеклянная камера имеет внутренний диаметр (ID) 1000 μm, который сливается в микроканал с внутренним диаметром 400 μm. Выровняйте верхнюю сторону этого микроканала цилиндрической формы, чтобы получить оптимальный обзор через объектив.
- Установите внешний конец стеклянного цилиндра на иглу 21G со снятым наконечником. Внутрь этой иглы приклейте вторую иглу (27G, ID 210 μm). Вставьте эту иглу меньшего диаметра в микроканал и прикрепите ее к полиэтиленовому (PE-10) катетеру (внутренний диаметр 280 мкм, длина 125 мм).
- Установите пластиковый корпус на заднюю часть стеклянной камеры с двумя входными отверстиями из нержавеющей стали; Здесь может быть прикреплена трубка для внутривенного введения физиологического раствора. В задней части этого корпуса есть вход для газа через специальный стеклянный капилляр, который расположен с помощью резины с уплотнительным кольцом и фиксируется на месте с помощью завинчивающейся крышки.
- При использовании метода CCA-entry конец катетера должен быть прикреплен к игле (30G, внутренний диаметр 159 мкм) со снятым пластиковым корпусом замка Люэра и осторожно согнуть его под углом 45°.
- Регулировка под микроскопом
- Расположите объектив (4x) под корпусом пузырькового генератора и подключите его к высокоскоростной камере. Напротив объектива разместите регулируемый светодиодный источник света.
- Перед началом каждого эксперимента убедитесь, что линза объектива чистая. Загрязнение приведет к неправильному анализу пузырьков.
- Создание стеклянного капилляра
ПРИМЕЧАНИЕ: Процесс создания капилляров включает в себя значительный объем тонкой настройки. Хотя предоставленные настройки служат в качестве базового уровня, для достижения желаемого диаметра пузырьков могут потребоваться корректировки.- Сделайте стеклянный капилляр с помощью пуллера для микропипеток (дополнительный рисунок 1A-C). Чтобы создать пипетки, настройте нагреватели съемников микропипеток: установите левый нагреватель (No 1) на регулировку = 70, а правый нагреватель (No 2) на регулировку = 980.
- Поместите стеклянный капилляр в съемник и добавьте два блока весом 100 г, чтобы обеспечить правильную форму после процесса вытягивания. Нажмите кнопку Старт. После того, как процесс вытягивания завершен, образуются два капилляра.
- Разрежьте или разбейте каждый капилляр по диагонали на кончике с помощью светлопольного микроскопа. Форма и диаметр наконечника имеют решающее значение, так как они влияют на диаметр пузырьков газа. Чтобы обеспечить постоянство размера пузырьков в разных экспериментах, используйте один и тот же капилляр для желаемого диаметра пузырька.
- Вставьте стеклянный капиллярный наконечник в цилиндрический канал (внутренний диаметр 400 мкм) корпуса пузырькового генератора.
- Настройка генератора микропузырьков
- Подключите генератор пузырьков к шприцевому насосу со стерильным физиологическим раствором (50 мл) и запустите непрерывный поток со скоростью 20 мл/ч. Убедитесь, что в системе нет воздуха. Если воздух попал в систему, держите генератор пузырьков вертикально, чтобы воздух мог выйти через катетер.
- Включите источник света, камеру и программное обеспечение.
- Когда давление в системе будет правильным (примерно через 2 минуты), проверьте систему на наличие утечек газа или жидкости.
- Чтобы создать пузырьки, медленно увеличивайте давление, увеличивая напряжение, начиная с 2,1 В и продолжая до тех пор, пока газ не заполнит стеклянный капилляр. Это может занять некоторое время, но важно не торопиться с этой частью. Когда давление в стеклянном капилляре сравняется с давлением в канале, может начаться образование пузырьков газа. При простом увеличении напряжения до 2,6 В будут образовываться пузыри.
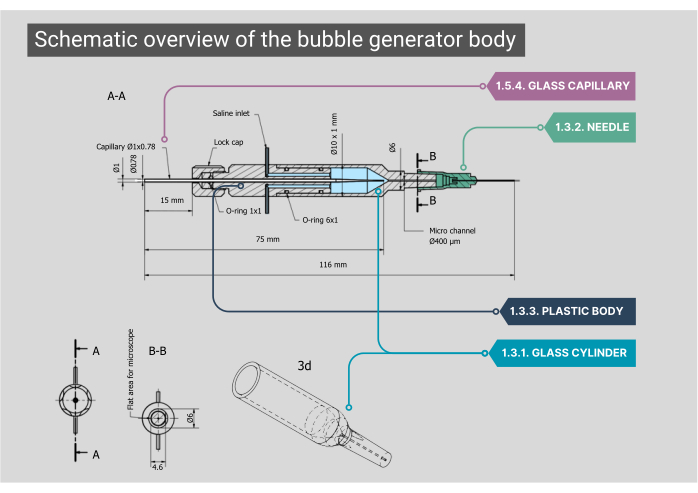
Рисунок 2: Схематический обзор корпуса генератора пузырьков. Подробный чертеж корпуса генератора пузырьков, включая размеры и аннотации для каждого компонента. Цифры соответствуют методологическим шагам в основном тексте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Обнаружение и анализ пузырьков газа
ПРИМЕЧАНИЕ: Код на языке Python (Дополнительный файл 1) предназначен для отслеживания и вычисления количества, диаметра и объема каждого газового пузыря в режиме реального времени. Во время производства газовых пузырей код обрабатывает каждый обнаруженный пузырь по мере его перемещения по полю зрения. Эти данные непрерывно отображаются в виде количества пузырьков, совокупного объема воздуха, среднего диаметра пузырьков и общей продолжительности записи. После каждой записи данные экспортируются в таблицу и .mp4 видеофайл.
- Настройки камеры (дополнительный рисунок 2)
- Когда генератор микропузырьков настроен правильно, включите камеру в Pylon Viewer. Выберите правильное усиление и порог.
- Найдите правильную область интереса, переместив оси X и Y генератора пузырьков, и увеличьте резкость, переместив ось Z.
- Чтобы оптимизировать частоту кадров (171 кадр в секунду), установите камеру на 2480 x 400 пикселей (ширина x высота). После завершения настройки камеры обязательно выключите ее в программе Pylon Viewer.
- Анализ пузырьков в режиме реального времени (дополнительный рисунок 2)
- Перед началом эксперимента проведите тестовый прогон сценария при создании пузырьков газа. Проверьте запись и при необходимости отрегулируйте порог и усиление.
- Чтобы начать анализ пузырьков, запустите код на языке Python. Код автоматически отобразит видео в реальном времени, количество пузырьков, диаметр и громкость.
3. Хирургия клетки
- Подготовка к операции
- Подготовьте операционную зону стерильной салфеткой под крысой и разложите все хирургические инструменты и швы на второй стерильной салфетке. Подготовьте необходимые лекарства.
- Убедитесь, что грелка с системой обратной связи установлена на 37 °C. Отрегулируйте микроскоп на правильную высоту.
- Извлеките крысу из домашней клетки и подготовьтесь к анестезии.
- Анестезия и предоперационная помощь
- Введите 0,05 мг/кг бупренорфина подкожно за 30 минут до операции.
- Обезболите крысу с использованием 4% изофлурана и 1 л/мин воздушной смеси (30% кислорода и 70% воздуха) в индукционной камере. После полного обезболивания взвесьте крысу и побрейте хирургическую область шеи с помощью электрической бритвы.
- Переместите крысу на операционный стол и переключите изофлуран на лицевую маску, чтобы поддерживать анестезию с 2%-2,5% изофлураном в воздушной смеси 70%/30%.
- Нанесите искусственные слезы на глаза, чтобы предотвратить высыхание. Смажьте температурный щуп и вставьте его ректально.
- Расположите крысу в положении лежа на спине и поместите шприц объемом 10 мл под шею для легкого доступа к операционной области.
- Закрепите передние лапы на операционном столе с помощью скотча. Продезинфицируйте операционную область скрабом на основе йода или хлоргексидина и спиртом несколько раз круговыми движениями, чтобы обеспечить стерильность. Подтвердите глубину анестезии ущипнутием пальца ноги.
- Надрез
- Сделайте скальпелем разрез по средней линии от грудинной выемки до нижней челюсти (примерно 1,5 см).
- С помощью двух пинцетов рассеките соединительную ткань (поверхностную шейную фасцию), обнажая нижележащие мышцы.
- Разделите левую и правую грудиноподъязычные мышцы, аккуратно разорвав соединительную ткань между ними.
- Определите и втяните следующие мышцы под ней: правую грудино-сосцевидную мышцу (втяните с помощью крючка для ткани латерально) и правую подъязычную мышцу (отведите с помощью крючка для ткани каудально-медиально). Должен быть виден правосторонний сонный треугольник (CCA, ECA, внутренняя сонная артерия (ICA))
- Хирургическая подготовка ОСА
- Подготовьте ОСА путем удаления вышележащей фасции и жировой ткани. Осторожно отделите ОСА от блуждающего нерва, не повреждая нерв. Не хватайте и не пережимайте нерв или его ветви. Только аккуратно оттолкните его от CCA. Не прикасайтесь к трахее и не прижимайтесь к ней во время подготовки сосудов.
- Наложите шов 3-0 вокруг ОСА с помощью изогнутого пинцета и закрепите нить гемостатиком. В дальнейшем это послужит повышению уровня CCA.
- Временная перевязка ЭХА, ВСА и их ветвей
- Найдите и выявите разветвления ECA и ICA. При необходимости очистите окружающую фасцию и жировую ткань. Временно перевязать ЭКА швом 3-0.
- Найдите затылочную артерию (ОА, в основном ответвляющуюся от ВСА, посередине между Y-образной бифуркацией ВСА и ЭХА) и верхнюю щитовидную артерию (ответвляющуюся от медиальной стороны ВСА). Эти мелкие ветви легко разрываются. Временно перевязать ОА швом 3-0 проксимально.
- После ВСА дистально следующей ветвью, движущейся латерально, является крыловидная небная артерия (ППА). Очистите окружающую его фасцию и жировую ткань, соблюдая при этом особую осторожность, чтобы не повредить блуждающий нерв. Временно перевязать PPA с помощью шва 3-0.
ПРИМЕЧАНИЕ: Рекомендуется подходить к ППА с краниального направления; Небольшой наклон крысы в сторону может облегчить доступ и визуализацию во время операции.
- Метод ECA-entry (Рисунок 3A)
- Перевязать артерии можно следующим образом: использовать шов из пункта 3.4.2. мягко и временно перевязывать CCA, обеспечивая остановку потока, но сводя к минимуму риск образования тромботических тромбов. Затем используйте шов 3-0 или сосудистый зажим, чтобы временно перевязать ICA и OA.
- Наложите два шва вокруг ЭКА: один проксимальный и один дистальный. Убедитесь, что дистальный шов включает верхнюю щитовидную артерию и затянут для постоянной остановки кровотока, в то время как проксимальный шов слабо завязан при дальнейшем использовании.
- Создайте артериотомию между двумя швами ЭКА с помощью сосудистых ножниц. На этой стадии кровотечения быть не должно.
- Вводите очищенный катетер от пузырькового генератора до тех пор, пока кончик не достигнет разветвления CCA. Затяните проксимальный шов, а затем переложите лигат и иссеките ECA дистальнее места артериотомии.
- Ослабьте лигатуры на ОСА и ВСА для восстановления кровотока и, в то же время, запустите подачу физиологического раствора через генератор пузырьков в катетер (шаг 1.6.3.). Подтвердите стабильность установки катетера и отсутствие утечки крови или физиологического раствора. Поверните культю ECA с введенным катетером примерно на 90° против часовой стрелки, чтобы поток из катетера шел в направлении ICA.
- Начните процесс эмболизации. Запустите код на Python и начните создание пузырьков воздуха, как описано в шаге 1.6.4.
- После завершения эмболизации временно остановите кровоток, затянув шовный / сосудистый зажим ВСА.
- Осторожно извлеките катетер и навсегда закройте проксимальный конец ЭХА, плотно завязав существующий шов.
- Аккуратно снимите шовные нити 3-0 и/или зажим с PPA, OA, ICA, CCA и CCA, чтобы обеспечить реперфузию. Удалите остатки крови вокруг области операции.
- Метод CCA-entry (Рисунок 3B)
- Продолжайте после шага 3.5.3; временно лигировать ЭХА проксимальнее верхней ветви щитовидной железы, близко к бифуркации.
- Начните прогон физиологического раствора через генератор пузырьков воздуха в катетер, но еще не начав производство пузырьков воздуха.
- Аккуратно увеличьте ОСА с помощью гемостатиков из шага 3.4.2. и приступайте к введению иглы, прикрепленной к катетеру генератора пузырьков, в просвет ОСА по направлению потока. Убедитесь, что отверстие иглы обращено вверх и что игла не проходит через противоположную стенку сосуда CCA.
- После введения снова медленно опустите гемостатики и сопутствующие ОСА, чтобы обеспечить реперфузию ОСА. Убедитесь, что вокруг места введения нет утечки крови или физиологического раствора.
- Начните процесс эмболизации, запустив код на Python и создание пузырьков воздуха, как описано в шаге 1.6.4.
- После завершения эмболизации снова поднимите ОСА и осторожно втяните иглу. Надавите ватным наконечником на место введения, сохраняя при этом высоту ОСА, чтобы остановить кровотечение.
- Продолжайте оказывать давление на место прокола. Аккуратно снимите хлопчатобумажный наконечник, раскатав его дистально вдоль CCA, используя минимальное давление, чтобы сгусток оставался нетронутым и оставался на месте. Для достижения гемостаза может потребоваться от 30 с до 5 минут.
ПРИМЕЧАНИЕ: У самок крыс закрытие места прокола может занять на несколько минут больше времени, чем у самцов крыс. - Осторожно извлеките швы 3-0 из ECA, ICA и CCA, чтобы обеспечить реперфузию. Опять же, убедитесь, что кровотечение навсегда остановилось, и при необходимости очистите остаточную кровь вокруг области операции.
- Закрытие и послеоперационный уход
- Отделите кожу от подкожной клетчатки шеи, чтобы облегчить наложение швов. Сшить кожу изогнутой иглой и 4-0 швов.
- Ввести подкожно бупивакаин в дозе 2,5 мг/мл (0,01 - 0,02 мл/кг) вокруг места разреза.
- Осторожно переложите животное в клетку для восстановления (33 - 35 °C) на 30-120 минут. В период восстановления животное не оставляют без присмотра до тех пор, пока оно не придет в сознание, достаточное для поддержания лежачего положения на грудине. Когда животное полностью выздоровеет, пересадите его обратно в домашнюю клетку. Поместите влажный корм в легкодоступное место внутри клетки.
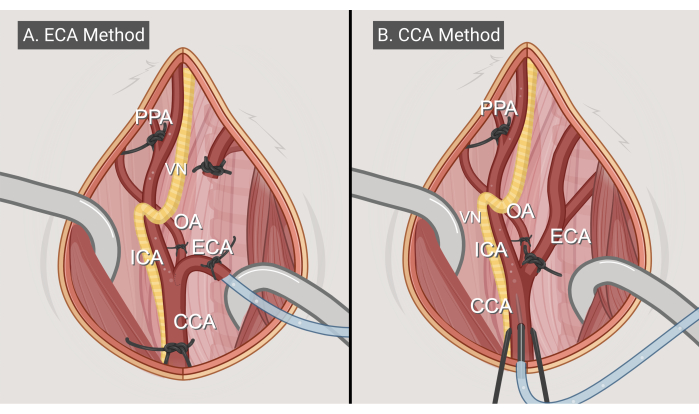
Рисунок 3: Методы хирургического вмешательства. Иллюстрации двух хирургических подходов: (А) метод ЭКА-входа и (В) метод ОСА-входа. Сокращения: CCA = общая сонная артерия; ECA = наружная сонная артерия; ICA = внутренняя сонная артерия; ОА = затылочная артерия; PPA = птеригопалатин; VN = блуждающий нерв. Фигурка выполнена с BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Последующие действия
- Мониторинг и гуманные конечные точки
- Наблюдение за животными в течение 7-дневного послеоперационного периода. Обеспечьте послеоперационную анальгезию подкожным бупренорфином в дозе 0,05 мг/кг в конце дня операции и повторно на следующее утро. Продолжайте ежедневное наблюдение за животными и при необходимости вводите дополнительные анальгетики на основе клинической оценки боли или дистресса. Усыпляйте крыс раньше, если достигнута гуманная конечная точка в соответствии с директивой 2010/63/ЕС Европейского парламента.
- Клинический неврологический дефицит
- Оцените клинический неврологический дефицит (КНД) в послеоперационные дни (например, в 1, 3 и 7 дни). Наше определение CND включает в себя снижение сгибания левой передней конечности (например, торможение разгибания передней конечности при поднятии крысы), неспособность ходить прямо или круговое поведение, аналогичное10 баллам по шкале Бедерсона. Используйте любые стандартизированные неврологические баллы или тесты для оценки двигательной функции и неврологического статуса.
- Магнитно-резонансная томография
- Проведите послеоперационную магнитно-резонансную томографию (МРТ) (например, в 1, 3, 5 и 7 дни) на системе МРТ мелких животных 7 Тл, обезболив крысу 1,2% - 2,5% изофлураном в смеси 0,5 л/мин медицинского воздуха и 0,5 л/мин кислорода. Непрерывно контролируйте дыхание и температуру.
- Получение Т2-взвешенных сканов с использованием следующих параметров последовательности: время повторения 2500 мс, время эхо 9 мс, расстояние между эхо-сигналами 9 мс и 10 эхо. Установите поле зрения на 35 x 35 мм с матрицей сбора данных 128 x 128. Толщина ломтика составляет 1,1 мм, всего получено 15 ломтиков, при этом сохраняется соотношение сторон 1,00 и используется один динамический захват.
- Гистологический анализ
- После завершения МРТ на7-е сутки (или при достижении экспериментальной конечной точки) поддерживать крысу под наркозом для эвтаназии с использованием сердечной перфузии 30 мл 0,1 М фосфат-буферного физиологического раствора с последующим введением 30 мл параформальдегида 4%.
- Извлеките мозг и зафиксируйте его на ночь в 4% параформальдегиде. После 24-часового периода фиксации мозг погрузить в парафин, сделать срез в корональные срезы и окрашивать гематоксилином и эозином (H&E) с использованием стандартного метода11.
Результаты
Неврологический исход
В таблице 1 представлен обзор всех включений и исключений в различных экспериментальных группах. Ни у одной из бутафорских крыс не было обнаружено никаких CND. В группе ECA-CAGE (8000 нл) у двух из пяти крыс не наблюдалось CND, в то время как у трех оставшихся крыс наблюдалась CND, из которых две умерли в течение 24 часов. В группе CCA-CAGE (8000 нл) у всех животных наблюдался CND, трое из пяти не дожили до 48 ч. В группах CCA-CAGE с меньшим объемом воздуха все крысы выжили после операции. У всех пяти крыс в группе 7000 нл наблюдался ХНД, тогда как в группе 6000 нл у двух из пяти крыс наблюдался ХНД.
| ЭКА | КЦА | |||||||
| притворство | 8000 нл | притворство | 8000 нл | 7000 нл | 6000 нл | |||
| Включенный | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Проявленный клинический неврологический дефицит | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Смертность < 24 ч | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Смертность 24-48 ч | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Без учета общего количества | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Исключен из-за осложнения кровотечения | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Исключен из-за тромботического осложнения | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Интраоперационная смерть в результате сдавления блуждающего нерва | 1 | 0 | 1 | 0 | 2 | 0 | ||
Таблица 1: Включение и исключение групп животных. Количество крыс в каждой группе, включения и исключения, смертность и выживаемость с клиническим неврологическим дефицитом.
МРТ
На рисунке 4 показано репрезентативное Т2-взвешенное изображение крысы, которая получала 7000 нл пузырьков воздуха с помощью метода CCA-entry, демонстрируя гиперинтенсивность коры головного мозга. Аналогичные аномалии наблюдались у всех животных в группе CCA-CAGE, получавших 7000 или 8000 нл, и в меньшей степени в группе 6000 нл и группе ECA-CAGE. Примечательно, что в то время как ни у одного из животных в фиктивных группах не было обнаружено никаких CND, у одной крысы ECA-фикции наблюдалась область гиперинтенсивности на МРТ; в группе CCA-sham ни у одной крысы не было обнаружено аномалий на МРТ.
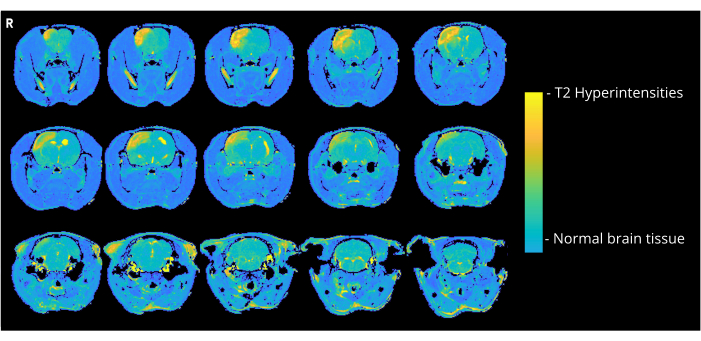
Рисунок 4: Примеры изображений МРТ. Репрезентативные Т2-взвешенные МРТ-изображения (через 3 дня после операции CAGE), показывающие гиперинтенсивность коры головного мозга из-за CAGE у крысы группы CCA-CAGE 7000 nL. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Гистология
На рисунке 5 показан репрезентативный окрашенный H&E срез мозга крысы с температурой 7000 нл CCA-Cage с рисунка 4, демонстрирующий ишемическое повреждение коры головного мозга с потерей нейрональных клеток и реактивным глиозом, включая реактивный астроглиоз и активацию микроглии.
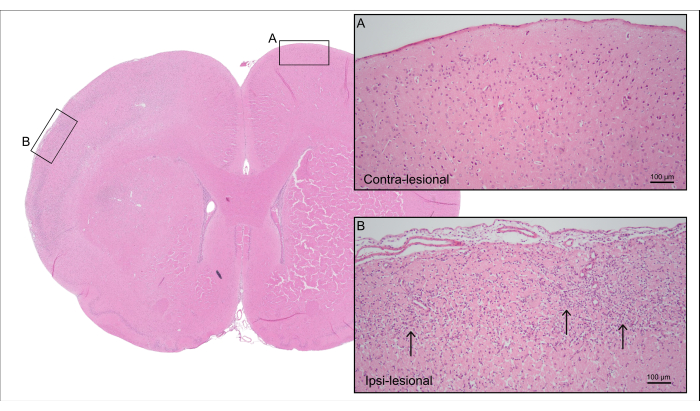
Рисунок 5: Посмертная гистология. Репрезентативное H&E окрашивание крысы на рисунке 4 , показывающее кортикальную ткань контрацепционной стороны с (А) интактными нейронами и (В) ипси-пораженную сторону с ишемизированной кортикальной тканью с потерей нейрональных клеток и реактивным глиозом (стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Технические проблемы
Из-за технических сложностей метод ввода ECA имел значительно более низкий процент успеха по сравнению с методом ввода CCA (Таблица 1). В основном это было связано с короткой длиной катетера, необходимой при методе ECA-entry, что часто приводило к вывиху катетера и кровотечению. Кроме того, метод ECA-entry также привел к увеличению времени операции примерно на 20 минут, а также к большему изменению диаметра пузырьков.
Дополнительный рисунок 1: Детали генератора воздушных пузырьков. (A) Изображения корпуса генератора пузырьков и капиллярного съемника подчеркивают их сборку и функциональные аспекты. (B) Вид сбоку на пузырьковый генератор, показывающий его конструкцию и конструктивные особенности с боковой перспективы. (C) Фронтальный вид генератора пузырей, иллюстрирующий ключевые фронтальные аспекты и особенности. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Шаги по запуску программного обеспечения. В этом файле содержится подробное руководство по процедурам и шагам, которые необходимо выполнить для эффективной работы и использования программного обеспечения, связанного с генератором воздушных пузырьков. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Код на Python. Код состоит из двух скриптов (A и B), которые должны быть сохранены в одной папке. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Мы описали, как вводить воздушные эмболии в мозговые артерии крыс с помощью двух методов, и показали, что введение через иглу, введенную в ОСА, имеет множество преимуществ по сравнению с методом, который включает эмболизацию через катетер в ЭХА. В частности, мы наблюдали меньшее количество осложнений при использовании метода CCA-entry, а также более постоянный диаметр пузырьков и сокращение времени операции. Метод CCA-entry приводит к дозозависимому CND и аномалиям на МРТ, указывающим на инфаркт головного мозга, что подтверждается гистологией.
Первоначальный выбор метода ECA-entry был вдохновлен Gerriets et al.7. Тем не менее, мы выявили несколько трудностей с этим подходом, в том числе значительные различия в размере пузырьков и более высокую частоту хирургических осложнений по сравнению с методом CCA-entry. Основной источник этих осложнений связан с длиной катетера. В нашей модели использование короткого катетера (125 мм) помогло сохранить стабильность пузырьков, потому что чем длиннее катетер, тем выше вероятность слияния пузырьков при прохождении через катетер9. Однако при использовании метода ECA-entry более длинный катетер облегчает его размещение и использование для движения. Использование короткого катетера при методе ECA-entry приводит к частым вывихам и ухудшению состояния культи ECA из-за чрезмерных манипуляций.
Вторая трудность, возникшая при использовании метода ECA-entry, связана с созданием пузырьков одинакового размера (рис. 6). При использовании метода ввода ЭХА поток физиологического раствора через катетер должен быть временно остановлен, пока катетер вставляется в ЭХА. Когда артериальный кровоток восстанавливается и может начаться эмболизация, катетер внезапно подвергается воздействию артериального давления крысы. В результате это приводит к тому, что кровь ретроградно поступает в катетер и генератор пузырьков. Влияние колебаний артериального давления на давление внутри генератора пузырьков приводит к более значительному изменению размера пузырьков, иногда приводя к заполнению канала пузырьками цилиндрической формы (Рисунок 6B). Этого можно избежать, увеличив давление внутри системы перед размещением катетера в ECA. Лучше всего это делать второму человеку для точного определения времени. Кроме того, поскольку этот метод является более трудоемким, он приводит к вливанию крысе большего количества физиологического раствора, чем метод CCA-entry. При методе CCA-entry физиологический раствор непрерывно протекает через катетер, а игла вводится в направлении потока крови через CCA, тем самым решая проблему градиента давления, описанную выше. Это приводит к отсутствию обратного потока в катетер и более равномерному размеру пузырьков.
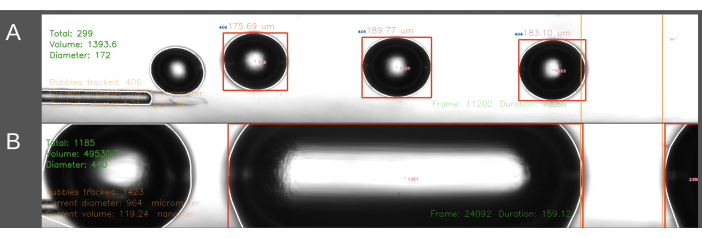
Рисунок 6: Пример записи и анализа производства пузырьков. Изображения отображают скриншоты, показывающие анализ в режиме реального времени общего количества пузырьков, общего объема и среднего диаметра в области измерения (зеленый цвет, верхний левый угол). Область измерения выделена между оранжевыми линиями справа. Диаметр и объем пузырьков рассчитываются на основе горизонтального диаметра. Изображения включают образование (А) успешно сгенерированных пузырьков воздуха и (В) неудачно сгенерированных цилиндрических пузырьков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Несмотря на то, что метод CCA-entry был излюбленным, мы все равно сталкивались с различными техническими трудностями. Во-первых, приготовление ППА является сложной задачей, так как случайное сдавливание блуждающего нерва может привести к угнетению дыхания и последующей смерти животного12. Чтобы снизить этот риск, следует слегка наклонить крысу вбок и подойти к ППА со стороны черепа. Кроме того, из-за сложной анатомии ВСА и бифуркации ППА существует риск повреждения сосудов и неконтролируемого кровотечения. Обойти это можно только путем совершенствования хирургических навыков. Эти проблемы подчеркивают, что освоение модели CAGE на крысах является сложным процессом и требует значительной практики и точности.
Предлагаемая техническая конфигурация генератора пузырьков воздуха имеет свои ограничения, в частности, связанные со стеклянными капиллярами, изготовленными на заказ, из-за их хрупкости. Трубка, соединяющая пневматический регулятор с капилляром, подвержена поломке при регулировке трехходового клапана для сброса давления после эмболизации. Кроме того, замена капилляра требует разрушения существующего капилляра из-за того, что к нему постоянно прикреплена термоусадочная резина. Кроме того, каждый капилляр обладает уникальными характеристиками пузырьков из-за незначительных различий в диаметре и форме кончика. Наконец, ручное управление генерацией пузырьков с помощью пневматического регулятора требовало значительного опыта. Неопытное обращение может привести к образованию чрезмерно крупных пузырей. Автоматизированное регулирование давления с петлей обратной связи из кода Python может повысить автоматизированную точность в будущих исследованиях.
Наша тщательная документация, включающая в себя как технические характеристики генератора пузырьков, так и подробный хирургический протокол, а также программное обеспечение, вносит важный вклад в эту область исследований. Наша методика ОСА обеспечивает минимальное нарушение физиологической перфузии головного мозга, поддерживая поток ОСА на протяжении всей процедуры и устраняя необходимость жертвовать ОСА. Наше исследование предоставляет надежную и воспроизводимую экспериментальную модель для изучения CAGE и его потенциальных методов лечения.
Раскрытие информации
Никакой
Благодарности
Это исследование было профинансировано Нидерландским фондом страхования военного здравоохранения (Stichting Ziektekosten Verzekering Krijgsmacht) в рамках гранта No 20-0232 и грантом Голландского фонда сердца 2021 года E. Dekker (03-006-2021-T019 в IAM). Мы также благодарим Линди Аллес, Пола Бломена и Эда ван Бавела за их выдающуюся помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Ссылки
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены