Method Article
ラットにおける脳動脈ガス塞栓症の誘発
* これらの著者は同等に貢献しました
要約
このプロトコルは、ラットにおける脳内空気塞栓の誘導についての詳細な説明を提供します。総頸動脈への直接注射と外部頸動脈を介した導入を比較します。気泡発生器の技術的な説明、さまざまな空気量の影響、および手順上の課題について説明します。
要約
私たちは、脳循環内のガス泡が多巣性虚血を引き起こす状態である脳動脈ガス塞栓症(CAGE)の前臨床研究のための方法論的アプローチを提示します。現在の研究では、ラットにCAGEを誘導する2つの外科的方法について説明しています:1つは外部頸動脈(ECA)を介して空気を注入し、それによって血管を犠牲にする方法、もう1つは総頸動脈(CCA)への直接注射によるものです。雄のWistarラットを使用し、グループ(n = 5)に分けて、異なる空気塞栓容積(6000、7000、および8000 nL)の注入を伴うECAまたはCCAエントリー法または偽手術を受けました。カスタムメイドの気泡発生器を使用して、一貫したサイズのガス塞栓を製造し、リアルタイムの気泡分析のためのオープンソースソフトウェアを開発しました。2つの方法の比較により、CCAアプローチは、バブルジェネレーター内での一貫したバブル生成、塞栓時間の短縮、および合併症の減少の点で優れていることが明らかになりました。
概要
脳動脈ガス塞栓症(CAGE)は、脳動脈循環内に気泡が滞留することを特徴とし、さまざまな神経障害を引き起こします。この状態は主にダイビングの合併症として知られており、浮上中に肺が過度に拡張すると、気圧外傷と肺静脈への空気の侵入が発生し、それが脳動脈に流れ込みます1。ダイビングでのこのよく知られた出来事に加えて、医療専門家はCAGEを侵襲的な医療処置の合併症としてますます認識しています。医原性空気塞栓症は、中心静脈カテーテルおよび胸腔ドレーンの配置、取り扱い、または除去中に発生する可能性があるだけでなく、虚血性脳卒中における心臓弁インターベンション、胸部血管内大動脈修復、血管内血栓摘出術などの開腹および血管内処置の過程を通じて発生する可能性があります 2,3。その臨床的意義にもかかわらず、CAGEに関する研究、特に動物モデルを用いた研究は、まばらで断片化されたままである4。
1977年にRosengrenらがラットを用いた先駆的な研究を行って以来、CAGEの動物モデルは大幅な改良が加えられてきた5。Rosengrenが採用したアプローチには、総頸動脈(CCA)のカニューレ挿入が含まれ、総量10μLの空気を導入しました。この技術は、動脈結紮による血行動態の変化や、空気塞栓6の制御されていないサイズと過剰な量など、制限がないわけではありませんでした。1982年に報告されたFurlowの方法は、カテーテルを内頸動脈に進め、総空気量5μLを投与することにより、空気塞栓術の精度を向上させました。しかし、その重要性は早くから認識されていましたが、均一なバブルサイズの概念が実装されたのは数十年後のことでした。Gerrietsらは、最初は160μm、後に45μmに減少した均一な直径で、一貫した数の気泡を生成することができた7,8。ここで使用された外科的方法は、外頸動脈(ECA)を犠牲にする必要がありました。最近、Schaeferらは、大腿動脈を介してCCAにマイクロカテーテルを挿入することにより、より侵襲性の低い方法を導入しました。これは、血管内処置中に見られる空気塞栓症のシナリオをより正確に模倣しています9。彼らの方法には、CCAの動脈枝(ECAや翼状口蓋動脈(PPA)など)を結紮しないという制限があり、それにより気泡が目的の大脳動脈だけでなく、非脳領域にも流れることができました。これにより、一貫性のない脳虚血性損傷が生じ、実験の再現性が複雑になる可能性があります。
前臨床CAGEモデルの進歩にもかかわらず、気泡発生技術の複製、手術方法の標準化、一貫した脳病変の獲得には課題が残っています。現在の研究では、ECAを犠牲にする必要がある従来の外科的アプローチと、気泡をCCAに直接注入する代替方法の両方を紹介しています。詳細な手順、課題、およびリアルタイムのバブル分析のためのオープンソースソフトウェアを報告します。また、バブルジェネレーターの構築に必要な技術的な詳細も含まれています。
プロトコル
動物に関するすべての手続きは、「実験動物の使用および手入れに関する手引き」に従って実施されました。オランダ中央動物実験委員会(AVD11800202114839)から全面的な承認を得ました。体重範囲が300〜350gの雄Wistarラットを使用しました。動物は、餌 と水と ペアで自由自在に、12時間の明暗サイクルで飼育されました。到着後、動物は実験手順が開始される前に7日間の順応期間を受けました。
注:ECAエントリー法とCCAエントリー法の2つの外科的方法を使用しました。どちらの手法についても、ラットを統計分析ツールを使用してVehicleまたは8000nL CAGEグループに無作為に割り付けました。ビヒクル治療には生理食塩水注射のみが含まれていました。CAGE処理では、生理食塩水中の気泡を8000nLの容量まで使用し、各気泡の目標直径は160μmでした。このシリーズの完成後、6000 nLと7000 nL(どちらも気泡径160 μm)のモデルは、CCAエントリー法によってのみ改良されました。手続き上の失敗の場合、代替ラットを追加して、n=5 の最終グループサイズを得ました。
1.気泡発生器
注意: 気泡発生器(図1、 図2、および 補足図1A-C)は、同じサイズの気泡を生成および検出するいくつかのカスタムメイドコンポーネントで構成されています。
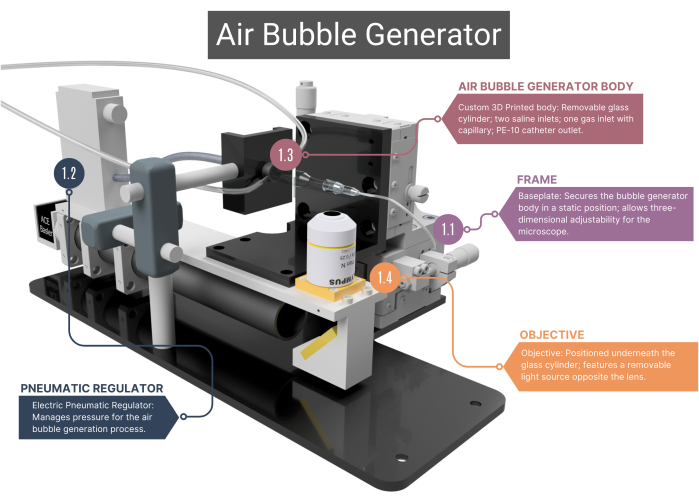
図1:気泡発生器の概要。 気泡発生器は、支持フレーム(1.1)と気流管理用の空気圧レギュレーター(1.2)で構成されています。ガラスキャピラリー(1.3)を収容する3Dプリントされた本体と、対物レンズと高速度カメラ(1.4)にリンクされた本体が含まれています。その他の画像については 、補足図1A-C を参照してください。番号は、本文の方法論的な手順に対応しています。 この図の拡大版を表示するには、ここをクリックしてください。
- フレーム
- カスタムメイドのステンレス製ベースプレートを備えたフレームを使用して、バブルジェネレーターの本体の静的な位置決めを確保し、その下に配置された顕微鏡対物レンズを3次元で動かすことができます。この調整機能は、視野の変更を可能にし、マイクロチャネルと気泡の先端に焦点を合わせることができるXYZアセンブリによって促進されます。
- 空気圧調整器
- 圧縮空気の供給には、圧力範囲が0.001〜0.1MPaの電動空気圧レギュレーターを使用します。レギュレーターが静脈内(IV)チューブを介してガラスキャピラリーに接続され、熱収縮スリーブでエアシールされていることを確認します。レギュレーターの電圧を変更して圧力を調整します。
- 気泡発生装置本体
注:バブルジェネレーターの本体は、ガラスチャンバー、プラスチック製の内部ハウジング、およびガラスキャピラリーで構成されています。ボディのすべてのコンポーネントは、空気や生理食塩水が漏れないように、気密性を確保する必要があります。- カスタムメイドの円筒形ガラスチャンバーの内径(ID)が1000μmで、IDが400μmのマイクロチャネルに合流していることを確認します。この円筒形のマイクロチャネルの上面を平らにして、対物レンズを通して最適なビューを取得します。
- ガラスシリンダーの外端を21Gの針に取り付け、先端を取り外して取り付けます。この針の内側に、2本目の針(27G、内径210μm)を接着します。この小径の針をマイクロチャネルに装着し、ポリエチレン(PE-10)カテーテル(内径280μm、長さ125mm)に取り付けます。
- ガラスチャンバーの背面にプラスチック製のボディを取り付けます。ガラスチャンバーには2つのステンレス製のインレットがあります。ここでは、生理食塩水の挿入用のIVチューブを取り付けることができます。このボディの後部には、Oリングゴムで配置され、キャップをねじ込むことで所定の位置にロックされたカスタムガラスキャピラリーを通るガスの入口があります。
- CCAエントリー方式は、プラスチック製のルアーロックハウジングを取り外した状態でカテーテルの端を針(30G、内径159μm)に取り付け、慎重に45°の角度に曲げます。
- 顕微鏡の調整
- 対物レンズ(4x)をバブルジェネレーター本体の下に配置して、ハイスピードカメラに接続します。レンズの反対側に、調整可能なLED光源を配置します。
- 各実験を開始する前に、対物レンズが汚れていないことを確認してください。汚れがあると、気泡解析が正しく行われません。
- ガラスキャピラリーの創製
注:キャピラリーを作成するプロセスには、かなりの量の微調整が含まれます。提供されている設定はベースラインとして機能しますが、目的の気泡直径を達成するために調整が必要な場合があります。- マイクロピペットプーラーを使用してガラスキャピラリーを作成します(補足図1A-C)。ピペットを作成するには、マイクロピペットプーラーヒーターをセットアップします:左側のヒーター(No.1)を調整= 70に、右側のヒーター(No.2)を調整= 980に設定します。
- ガラスキャピラリーをプーラーに置き、100 gの重りのブロックを2つ追加して、引っ張りプロセス後に正しい形状を確保します。 [スタート]を押します。引っ張り工程が完了すると、2本のキャピラリーが形成されます。
- 明視野顕微鏡を使用して、各毛細血管を先端で斜めに切断または切断します。チップの形状と直径は、気泡の直径に影響を与えるため、非常に重要です。実験間で気泡サイズの一貫性を確保するには、目的の気泡直径に同じキャピラリーを使用します。
- ガラスキャピラリーチップを気泡発生装置本体の円筒形チャネル(内径400μm)に挿入します。
- マイクロバブルジェネレーターのセットアップ
- 滅菌生理食塩水(50 mL)を入れたシリンジポンプにバブルジェネレーターを接続し、20 mL/hで連続流を開始します。システムに空気が閉じ込められていないことを確認してください。システムに空気が閉じ込められている場合は、気泡発生器を垂直に保持して、空気がカテーテルを通って逃げるようにします。
- 光源、カメラ、ソフトウェアの電源を入れます。
- システムが適切な圧力(約2分後)になったら、システムにガスまたは液体の漏れがないか確認します。
- 気泡を発生させるには、2.1 Vから始まり、ガスがガラスキャピラリーを満たすまで電圧を上げて圧力をゆっくりと上げます。これには時間がかかる場合がありますが、この部分を急がないことが重要です。ガラスキャピラリー内の圧力がチャネル内の圧力と等しくなると、気泡の生成を開始できます。電圧を2.6Vまで上げるだけで、気泡が発生します。
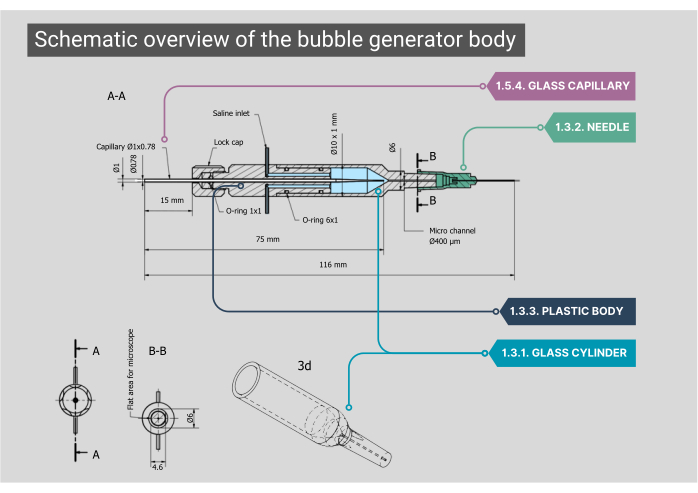
図2:バブルジェネレーター本体の概略図。 バブル ジェネレータ本体の詳細な設計図(各コンポーネントの寸法と注釈を含む)。番号は、本文の方法論的な手順に対応しています。 この図の拡大版を表示するには、ここをクリックしてください。
2. 気泡の検出と分析
注:Pythonコード(補足ファイル1)は、各気泡の数、直径、および体積をリアルタイムで追跡および計算するように設計されています。気泡の生成中、コードは検出された各気泡が視野内を移動するときに処理します。このデータは、気泡の数、空気の累積体積、平均気泡の直径、および記録の合計時間として連続的に表示されます。録画のたびに、データはスプレッドシートにエクスポートされ、ビデオファイル.mp4。
- カメラの設定(補足図2)
- マイクロバブルジェネレーターが正しく設定されている場合は、Pylon Viewerでカメラの電源を入れます。正しいゲインとスレッショルドを選択します。
- バブルジェネレーターのX軸とY軸を動かして正しい関心領域を見つけ、Z軸を動かしてシャープネスを高めます。
- フレームレート(171 fps)を最適化するには、カメラを2480 x 400ピクセル(幅x高さ)に設定します。カメラのセットアップが完了したら、Pylon Viewerでカメラの電源を切ってください。
- リアルタイムバブル解析(補足図2)
- 実験を開始する前に、気泡を生成しながらスクリプトのテストを実行します。録音を確認し、必要に応じてしきい値とゲインを調整します。
- バブルの解析を開始するには、Python コードを実行します。このコードは、ライブビデオ、バブルカウント、直径、ボリュームを自動的に表示します。
3. ケージ手術
- 手術の準備
- ラットの下に滅菌布で手術領域を準備し、すべての手術器具と縫合糸を2番目の滅菌布に広げます。必要な薬を準備します。
- フィードバックシステム付きの加熱パッドが37°Cに設定されていることを確認します。 顕微鏡を正しい高さに調整します。
- ラットを家のケージから取り出し、麻酔の準備をします。
- 麻酔と術前ケア
- 手術の30分前に0.05 mg / kgブプレノルフィンを皮下投与します。.
- 誘導チャンバー内で 4% イソフルランと 1 L/min の空気混合物 (30% 酸素と 70% 空気) を使用してラットに麻酔をかけます。完全に麻酔をかけたら、ラットの体重を量り、電気カミソリを使用して手術頸部を剃ります。
- ラットを手術台に移動し、イソフルランを顔面マスクに切り替えて、70%/ 30%の空気混合物で2%〜2.5%のイソフルランで麻酔を維持します。.
- 乾燥を防ぐために目に人工涙液を塗布します。温度プローブに注油し、直腸に挿入します。
- ラットを仰臥位に置き、10mLの注射器を首の下に置いて、手術部位に簡単にアクセスできるようにします。
- 前足をテープで手術台に固定します。手術部位をヨウ素またはクロルヘキシジンベースのスクラブとアルコールで円を描くように数回消毒し、無菌性を確保します。つま先をつまんで麻酔の深さを確認します。
- 切開
- 胸骨の切り欠きから下顎骨の下(約1.5cm)までメスで正中線を切開します。
- 2本のピンセットを使用して結合組織(表在性頸部筋膜)を解剖し、下にある筋肉を露出させます。
- 左右の胸骨舌骨筋を分離し、その間の結合組織を優しく引き裂きます。
- 右胸骨乳様突起筋(ティッシュフックを横方向に引っ込める)と右舌骨筋(ティッシュフックを尾側内側に引っ込める)の下にある次の筋肉を特定して引っ込めます。右側の頸動脈三角形(CCA、ECA、内頸動脈(ICA))が見えるはずです。
- CCAの外科的準備
- その上にある筋膜と脂肪組織を取り除いてCCAを準備します。迷走神経からCCAを神経を損傷することなく慎重に分離します。神経やその枝をつかんだりつまんだりしないでください。CCAからそっと押し離すだけです。血管の準備中は、気管に触れたり押したりしないでください。
- 湾曲したピンセットを使用してCCAの周りに3-0縫合糸を配置し、止血剤で糸を固定します。これは後にCCAを向上させるのに役立ちます。
- ECA、ICA、およびそれらのブランチの一時的な結紮
- ECA と ICA 分岐点を見つけて公開します。必要に応じて、周囲の筋膜と脂肪組織をクリアにします。ECAを3-0縫合糸で一時的に結紮します。
- 後頭動脈(OA、主にICAから分岐し、ICAとECA起源のY字型分岐部の中央)と上甲状腺動脈(ECAの内側から分岐)を見つけます。これらの小さな枝は簡単に破裂します。近位に3-0縫合糸でOAを一時的に結紮します。
- ICAを遠位に続いて、横方向に移動する次の分岐は翼状口蓋動脈(PPA)です。迷走神経を傷つけないように細心の注意を払いながら、周囲の筋膜と脂肪組織をきれいにします。PPAを3-0縫合糸で一時的に結紮します。
注:頭蓋方向からPPAにアプローチすることをお勧めします。ラットを少し横に傾けると、手術中のアクセスと視覚化が容易になります。
- ECAエントリー方式(図3A)
- 次のように動脈を結紮します:ステップ3.4.2の縫合糸を使用します。CCAを穏やかかつ一時的にライゲーションし、流れが止まるようにしますが、血栓性血栓を生成するリスクを最小限に抑えます。次に、3-0縫合糸または血管クリップを使用して、ICAとOAを一時的に結紮します。
- ECAの周囲に2つの縫合糸を当てます:1つは近位、もう1つは遠位です。遠位縫合糸が上甲状腺動脈を含み、血流を永久に止めるために引き締まっていることを確認し、近位縫合糸はさらに使用するときに緩く結ばれていることを確認してください。
- 血管はさみを使用して、ECAの2つの縫合糸の間に動脈切開術を作成します。この段階では出血はないはずです。
- 気泡発生器から脱気されたカテーテルを、先端がCCAの分岐点に達するまで挿入します。近位縫合糸を締めてから、動脈切開部位の遠位にあるECAを結紮して切除します。
- CCAとICAの結紮糸を緩めて血流を回復させると同時に、気泡発生器を通ってカテーテルへの生理食塩水の流れを開始します(ステップ1.6.3)。カテーテル留置の安定性と、血液や生理食塩水の漏れがないことを確認します。カテーテルを挿入した状態でECA切り株を反時計回りに約90°回転させ、カテーテルからの流れがICAの方向に進むようにします。
- 塞栓術を開始します。Python コードを開始し、ステップ 1.6.4 で説明されているように気泡の作成を開始します。
- 塞栓術が終了したら、ICA縫合糸/血管クランプを締めて血流を一時的に停止します。
- カテーテルを取り外し、既存の縫合糸をしっかりと結んで、ECAの近位端を慎重に永久に閉じます。
- 3-0縫合糸および/またはクランプをPPA、OA、ICA、およびCCAからそっと取り外して、再灌流を可能にします。手術部位の周囲に残った血液をきれいにします。
- CCAエントリー方式(図3B)
- ステップ3.5.3の後に進みます。ECAを上甲状腺枝から近位に、分岐部の近くに一時的に結紮します。
- 気泡発生器を介して生理食塩水をカテーテルに流し込みますが、まだ気泡の生成は開始しません。
- ステップ3.4.2の止血剤を使用してCCAを穏やかに上昇させます。.気泡発生装置のカテーテルに取り付けられた針をCCAの内腔に流れ方向に挿入する。針の開口部が上を向いており、針がCCAの反対側の血管壁を貫通していないことを確認してください。
- 挿入後、止血剤と付随するCCAを再度ゆっくりと下げて、CCAの再灌流を可能にします。.挿入部位の周囲に血液や生理食塩水が漏れていないことを確認してください。
- Pythonコードを開始し、ステップ1.6.4で説明されているように気泡を作成することにより、塞栓形成プロセスを開始します。
- 塞栓術が完了したら、CCAを再度持ち上げ、針を慎重に引っ込めます。CCAの高さを保ちながら、挿入部位にコットンチップで圧力をかけ、出血を止めます。
- 穿刺部位に圧力をかけ続けます。綿の先端をCCAに沿って遠位に転がしてゆっくりと取り外し、最小限の圧力で血栓が邪魔されず、所定の位置に留まるようにします。止血を達成するには30秒から5分かかる場合があります。
注:雌ラットでは、穿刺部位を閉じるのに雄ラットよりも数分長くかかる場合があります。 - ECA、ICA、およびCCAから3-0縫合糸を慎重に取り出して、再灌流を可能にします。繰り返しになりますが、出血が永久に止まったことを確認し、必要に応じて手術部位の周囲に残っている血液をきれいにします。
- 閉鎖と術後ケア
- 縫合を容易にするために、首の皮下組織から皮膚を分離します。湾曲した針と4-0縫合糸で皮膚を縫合します。
- 切開部位の周囲にブピバカイン2.5 mg / mL(0.01 - 0.02 mL / kg)を皮下投与します。.
- 動物を回復ケージ(33〜35°C)に30〜120分間慎重に移します。回復期間中、動物は胸骨の横臥位を維持するのに十分な意識を取り戻すまで、放置されません。動物が完全に回復したら、ホームケージに戻します。濡れたチャウはケージ内の手の届きやすいところに置きます。
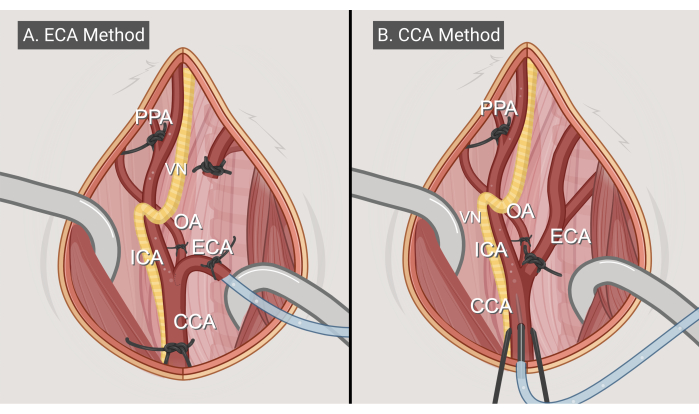
図3:手術方法。 2つの外科的アプローチ、(A)ECAエントリー法と(B)CCAエントリー法の図。略語:CCA =総頸動脈;ECA =外部頸動脈;ICA = 内頸動脈;OA =後頭動脈;PPA =翼状口蓋;VN = 迷走神経。BioRender.com で作られたフィギュア。この図の拡大版を表示するには、ここをクリックしてください。
4. フォローアップ
- 監視と人道的なエンドポイント
- 術後7日間動物を監視します。手術日の終わりと翌朝に 0.05 mg/kg のブプレノルフィンを皮下投与して術後鎮痛剤を投与します。動物を毎日監視し続け、痛みや苦痛の臨床評価に基づいて必要に応じて追加の鎮痛薬を投与します。.人道的なエンドポイントが欧州議会の指令2010/63 / EUに従って達成された場合、ラットを早期に安楽死させます。
- 臨床的神経学的欠損
- 術後の数日間 (たとえば、1 日目、3 日目、7 日目) の臨床的神経学的欠損 (CND) を評価します。CNDの定義には、左前肢の屈曲の減少(たとえば、ラットを飼育している間の前肢の伸展の抑制)、まっすぐ歩くことができない、またはベダーソンスコア10と同様に旋回行動が含まれます。標準化された神経学的スコアリングまたはテストを使用して、運動機能と神経学的状態を評価します。
- 磁気共鳴画像法
- 術後磁気共鳴画像法 (MRI) (たとえば、1、3、5、および 7 日目) を 7 T 小動物 MRI システムで実施し、ラットは 0.5 L/分の医療用空気と 0.5 L/分の酸素の混合物で 1.2% - 2.5% イソフルランで麻酔されます。呼吸と体温を継続的に監視します。
- 次のシーケンスパラメータを使用してT2強調スキャンを取得します:繰り返し時間2500ミリ秒、エコー時間9ミリ秒、エコー間隔9ミリ秒、および10エコー。視野を 35 x 35 mm に設定し、取得マトリックスを 128 x 128 に設定します。スライスの厚さは 1.1 mm で、合計 15 個のスライスが取得され、アスペクト比は 1.00 に維持され、1 つのダイナミック取得が使用されます。
- 組織学的解析
- 7日目 (または実験エンドポイントに到達)のMRIの完了後、30 mLの0.1 Mリン酸緩衝生理食塩水とそれに続く30 mLのパラホルムアルデヒド4%による心臓灌流を使用して、安楽死のための麻酔下でラットを維持します。
- 脳を取り出し、4%パラホルムアルデヒドで一晩後固定します。24時間の固定期間後、脳をパラフィンに埋め込み、冠状切片でスライスし、標準的な方法11を使用してヘマトキシリンとエオシン(H&E)で染色します。
結果
神経学的転帰
表1 は、さまざまな実験群にわたるすべての包含と除外の概要を示しています。偽手術を受けたラットはいずれもCNDを示さなかった。ECA-CAGE群(8000nL)では、ラットの5匹中2匹はCNDを示さなかったが、残りの3匹のラットはCNDを経験し、そのうち2匹は24時間以内に死亡した。CCA-CAGE群(8000nL)では、すべての動物がCNDを示し、5匹中3匹は48時間まで生存しなかった。空気量が少ないCCA-CAGE群では、すべてのラットが術後に生存した。7000nLのグループの5匹のラットすべてがCNDを示しましたが、6000nLのグループでは、5匹中2匹のラットがCNDを示しました。
| ECAの | CCAの | |||||||
| 真似事 | 8000 nL | 真似事 | 8000 nL | 7000 nL | 6000 nL | |||
| 含ま | 5 | 5 | 5 | 5 | 5 | 5 | ||
| 臨床的神経学的欠損を示した | 0 | 3 | 0 | 5 | 5 | 2 | ||
| 死亡率<24時間 | 0 | 2 | 0 | 2 | 0 | 0 | ||
| 死亡率 24-48時間 | 0 | 0 | 0 | 1 | 0 | 0 | ||
| 除外合計 | 3 | 4 | 1 | 0 | 2 | 1 | ||
| 出血性合併症のため除く | 2 | 3 | 0 | 0 | 0 | 0 | ||
| 血栓性合併症のため除外 | 0 | 1 | 0 | 0 | 0 | 1 | ||
| 迷走神経圧迫による術中死亡 | 1 | 0 | 1 | 0 | 2 | 0 | ||
表1:動物群の包含と除外。 各グループのラットの数、包含と除外、死亡、および臨床的神経学的欠損の生存率。
MRI検査
図4は、CCAエントリー法により7000nLの気泡を受容したラットの代表的なT2強調画像を示しており、皮質の高信号を示しています。同様の異常は、7000または8000nLを投与されたCCA-CAGEグループのすべての動物に見られ、6000nLグループとECA-CAGEグループでは程度は低いが見られた。注目すべきは、偽群の動物はいずれもCNDを示さなかったが、1匹のECA偽ラットはMRIで高信号領域を示した。CCA-shamグループでは、MRIで異常を示したラットはいませんでした。
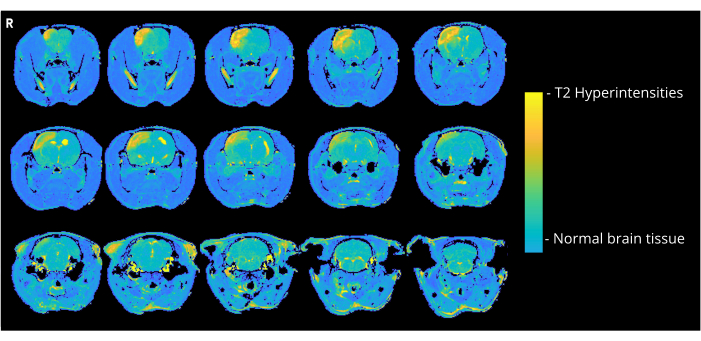
図4:MRIサンプル画像。 CCA-CAGE 7000 nL 群のラットにおける CAGE による皮質高信号を示す代表的な T2 強調 MRI 画像 (CAGE 手術の 3 日後)。 この図の拡大版を表示するには、ここをクリックしてください。
組織学
図5は、 図4の7000 nL CCA-CAGEラットの代表的なH&E染色脳切片を示しており、ニューロン細胞の喪失と反応性神経膠症を伴う皮質虚血性脳損傷(反応性アストログリア症やミクログリア活性化を含む)を示しています。
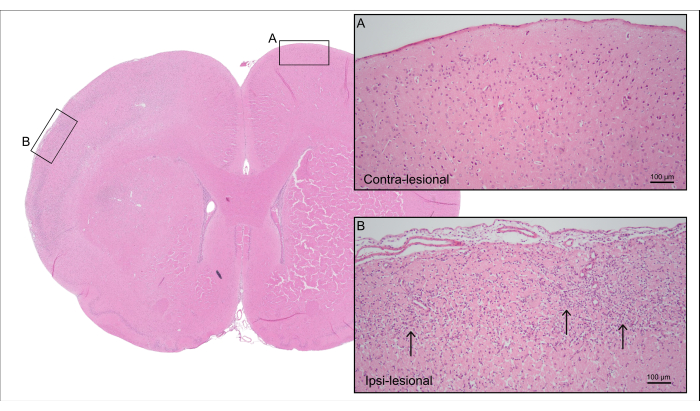
図5:死後組織学。図4のラットの代表的なH&E染色は、(A)無傷のニューロンを持つ対病巣側の皮質組織と、(B)ニューロン細胞の喪失と反応性神経膠症を伴う虚血性皮質組織を持つ同種病変側の皮質組織を示しています(矢印)。この図の拡大版を表示するには、ここをクリックしてください。
技術的な課題
技術的な課題により、ECAエントリー法はCCAエントリー法と比較して成功率が大幅に低かった(表1)。これは主に、ECAエントリー法で必要とされるカテーテルの長さが短いことに起因しており、カテーテルの脱臼や出血が頻繁に発生しました。さらに、ECAエントリー法では、手術時間が約20分長くなり、気泡径のばらつきも大きくなりました。
補足図1:気泡発生器の詳細。(A) 気泡発生器とキャピラリープーラーの本体の画像は、それらの組み立てと機能面を強調しています。(B)バブルジェネレーターの側面図、側面からの設計と構造的特徴を示す。(C)気泡発生器の正面図、主要な正面の側面と特徴を示しています。 このファイルをダウンロードするには、ここをクリックしてください。
補足図 2: ソフトウェアの実行手順。 このファイルは、気泡発生器に関連付けられたソフトウェアを効果的に実行および利用するために従うべき手順と手順に関する詳細なガイドを提供します。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:Pythonコード。 コードは、同じフォルダ内に保存する必要がある 2 つのスクリプト (A と B) で構成されます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
2つの方法を使用してラットの脳動脈に空気塞栓を導入する方法を説明し、CCAに挿入された針を介した導入には、カテーテルを介したECAへの塞栓術を含む方法よりも複数の利点があることを示しました。具体的には、CCAエントリー法による合併症の減少、気泡径の均一化、手術時間の短縮が認められました。CCAエントリー法は、用量依存的なCNDを生じ、MRIで脳梗塞を示す異常が組織学で確認されました。
ECAエントリー法の最初の選択は、Gerrietsら7に触発されました。しかし、このアプローチには、CCAエントリー法と比較して、バブルサイズの大幅なばらつきや外科的合併症の発生率が高いなど、いくつかの困難が特定されました。これらの合併症の主な原因は、カテーテルの長さに関連しています。我々のモデルでは、短いカテーテル(125mm)を使用すると、カテーテルが長いほど、気泡がカテーテルを流れるときに合流する確率が高くなるため、気泡の安定性を維持するのに役立った9。ただし、ECAエントリー方式では、カテーテルが長いほど、配置と動きのレバレッジが容易になります。ECAエントリー法で短いカテーテルを使用すると、過度の操作によりECA断端が頻繁に脱臼し、劣化します。
ECAエントリー法で遭遇した2番目の問題は、一貫したサイズのバブルの作成に関するものでした(図6)。ECAエントリー法では、カテーテルがECAに挿入されている間、カテーテルを通る生理食塩水の流れを一時的に停止する必要があります。動脈の流れが回復し、塞栓術を開始できるようになったら、カテーテルは突然ラットの血圧にさらされます。その結果、血液が逆行性してカテーテルや気泡発生器に入ることになります。変動する血圧が気泡発生器内の圧力に及ぼす影響により、気泡サイズの変動が大きくなり、場合によっては円筒形の気泡がチャネルを埋め尽くすことがあります(図6B)。これは、カテーテルをECAに配置する前にシステム内の圧力を上げることで回避できます。これは、正確なタイミングのために2人目が行うのが最適です。さらに、この方法は時間がかかるため、CCAエントリー法よりもラットに大量の生理食塩水を注入することになります。CCAエントリー法では、カテーテル内を生理食塩水が連続的に流れ、CCAを通る血流方向に針が挿入されるため、上述の圧力勾配の問題が解決されます。これにより、カテーテルへの逆流がなくなり、気泡サイズがより均一になります。
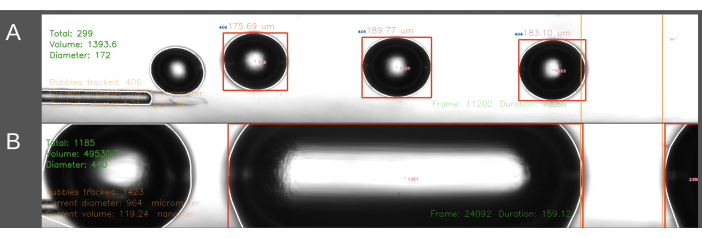
図6:バブル生成の記録と分析の例。 画像は、測定エリア内の気泡の総数、総体積、および平均直径のリアルタイム分析を示す画面グラブを表示します(緑、左上隅)。測定エリアは、右側のオレンジ色の線で強調表示されています。気泡の直径と体積は、水平方向の直径に基づいて計算されます。画像には、(A)正常に生成された気泡と(B)正常に生成されなかった円筒形の気泡の形成が含まれます。 この図の拡大版を表示するには、ここをクリックしてください。
CCAエントリー方式が好評だったにもかかわらず、様々な技術的な問題に遭遇しました。第一に、迷走神経の偶発的な圧迫が呼吸の低下とその後の動物の死をもたらす可能性があるため、PPAの準備は困難です12。このリスクを減らすには、ラットを少し横に傾け、頭蓋方向からPPAに近づく必要があります。さらに、ICAとPPAの分岐部の解剖学的構造が困難なため、血管の損傷や制御不能な出血のリスクがあります。これは、手術技術を向上させることによってのみ回避できます。これらの課題は、ラットでCAGEモデルを習得することは複雑であり、かなりの練習と精度が必要であることを浮き彫りにしています13。
気泡発生器の提案された技術的セットアップには、特にカスタムメイドのガラスキャピラリーに関連する、その脆弱性のために制限があります。空気圧レギュレーターをキャピラリーに接続するチューブは、塞栓術後の圧力解放のために三方弁を調整するときに破損しやすくなります。さらに、キャピラリーを交換するには、熱収縮ゴムが恒久的に取り付けられているため、既存のキャピラリーを破壊する必要があります。また、各キャピラリーは、先端の直径や形状のわずかな違いにより、独自の気泡特性を持っています。最後に、空気圧レギュレーターによる気泡発生の手動操作には、かなりの経験が必要でした。取り扱いの経験が浅いと、過度に大きな気泡が発生する可能性があります。Pythonコードからのフィードバックループによる自動圧力調整は、将来の研究で自動精度を向上させる可能性があります。
気泡発生器の技術仕様、詳細な手術プロトコル、ソフトウェアの提供の両方を網羅した当社の徹底的な文書化は、この研究分野に重要な貢献をしています。当社のCCA技術は、処置全体を通してCCAの流れを維持し、ECAを犠牲にする必要性をなくすことにより、生理学的脳灌流の混乱を最小限に抑えます。私たちの研究は、CAGEとその潜在的な治療法を調査するための信頼性と再現性のある実験モデルを提供します。
開示事項
何一つ
謝辞
この研究は、助成金番号20-0232でオランダ軍事医療保険財団(Stichting Ziektekosten Verzekering Krijgsmacht)とオランダ心臓財団2021 E.デッカー助成金(03-006-2021-T019からIAMまで)によって資金提供されました。また、Lindy Alles氏、Paul Bloemen氏、Ed van Bavel氏の多大なる支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
参考文献
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved