Method Article
Induzione dell'embolia gassosa arteriosa cerebrale nel ratto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo fornisce una descrizione dettagliata dell'induzione di emboli aerostatici cerebrali nei ratti. Confrontando l'iniezione diretta nell'arteria carotide comune e l'introduzione attraverso l'arteria carotide esterna. Fornisce una descrizione tecnica del generatore di bolle d'aria, l'effetto dei diversi volumi d'aria e le sfide procedurali.
Abstract
Presentiamo un approccio metodologico per la ricerca preclinica dell'embolia gassosa arteriosa cerebrale (CAGE), una condizione caratterizzata da bolle di gas all'interno della circolazione cerebrale che causano ischemia multifocale. Il presente lavoro descrive due metodi chirurgici per indurre la CAGE nel ratto: uno con iniezione di aria attraverso l'arteria carotide esterna (ECA), sacrificando così il vaso, e uno tramite iniezione diretta nell'arteria carotide comune (CCA). I ratti maschi Wistar sono stati utilizzati e divisi in gruppi (n=5) per sottoporsi al metodo di ingresso ECA o CCA con iniezione di diversi volumi di emboli d'aria (6000, 7000 e 8000 nL) o a un intervento chirurgico fittizio. È stato utilizzato un generatore di bolle su misura per produrre emboli di gas di dimensioni costanti ed è stato sviluppato un software open source per l'analisi delle bolle in tempo reale. Il confronto tra i due metodi ha rivelato che l'approccio CCA è superiore in termini di produzione costante di bolle all'interno del generatore di bolle, riduzione del tempo di embolizzazione e minori complicanze.
Introduzione
L'embolia gassosa arteriosa cerebrale (CAGE) è caratterizzata dall'allettamento di bolle di gas all'interno della circolazione arteriosa cerebrale, che portano a uno spettro di compromissioni neurologiche. Questa condizione è prevalentemente nota come complicanza nelle immersioni, dove l'eccessiva espansione dei polmoni durante la risalita provoca barotrauma e l'ingresso di aria nelle vene polmonari, che poi fluiscono verso le arterie cerebrali1. Oltre a questo evento ben noto nelle immersioni, i professionisti medici stanno riconoscendo sempre più la CAGE come una complicanza delle procedure mediche invasive. L'embolia gassosa iatrogena può verificarsi durante il posizionamento, la manipolazione o la rimozione dei cateteri venosi centrali e dei drenaggi toracici, nonché durante il corso di procedure aperte ed endovascolari, inclusi interventi sulle valvole cardiache, riparazioni endovascolari dell'aorta toracica e trombectomia endovascolare nell'ictus ischemico 2,3. Nonostante la sua importanza clinica, la ricerca su CAGE, in particolare utilizzando modelli animali, rimane scarsa e frammentata4.
Dallo studio pionieristico di Rosengren et al. nel 1977 con i ratti, i modelli animali per CAGE hanno subito un significativo perfezionamento5. L'approccio impiegato da Rosengren prevedeva l'incannulamento dell'arteria carotide comune (CCA) per introdurre un volume totale di 10 μL di aria. Questa tecnica non era priva di limitazioni, tra cui l'emodinamica alterata dovuta alla legatura arteriosa e le dimensioni incontrollate e il volume eccessivo dell'embolo d'aria6. Il metodo di Furlow, descritto nel 1982, ha migliorato la precisione dell'embolizzazione dell'aria facendo avanzare un catetere nell'arteria carotide interna e somministrando un volume d'aria totale di 5 μL. Tuttavia, sebbene la sua importanza sia stata riconosciuta presto, il concetto di dimensione uniforme delle bolle è stato implementato solo decenni dopo. Gerriets et al. sono stati in grado di produrre un numero consistente di bolle con un diametro uniforme, inizialmente 160 μm, successivamente ridotto a 45 μm 7,8. Il metodo chirurgico utilizzato qui richiedeva il sacrificio dell'arteria carotide esterna (ECA). Recentemente, Schaefer et al. hanno introdotto un metodo meno invasivo inserendo un microcatetere nel CCA attraverso l'arteria femorale, imitando più accuratamente gli scenari di embolia gassosa osservati durante le procedure endovascolari9. Il loro metodo aveva il limite di non legare i rami arteriosi del CCA (ad esempio, ECA e arteria pterigopalatina (PPA)), consentendo così alle bolle non solo di fluire verso le arterie cerebrali desiderate, ma anche verso i territori non cerebrali. Ciò può comportare un danno ischemico cerebrale incoerente, complicando la riproducibilità degli esperimenti.
Nonostante i progressi nei modelli preclinici CAGE, permangono sfide nella replicazione delle tecniche di generazione di bolle, nella standardizzazione dei metodi chirurgici e nell'acquisizione di lesioni cerebrali coerenti. L'attuale studio introduce sia un approccio chirurgico convenzionale che richiede il sacrificio dell'ECA sia un metodo alternativo in cui le bolle d'aria vengono iniettate direttamente nel CCA. Segnaliamo procedure dettagliate, sfide e software open source per l'analisi delle bolle in tempo reale. Includiamo anche i dettagli tecnici necessari per costruire un generatore di bolle.
Protocollo
Tutte le procedure che coinvolgono gli animali sono state condotte in conformità con la Guida per l'uso e la cura degli animali da laboratorio. Abbiamo ottenuto la piena approvazione dal Comitato Centrale per gli Esperimenti Animali dei Paesi Bassi (AVD11800202114839). Sono stati utilizzati ratti Wistar maschi con un intervallo di peso compreso tra 300 e 350 g. Gli animali sono stati alloggiati in coppia con cibo e acqua ad libitum e cicli luce-buio di 12 ore. All'arrivo, gli animali sono stati sottoposti a un periodo di acclimatazione di 7 giorni prima di iniziare qualsiasi procedura sperimentale.
NOTA: Abbiamo utilizzato due metodi chirurgici, il metodo ECA-entry e il metodo CCA-entry. Per entrambe le tecniche, i ratti sono stati randomizzati in gruppi Vehicle o 8000 nL CAGE utilizzando uno strumento di analisi statistica. Il trattamento del veicolo includeva solo l'iniezione di soluzione salina; Il trattamento CAGE ha utilizzato bolle d'aria in soluzione salina fino a un volume di 8000 nL, con ogni bolla con un diametro target di 160 μm. Dopo il completamento di questa serie, un ulteriore perfezionamento del modello con 6000 nL e 7000 nL (entrambi con diametro della bolla di 160 μm) è stato effettuato solo attraverso il metodo di ingresso CCA. In caso di fallimento procedurale, sono stati aggiunti ratti di ricambio per ottenere dimensioni finali del gruppo di n=5.
1. Generatore di bolle d'aria
NOTA: Il generatore di bolle d'aria (Figura 1, Figura 2 e Figura supplementare 1A-C) è costituito da diversi componenti su misura che generano e rilevano bolle di gas di uguali dimensioni.
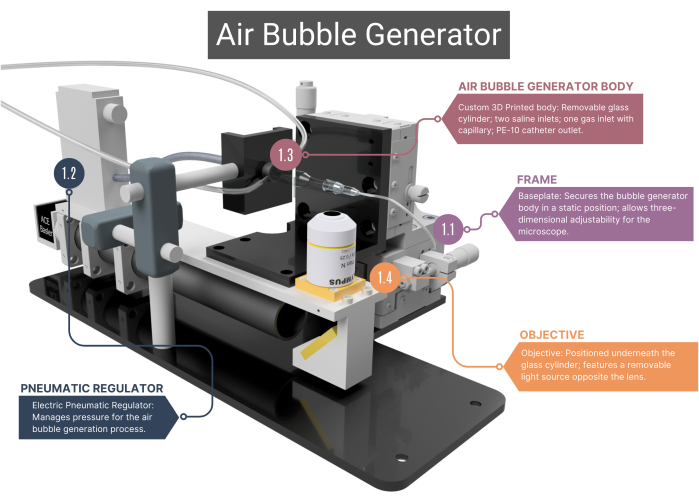
Figura 1: Panoramica del generatore di bolle d'aria. Il generatore di bolle è costituito da un telaio di supporto (1.1) e da un regolatore pneumatico per la gestione del flusso d'aria (1.2). Include un corpo principale stampato in 3D che ospita un capillare di vetro (1,3), collegato a un obiettivo e a una telecamera ad alta velocità (1,4). Vedere la Figura supplementare 1A-C per ulteriori immagini. I numeri corrispondono ai passaggi metodologici del testo principale. Clicca qui per visualizzare una versione più grande di questa figura.
- Cornice
- Utilizzare un telaio con una piastra di base in acciaio inossidabile realizzata su misura che garantisce il posizionamento statico del corpo principale del generatore di bolle, mentre l'obiettivo del microscopio posizionato sotto di esso può essere spostato in tre dimensioni. Questa capacità di regolazione è facilitata dai gruppi XYZ che consentono di alterare il campo visivo e di mettere a fuoco la punta del microcanale e le bolle d'aria.
- Regolatore pneumatico
- Per l'alimentazione dell'aria compressa, utilizzare un regolatore pneumatico elettrico, che ha un intervallo di pressione da 0,001 a 0,1 MPa. Assicurarsi che il regolatore sia collegato al capillare di vetro attraverso un tubo endovenoso (IV), sigillato ad aria con guaina termoretraibile. Regolare la pressione modificando la tensione del regolatore.
- Corpo generatore di bolle d'aria
NOTA: Il corpo principale del generatore di bolle è costituito da una camera di vetro, un alloggiamento interno in plastica e un capillare in vetro. Tutti i componenti del corpo devono essere ermetici, garantendo che non siano possibili perdite d'aria o soluzione salina.- Assicurarsi che la camera cilindrica in vetro su misura abbia un diametro interno (ID) di 1000 μm che si fonde in un microcanale con un ID di 400 μm. Appiattire il lato superiore di questo microcanale di forma cilindrica per ottenere una visione ottimale attraverso l'obiettivo.
- Montare l'estremità esterna del cilindro di vetro su un ago da 21G con la punta rimossa. All'interno di questo ago, incollare un secondo ago (27G, ID 210 μm). Inserire questo ago di diametro inferiore nel microcanale e collegarlo a un catetere in polietilene (PE-10) (ID 280 μm, lunghezza 125 mm).
- Montare un corpo in plastica sul retro della camera in vetro, che presenta due ingressi in acciaio inox; qui può essere fissato il tubo IV per l'ingresso della soluzione salina. La parte posteriore di questo corpo ha un ingresso per il gas attraverso un capillare di vetro personalizzato che viene posizionato con gommini O-ring e bloccato in posizione avvitando un tappo.
- Per il metodo di inserimento CCA, collegare l'estremità del catetere a un ago (30G, ID 159 μm) con l'alloggiamento Luer-lock in plastica rimosso e piegarlo con cura a un angolo di 45°.
- Regolazione del microscopio
- Posizionare l'obiettivo (4x) sotto il corpo del generatore di bolle e collegarlo a una telecamera ad alta velocità. Di fronte alla lente, posizionare una sorgente luminosa a LED regolabile.
- Prima dell'inizio di ogni esperimento, assicurarsi che la lente dell'obiettivo sia pulita. Lo sporco provocherà analisi errate delle bolle.
- Creazione del capillare in vetro
NOTA: Il processo di creazione dei capillari comporta una notevole quantità di messa a punto. Sebbene le impostazioni fornite servano come linea di base, potrebbero essere necessarie regolazioni per ottenere il diametro della bolla desiderato.- Realizzare il capillare di vetro utilizzando un estrattore per micropipette (Figura supplementare 1A-C). Per creare le pipette, predisporre i riscaldatori dell'estrattore per micropipette: impostare il riscaldatore sinistro (n. 1) sulla regolazione = 70 e il riscaldatore destro (n. 2) sulla regolazione = 980.
- Posizionare il capillare di vetro nell'estrattore e aggiungere due blocchi di 100 g di peso per garantire la forma corretta dopo il processo di trazione. Premere Start. Una volta completato il processo di estrazione, si formano due capillari.
- Tagliare o rompere ogni capillare in diagonale sulla punta utilizzando un microscopio a campo chiaro. La forma e il diametro della punta sono fondamentali in quanto influenzano il diametro delle bolle di gas. Per garantire la coerenza delle dimensioni delle bolle tra gli esperimenti, utilizzare lo stesso capillare per il diametro della bolla desiderato.
- Inserire la punta del capillare in vetro nel canale cilindrico (ID 400 μm) del corpo del generatore di bolle.
- Configurazione del generatore di microbolle
- Collegare il generatore di bolle a una pompa a siringa con soluzione fisiologica sterile (50 mL) e avviare un flusso continuo a 20 mL/h. Assicurarsi che non vi sia aria intrappolata nel sistema. Nel caso in cui l'aria sia intrappolata nel sistema, tenere il generatore di bolle in verticale in modo che l'aria possa fuoriuscire attraverso il catetere.
- Accendi la fonte di luce, la fotocamera e il software.
- Quando il sistema è alla pressione corretta (dopo circa 2 minuti), controllare il sistema per perdite di gas o fluidi.
- Per creare bolle, aumentare lentamente la pressione aumentando la tensione, partendo da 2,1 V e continuando fino a quando il gas non riempie il capillare di vetro. Questo potrebbe richiedere del tempo, ma è importante non affrettare questa parte. Quando la pressione nel capillare di vetro è uguale a quella nel canale, può iniziare la produzione di bolle di gas. Aumentando semplicemente la tensione fino a 2,6 V, si producono delle bolle.
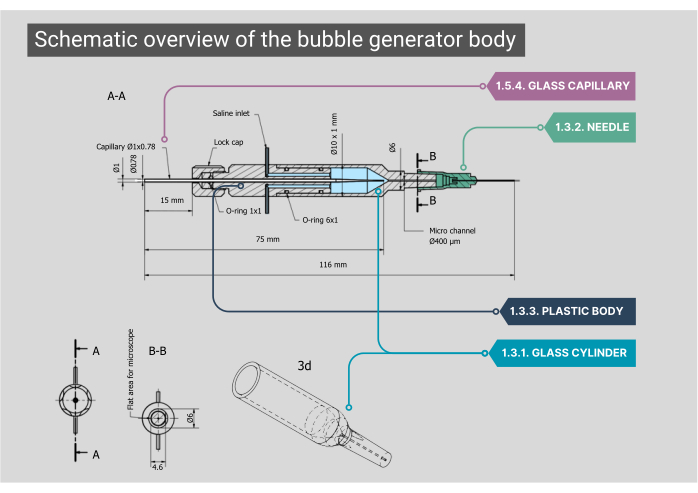
Figura 2: Panoramica schematica del corpo del generatore di bolle. Un progetto dettagliato del corpo del generatore di bolle, comprese le dimensioni e le annotazioni per ogni componente. I numeri corrispondono ai passaggi metodologici del testo principale. Clicca qui per visualizzare una versione più grande di questa figura.
2. Rilevamento e analisi delle bolle di gas
NOTA: Il codice Python (File supplementare 1) è progettato per tracciare e calcolare il numero, il diametro e il volume di ogni bolla di gas in tempo reale. Durante la produzione di bolle di gas, il codice elabora ogni bolla rilevata mentre si muove attraverso il campo visivo. Questi dati vengono visualizzati continuamente come il conteggio delle bolle, il volume cumulativo dell'aria, il diametro medio delle bolle e la durata totale della registrazione. Dopo ogni registrazione, i dati vengono esportati in un foglio di calcolo e .mp4 file video.
- Impostazioni della fotocamera (Figura 2 supplementare)
- Quando il generatore di microbolle è impostato correttamente, accendi la fotocamera nel Pylon Viewer. Seleziona il guadagno e la soglia corretti.
- Trova la regione di interesse corretta spostando gli assi X e Y del generatore di bolle e migliora la nitidezza spostando l'asse Z.
- Per ottimizzare la frequenza dei fotogrammi (171 fps), impostare la fotocamera su 2480 x 400 pixel (larghezza x altezza). Al termine della configurazione della telecamera, assicurati di spegnere la telecamera in Pylon Viewer.
- Analisi delle bolle in tempo reale (Figura 2 supplementare)
- Prima di iniziare un esperimento, eseguire un test dello script producendo bolle di gas. Controllare la registrazione e regolare la soglia e il guadagno quando necessario.
- Per avviare l'analisi delle bolle, eseguire il codice Python. Il codice visualizzerà automaticamente il video in diretta, il conteggio delle bolle, il diametro e il volume.
3. Chirurgia CAGE
- Preparazione per l'intervento chirurgico
- Preparare l'area chirurgica con un panno sterile sotto il ratto e stendere tutti gli strumenti chirurgici e le suture su un secondo panno sterile. Preparare i farmaci necessari.
- Assicurarsi che il termoforo, con sistema di feedback, sia impostato a 37 °C. Regolare il microscopio all'altezza corretta.
- Rimuovi il ratto dalla sua gabbia domestica e preparati per l'anestesia.
- Anestesia e cure pre-chirurgiche
- Somministrare 0,05 mg/kg di buprenorfina per via sottocutanea 30 minuti prima dell'intervento chirurgico.
- Anestetizzare il ratto utilizzando isoflurano al 4% e una miscela d'aria da 1 L/min (30% di ossigeno e 70% di aria) nella camera di induzione. Una volta completamente anestetizzato, pesare il ratto e radere la zona chirurgica del collo usando un rasoio elettrico.
- Spostare il ratto sul tavolo operatorio e passare l'isoflurano alla maschera facciale per mantenere l'anestesia con isoflurano al 2%-2,5% in una miscela d'aria al 70%/30%.
- Applicare lacrime artificiali sugli occhi per prevenire la secchezza. Lubrificare la sonda di temperatura e inserirla per via rettale.
- Posizionare il ratto in posizione supina e posizionare una siringa da 10 ml sotto il collo per un facile accesso all'area chirurgica.
- Fissare le zampe anteriori al tavolo operatorio con del nastro adesivo. Disinfettare l'area chirurgica con scrub a base di iodio o clorexidina e alcol più volte con un movimento circolare per garantire la sterilità. Confermare la profondità dell'anestesia pizzicando le dita dei piedi.
- Incisione
- Praticare un'incisione sulla linea mediana con un bisturi dalla tacca sternale a sotto la mandibola (circa 1,5 cm).
- Utilizzare due pinzette per sezionare il tessuto connettivo (fascia cervicale superficiale), esponendo i muscoli sottostanti.
- Separa i muscoli sternoioidi sinistro e destro strappando delicatamente il tessuto connettivo in mezzo.
- Identificare e ritrarre i seguenti muscoli sottostanti: muscolo sternomastoideo destro (ritrarre utilizzando lateralmente un gancio tissutale) e muscolo omoioideo destro (ritrarre utilizzando un uncino tissutale caudale-mediale). Il triangolo carotideo destro (CCA, ECA, arteria carotide interna (ICA)) dovrebbe essere visibile.
- Preparazione chirurgica del CCA
- Preparare il CCA rimuovendo la fascia sovrastante e il tessuto adiposo. Separare con cura il CCA dal nervo vago senza danneggiare il nervo. Non afferrare o pizzicare il nervo o i suoi rami. Spingerlo solo delicatamente lontano dal CCA. Non toccare o premere contro la trachea durante la preparazione dei vasi.
- Posiziona una sutura 3-0 attorno al CCA usando una pinzetta curva e fissa il filo con gli emostatici. Questo servirà in seguito ad elevare il CCA.
- Legatura temporanea della ECA, dell'ICA e delle loro succursali
- Individuare ed esporre l'ECA e la biforcazione ICA. Pulire la fascia circostante e il tessuto adiposo, se necessario. Legare temporaneamente l'ECA con sutura 3-0.
- Localizzare l'arteria occipitale (OA, che si ramifica principalmente dall'ICA, nel mezzo tra la biforcazione a forma di Y di origine ICA e ECA) e l'arteria tiroidea superiore (che si ramifica dal lato mediale dell'ECA). Questi piccoli rami si rompono facilmente. Legare temporaneamente l'OA con una sutura 3-0 prossimalmente.
- Dopo l'ICA distalmente, il ramo successivo che si muove lateralmente è l'arteria pterigopalatina (PPA). Pulisci la fascia circostante e il tessuto adiposo facendo molta attenzione a non danneggiare il nervo vago. Legare temporaneamente il PPA con una sutura 3-0.
NOTA: Si consiglia di avvicinarsi al PPA da una direzione cranica; Inclinare leggermente il ratto lateralmente può facilitare l'accesso e la visualizzazione durante l'intervento chirurgico.
- Metodo di ingresso ECA (Figura 3A)
- Legare le arterie come segue: utilizzare la sutura dal passaggio 3.4.2. legare delicatamente e temporaneamente il CCA, assicurando che il flusso venga interrotto ma riducendo al minimo il rischio di creare coaguli trombotici. Quindi, utilizzare una sutura 3-0 o una clip vascolare per legare temporaneamente l'ICA e l'OA.
- Applicare due suture intorno all'ECA: una prossimale e una distale. Assicurarsi che la sutura distale includa l'arteria tiroidea superiore e sia stretta per interrompere il flusso sanguigno in modo permanente, mentre la sutura prossimale è legata in modo lasco dopo un ulteriore utilizzo.
- Creare un'arteriotomia tra le due suture dell'ECA usando le forbici vascolari. Non ci dovrebbe essere sanguinamento in questa fase.
- Inserire il catetere disaerato dal generatore di bolle fino a quando la punta raggiunge la biforcazione del CCA. Stringere la sutura prossimale, quindi legare e asportare l'ECA distalmente al sito dell'arteriotomia.
- Allentare le legature sul CCA e sull'ICA per ripristinare il flusso sanguigno e, allo stesso tempo, avviare il flusso di soluzione salina attraverso il generatore di bolle nel catetere (passaggio 1.6.3.). Verificare la stabilità del posizionamento del catetere e l'assenza di perdite di sangue o soluzione fisiologica. Ruotare il moncone ECA con il catetere inserito di circa 90° in senso antiorario in modo che il flusso dal catetere vada nella direzione dell'ICA.
- Inizia il processo di embolizzazione. Avvia il codice Python e avvia la creazione di bolle d'aria come descritto nel passaggio 1.6.4.
- Al termine dell'embolizzazione, arrestare temporaneamente il flusso sanguigno stringendo la sutura/morsetto vascolare ICA.
- Rimuovere il catetere con cautela e chiudere definitivamente l'estremità prossimale dell'ECA legando saldamente la sutura esistente.
- Rimuovere delicatamente le suture 3-0 e/o il morsetto da PPA, OA, ICA e CCA per consentire la riperfusione. Pulire eventuali residui di sangue intorno all'area chirurgica.
- Metodo di inserimento CCA (Figura 3B)
- Continuare dopo il passaggio 3.5.3; legare temporaneamente l'ECA prossimale dal ramo tiroideo superiore, vicino alla biforcazione.
- Avviare la corsa della soluzione salina attraverso il generatore di bolle d'aria nel catetere, ma senza ancora iniziare la produzione di bolle d'aria.
- Sollevare delicatamente il CCA utilizzando gli emostatici del passaggio 3.4.2. e procedere all'inserimento dell'ago attaccato al catetere del generatore di bolle nel lume del CCA nella direzione del flusso. Assicurarsi che l'apertura dell'ago sia rivolta verso l'alto e che l'ago non penetri attraverso la parete del vaso opposto del CCA.
- Dopo l'inserimento, abbassare lentamente gli emostatici e il CCA di accompagnamento per consentire la riperfusione del CCA. Assicurarsi che non vi siano perdite di sangue o soluzione salina intorno al sito di inserimento.
- Avviare il processo di embolizzazione avviando il codice Python e la creazione di bolle d'aria come descritto nel passaggio 1.6.4.
- Dopo aver completato l'embolizzazione, sollevare nuovamente il CCA e ritrarre con cautela l'ago. Applicare pressione con una punta di cotone sul sito di inserimento mantenendo l'elevazione del CCA per fermare l'emorragia.
- Continuare ad applicare pressione sul sito di puntura. Rimuovere delicatamente la punta di cotone facendola rotolare distalmente lungo il CCA, esercitando una pressione minima per garantire che il coagulo rimanga indisturbato e in posizione. Potrebbero essere necessari da 30 s a 5 minuti per raggiungere l'emostasi.
NOTA: Nei ratti femmina, la chiusura del sito di puntura può richiedere alcuni minuti in più rispetto ai ratti maschi. - Recuperare con attenzione le suture 3-0 dall'ECA, dall'ICA e dal CCA per consentire la riperfusione. Ancora una volta, confermare che l'emorragia si sia fermata definitivamente e pulire il sangue residuo intorno all'area chirurgica, se necessario.
- Chiusura e cure post-chirurgiche
- Separare la pelle dal tessuto sottocutaneo del collo per facilitare la sutura. Sutura la pelle con un ago curvo e sutura 4-0.
- Somministrare bupivacaina sottocutanea 2,5 mg/mL (0,01 - 0,02 mL/kg) intorno al sito di incisione.
- Trasferire con cautela l'animale in una gabbia di recupero (33 - 35 °C) per 30-120 minuti. Durante il periodo di recupero, l'animale non viene lasciato incustodito fino a quando non ha riacquistato sufficiente coscienza per mantenere una posizione di decubito sternale. Quando l'animale si è completamente ripreso, trasferiscilo nuovamente nella gabbia di casa. Metti il cibo bagnato a portata di mano all'interno della gabbia.
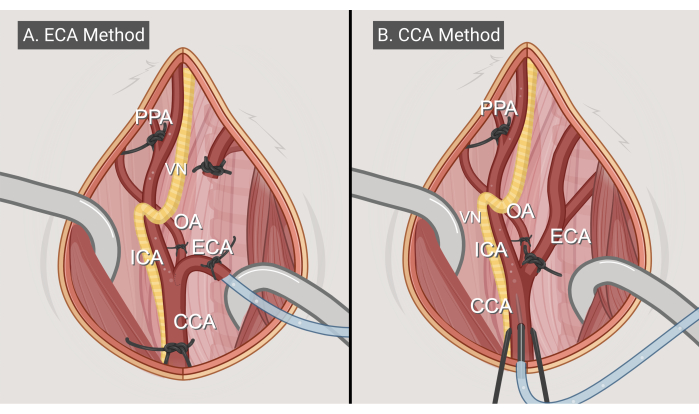
Figura 3: Metodi chirurgici. Illustrazioni dei due approcci chirurgici, (A) il metodo di ingresso ECA e (B) il metodo di ingresso CCA. Abbreviazioni: CCA = arteria carotide comune; ECA = arteria carotide esterna; ICA = arteria carotide interna; OA = arteria occipitale; PPA = pterigopalatina; VN = nervo vago. Figura realizzata con BioRender.com. Clicca qui per visualizzare una versione più grande di questa figura.
4. Seguito
- Monitoraggio ed endpoint umani
- Monitorare gli animali per un periodo postoperatorio di 7 giorni. Fornire analgesia postoperatoria con buprenorfina sottocutanea a 0,05 mg/kg alla fine del giorno dell'intervento e di nuovo la mattina successiva. Continuare a monitorare gli animali quotidianamente e somministrare ulteriori analgesici se necessario in base alla valutazione clinica del dolore o dell'angoscia. Eutanasia precoce del ratto se viene raggiunto l'endpoint umanitario secondo la direttiva 2010/63/UE del Parlamento Europeo.
- Deficit neurologici clinici
- Valutare i deficit neurologici clinici (CND) nei giorni postoperatori (ad esempio, giorni 1, 3 e 7). La nostra definizione di CND include la diminuzione della flessione dell'arto anteriore sinistro (ad esempio, l'inibizione dell'estensione dell'arto anteriore durante l'innalzamento del ratto), l'incapacità di camminare dritto o il comportamento circolare, simile al punteggio di Bederson10. Utilizza qualsiasi punteggio o test neurologico standardizzato per valutare la funzione motoria e lo stato neurologico.
- Risonanza magnetica per immagini
- Eseguire la risonanza magnetica (MRI) postoperatoria (ad esempio, nei giorni 1, 3, 5 e 7) su un sistema di risonanza magnetica per piccoli animali da 7 T con il ratto anestetizzato con isoflurano all'1,2% - 2,5% in una miscela di 0,5 L/min di aria medica e 0,5 L/min di ossigeno. Monitorare continuamente la respirazione e la temperatura.
- Ottieni scansioni pesate in T2 utilizzando i seguenti parametri di sequenza: tempo di ripetizione 2500 ms, tempo di eco 9 ms, spaziatura dell'eco 9 ms e 10 echi. Impostare il campo visivo su 35 x 35 mm con una matrice di ripresa di 128 x 128. Lo spessore della fetta è di 1,1 mm con un totale di 15 fette acquisite, mantenendo un rapporto d'aspetto di 1,00 e utilizzando una singola acquisizione dinamica.
- Analisi istologica
- Dopo il completamento della risonanza magnetica il 7° giorno ( o quando viene raggiunto l'endpoint sperimentale), mantenere il ratto in anestesia per eutanasia utilizzando la perfusione cardiaca con 30 ml di soluzione salina tamponata con fosfato 0,1 M seguiti da 30 ml di paraformaldeide al 4%.
- Estrarre il cervello e post-fissarlo per una notte in paraformaldeide al 4%. Dopo un periodo di fissazione di 24 ore, incorporare il cervello nella paraffina, tagliare le sezioni coronali e colorare con ematossilina ed eosina (H&E) utilizzando il metodo standard11.
Risultati
Esito neurologico
La Tabella 1 fornisce una panoramica di tutte le inclusioni ed esclusioni nei diversi gruppi sperimentali. Nessuno dei ratti operati con sham ha mostrato alcuna CND. Nel gruppo ECA-CAGE (8000 nL), due ratti su cinque non presentavano CND, mentre i tre ratti rimanenti presentavano CND, di cui due morivano entro 24 ore. Nel gruppo CCA-CAGE (8000 nL) tutti gli animali hanno mostrato CND, tre su cinque non sono sopravvissuti fino a 48 ore. Nei gruppi CCA-CAGE con volumi d'aria inferiori, tutti i ratti sono sopravvissuti dopo l'intervento. Tutti e cinque i ratti nel gruppo 7000 nL hanno dimostrato CND, mentre nel gruppo 6000 nL, due ratti su cinque hanno mostrato CND.
| ECA | CCA | |||||||
| finto | 8000 nL | finto | 8000 nL | 7000 nL | 6000 nL | |||
| Incluso | 5 | 5 | 5 | 5 | 5 | 5 | ||
| Deficit neurologici clinici esibiti | 0 | 3 | 0 | 5 | 5 | 2 | ||
| Mortalità < 24 h | 0 | 2 | 0 | 2 | 0 | 0 | ||
| Mortalità 24-48 h | 0 | 0 | 0 | 1 | 0 | 0 | ||
| Totale escluso | 3 | 4 | 1 | 0 | 2 | 1 | ||
| Escluso a causa di complicanze emorragiche | 2 | 3 | 0 | 0 | 0 | 0 | ||
| Escluso a causa di complicanza trombotica | 0 | 1 | 0 | 0 | 0 | 1 | ||
| Morte intraoperatoria dovuta a compressione del nervo vagale | 1 | 0 | 1 | 0 | 2 | 0 | ||
Tabella 1: Inclusioni ed esclusione dei gruppi di animali. Il numero di ratti in ciascun gruppo, le inclusioni e le esclusioni, i decessi e la sopravvivenza con deficit neurologici clinici.
MRI
La Figura 4 mostra un'immagine rappresentativa pesata in T2 di un ratto che ha ricevuto 7000 nL di bolle d'aria attraverso il metodo di ingresso in CCA, mostrando iperintensità corticali. Anomalie simili sono state osservate in tutti gli animali del gruppo CCA-CAGE che hanno ricevuto 7000 o 8000 nL e, in misura minore, nel gruppo 6000 nL e nel gruppo ECA-CAGE. In particolare, mentre nessuno degli animali nei gruppi fittizi mostrava alcuna CND, un ratto ECA-sham mostrava un'area di iperintensità alla risonanza magnetica; nel gruppo CCA-sham, nessun ratto ha mostrato anomalie alla risonanza magnetica.
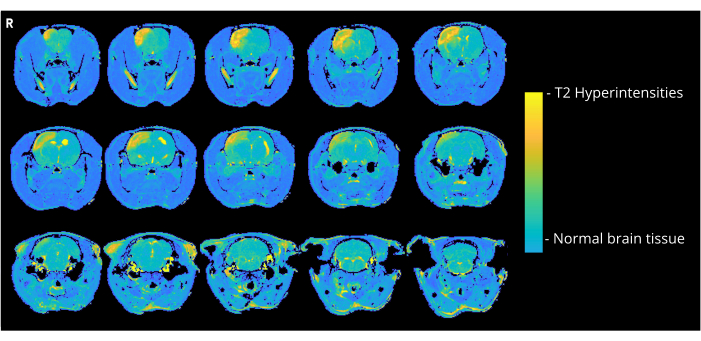
Figura 4: Immagini di esempio per la risonanza magnetica. Immagini rappresentative della risonanza magnetica pesata in T2 (3 giorni dopo l'intervento chirurgico CAGE) che mostrano iperintensità corticali dovute a CAGE in un ratto del gruppo CCA-CAGE 7000 nL. Clicca qui per visualizzare una versione più grande di questa figura.
Istologia
La Figura 5 mostra una sezione cerebrale rappresentativa colorata con H&E del ratto 7000 nL CCA-CAGE della Figura 4, che dimostra un danno cerebrale ischemico corticale con perdita di cellule neuronali e gliosi reattiva, tra cui astrogliosi reattiva e attivazione microgliale.
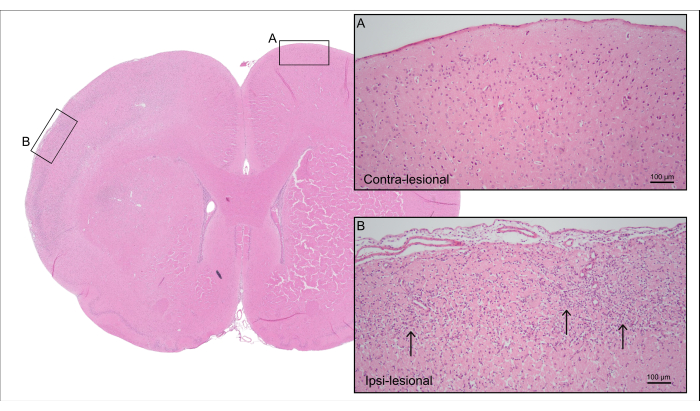
Figura 5: Istologia post-mortem. Colorazione H&E rappresentativa del ratto dalla Figura 4 che mostra il tessuto corticale del lato controlesionale con (A) neuroni intatti e (B) il lato ipsi-lesionale con tessuto corticale ischemico con perdita di cellule neuronali e gliosi reattiva (frecce). Clicca qui per visualizzare una versione più grande di questa figura.
Sfide tecniche
A causa di sfide tecniche, il metodo di ingresso nell'ECA ha avuto un tasso di successo sostanzialmente inferiore rispetto al metodo di ingresso nell'ECA (Tabella 1). Ciò derivava principalmente dalla breve lunghezza del catetere richiesta nel metodo di ingresso nell'ECA, che spesso provocava lussazione e sanguinamento del catetere. Inoltre, il metodo di ingresso nell'ECA ha comportato anche un tempo di intervento chirurgico più lungo di circa 20 minuti, nonché una maggiore variazione del diametro della bolla.
Figura supplementare 1: Dettagli del generatore di bolle d'aria. (A) Le immagini del corpo del generatore di bolle e dell'estrattore capillare ne evidenziano gli aspetti di montaggio e funzionali. (B) Vista laterale del generatore di bolle, che mostra il suo design e le caratteristiche strutturali da una prospettiva laterale. (C) Vista frontale del generatore di bolle, che illustra gli aspetti e le caratteristiche frontali chiave. Clicca qui per scaricare questo file.
Figura 2 supplementare: Passaggi per l'esecuzione del software. Questo file fornisce una guida dettagliata sulle procedure e i passaggi da seguire per eseguire e utilizzare efficacemente il software associato al generatore di bolle d'aria. Clicca qui per scaricare questo file.
File supplementare 1: codice Python. Il codice è costituito dai due script (A e B) che devono essere salvati all'interno della stessa cartella. Clicca qui per scaricare questo file.
Discussione
Abbiamo descritto come introdurre emboli d'aria nelle arterie cerebrali di ratto utilizzando due metodi e abbiamo dimostrato che l'introduzione attraverso un ago inserito nel CCA ha molteplici vantaggi rispetto a un metodo che prevede l'embolizzazione attraverso un catetere nell'ECA. In particolare, abbiamo osservato un minor numero di complicanze con il metodo CCA-entry, nonché un diametro della bolla più coerente e un tempo chirurgico ridotto. Il metodo di inserimento CCA provoca CND dose-dipendente e anomalie alla risonanza magnetica indicative di infarto cerebrale, come confermato dall'istologia.
La scelta iniziale del metodo di ingresso ECA è stata ispirata da Gerriets et al.7. Tuttavia, abbiamo identificato diverse difficoltà con questo approccio, tra cui variazioni sostanziali nella dimensione delle bolle e un tasso di complicanze chirurgiche più elevato rispetto al metodo di ingresso in CCA. Una fonte primaria di queste complicanze è correlata alla lunghezza del catetere. Nel nostro modello, l'uso di un catetere corto (125 mm) ha aiutato a mantenere la stabilità delle bolle perché più lungo è il catetere, maggiore è la probabilità che le bolle si fondano mentre scorrono attraverso il catetere9. Tuttavia, nel metodo di ingresso ECA, un catetere più lungo facilita il posizionamento e la leva per il movimento. L'uso di un catetere corto nel metodo di ingresso nell'ECA provoca frequenti lussazioni e deterioramento del moncone dell'ECA a causa di un'eccessiva manipolazione.
Una seconda difficoltà incontrata nel metodo di ingresso ECA ha riguardato la creazione di bolle di dimensioni coerenti (Figura 6). Nel metodo di ingresso nell'ECA, il flusso di soluzione salina attraverso il catetere deve essere temporaneamente interrotto mentre il catetere viene inserito nell'ECA. Quando il flusso arterioso viene ripristinato e l'embolizzazione può iniziare, il catetere è improvvisamente sottoposto alla pressione sanguigna del ratto. Di conseguenza, questo porta all'ingresso retrogrado del sangue nel catetere e nel generatore di bolle. L'effetto della fluttuazione della pressione sanguigna sulla pressione all'interno del generatore di bolle porta a una maggiore variazione delle dimensioni delle bolle, che a volte porta a bolle di forma cilindrica che riempiono il canale (Figura 6B). Questo può essere evitato aumentando la pressione all'interno del sistema prima di posizionare il catetere nell'ECA. È meglio farlo da una seconda persona per un tempismo preciso. Inoltre, poiché questo metodo richiede più tempo, porta a una maggiore quantità di soluzione salina infusa nel ratto rispetto al metodo di ingresso in CCA. Nel metodo di ingresso CCA, la soluzione salina scorre continuamente attraverso il catetere e l'ago viene inserito nella direzione del flusso sanguigno attraverso il CCA, risolvendo così il problema del gradiente di pressione descritto sopra. Ciò si traduce nell'assenza di riflusso nel catetere e in una dimensione della bolla più uniforme.
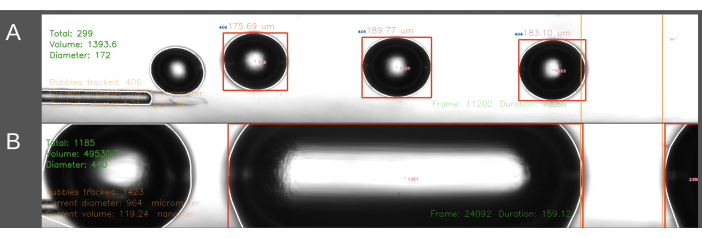
Figura 6: Esempio di registrazione e analisi della produzione di bolle. Le immagini mostrano schermate che mostrano l'analisi in tempo reale del numero totale di bolle, del volume totale e del diametro medio nell'area di misurazione (verde, angolo in alto a sinistra). L'area di misurazione è evidenziata tra le linee arancioni a destra. Il diametro e il volume della bolla vengono calcolati in base al diametro orizzontale. Le immagini includono la formazione di (A) bolle d'aria generate con successo e (B) bolle cilindriche generate senza successo. Clicca qui per visualizzare una versione più grande di questa figura.
Nonostante il metodo di iscrizione CCA sia uno dei preferiti, abbiamo comunque riscontrato diverse difficoltà tecniche. In primo luogo, la preparazione del PPA è impegnativa, poiché la compressione accidentale del nervo vago può provocare depressione della respirazione e successiva morte dell'animale12. Per ridurre questo rischio, si dovrebbe inclinare leggermente il ratto lateralmente e avvicinarsi al PPA dalla direzione cranica. Inoltre, a causa dell'anatomia impegnativa della biforcazione ICA e PPA, esiste il rischio di danni vascolari e sanguinamento incontrollabile. Questo può essere aggirato solo migliorando le capacità chirurgiche. Queste sfide evidenziano che la padronanza del modello CAGE nei ratti è complessa e richiede una notevole pratica e precisione13.
La configurazione tecnica proposta del generatore di bolle d'aria ha i suoi limiti, in particolare legati ai capillari in vetro su misura, a causa della loro fragilità. Il tubo che collega il regolatore pneumatico al capillare è soggetto a rotture durante la regolazione della valvola a tre vie per il rilascio della pressione dopo l'embolizzazione. Inoltre, la sostituzione di un capillare richiede la distruzione del capillare esistente a causa della gomma termorestringente che è attaccata in modo permanente ad esso. Inoltre, ogni capillare ha caratteristiche uniche di bolla dovute a piccole differenze nel diametro e nella forma della punta. Infine, il funzionamento manuale della generazione delle bolle tramite il regolatore pneumatico ha richiesto una notevole esperienza. Una manipolazione inesperta può portare alla produzione di bolle eccessivamente grandi. La regolazione automatizzata della pressione con un ciclo di feedback dal codice Python potrebbe migliorare la precisione automatizzata negli studi futuri.
La nostra documentazione accurata, che comprende sia le specifiche tecniche del generatore di bolle, un protocollo chirurgico dettagliato e la fornitura del software, fornisce un importante contributo a questo campo di ricerca. La nostra tecnica CCA garantisce un'interruzione minima della perfusione cerebrale fisiologica, mantenendo il flusso di CCA durante tutta la procedura e abolendo la necessità di sacrificare l'ECA. Il nostro studio fornisce un modello sperimentale affidabile e riproducibile per studiare CAGE e i suoi potenziali trattamenti.
Divulgazioni
Nessuno
Riconoscimenti
Questa ricerca è stata finanziata dalla Netherlands Military Healthcare Insurance Foundation (Stichting Ziektekosten Verzekering Krijgsmacht) con il numero di sovvenzione 20-0232 e dalla Dutch Heart Foundation 2021 E. Dekker Grant (03-006-2021-T019 a IAM). Ringraziamo anche Lindy Alles, Paul Bloemen e Ed van Bavel per la loro eccezionale assistenza.
Materiali
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
Riferimenti
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon