Method Article
אינדוקציה של תסחיף גז עורקי מוחי בחולדה
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מספק תיאור מפורט של השראת תסחיפי אוויר מוחי בחולדות. הוא משווה הזרקה ישירה לעורק הצוואר המשותף והחדרה דרך עורק הצוואר החיצוני. הוא מספק תיאור טכני של מחולל בועות האוויר, ההשפעה של נפחי אוויר שונים ואתגרים פרוצדורליים.
Abstract
אנו מציגים גישה מתודולוגית למחקר פרה-קליני של תסחיף גז עורקי מוחי (CAGE), מצב המאופיין בבועות גז במחזור המוח הגורמות לאיסכמיה רב-מוקדית. העבודה הנוכחית מתארת שתי שיטות כירורגיות להשראת כלוב בחולדה: אחת באמצעות הזרקת אוויר דרך עורק הצוואר החיצוני (ECA), ובכך הקרבת כלי הדם, ואחת באמצעות הזרקה ישירה לעורק הצוואר המשותף (CCA). חולדות וויסטאר זכרות שימשו וחולקו לקבוצות (n=5) כדי לעבור את שיטת הכניסה ל-ECA או CCA עם הזרקת נפחי תסחיפי אוויר שונים (6000, 7000 ו-8000 נ"ל) או ניתוח דמה. מחולל בועות בהתאמה אישית שימש לייצור תסחיפי גז בגודל עקבי, ותוכנת קוד פתוח פותחה לניתוח בועות בזמן אמת. ההשוואה בין שתי השיטות גילתה שגישת ה-CCA עדיפה מבחינת ייצור בועות עקבי בתוך מחולל הבועות, זמן אמבוליזציה מופחת ופחות סיבוכים.
Introduction
תסחיף גז עורקי מוחי (CAGE) מאופיין בלינה של בועות גז בתוך מחזור הדם העורקי במוח, מה שמוביל לספקטרום של ליקויים נוירולוגיים. מצב זה ידוע בעיקר כסיבוך בצלילה, כאשר התרחבות יתר של הריאות במהלך העלייה גורמת לברוטראומה וכניסת אוויר לוורידי הריאה, אשר זורמים לאחר מכן לעורקי המוח1. בנוסף לתופעה הידועה הזו בצלילה, אנשי מקצוע רפואיים מכירים יותר ויותר ב-CAGE כסיבוך של פרוצדורות רפואיות פולשניות. תסחיף אוויר יאטרוגני יכול להתרחש במהלך המיקום, הטיפול או ההסרה של צנתרים ורידיים מרכזיים ונקזי חזה, כמו גם במהלך הליכים פתוחים ואנדווסקולריים, כולל התערבויות במסתמי הלב, תיקוני אבי העורקים האנדווסקולרי של בית החזה וכריתת פקקת אנדווסקולרית בשבץ איסכמי 2,3. למרות חשיבותו הקלינית, המחקר על CAGE, במיוחד באמצעות מודלים של בעלי חיים, נותר דליל ומקוטע4.
מאז המחקר החלוצי של Rosengren et al. ב-1977 עם חולדות, מודלים של בעלי חיים עבור CAGE עברו שכלול משמעותי5. הגישה בה השתמש רוזנגרן כללה קנולציה של עורק הצוואר המשותף (CCA) כדי להכניס נפח כולל של 10 מיקרוליטר אוויר. טכניקה זו לא הייתה חפה ממגבלות, כולל המודינמיקה משתנה עקב קשירת עורקים והגודל הבלתי מבוקר והנפח המוגזם של תסחיף האוויר6. השיטה של פורלו, שתוארה ב-1982, שיפרה את הדיוק של אמבוליזציה של אוויר על ידי קידום קטטר לעורק הצוואר הפנימי ומתן נפח אוויר כולל של 5 מיקרוליטר. עם זאת, למרות שחשיבותו הוכרה מוקדם, הרעיון של גודל בועה אחיד יושם רק עשרות שנים לאחר מכן. Gerriets et al. הצליחו לייצר מספר עקבי של בועות בקוטר אחיד, בתחילה 160 מיקרומטר, מאוחר יותר הופחת ל-45 מיקרומטר 7,8. השיטה הכירורגית המשמשת כאן דרשה הקרבת עורק הצוואר החיצוני (ECA). לאחרונה, שייפר ועמיתיו הציגו שיטה פחות פולשנית על ידי החדרת מיקרו-קטטר ל-CCA דרך עורק הירך, תוך חיקוי מדויק יותר של תרחישי תסחיף אוויר הנראים במהלך פרוצדורות אנדווסקולריות9. לשיטה שלהם הייתה מגבלה של אי קשירת ענפי העורקים של ה-CCA (למשל, ECA ועורק פטריגופלטין (PPA)), ובכך אפשרה לבועות לזרום לא רק לעורקי המוח הרצויים אלא גם לטריטוריות שאינן מוחיות זה עלול לגרום לנזק איסכמי מוחי לא עקבי, מה שמסבך את יכולת השחזור של ניסויים.
למרות ההתקדמות במודלים פרה-קליניים של CAGE, נותרו אתגרים בשכפול טכניקות יצירת בועות, סטנדרטיזציה של שיטות כירורגיות ורכישת נגעים מוחיים עקביים. המחקר הנוכחי מציג הן גישה כירורגית קונבנציונלית הדורשת הקרבת ה-ECA והן שיטה חלופית שבה בועות אוויר מוזרקות ישירות ל-CCA. אנו מדווחים על נהלים מפורטים, אתגרים ותוכנות קוד פתוח לניתוח בועות בזמן אמת. אנו כוללים גם את הפרטים הטכניים הדרושים לבניית מחולל בועות.
Protocol
כל ההליכים הקשורים לבעלי חיים נערכו בהתאם למדריך לשימוש וטיפול בחיות מעבדה. קיבלנו אישור מלא מהוועדה המרכזית לניסויים בבעלי חיים של הולנד (AVD11800202114839). נעשה שימוש בחולדות וויסטאר זכרות בטווח משקל של 300 - 350 גרם. בעלי החיים שוכנו בזוגות עם מזון ומים אד ליביטום ומחזורי אור-חושך של 12 שעות. עם הגעתם, בעלי החיים עברו תקופת התאקלמות של 7 ימים לפני תחילת הליך ניסיוני כלשהו.
הערה: השתמשנו בשתי שיטות כירורגיות, שיטת כניסת ECA ושיטת כניסת CCA. עבור שתי הטכניקות, החולדות חולקו באקראי לקבוצות רכב או 8000 nL CAGE באמצעות כלי ניתוח סטטיסטי. הטיפול ברכב כלל הזרקת מי מלח בלבד; בטיפול בכלוב השתמשו בבועות אוויר במי מלח עד לנפח של 8000 נ"ל, כאשר לכל בועה קוטר מטרה של 160 מיקרומטר. לאחר השלמת סדרה זו, חידוד נוסף של הדגם עם 6000 nL ו-7000 nL (שניהם בקוטר בועה של 160 מיקרומטר) נעשה רק בשיטת CCA-entry. במקרה של כשל פרוצדורלי, נוספו חולדות חלופיות כדי לקבל גודל קבוצה סופי של n=5.
1. מחולל בועות אוויר
הערה: מחולל בועות האוויר (איור 1, איור 2 ואיור משלים 1A-C) מורכב ממספר רכיבים בהתאמה אישית המייצרים ומזהים בועות גז בגודל שווה.
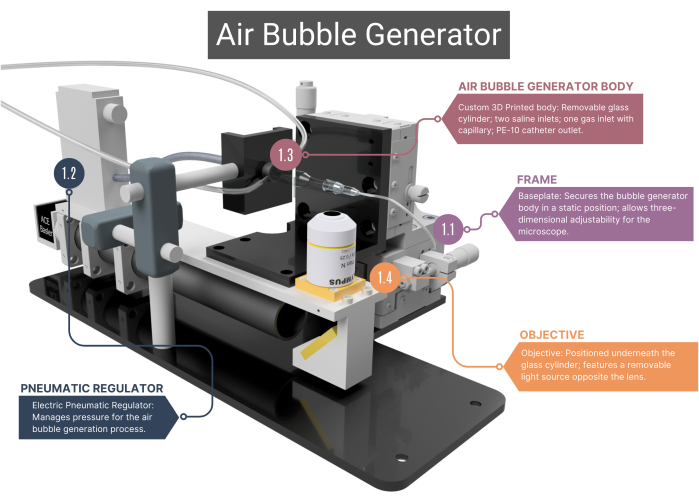
איור 1: סקירה כללית של מחולל בועות האוויר. מחולל הבועות כולל מסגרת תומכת (1.1) ווסת פנאומטי לניהול זרימת אוויר (1.2). הוא כולל גוף ראשי שהודפס בתלת מימד ומכיל נימי זכוכית (1.3), המקושר למצלמה אובייקטיבית ומהירה (1.4). ראה איור משלים 1A-C לתמונות נוספות. המספרים תואמים את השלבים המתודולוגיים בטקסט העיקרי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- מסגרת
- השתמש במסגרת עם לוחית בסיס נירוסטה בהתאמה אישית המבטיחה את המיקום הסטטי של הגוף הראשי של מחולל הבועות, בעוד שמטרת המיקרוסקופ הממוקמת מתחתיה ניתנת להזזה בתלת מימד. יכולת התאמה זו מתאפשרת על ידי מכללי XYZ המאפשרים שינויים בשדה הראייה ומאפשרים מיקוד בקצה המיקרו-ערוץ ובועות האוויר.
- ווסת פנאומטי
- לאספקת אוויר דחוס, השתמש בווסת פנאומטי חשמלי, בעל טווח לחץ של 0.001 עד 0.1 מגה פיקסל. ודא שהווסת מחובר לנימי הזכוכית באמצעות צינורות תוך ורידיים (IV), אטומים באוויר עם כיווץ חום. לווסת את הלחץ על ידי שינוי מתח הרגולטור.
- גוף מחולל בועות אוויר
הערה: הגוף העיקרי של מחולל הבועות מורכב מתא זכוכית, בית פנימי מפלסטיק ונימי זכוכית. כל מרכיבי הגוף צריכים להיות אטומים, כדי להבטיח שלא תיתכן דליפת אוויר או מי מלח.- ודא שלתא הזכוכית הגלילי בהתאמה אישית יש קוטר פנימי (ID) של 1000 מיקרומטר המתמזג למיקרו-ערוץ עם מזהה של 400 מיקרומטר. שטח את הצד העליון של מיקרו-ערוץ בצורת גליל זה כדי לקבל תצוגה אופטימלית דרך המטרה.
- התקן את הקצה החיצוני של גליל הזכוכית למחט 21G כשהקצה מוסר. בתוך מחט זו, הדביקו מחט שנייה (27 גרם, מזהה 210 מיקרומטר). הכנס את המחט בקוטר קטן יותר לתוך המיקרו-ערוץ והצמד אותה לצנתר פוליאתילן (PE-10) (מזהה 280 מיקרומטר, אורך 125 מ"מ).
- התקן גוף פלסטיק על גב תא הזכוכית, הכולל שני כניסות נירוסטה; כאן ניתן לחבר את צינור העירוי לכניסת מי מלח. בחלק האחורי של גוף זה יש כניסה לגז דרך נימי זכוכית מותאמים אישית הממוקמים עם גומי טבעת O וננעלים במקומו על ידי הברגת מכסה.
- לשיטת כניסת CCA, חבר את קצה הקטטר למחט (30G, ID 159 מיקרומטר) כשבית הפלסטיק Luer-lock מוסר וכופף אותו בזהירות לזווית של 45°.
- התאמת מיקרוסקופ
- מקם את המטרה (4x) מתחת לגוף מחולל הבועות וחבר אותה למצלמה מהירה. מול העדשה, הנח מקור אור LED מתכוונן.
- לפני תחילת כל ניסוי, ודא שעדשת המטרה נקייה. לכלוך יגרום לניתוחי בועות שגויים.
- יצירת נימי הזכוכית
הערה: תהליך יצירת הנימים כרוך בכמות משמעותית של כוונון עדין. בעוד שההגדרות המסופקות משמשות כקו בסיס, ייתכן שיהיה צורך בהתאמות כדי להשיג את קוטר הבועה הרצוי.- הפוך את נימי הזכוכית באמצעות חולץ מיקרו-פיפטה (איור משלים 1A-C). כדי ליצור את הפיפטות, הגדר את תנורי החימום של המיקרופיפטה: הגדר את המחמם השמאלי (מס' 1) לכוונון = 70 ואת המחמם הימני (מס' 2) לכוונון = 980.
- הנח את נימי הזכוכית לתוך המושך והוסף שני בלוקים במשקל 100 גרם כדי להבטיח את הצורה הנכונה לאחר תהליך המשיכה. לחץ על התחל. לאחר השלמת תהליך המשיכה נוצרים שני נימים.
- חותכים או שוברים כל נימים באלכסון בקצה באמצעות מיקרוסקופ שדה בהיר. הצורה והקוטר של הקצה הם קריטיים מכיוון שהם משפיעים על קוטר בועות הגז. כדי להבטיח עקביות בגודל הבועה על פני ניסויים, השתמש באותו נימי עבור קוטר הבועה הרצוי.
- הכנס את קצה נימי הזכוכית לתעלה הגלילית (מזהה 400 מיקרומטר) של גוף מחולל הבועות.
- הגדרת מחולל המיקרו-בועות
- חבר את מחולל הבועות למשאבת מזרק עם מי מלח סטריליים (50 מ"ל) והתחל זרימה רציפה במהירות של 20 מ"ל לשעה. ודא שאין אוויר כלוא במערכת. במקרה שאוויר נלכד במערכת, החזק את מחולל הבועות בצורה אנכית כדי שהאוויר יוכל לברוח דרך הצנתר.
- הפעל את מקור האור, המצלמה והתוכנה.
- כאשר המערכת נמצאת בלחץ הנכון (לאחר כ-2 דקות), בדוק אם יש דליפת גז או נוזל במערכת.
- כדי ליצור בועות, הגדל לאט את הלחץ על ידי הגדלת המתח, החל מ -2.1 וולט והמשך עד שהגז ממלא את נימי הזכוכית. זה עשוי לקחת קצת זמן, אבל חשוב לא למהר בחלק הזה. כאשר הלחץ בנימי הזכוכית שווה לזה שבתעלה, ייצור בועות גז יכול להתחיל. פשוט על ידי הגדלת המתח עד 2.6 וולט, ייווצרו בועות.
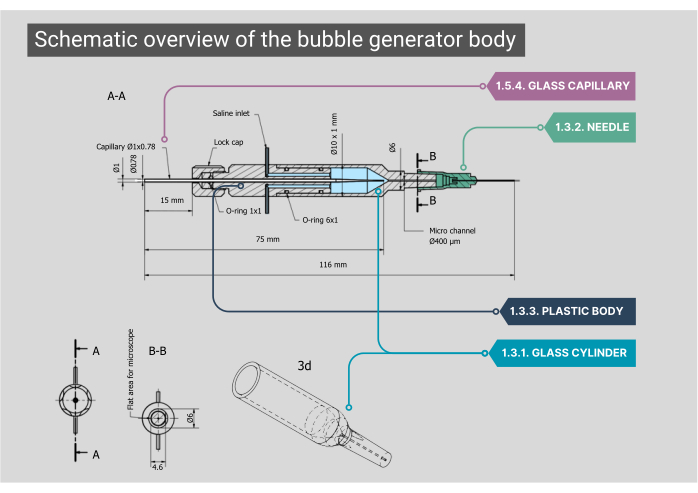
איור 2: סקירה סכמטית של גוף מחולל הבועות. שרטוט מפורט של גוף מחולל הבועות, כולל מידות והערות לכל רכיב. המספרים תואמים את השלבים המתודולוגיים בטקסט העיקרי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
2. איתור וניתוח בועות גז
הערה: קוד Python (קובץ משלים 1) נועד לעקוב ולחשב את המספר, הקוטר והנפח של כל בועת גז בזמן אמת. במהלך ייצור בועות גז, הקוד מעבד כל בועה שזוהתה כשהיא נעה בשדה הראייה. נתונים אלה מוצגים באופן רציף כספירת הבועות, נפח האוויר המצטבר, קוטר הבועה הממוצע ומשך הזמן הכולל של ההקלטה. לאחר כל הקלטה, הנתונים מיוצאים לגיליון אלקטרוני ולקובץ וידאו .mp4.
- הגדרות מצלמה (איור משלים 2)
- כאשר מחולל המיקרו-בועות מוגדר כהלכה, הפעל את המצלמה ב-Pylon Viewer. בחר את הרווח והסף הנכונים.
- מצא את אזור העניין הנכון על ידי הזזת ציר ה-X וה-Y של מחולל הבועות ושפר את החדות על ידי הזזת ציר ה-Z.
- למיטוב קצב המסגרות (171 fps), קבעו את המצלמה ל- 2480 x 400 פיקסלים (רוחב x גובה). בסיום הגדרת המצלמה, הקפד לכבות את המצלמה ב-Pylon Viewer.
- ניתוח בועות בזמן אמת (איור משלים 2)
- לפני תחילת הניסוי, בצע ריצת מבחן של הסקריפט תוך הפקת בועות גז. בדוק את ההקלטה והתאם את הסף והרווח בעת הצורך.
- כדי להתחיל בניתוח הבועות, הפעל את קוד Python. הקוד יציג אוטומטית את הסרטון החי, ספירת הבועות, הקוטר והנפח.
3. ניתוח כלוב
- הכנה לניתוח
- הכן את אזור הניתוח עם מטלית סטרילית מתחת לחולדה והניח את כל מכשירי הניתוח והתפרים על מטלית סטרילית שנייה. הכן את התרופות הדרושות.
- ודא שכרית החימום, עם מערכת משוב, מוגדרת ל-37 מעלות צלזיוס. כוונן את המיקרוסקופ לגובה הנכון.
- הוציאו את החולדה מהכלוב הביתי שלה והתכוננו להרדמה.
- הרדמה וטיפול טרום ניתוחי
- יש לתת 0.05 מ"ג/ק"ג בופרנורפין תת עורי 30 דקות לפני הניתוח.
- הרדמו את החולדה באמצעות 4% איזופלורן ותערובת אוויר של 1 ליטר לדקה (30% חמצן ו-70% אוויר) בתא האינדוקציה. לאחר הרדמה מלאה, שקלו את החולדה וגלחו את אזור הצוואר הניתוחי באמצעות סכין גילוח חשמלי.
- העבירו את החולדה לשולחן הניתוחים והעבירו את האיזופלורן למסכת הפנים כדי לשמור על הרדמה עם 2%-2.5% איזופלורן בתערובת אוויר של 70%/30%.
- מרחו דמעות מלאכותיות על העיניים כדי למנוע התייבשות. יש לשמן את בדיקת הטמפרטורה ולהכניס אותה פי הטבעת.
- מקם את החולדה במצב שכיבה והנח מזרק של 10 מ"ל מתחת לצוואר לגישה נוחה לאזור הניתוח.
- אבטח את הכפות הקדמיות לשולחן הניתוחים באמצעות סרט. יש לחטא את אזור הניתוח עם קרצוף ואלכוהול על בסיס יוד או כלורהקסידין, מספר פעמים בתנועה סיבובית כדי להבטיח סטריליות. אשר את עומק ההרדמה על ידי צביטת הבוהן.
- החתך
- בצע חתך בקו האמצע בעזרת אזמל מהחריץ החזה עד מתחת ללסת התחתונה (כ -1.5 ס"מ).
- השתמש בשתי פינצטה כדי לנתח את רקמת החיבור (פאשיה צווארית שטחית), ולחשוף את השרירים הבסיסיים.
- הפרד את שרירי הסטרנוהיואיד השמאלי והימני על ידי קריעה עדינה של רקמת החיבור ביניהם.
- זהה ומשוך את השרירים הבאים שמתחת: שריר סטרנומסטואיד ימני (נסיגה באמצעות וו רקמה לרוחב) ושריר אומוהיואיד ימני (נסיגה באמצעות וו רקמה זנבי-מדיאלי). משולש הצוואר הימני (CCA, ECA, עורק הצוואר הפנימי (ICA)) צריך להיות גלוי.
- הכנה כירורגית של ה-CCA
- הכן את ה-CCA על ידי הסרת הפאשיה ורקמת השומן העליונה. הפרד בזהירות את ה-CCA מהעצב התועה מבלי לפגוע בעצב. אין לתפוס או לצבוט את העצב או את ענפיו. רק דחף אותו בעדינות הרחק מה-CCA. אין לגעת או ללחוץ על קנה הנשימה בזמן הכנת הכלים.
- הנח תפר 3-0 סביב ה-CCA באמצעות פינצטה מעוקלת ואבטח את החוט עם המוסטטים. זה ישמש מאוחר יותר להעלאת ה-CCA.
- קשירה זמנית של ה-ECA, ה-ICA וסניפיהם
- אתר וחשוף את ה-ECA ואת ה-ICA. נקה את הפאשיה ורקמת השומן שמסביב במידת הצורך. לקשור זמנית את ה-ECA עם תפר 3-0.
- לאתר את העורק העורפי (OA, המסתעף בעיקר מה-ICA, באמצע בין ההסתעפות בצורת Y של ICA ומקור ECA) ואת עורק בלוטת התריס העליון (מסתעף מהצד המדיאלי של ה-ECA). ענפים קטנים אלה נקרעים בקלות. קשר זמנית את ה-OA עם תפר 3-0 בסמיכות.
- בעקבות ה-ICA באופן דיסטלי, הענף הבא הנע לרוחב הוא עורק הפטריגופלטין (PPA). נקה את הפאשיה ורקמת השומן שסביבו תוך הקפדה רבה לא לפגוע בעצב התועה. קשר זמנית את ה- PPA עם תפר 3-0.
הערה: מומלץ לגשת ל-PPA מכיוון גולגולת; הטיית החולדה מעט הצידה יכולה להקל על גישה והדמיה קלה יותר במהלך הניתוח.
- שיטת כניסת ECA (איור 3A)
- קשר את העורקים באופן הבא: השתמש בתפר משלב 3.4.2. כדי לקשור בעדינות ובאופן זמני את ה-CCA, להבטיח את עצירת הזרימה אך למזער את הסיכון ליצירת קרישי דם טרומבוטיים. לאחר מכן, השתמש בתפר 3-0 או קליפ כלי דם כדי לקשור זמנית את ה-ICA וה-OA.
- יש למרוח שני תפרים סביב ה-ECA: אחד פרוקסימלי ואחד דיסטלי. ודא שהתפר הדיסטלי כולל את עורק בלוטת התריס העליון ומהודק כדי לעצור את זרימת הדם לצמיתות, בעוד שהתפר הפרוקסימלי נקשר באופן רופף בשימוש נוסף.
- צור כריתת עורקים בין שני התפרים של ה- ECA באמצעות מספריים לכלי הדם. לא אמור להיות דימום בשלב זה.
- הכנס את הצנתר שהוסר ממחולל הבועות עד שהקצה יגיע לפיצול של ה-CCA. הדק את התפר הפרוקסימלי ולאחר מכן קשר והוצא את ה-ECA הדיסטלי לאתר כריתת העורקים.
- שחרר את הקשרים ב-CCA וב-ICA כדי להחזיר את זרימת הדם ובמקביל, התחל את זרימת המלח דרך מחולל הבועות לתוך הצנתר (שלב 1.6.3). אשר את יציבות מיקום הצנתר ואת היעדר דליפת דם או מי מלח. סובב את גדם ה-ECA עם הצנתר המוחדר כ-90 מעלות נגד כיוון השעון כך שהזרימה מהקטטר תעבור לכיוון ה-ICA.
- התחל את תהליך האמבוליזציה. התחל את קוד Python והתחל ליצור בועות אוויר כמתואר בשלב 1.6.4.
- לאחר סיום האמבוליזציה, עצור זמנית את זרימת הדם על ידי הידוק תפר ה-ICA/מהדק כלי הדם.
- הסר את הצנתר בזהירות וסגור לצמיתות את הקצה הפרוקסימלי של ה-ECA על ידי קשירה חזקה של התפר הקיים.
- הסר בעדינות את 3-0 התפרים ו/או clamp מה-PPA, OA, ICA ו-CCA כדי לאפשר עירוי מחדש. נקה את שאריות הדם סביב אזור הניתוח.
- שיטת כניסת CCA (איור 3B)
- המשך לאחר שלב 3.5.3; קשר באופן זמני את ה-ECA הפרוקסימלי מענף בלוטת התריס העליון, קרוב להתפצלות.
- התחל את זרימת מי המלח דרך מחולל בועות האוויר לתוך הצנתר, אך מבלי להתחיל בייצור בועות אוויר עדיין.
- הרם בעדינות את ה-CCA באמצעות ההמוסטטים משלב 3.4.2. והמשך להכניס את המחט המחוברת לצנתר של מחולל הבועות ללומן של ה-CCA בכיוון הזרימה. ודא שפתח המחט פונה כלפי מעלה ושהמחט אינה מחוררת דרך דופן הכלי הנגדי של ה-CCA.
- לאחר ההחדרה, הורד לאט לאט את ההמוסטטים ואת ה-CCA הנלווה שוב כדי לאפשר זלוף מחדש של ה-CCA. ודא שאין דליפה של דם או מי מלח סביב מקום ההחדרה.
- התחל את תהליך האמבוליזציה על ידי הפעלת קוד Python ויצירת בועות אוויר כמתואר בשלב 1.6.4.
- לאחר השלמת התסחיף, הרם שוב את ה-CCA ומשוך בזהירות את המחט. הפעל לחץ עם קצה כותנה על מקום ההחדרה תוך שמירה על העלאת ה-CCA כדי לעצור את הדימום.
- המשך להפעיל לחץ על מקום הניקוב. הסירו בעדינות את קצה הכותנה על ידי גלגולו לאורך ה-CCA, תוך שימוש בלחץ מינימלי כדי להבטיח שהקריש יישאר ללא הפרעה ובמקומו. ייתכן שיידרשו בין 30 שניות ל-5 דקות כדי להגיע להמוסטזיס.
הערה: אצל חולדות נקבות, סגירת אתר הניקוב יכולה להימשך כמה דקות יותר מאשר אצל חולדות זכרים. - אחזר בזהירות את התפרים 3-0 מה-ECA, ICA ו-CCA כדי לאפשר זלוף מחדש. שוב, ודא שהדימום פסק לצמיתות ונקה את כל שאריות הדם סביב אזור הניתוח במידת הצורך.
- סגירה וטיפול לאחר ניתוח
- הפרד את העור מהרקמה התת עורית של הצוואר כדי להקל על התפירה. לתפור את העור בעזרת מחט מעוקלת ותפר 4-0.
- יש לתת בופיבקאין תת עורי במינון 2.5 מ"ג/מ"ל (0.01 - 0.02 מ"ל/ק"ג) סביב מקום החתך.
- העבירו בזהירות את החיה לכלוב התאוששות (33 - 35 מעלות צלזיוס) למשך 30-120 דקות. במהלך תקופת ההחלמה, החיה לא נשארת ללא השגחה עד שהיא חוזרת להכרה מספקת כדי לשמור על תנוחת שכיבה של עצם החזה. כאשר החיה מתאוששת לחלוטין, העבירו אותה בחזרה לכלוב הביתי. הניחו צ'או רטוב בהישג יד בתוך הכלוב.
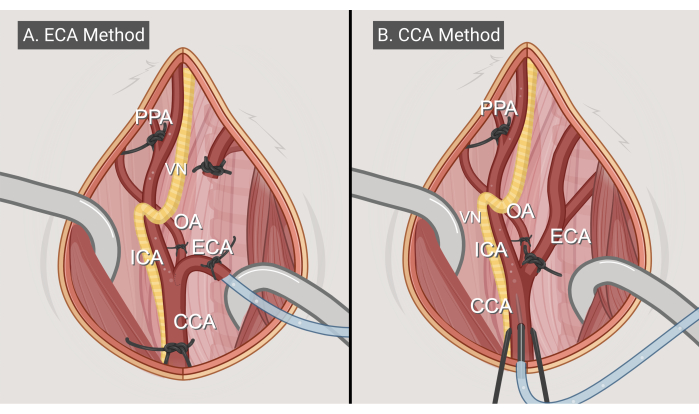
איור 3: שיטות ניתוח. איורים של שתי הגישות הכירורגיות, (א) שיטת הכניסה ל-ECA ו-(ב) שיטת הכניסה ל-CCA. קיצורים: CCA = עורק הצוואר המשותף; ECA = עורק הצוואר החיצוני; ICA = עורק הצוואר הפנימי; OA = עורק עורפי; PPA = פטריגופלטין; VN = עצב התועה. דמות עשויה BioRender.com. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
4. מעקב
- ניטור ונקודות קצה אנושיות
- עקוב אחר בעלי חיים לתקופה של 7 ימים לאחר הניתוח. לספק משככי כאבים לאחר הניתוח עם בופרנורפין תת עורי במינון של 0.05 מ"ג/ק"ג בסוף יום הניתוח ושוב בבוקר שלמחרת. המשיכו לעקוב אחר בעלי חיים מדי יום ולתת משככי כאבים נוספים לפי הצורך על סמך הערכה קלינית של כאב או מצוקה. המתת חסד של חולדה מוקדם יותר אם מגיעים לנקודת קצה אנושית על פי ההנחיה 2010/63/EU של הפרלמנט האירופי.
- ליקויים נוירולוגיים קליניים
- הערכת ליקויים נוירולוגיים קליניים (CND) בימים שלאחר הניתוח (לדוגמה, ימים 1, 3 ו-7). ההגדרה שלנו ל-CND כוללת ירידה בכיפוף הגפה הקדמית השמאלית (למשל, עיכוב הארכת הגפה הקדמית בזמן הרמת החולדה), חוסר יכולת ללכת ישר, או התנהגות מעגלית, בדומה לציוןבדרסון 10. השתמש בכל ניקוד או מבחנים נוירולוגיים סטנדרטיים כדי להעריך את התפקוד המוטורי והמצב הנוירולוגי.
- הדמיית תהודה מגנטית
- בצע הדמיית תהודה מגנטית (MRI) לאחר הניתוח (לדוגמה, בימים 1, 3, 5 ו-7) במערכת MRI של בעלי חיים קטנים 7 T כאשר החולדה מורדמת עם 1.2% - 2.5% איזופלורן בתערובת של 0.5 ליטר לדקה אוויר רפואי ו-0.5 ליטר לדקה חמצן. עקוב אחר הנשימה והטמפרטורה ברציפות.
- השג סריקות משוקללות T2 באמצעות פרמטרי הרצף הבאים: זמן חזרה 2500 אלפיות השנייה, זמן הד 9 אלפיות השנייה, מרווח הד 9 אלפיות השנייה ו-10 הדים. הגדר את שדה הראייה ל 35 x 35 מ"מ עם מטריצת רכישה של 128 x 128. עובי הפרוסה הוא 1.1 מ"מ עם סך של 15 פרוסות שנרכשו, תוך שמירה על יחס גובה-רוחב של 1.00 ושימוש ברכישה דינמית אחת.
- ניתוח היסטולוגי
- לאחר השלמת ה-MRIביום השביעי (או כאשר מגיעים לנקודת הסיום של הניסוי), החזיקו את החולדה תחת הרדמה להמתת חסד באמצעות זלוף לב עם 30 מ"ל של 0.1 M מי מלח עם פוספט ואחריו 30 מ"ל של פרפורמלדהיד 4%.
- חלצו את המוח וקיבעו אותו לאחר מכן למשך הלילה ב-4% פרפורמלדהיד. לאחר תקופת קיבוע של 24 שעות, הטמיעו את המוח בפרפין, חתכו בחתכים עטרתיים וצבעו בהמטוקסילין ואאוזין (H&E) בשיטה הסטנדרטית11.
תוצאות
תוצאה נוירולוגית
טבלה 1 נותנת סקירה כללית של כל ההכללות וההחרגות בקבוצות הניסוי השונות. אף אחת מהחולדות שנותחו בדמה לא הראתה שום CND. בקבוצת ECA-CAGE (8000 nL), שתיים מתוך חמש חולדות לא הראו CND, בעוד ששלוש החולדות הנותרות חוו CND, מתוכם שתיים מתו תוך 24 שעות. בקבוצת CCA-CAGE (8000 nL) כל בעלי החיים הראו CND, שלושה מתוך חמישה לא שרדו עד 48 שעות. בקבוצות CCA-CAGE עם נפחי אוויר נמוכים יותר, כל החולדות שרדו לאחר הניתוח. כל חמש החולדות בקבוצת ה-7000 nL הראו CND, בעוד שבקבוצת 6000 nL, שתיים מתוך חמש חולדות הראו CND.
| ECA | CCA | |||||||
| שאם | 8000 נ"ל | שאם | 8000 נ"ל | 7000 נ"ל | 6000 נ"ל | |||
| כלול | 5 | 5 | 5 | 5 | 5 | 5 | ||
| הפגין ליקויים נוירולוגיים קליניים | 0 | 3 | 0 | 5 | 5 | 2 | ||
| תמותה < 24 שעות | 0 | 2 | 0 | 2 | 0 | 0 | ||
| תמותה 24-48 שעות | 0 | 0 | 0 | 1 | 0 | 0 | ||
| סה"כ לא כלול | 3 | 4 | 1 | 0 | 2 | 1 | ||
| לא נכלל עקב סיבוך דימום | 2 | 3 | 0 | 0 | 0 | 0 | ||
| לא נכלל עקב סיבוך טרומבוטי | 0 | 1 | 0 | 0 | 0 | 1 | ||
| מוות תוך ניתוחי עקב דחיסת עצב הנרתיק | 1 | 0 | 1 | 0 | 2 | 0 | ||
טבלה 1: הכללות והדרה של קבוצות בעלי חיים. מספר החולדות בכל קבוצה, הכללות והחרגות, מקרי מוות והישרדות עם ליקויים נוירולוגיים קליניים.
MRI
איור 4 מציג תמונה משוקללת T2 מייצגת של חולדה שקיבלה בועות אוויר של 7000 nL באמצעות שיטת הכניסה ל-CCA, המציגה היפר-אינטנסיביות בקליפת המוח. חריגות דומות נצפו בכל בעלי החיים בקבוצת CCA-CAGE שקיבלו 7000 או 8000 nL, ובמידה פחותה בקבוצת 6000 nL ובקבוצת ECA-CAGE. יש לציין כי בעוד שאף אחת מהחיות בקבוצות הדמה לא הראתה CND כלשהו, חולדת דמה ECA אחת הראתה אזור של עוצמת יתר ב-MRI; בקבוצת CCA-sham, אף חולדה לא הראתה חריגות ב-MRI.
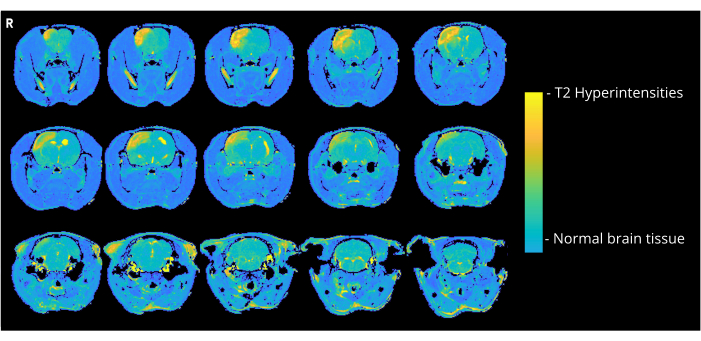
איור 4: תמונות לדוגמה של MRI. תמונות MRI משוקללות T2 מייצגות (3 ימים לאחר ניתוח CAGE) המראות עוצמות יתר בקליפת המוח עקב כלוב בחולדה מקבוצת CCA-CAGE 7000 nL. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
היסטולוגיה
איור 5 מציג קטע מוח מייצג מוכתם H&E של חולדת כלוב CCA 7000 nL מאיור 4, המדגים נזק מוחי איסכמי בקליפת המוח עם אובדן תאי עצב וגליוזיס תגובתי, כולל אסטרוגליוזיס תגובתי והפעלת מיקרוגליה.
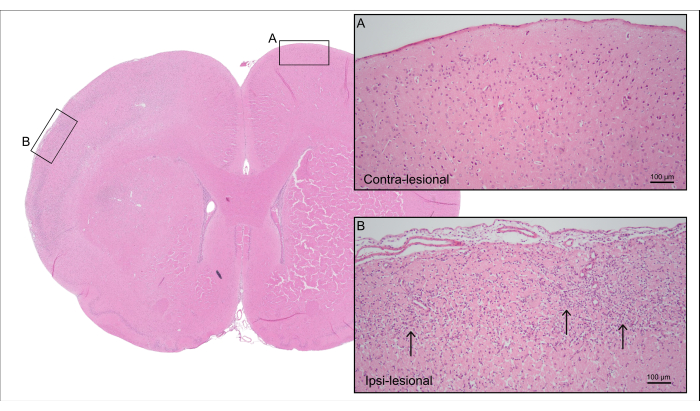
איור 5: היסטולוגיה לאחר המוות. צביעה מייצגת של H&E של החולדה מאיור 4 המציגה רקמת קליפת המוח של הצד הנגדי עם (A) נוירונים שלמים ו-(B) הצד ה-ipsi-נגעי עם רקמת קליפת המוח האיסכמית עם אובדן תאים עצביים וגליוזיס תגובתי (חיצים). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
אתגרים טכניים
בשל אתגרים טכניים, לשיטת הכניסה ל-ECA היה שיעור הצלחה נמוך משמעותית בהשוואה לשיטת הכניסה ל-CCA (טבלה 1). זה נבע בעיקר מאורך הצנתר הקצר הנדרש בשיטת הכניסה ל-ECA, שלעתים קרובות הביא לפריקת קטטר ודימום. בנוסף, שיטת הכניסה ל-ECA הביאה גם להארכת זמן הניתוח בכ-20 דקות, כמו גם לשונות גדולה יותר בקוטר הבועה.
איור משלים 1: פרטים על מחולל בועות האוויר. (A) תמונות של גוף מחולל הבועות וחולץ הנימים מדגישות את ההרכבה וההיבטים הפונקציונליים שלהם. (B) מבט רוחבי של מחולל הבועות, שמראה את העיצוב ואת המאפיינים המבניים שלו מנקודת מבט צדדית. (C) מבט חזיתי של מחולל הבועות, הממחיש את ההיבטים והתכונות הקדמיות המרכזיות. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: שלבים להפעלת התוכנה. קובץ זה מספק מדריך מפורט על הנהלים והשלבים שיש לבצע להפעלה ושימוש יעילים בתוכנה המשויכת למחולל בועות האוויר. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: קוד Python. הקוד מורכב משני קבצי Script (A ו-B) שיש לשמור באותה תיקייה. אנא לחץ כאן להורדת קובץ זה.
Discussion
תיארנו כיצד להחדיר תסחיפי אוויר לעורקי המוח של החולדות בשתי שיטות והראינו כי להחדרה דרך מחט המוחדרת ל-CCA יש יתרונות מרובים על פני שיטה הכוללת אמבוליזציה דרך קטטר לתוך ה-ECA. באופן ספציפי, ראינו פחות סיבוכים בשיטת הכניסה ל-CCA, כמו גם קוטר בועה עקבי יותר וזמן ניתוח מופחת. שיטת הכניסה ל-CCA מביאה ל-CND תלוי מינון, וחריגות ב-MRI המעידות על אוטם מוחי כפי שאושר בהיסטולוגיה.
הבחירה הראשונית בשיטת הכניסה ל-ECA נעשתה בהשראת Gerriets et al.7. עם זאת, זיהינו מספר קשיים בגישה זו, כולל שינויים משמעותיים בגודל הבועה ושיעור סיבוכים כירורגי גבוה יותר בהשוואה לשיטת הכניסה ל-CCA. מקור עיקרי לסיבוכים אלה קשור לאורך הצנתר. במודל שלנו, שימוש בצנתר קצר (125 מ"מ) עזר לשמור על יציבות הבועות מכיוון שככל שהצנתר ארוך יותר, כך גדלה ההסתברות שהבועות יתמזגו תוך כדי זרימה דרך הצנתר9. עם זאת, בשיטת כניסת ECA, קטטר ארוך יותר מאפשר מיקום קל יותר ומינוף לתנועה. שימוש בצנתר קצר בשיטת כניסת ECA מביא לנקע והידרדרות תכופים של גדם ה-ECA עקב מניפולציה מוגזמת.
קושי שני שנתקלו בו בשיטת כניסת ECA התייחס ליצירת בועות בגודל עקבי (איור 6). בשיטת כניסת ECA, יש לעצור זמנית את זרימת מי המלח דרך הצנתר בזמן שהקטטר מוחדר ל-ECA. כאשר זרימת העורקים משוחזרת והתסחיף יכול להתחיל, הצנתר נתון לפתע ללחץ הדם של החולדה. כתוצאה מכך, זה מוביל לדם שנכנס לאחור לקטטר ולמחולל הבועות. ההשפעה של לחץ הדם המשתנה על הלחץ בתוך מחולל הבועות מובילה לשונות גבוהה יותר בגודל הבועה, מה שמוביל לפעמים לבועות בצורת גליל שממלאות את התעלה (איור 6B). ניתן להימנע מכך על ידי הגדלת הלחץ בתוך המערכת לפני מיקום הצנתר ב-ECA. זה נעשה בצורה הטובה ביותר על ידי אדם שני לתזמון מדויק. יתר על כן, מכיוון ששיטה זו גוזלת זמן רב יותר, היא מובילה להחדרת כמות גדולה יותר של מי מלח לחולדה מאשר שיטת הכניסה ל-CCA. בשיטת הכניסה ל-CCA, מי מלח זורמים ברציפות דרך הצנתר, והמחט מוחדרת לכיוון זרימת הדם דרך ה-CCA, ובכך פותרת את בעיית שיפוע הלחץ שתוארה לעיל. התוצאה היא היעדר זרימה חוזרת לתוך הצנתר וגודל בועה אחיד יותר.
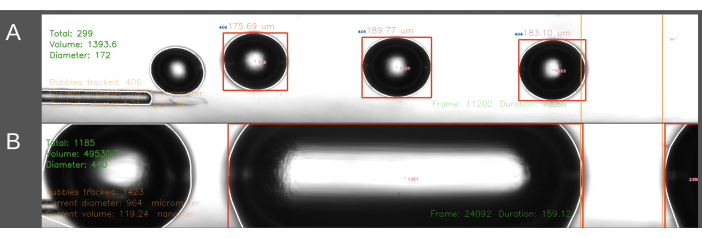
איור 6: דוגמה לרישום וניתוח של ייצור בועות. תמונות מציגות צילומי מסך המציגים את הניתוח בזמן אמת של המספר הכולל של בועות, נפח כולל וקוטר ממוצע באזור המדידה (ירוק, פינה שמאלית עליונה). אזור המדידה מודגש בין הקווים הכתומים מימין. קוטר הבועה ונפח הבועה מחושבים על פי הקוטר האופקי. התמונות כוללות היווצרות של (A) בועות אוויר שנוצרו בהצלחה ו-(B) בועות גליליות שנוצרו ללא הצלחה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
למרות ששיטת הכניסה ל-CCA הייתה מועדפת, עדיין נתקלנו בקשיים טכניים שונים. ראשית, הכנת ה-PPA היא מאתגרת, שכן דחיסה מקרית של עצב הנרתיק עלולה לגרום לדיכוי נשימה ולמוות של החיהלאחר מכן 12. כדי להפחית סיכון זה, יש להטות את החולדה מעט הצידה ולהתקרב ל-PPA מכיוון הגולגולת. בנוסף, בשל האנטומיה המאתגרת של התפצלות ICA ו-PPA, קיים סיכון לנזק לכלי הדם ולדימום בלתי נשלט. ניתן לעקוף זאת רק על ידי שיפור מיומנויות כירורגיות. אתגרים אלה מדגישים כי שליטה במודל הכלוב בחולדות היא מורכבת ודורשת תרגול ודיוק משמעותיים13.
להתקנה הטכנית המוצעת של מחולל בועות האוויר יש מגבלות, במיוחד הקשורות לנימי הזכוכית בהתאמה אישית, בגלל שבריריותם. הצינור המחבר את הרגולטור הפנאומטי לנימים נוטה להישבר בעת התאמת השסתום התלת-כיווני לשחרור לחץ לאחר אמבוליזציה. יתר על כן, החלפת נימים מחייבת הרס הנימים הקיימים עקב הצמדת הגומי המתכווץ בחום אליו לצמיתות. בנוסף, לכל נימי יש מאפייני בועה ייחודיים עקב הבדלים קלים בקוטר הקצה ובצורתו. לבסוף, הפעולה הידנית של ייצור הבועות באמצעות הרגולטור הפנאומטי דרשה ניסיון משמעותי. טיפול חסר ניסיון עלול לגרום לייצור בועות גדולות מדי. ויסות לחץ אוטומטי עם לולאת משוב מקוד Python יכול לשפר את הדיוק האוטומטי במחקרים עתידיים.
התיעוד היסודי שלנו, המקיף הן את המפרט הטכני של מחולל הבועות, פרוטוקול כירורגי מפורט והן אספקת התוכנה, תורם תרומה חשובה לתחום מחקר זה. טכניקת ה-CCA שלנו מבטיחה הפרעה מינימלית לזלוף המוח הפיזיולוגי, על ידי שמירה על זרימת CCA לאורך כל ההליך וביטול הצורך להקריב את ה-ECA. המחקר שלנו מספק מודל ניסיוני אמין וניתן לשחזור כדי לחקור את CAGE ואת הטיפולים הפוטנציאליים שלו.
Disclosures
ללא
Acknowledgements
מחקר זה מומן על ידי הקרן לביטוח בריאות צבאי הולנדי (Stichting Ziektekosten Verzekering Krijgsmacht) במסגרת מענק מספר 20-0232 ומענק קרן הלב ההולנדית 2021 E. Dekker (03-006-2021-T019 ל-IAM). אנו מודים גם ללינדי אלס, פול בלומן ואד ואן בבל על עזרתם יוצאת הדופן.
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum Crossed Roller XYZ Stage Center Drive Metric Threads with Fine Pitch Screw | Optosigma | TAM-405CLFP | Part of frame (Step 1.1.) |
| Basler Ace - acA2440-35um | Basler AG | 107208 | High speed camera (Step 1.4.) |
| Bupivacaine 2.5 mg/ml | Aurobindo Pharma B.V. | RVG20949 | Medication perioperative (Step 3.8.3.) |
| Buprenorfine 0.3 mg/ml | Indivior | 112515 | Medication perioperative (Step 3.2.1.) |
| Custom glass chamber | Technoglas Lab. App. B.V. | - | Custom made (Step 1.3.1.) |
| Duratears | Alcon | - | Artificial tears (Step 3.2.5.) |
| Electric razor | Aesculap | GT416-VR | |
| Electro-Pneumatic Regulator - ITV0010-3L | SMC | ITV0010-3L | Pneumatic regulator of bubble generator (Step 1.2.) |
| GC100T-15 thin wall W/O filament 1.0mmOD | Multi Channel Systems | 300036 | Borosilicate glass capillaries (Step 1.5.) |
| Graphpad Tool: www.graphpad.com/quickscalcs/randomize1/ | Dotmatics | - | Randomly assign subjects to treatment groups |
| Heatshrink rubber | Pro-POWER | 1190988 | Holds capillary and pneumatic tubing in place (Step 1.2.) |
| Isoflurane 1000 mg/g | Laboratorios Karizoo S.A. | 118938 | |
| Laptop | Dell | - | 12th Gen Intel® Core™ i5-1235U 1.30 GHz, 16.0 GB ram, Windows 10 |
| Light source station with two dual white LED and goosenecks | Euromex Microscopen B.V. | LE.5212 | Led light source (Step 1.4.) |
| Micro forceps bent | Aesculap | BD329R | (Step 3.3.2.) |
| Micro needle holder | Silber | GU1870 | For inserting needle in CCA (Step 3.7.3.) |
| Micro scissors | HEBU medical | HB7384 | Vascular scissor (Step 3.6.3) |
| Micro vascular clip | Biemer | FD562R | (Step 3.6.1.) |
| Microlance 3 (21G, 27G and 30G) | BD Medical | 304000 | (Step 1.3.2.) |
| Mosquito artery clamp | Aesculap | BH105R | (Step 3.4.3.) |
| NexiusZoom | Euromex Microscopen B.V. | NZ.1903-B | Microscope for surgery (Step 3.3.) |
| Narishige PB-7 | Narishige Group | - | Micropipette puller (Step 1.5.1.) |
| Optomechanical mounts, adapter and post assemblies | Thor Labs | - | Various parts to hold the bubble generator body in static position (Step 1.1.) |
| PE-10 tubing | Intramedic | 427401 | Catheter (Step 1.3.2.) |
| Perfusor Space | B.Braun | 8713030 | Syringe pump (Step 1.6.1.) |
| Plan Achromat Objective, 0.10 NA, 18.5 mm WD 4X | Olympus | RMS4X | Magnification lens (Step 1.4.) |
| Python | Python Software Foundation | - | Version 3.11.2 (Step 2.2.1.) |
| Pylon viewer | Basler AG | - | Version 7.4.0 (Step 2.1.1.) |
| Rubber O-RING 1 x 1 mm silicone | Op den Velde Industrie B.V. | 99002887 | Prevents leakage of saline (Step 1.3.3.) |
| Rubber O-RING 6 x 1 mm silicone | Op den Velde Industrie B.V. | 99002886 | Holds glass chamber in place (Figure 2.) |
| Rodent Warmer X1 with Rat Heating Pad and Rectal Probe | Stoelting | 53800R | Heating pad (Step 3.1.2.) |
| Skeleton Fine Forceps | Hoskins | 2710-B-2074 | (Step 3.3.2.) |
| Wistar rats | Charles River Laboratory | - |
References
- Mitchell, S. J., Bennett, M. H., Moon, R. E. Decompression sickness and arterial gas embolism. N Engl J Med. 386 (13), 1254-1264 (2022).
- Bessereau, J., et al. Long-term outcome of iatrogenic gas embolism. Intensive Care Med. 36 (7), 1180-1187 (2010).
- Brown, A. E., Rabinstein, A. A., Braksick, S. A. Clinical characteristics, imaging findings, and outcomes of cerebral air embolism. Neurocrit Care. 38 (1), 158-164 (2023).
- Weenink, R. P., Hollmann, M. W., Van Hulst, R. A. Animal models of cerebral arterial gas embolism. J Neurosci Methods. 205 (2), 233-245 (2012).
- Rosengren, L., Persson, L. Enhanced blood-brain barrier leakage to Evans blue-labelled albumin after air embolism in ethanol-intoxicated rats. Acta neuropathologica. 38 (2), 149-152 (1977).
- Furlow, T. W. Experimental air embolism of the brain: An analysis of the technique in the rat. Stroke. 13 (6), 847-852 (1982).
- Gerriets, T., et al. A rat model for cerebral air microembolisation. J Neurosci Methods. 190 (1), 10-13 (2010).
- Juenemann, M., et al. Impact of bubble size in a rat model of cerebral air microembolization. J Cardiothorac Surg. 8, 198 (2013).
- C Schaefer, T., et al. Investigation of experimental endovascular air embolisms using a new model for the generation and detection of highly calibrated micro air bubbles. J Endovasc Ther. 30 (3), 461-470 (2022).
- Bederson, J. B., et al. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke. 17 (3), 472-476 (1986).
- Schulte, E. K. Standardization of biological dyes and stains: Pitfalls and possibilities. Histochemistry. 95 (4), 319-328 (1991).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
- Themistoklis, K. M., et al. Transient intraluminal filament middle cerebral artery occlusion stroke model in rats: A step-by-step guide and technical considerations. World Neurosurg. 168, 43-50 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved