Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de esferoides a partir de varios condrocitos utilizando condiciones de baja adherencia por gravedad y mini-biorreactores caseros
En este artículo
Resumen
Este estudio describe un método para producir esferoides condrocíticos mediante la agregación de células en esferoides en condiciones de baja adherencia utilizando la gravedad, seguido de un cultivo de los esferoides resultantes en mini-biorreactores.
Resumen
La reparación del cartílago en las enfermedades articulares crónicas exige terapias avanzadas basadas en células para regenerar los tejidos dañados de manera efectiva. Este protocolo proporciona un método paso a paso para diferenciar células madre pluripotentes inducidas (iPSC) en esferoides basados en condrocitos, lo que respalda las aplicaciones de ingeniería de tejidos y terapia celular. El proceso de diferenciación está cuidadosamente estructurado para promover el compromiso del linaje condrogénico, comenzando con iPSCs cultivadas en medios específicos que guían secuencialmente a las células a través de etapas críticas de diferenciación. Inicialmente, las iPSCs se expanden para alcanzar una confluencia óptima antes de la inducción hacia el linaje condrogénico utilizando una serie de cambios de medio definidos. Para el día 10, las células se transforman en un medio promotor de la condrogénesis que mejora la formación de células similares a los condrocitos que expresan marcadores clave de condrocitos maduros. Una mayor agregación en placas recubiertas de agarosa de 96 pocillos conduce a la formación de esferoides tridimensionales, que luego se cultivan en mini-biorreactores personalizados diseñados para simular un microambiente que fomenta la deposición de la matriz extracelular (ECM). Al permitir la producción escalable de esferoides de condrocitos que imitan las características del cartílago nativo, este enfoque ofrece una solución prometedora y reproducible para el desarrollo de tratamientos basados en células para los defectos del cartílago, proporcionando una amplia utilidad para aplicaciones clínicas y de investigación en medicina regenerativa musculoesquelética.
Introducción
La prevalencia de la enfermedad articular conlleva importantes cargas económicas debido al creciente número de pacientes discapacitados y a los costes asociados a su atención. El cartílago hialino es un tejido conectivo avascular con un potencial regenerativo limitado1. El uso prolongado de ciertos medicamentos antiinflamatorios no esteroideos (AINE), glucocorticoides y quimioterapia o radioterapia puede disminuir aún más la capacidad regenerativa del cartílago, eliminando casi por completo su capacidad decuración. Esto dificulta la obtención de células autólogas de cartílago para la terapia celular.
La tecnología de cultivo celular tridimensional (3D), incluidos los condrocitos, ha sido reconocida durante mucho tiempo como un área de investigación emergente con un potencial significativo. Estas estructuras 3D se están estudiando para aplicaciones tanto en investigación biológica fundamental como en medicina regenerativa. Los esferoides derivados de condrocitos autólogos son prometedores terapéuticamente para tratar la degeneración del tejido cartilaginoso, una afección que actualmente recibe una considerable atención mundial3.
Los esferoides derivados de condrocitos diferenciados de las iPSC representan una alternativa prometedora a los condrocitos primarios, ofreciendo ventajas significativas para la reparación del cartílago. Las iPSCs proporcionan una capacidad casi ilimitada de autorrenovación y poseen un amplio potencial de diferenciación, lo que permite la producción de condrocitos en cantidades suficientes para aplicaciones clínicas sin procedimientos invasivos para la recolección de células4. Además, la transición de los cultivos tradicionales de condrocitos bidimensionales (2D) a los sistemas de cultivo 3D, como las condrosferas, mejora aún más la viabilidad y la funcionalidad de estas células al crear un entorno fisiológicamente más relevante. Los estudios muestran que los condrocitos cultivados en esferoides 3D mantienen mejor su fenotipo, mostrando tasas más bajas de desdiferenciación y niveles de expresión más altos de marcadores clave del cartílago hialino, como el colágeno tipo II y el agrecan5.
A pesar del potencial de las condrosferas derivadas de iPSC, los protocolos estandarizados para generar condrosferas de alta calidad siguen siendo limitados. La variabilidad en los protocolos entre estudios a menudo conduce a inconsistencias en la calidad de los condrocitos y la composición de la matriz extracelular, lo que afecta su efectividad para uso terapéutico6. Aquí, se presenta un protocolo refinado que estandariza la generación de esferoides a partir de condrocitos derivados de iPSC utilizando mini-biorreactores asequibles y hechos a medida. La fase de cultivo del mini-biorreactor es esencial, ya que proporciona un ajuste controlado y de baja adherencia que optimiza la distribución de nutrientes, la maduración de la MEC y la compactación de esferoides7. Esta fase promueve una expresión robusta de marcadores de condrocitos esenciales, incluido el colágeno tipo II, agrecano y SOX9, junto con una composición de ECM que se asemeja mucho al cartílago nativo. Los cambios regulares de medios y el control cuidadoso de las condiciones ambientales (temperatura, CO2 y velocidad de rotación) aseguran aún más la viabilidad y maduración de los esferoides condrocitos. Este protocolo se ha optimizado para crear condrosferas de alta calidad con una fuerte expresión de marcadores de cartílago hialino de una manera rentable y escalable, adecuada para aplicaciones clínicas y de investigación en la reparación del cartílago.
Protocolo
El estudio fue revisado y aprobado por el Comité de Ética de la LOPUKHIN FRCC PCM (protocolo n.º 2019/02 del 9 de abril de 2019). Todas las muestras de los donantes se obtuvieron de acuerdo con los principios de la Declaración de Helsinki. Se obtuvo el consentimiento informado de todos los participantes y/o de sus tutores legales.
NOTA: Mantener la técnica estéril durante todo el protocolo. Calentar todos los medios y soluciones de cultivo a 37 °C antes de aplicarlos a células o esferoides. Cultive las células en una incubadora de CO2 a 37 °C, con 5% de CO2 sobre 80% de humedad. El esquema de protocolo se muestra en la Figura 1.
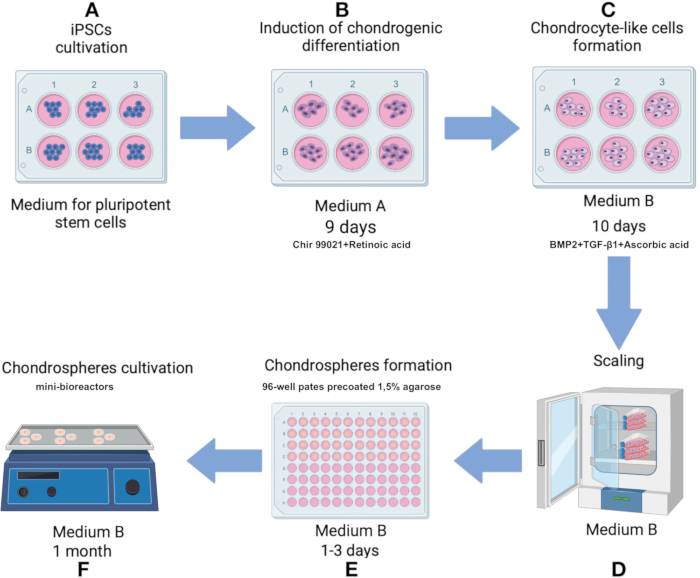
Figura 1: Protocolo para la producción de condrosferas a partir de la línea IPSRG4S iPSC. (A) Inicialmente, las iPSCs se cultivan en medios de células madre pluripotentes hasta que se alcanza el 80% de confluencia. (B) Para inducir la diferenciación hacia el linaje condrocítico, las iPSC se cultivan en el medio A durante 2 días. Posteriormente, el medio se sustituye por una formulación que carece de Chir 99021 y de inhibidor de la Rho quinasa, y las células se cultivan durante 6 días adicionales con cambios de medio cada 2 días. (C) A continuación, las células se transfieren al medio B para promover la condrogénesis durante los próximos 10 días. (D) Una vez que se alcanza un número suficiente de células, el proceso avanza a la etapa de producción de esferoides. (E) Las células se agregan en esferoides en condiciones de baja adherencia bajo gravedad. (F) Los esferoides resultantes se cultivan en mini-biorreactores con medio B. Haga clic aquí para ver una versión más grande de esta figura.
1. Transformación de placas de Petri en mini-biorreactores
NOTA: Detalles en un artículo anterior5.
- Corte los tubos de la centrífuga en anillos de 7-8 mm de altura con unas tijeras de autoclave estériles (ajustes del autoclave: 121 °C (250 °F) a 15 psi, 30 min y secado post-autoclave durante 20 min).
- Triture las placas de Petri de baja adherencia, sin tratar o microbiológicas en trozos pequeños. Disuelva aproximadamente 1 g de partículas de plástico en 10 ml de cloroformo durante la noche para crear una solución de plástico líquido. Realice este procedimiento en una campana extractora.
- Verifique que el plástico líquido sea lo suficientemente viscoso para el pipeteo. Asegúrese de que las gotas mantengan una forma esférica en lugar de extenderse por la superficie. Si la solución es demasiado delgada, agregue más partículas de plástico, que generalmente requieren de 1 a 3 g. Si es demasiado espeso, agregue cloroformo adicional, que generalmente requiere hasta 5 mL.
- Forme una perilla de plástico en el centro de una placa de Petri estéril de 60 mm de adherencia ultra baja utilizando uno de los dos métodos efectivos que se describen a continuación.
- Opción 1: Coloque el anillo de plástico esterilizado en autoclave en el centro de la placa de Petri, luego aplique plástico líquido dentro del anillo; una gota requerirá alrededor de 100-200 μL de plástico líquido.
- Opción 2: Aplique la misma cantidad de gotas de plástico líquido directamente en el centro de la placa de Petri sin usar el anillo de plástico.
- Deje que los platos se sequen sin tapar durante 2-3 h en una campana de flujo laminar. Después del secado, exponga los platos a la radiación ultravioleta durante 20-30 minutos.
2. Tratamiento de placas de cultivo con gelatina
- Prepare una solución de gelatina al 0,1% disolviendo gelatina en polvo en agua destilada a 95 °C. Pase la solución secuencialmente a través de filtros de membrana de 0,45 μm y 0,25 μm, luego almacene el filtrado a 4 °C.
- Inmediatamente antes de la resiembra de condrocitos, aplique 3 mL de solución de gelatina al matraz de 25cm2 (se recomiendan hasta 15 g de tejido cartilaginoso por matraz T25). Incubar a temperatura ambiente (RT) durante 30 min, retirar la gelatina, enjuagar dos veces con PBS y proceder a la siembra de células.
3. Aislamiento y cultivo de condrocitos
NOTA: Los condrocitos se aíslan de las regiones del cartílago que no soportan peso de los pacientes que se someten a un reemplazo total de rodilla. Recoja todas las muestras en condiciones estériles y guárdelas en tubos estériles llenos de DMEM que contengan 200 U/mL de solución de penicilina/estreptomicina. Almacene el tejido cartilaginoso en el frigorífico a una temperatura de 2-8 °C.
- Comience el tratamiento enzimático dentro de los 2 días posteriores a la recolección del cartílago. Lave las piezas de cartílago en la solución de Hanks utilizando placas de Petri de 60 mm, luego corte el cartílago en fragmentos de aproximadamente 1-2 mm de diámetro con tijeras esterilizadas en autoclave.
- Transfiera los trozos de cartílago a tubos de 15 ml y digéralos en una solución de colagenasa tipo II al 0,01% en DMEM, aproximadamente 1 ml por 1 g de cartílago, dentro de 8-12 h en una incubadora de CO2 configurada a 37 °C con 5% de CO2, 100% de humedad, bajo agitación continua en un agitador orbital a 150-200 rpm.
- Después de la digestión, lavar los fragmentos de cartílago añadiendo DMEM a un tubo de 15 ml, luego centrifugar a 300 × g durante 10 minutos. Resuspender los fragmentos en un medio de cultivo de condrocitos (Tabla suplementaria 1) y sembrarlos en un matraz adhesivo T25 prerrecubierto con una solución de gelatina al 0,1%.
- Condrocitos de paso cuando se alcanza una densidad confluente del 80%.
- Para el paso, lavar los condrocitos con la solución de Hanks, luego incubar las células con una solución de tripsina al 0,25% a 37 °C durante 5 min.
- Para inactivar la tripsina, agregue un volumen igual de DMEM + 10% FBS. Vuelva a suspender los condrocitos en un medio de cultivo fresco, luego distribúyalos en una proporción de 1:3, sembrando 20.000-30.000 células por 1cm2.
- Colocar el matraz de cultivo en una incubadora a 37 °C con 5% de CO2 y 100% de humedad.
4. Cultivo de células madre pluripotentes
NOTA: En colaboración con el Laboratorio de Células Madre del Grupo de Investigación Molecular del Cerebro, Departamento de Neurobiología, Instituto A.I. Virtanen, Universidad de Finlandia Oriental, Kuopio, Finlandia, se generó con éxito una línea de iPSCs IPSRG4S, en un estudio anterior8.
- Cultive iPSCs en placas de 6 pocillos pre-recubiertas con una matriz que contiene proteínas extracelulares ( Figura 1A). Utilice un medio para células madre pluripotentes (Tabla suplementaria 1).
- Células de paso al 80% de confluencia, manteniendo una proporción 1:4 (50.000-75.000 células por 1cm2). Aproximadamente 2-3 h antes del desprendimiento, transfiera las iPSC al medio para obtener células madre pluripotentes que contengan el inhibidor de la Rho quinasa Y27632 a una concentración final de 1 μM durante 1 día.
- Lave las iPSC con la solución de Hanks e incube a 37 °C con una solución de tripsina al 0,05%. Para inactivar la tripsina, agregue un volumen igual de DMEM + 10% FBS. Centrifugar la suspensión celular a 200 x g durante 5 min en tubos de 15 mL.
- Deseche el sobrenadante y vuelva a suspender las células en un medio fresco para obtener células madre pluripotentes. Para mejorar la viabilidad celular, agregue el inhibidor de la Rho quinasa Y27632 al medio a una concentración final de 1 μM durante 1 día. Coloque la placa de cultivo en una incubadora de CO2 a 37 °C con 5% de CO2 y 100% de humedad.
5. Diferenciación condrogénica de las iPSCs
- Iniciar la diferenciación hacia el linaje condrocítico mediante el cultivo de células en el Medio A (Tabla Suplementaria 1) durante los primeros 2 días. El día 3, reemplace el medio A con una solución que excluya Chir 99021 y el inhibidor de la Rho quinasa, manteniendo todos los demás componentes sin cambios. Cambie el medio cada 2 días desde los días 3 hasta los 9 (Figura 1B).
- En el día 10, transfiera las células similares a los condrocitos al medio B (Tabla suplementaria 1), formulado para facilitar la condrogénesis. Cambie el medio cada 2 días durante 10 días (Figura 1C).
- Prepare una placa de cultivo en suspensión celular de 96 pocillos con anticipación cubriendo cada pocillo con agarosa al 1,5% en agua destilada. Derretir la agarosa en el microondas hasta que hierva (unos 60-90 s a 700 W). Una vez que la agarosa esté licuada, agregue 75 μL de agarosa a cada pocillo y deje que se endurezca a RT (aproximadamente 15 min).
- Añadir 150 μL de medio DMEM a cada pocillo e incubar la placa en una incubadora deCO2 durante al menos 12 h.
NOTA: Las placas preparadas pueden almacenarse hasta 1 mes en una incubadora deCO2 a 37 °C si se repone el medio de cada pocillo para compensar la evaporación. - En el día 12, después de observar los cambios fenotípicos asociados con la condrogénesis, se inicia la formación de esferoides utilizando las células similares a los condrocitos generadas.
NOTA: En esta etapa, es aconsejable analizar la expresión de marcadores condrocíticos clave con inmunocitoquímica (ICC) y reacción en cadena de la polimerasa cuantitativa (qPCR) utilizando el método 2-ΔΔCT 9 para confirmar la diferenciación condrogénica exitosa de las iPSC. Durante el paso de una placa de 6 pocillos a un matraz de cultivo celular de75 cm2 , se puede sembrar una pequeña porción de células en una placa de 48 pocillos, coincidiendo con el número de marcadores que se van a analizar. Realice análisis ICC en estas muestras para verificar la expresión génica.
6. Formación de esferoides a partir de células derivadas de iPSC similares a condrocitos
- Después de obtener derivados similares a los condrocitos, las células pasan al 80% de confluencia. Separe las células de las placas de 6 pocillos utilizando una solución de tripsina al 0,05%. Para inactivar la tripsina, agregue un volumen igual de DMEM + 10% de FBS, y luego transfiera las células a un tubo de 15 mL y centrifugue a 200 x g durante 5 min.
- Retirar el sobrenadante, resuspender las células en 1 mL de medio B y transferir a un matraz de cultivo celular de 75cm2 pre-recubierto con una solución de gelatina al 0,1% (Figura 1D). Una vez que las células alcancen el 80% de confluencia como una monocapa, separe las células nuevamente con tripsina y vuelva a suspender en el medio B como se describe.
- Transfiera las células a una placa de 96 pocillos recubierta con agarosa al 1,5% a una densidad de 100.000 células por pocillo. Cultivar en Medio B, agregando 150 μL de medio completo por pocillo (Figura 1D, 3A).
- Mantenga las células en la placa de 96 pocillos recubiertas con 1.5% de agarosa durante un mínimo de 1 día y un máximo de 3 días hasta que se formen esferoides (Figura 2B). Transfiera los esferoides de los pocillos con una punta de pipeta de 1 mL con un extremo recortado y, a continuación, transfiéralos a un tubo de 15 mL. Deje que los esferoides se asienten durante 2-3 minutos y elimine el sobrenadante.
- Sumerja los esferoides en una solución de matriz de membrana basal sin diluir recién descongelada y mantenida a 4 °C. Después de 30 minutos, recoja los esferoides por sedimentación pasiva en un tubo de 15 ml o por centrifugación suave a 100 x g durante 1 minuto.
NOTA: La matriz debe descongelarse durante la noche en hielo en un refrigerador de 2-8 °C. Después del primer deshielo, se fabrican alícuotas de un solo uso de la matriz para evitar ciclos repetidos de congelación-descongelación. Se utilizan tubos de polipropileno u otros tubos compatibles con el congelador y se almacenan a -70 °C o -20 °C. Tenga en cuenta la fecha de caducidad del lote, que es de 2 años a partir de la fecha de fabricación. - Transfiera los esferoides a mini-biorreactores y agregue 6 mL de medio B. Coloque el mini-biorreactor en un agitador orbital dentro de una incubadora de CO2 configurada a 37 °C con 5% de CO2 y 100% de humedad y una velocidad de agitación de 70-75 rpm (Figura 1F).
- Cambie el medio semanalmente o según sea necesario por agotamiento del medio o cambio de color del indicador ácido-base. Para hacer esto, deje que los esferoides se depositen por gravedad en un tubo de 15 mL y luego retire con cuidado el sobrenadante. Agregue medio B fresco al tubo y transfiera los esferoides de nuevo a los mini-biorreactores.
Resultados
El protocolo descrito se ilustra en la Figura 1. Esta metodología emplea dos medios de cultivo distintos para impulsar la diferenciación de las iPSC en esferoides condrocitos durante una duración mínima de 1 mes (Figura 2). El proceso de diferenciación se inicia cuando las iPSC alcanzan una confluencia del 75%-90% (Figura 1B). Los primeros indicadores de diferen...
Discusión
Las iPSC representan una herramienta transformadora en la medicina regenerativa, ya que ofrecen el potencial de generar condrocitos específicos del paciente para la reparación del cartílago. Los protocolos actuales aprovechan la diferenciación dirigida a través de las vías mesodérmicas, con moléculas de señalización clave como TGF-β y BMP-2 que promueven el compromiso del linaje condrocítico. Estos métodos tienen como objetivo replicar el desarrollo del cartílago embrionari...
Divulgaciones
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
La investigación fue apoyada con la asignación #22-15-00250 de la Fundación Rusa de Ciencias.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Referencias
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados