Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Получение сфероидов из различных хондроцитов в условиях низкой адгезии под действием силы тяжести и самодельных мини-биореакторов
В этой статье
Резюме
В данном исследовании описан метод получения хондроцитарных сфероидов путем агрегации клеток в сфероиды в условиях низкой адгезии с использованием силы тяжести с последующим культивированием полученных сфероидов в мини-биореакторах.
Аннотация
Восстановление хряща при хронических заболеваниях суставов требует передовой клеточной терапии для эффективной регенерации поврежденных тканей. Этот протокол представляет собой пошаговый метод дифференцировки индуцированных плюрипотентных стволовых клеток (ИПСК) в сфероиды на основе хондроцитов, поддерживая применение тканевой инженерии и клеточной терапии. Процесс дифференцировки тщательно структурирован таким образом, чтобы способствовать приверженности хондрогенной линии, начиная с иПСК, культивируемых в определенных средах, которые последовательно направляют клетки через критические стадии дифференцировки. Первоначально ИПСК расширяют для достижения оптимального слияния перед индукцией к хондрогенной линии с использованием серии определенных изменений среды. К 10-му дню клетки переходят в среду, способствующую хондрогенезу, которая усиливает образование хондроцитоподобных клеток, экспрессирующих ключевые маркеры зрелых хондроцитов. Дальнейшая агрегация в 96-луночных пластинах, покрытых агарозой, приводит к образованию трехмерных сфероидов, которые затем культивируются в специализированных мини-биореакторах, предназначенных для моделирования микросреды, способствующей осаждению внеклеточного матрикса (ВКМ). Обеспечивая масштабируемое производство сфероидов хондроцитов, которые имитируют характеристики нативного хряща, этот подход предлагает многообещающее, воспроизводимое решение для разработки клеточных методов лечения дефектов хряща, обеспечивая широкую полезность для клинических и исследовательских применений в регенеративной медицине опорно-двигательного аппарата.
Введение
Распространенность заболеваний суставов приводит к значительному экономическому бремени из-за растущего числа нетрудоспособных пациентов и расходов, связанных с их лечением. Гиалиновый хрящ представляет собой соединительную аваскулярную ткань с ограниченным регенеративным потенциалом1. Длительное использование некоторых нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидов, а также химиотерапии или лучевой терапии может еще больше снизить регенеративную способность хряща, практически уничтожая его способность к заживлению. Это затрудняет получение аутологичных хрящевых клеток для клеточной терапии.
Технология трехмерного (3D) культивирования клеток, в том числе хондроцитов, уже давно признана новой областью исследований со значительным потенциалом. Эти 3D-структуры изучаются для применения как в фундаментальных биологических исследованиях, так и в регенеративной медицине. Сфероиды, полученные из аутологичных хондроцитов, являются терапевтическими перспективами для борьбы с дегенерацией хрящевой ткани, состоянием, которому в настоящее время уделяетсязначительное внимание во всем мире.
Сфероиды, полученные из хондроцитов, дифференцированных от иПСК, представляют собой многообещающую альтернативу первичным хондроцитам, предлагая значительные преимущества для восстановления хряща. ИПСК обеспечивают практически безграничную способность к самообновлению и обладают широким потенциалом дифференцировки, что позволяет производить хондроциты в количествах, достаточных для клинического применения без инвазивныхпроцедур сбора клеток. Более того, переход от традиционных двумерных (2D) культур хондроцитов к 3D-системам культивирования, таким как хондросферы, еще больше повышает жизнеспособность и функциональность этих клеток за счет создания более физиологически значимой среды. Исследования показывают, что хондроциты, культивируемые в 3D-сфероидах, лучше сохраняют свой фенотип, демонстрируя более низкие темпы дедифференцировки и более высокие уровни экспрессии ключевых маркеров гиалинового хряща, таких как коллаген II типа и агрекан5.
Несмотря на потенциал хондросфер, полученных из iPSC, стандартизированные протоколы для генерации высококачественных хондросфер остаются ограниченными. Вариабельность протоколов в разных исследованиях часто приводит к несоответствиям в качестве хондроцитов и составе внеклеточного матрикса, что влияет на их эффективность для терапевтического использования6. Здесь представлен усовершенствованный протокол, который стандартизирует генерацию сфероидов из хондроцитов, полученных из iPSC, с использованием доступных, изготовленных по индивидуальному заказу мини-биореакторов. Фаза культивирования в мини-биореакторе имеет важное значение, так как она обеспечивает контролируемую настройку с низким уровнем адгезии, которая оптимизирует распределение питательных веществ, созревание ECM и уплотнение сфероидов7. Эта фаза способствует устойчивой экспрессии основных маркеров хондроцитов, включая коллаген II типа, аггрекан и SOX9, а также композицию ВКМ, которая очень похожа на нативный хрящ. Регулярная смена среды и тщательный контроль условий окружающей среды – температуры,CO2 и скорости вращения – еще больше обеспечивают жизнеспособность и созревание сфероидов хондроцитов. Этот протокол был оптимизирован для создания высококачественных хондросфер с сильной экспрессией маркеров гиалинового хряща экономически эффективным и масштабируемым способом, пригодных для исследований и клинического применения в области восстановления хряща.
протокол
Исследование прошло рецензирование и одобрение Этического комитета ФНКЦ ПКМ «ФНК им. Н.И. Лопухина» (протокол No 2019/02 от 9 апреля 2019 года). Все донорские образцы были получены в соответствии с принципами Хельсинкской декларации. Информированное согласие было получено от всех участников и/или их законных опекунов.
ПРИМЕЧАНИЕ: Поддерживайте стерильную технику на протяжении всего протокола. Нагрейте все питательные среды и растворы до 37 °C перед нанесением на клетки или сфероиды. Культивируйте клетки в инкубаторе сCO2 при температуре 37 °C, с 5%CO2 при влажности 80%. Схема протокола представлена на рисунке 1.
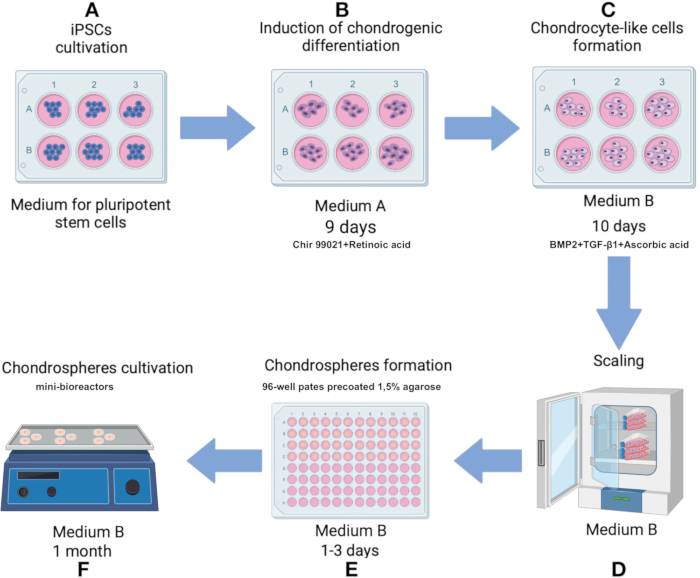
Рисунок 1: Протокол получения хондросфер из линии IPSRG4S iPSC. (A) Первоначально iPSCs культивируют в средах плюрипотентных стволовых клеток до тех пор, пока не будет достигнуто 80% слияние. (В) Чтобы индуцировать дифференцировку в направлении хондроцитарной линии, иПСК затем культивируют в среде А в течение 2 дней. Затем среду заменяют композицией, в которой отсутствует Chir 99021 и ингибитор рокиназы, и клетки культивируют в течение дополнительных 6 дней со сменой среды каждые 2 дня. (C) Затем клетки переносят в среду B для стимулирования хондрогенеза в течение следующих 10 дней. (D) Как только достигнуто достаточное количество клеток, процесс переходит к стадии производства сфероидов. (E) Клетки агрегируются в сфероиды в условиях низкой адгезии под действием силы тяжести. (F) Полученные сфероиды культивируются в мини-биореакторах со средой B. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Превращение чашек Петри в мини-биореакторы
ПРИМЕЧАНИЕ: Подробности в предыдущей статье5.
- Разрежьте центрифужные пробирки на кольца высотой 7-8 мм с помощью стерильных автоклавных ножниц (настройки автоклава: 121 °C (250 °F) при 15 фунтах на квадратный дюйм, 30 мин и поставтоклавная сушка в течение 20 мин).
- Измельчите чашки Петри с низкой адгезией, необработанные или микробиологические на мелкие кусочки. Растворите примерно 1 г частиц пластика в 10 мл хлороформа на ночь, чтобы получить жидкий пластиковый раствор. Проводят эту процедуру в вытяжном шкафу.
- Убедитесь, что жидкий пластик достаточно вязкий для пипетирования. Следите за тем, чтобы капли сохраняли сферическую форму, а не растекались по поверхности. Если раствор слишком жидкий, добавьте еще пластиковых частиц, обычно требуется 1-3 г. Если он слишком густой, добавьте дополнительно хлороформ, обычно требуется до 5 мл.
- Сформируйте пластиковую ручку в центре стерильной чашки Петри со сверхнизкой адгезией диаметром 60 мм, используя один из двух эффективных методов, описанных ниже.
- Вариант 1: Поместите автоклавное пластиковое кольцо в центр чашки Петри, затем нанесите жидкий пластик внутрь кольца; на одну каплю потребуется около 100-200 μL капель жидкого пластика.
- Вариант 2: Нанесите такое же количество капель жидкого пластика непосредственно в центр чашки Петри без использования пластикового кольца.
- Дайте посуде высохнуть без крышки в течение 2-3 часов в вытяжке с ламинарным потоком. После высыхания подвергните посуду воздействию ультрафиолета на 20-30 минут.
2. Обработка посуды с культурой желатином
- Приготовьте 0,1% раствор желатина, растворив порошкообразный желатин в дистиллированной воде при температуре 95 °C. Раствор последовательно пропустите через мембранные фильтры 0,45 мкм и 0,25 мкм, затем храните фильтрат при температуре 4 °C.
- Непосредственно перед повторным посевом хондроцитов нанесите 3 мл раствора желатина на колбу 25 см2 (рекомендуется до 15 г хрящевой ткани на колбу Т25). Инкубировать при комнатной температуре (RT) в течение 30 минут, удалить желатин, дважды промыть PBS и приступить к посеву клеток.
3. Выделение и культивирование хондроцитов
Хондроциты выделяются из хрящевых областей, не несущих вес, у пациентов, перенесших полную замену коленного сустава. Соберите все образцы в стерильных условиях и храните их в стерильных пробирках, заполненных DMEM, содержащим 200 Ед/мл раствора пенициллина/стрептомицина. Хранить хрящевую ткань в холодильнике при температуре 2-8 °C.
- Начните ферментативную обработку в течение 2 дней после забора хрящей. Кусочки хрящей промыть в растворе Хэнкса с помощью 60 мм чашки Петри, затем разрезать хрящ на фрагменты диаметром примерно 1-2 мм с помощью автоклавных ножниц.
- Переложите кусочки хряща в пробирки объемом 15 мл и расщепите их в 0,01% растворе коллагеназы типа II в DMEM, примерно 1 мл на 1 г хряща, в течение 8-12 ч в инкубаторе CO2 , настроенном на 37 °C с 5% CO2, 100% влажности, при непрерывном перемешивании на орбитальном шейкере при 150-200 об/мин.
- После разложения промойте фрагменты хряща, добавив DMEM в пробирку объемом 15 мл, затем центрифугируйте при 300 × г в течение 10 минут. Ресуспендируйте фрагменты в питательной среде хондроцитов (дополнительная таблица 1) и высадите их на адгезивную колбу Т25, предварительно покрытую 0,1% раствором желатина.
- Пассаж хондроцитов при достижении плотности слияния 80%.
- Для пассирования хондроциты промывают раствором Хэнкса, затем инкубируют клетки с 0,25% раствором трипсина при 37 °С в течение 5 мин.
- Чтобы инактивировать трипсин, добавьте равный объем DMEM + 10% FBS. Ресуспендируйте хондроциты в свежей питательной среде, затем распределите их в соотношении 1:3, высевая 20 000-30 000 клеток на 1 см2 .
- Поместите колбу с культурой в инкубатор при температуре 37 °C с 5%CO2 и 100% влажности.
4. Культивирование плюрипотентных стволовых клеток
ПРИМЕЧАНИЕ: В сотрудничестве с Лабораторией стволовых клеток Группы молекулярных исследований мозга, Департамент нейробиологии, Институт А.И. Виртанена, Университет Восточной Финляндии, Куопио, Финляндия, впредыдущем исследовании была успешно создана линия iPSCs IPSRG4S.
- Культивируйте иПСК в 6-луночных планшетах, предварительно покрытых матрицей, содержащей внеклеточные белки ( рис. 1A). Используйте среду для плюрипотентных стволовых клеток (Дополнительная таблица 1).
- Пассаж клеток на 80% конфлюенции, поддерживая соотношение 1:4 (50 000-75 000 клеток на 1 см2 ). Примерно за 2-3 ч до отслойки перенесите иПСК в среду для плюрипотентных стволовых клеток, содержащих ингибитор рокиназы Y27632 в конечной концентрации 1 мкМ в течение 1 суток.
- Промыть ИПСК раствором Хэнкса и инкубировать при 37 °C с 0,05% раствором трипсина. Чтобы инактивировать трипсин, добавьте равный объем DMEM + 10% FBS. Центрифугируйте клеточную суспензию при плотности 200 x g в течение 5 мин в пробирках объемом 15 мл.
- Выбросьте надосадочную жидкость и ресуспендируйте клетки в свежей среде для плюрипотентных стволовых клеток. Для повышения жизнеспособности клеток добавляют в среду ингибитор рокиназы Y27632 в конечной концентрации 1 мкМ в течение 1 суток. Поместите планшет с культурой в инкубатор сСО2 , установленный на 37 °C с 5%СО2 и 100% влажности.
5. Хондрогенная дифференцировка ИПСК
- Инициируйте дифференцировку в направлении хондроцитарной линии путем культивирования клеток в среде А (дополнительная таблица 1) в течение первых 2 дней. На 3-й день замените среду А раствором, который исключает Chir 99021 и ингибитор рокиназы, сохраняя при этом все остальные компоненты без изменений. Меняйте среду каждые 2 дня с 3 по 9 день (рисунок 1В).
- На 10-й день перенесите хондроцитоподобные клетки в среду B (дополнительная таблица 1), разработанную для облегчения хондрогенеза. Меняйте носитель каждые 2 дня в течение 10 дней (рисунок 1С).
- Заранее приготовьте 96-луночный планшет для культивирования клеточной суспензии, покрыв каждую лунку 1,5% агарозой в дистиллированной воде. Растопите агарозу в микроволновке до закипания (около 60-90 с при 700 Вт). После того, как агароза разжижается, добавьте по 75 мкл агарозы в каждую лунку и дайте ей застыть при RT (примерно 15 минут).
- Добавьте 150 мкл среды DMEM в каждую лунку и инкубируйте планшет в инкубаторе сCO2 в течение не менее 12 часов.
ПРИМЕЧАНИЕ: Подготовленные планшеты можно хранить до 1 месяца в инкубаторе сCO2 при температуре 37 °C, если среду в каждой лунке пополнять для компенсации испарения. - На 12-е сутки, после наблюдения фенотипических изменений, связанных с хондрогенезом, инициируют формирование сфероидов с использованием сгенерированных хондроцитоподобных клеток.
Примечание: На данном этапе целесообразно провести анализ экспрессии ключевых хондроцитарных маркеров с помощью иммуноцитохимии (ИКЦ) и количественной полимеразной цепной реакции (кПЦР) методом 2-ΔΔCT 9 для подтверждения успешной хондрогенной дифференцировки иПСК. Во время переноса из 6-луночного планшета в колбу для клеточных культур размером 75см2 небольшая часть клеток может быть засеяна в 48-луночный планшет, что соответствует количеству анализируемых маркеров. Проведите анализ ICC на этих образцах, чтобы проверить экспрессию генов.
6. Образование сфероидов из хондроцитоподобных клеток, полученных из iPSC
- После получения хондроцитоподобных производных, клетки проходят при 80% конфлюенции. Отделите клетки от 6-луночных планшетов с помощью 0,05% раствора трипсина. Чтобы инактивировать трипсин, добавьте равный объем DMEM + 10% FBS, а затем перенесите клетки в пробирку объемом 15 мл и центрифугируйте при 200 x g в течение 5 минут.
- Удалите надосадочную жидкость, повторно суспендируйте клетки в 1 мл среды B и переложите в колбу для клеточных культур размером 75 см2 , предварительно покрытую 0,1% раствором желатина (рис. 1D). Как только клетки достигнут 80% конфлюенции в виде монослоя, снова отделите клетки трипсином и повторно суспендируйте в среде В, как описано.
- Переведите ячейки в 96-луночный планшет, покрытый 1,5% агарозой, с плотностью 100 000 ячеек на лунку. Культивируйте в среде В, добавляя 150 мкл готовой среды на лунку (рис. 1D, 3A).
- Поддерживайте клетки в 96-луночном планшете, покрытом 1,5% агарозой, в течение минимум 1 дня и максимум 3 дней до образования сфероидов (Рисунок 2B). Перенесите сфероиды из лунок с помощью наконечника пипетки объемом 1 мл с обрезанным концом, затем переложите в пробирку объемом 15 мл. Дайте сфероидам отстояться в течение 2-3 минут и удалите надосадочную жидкость.
- Погрузите сфероиды в только что размороженный, неразбавленный матричный раствор базальной мембраны при температуре 4 °C. Через 30 мин соберите сфероиды путем пассивного осаждения в пробирке объемом 15 мл или путем щадящего центрифугирования при 100 x g в течение 1 мин.
ПРИМЕЧАНИЕ: Матрикс следует разморозить на ночь на льду в холодильнике при температуре 2-8 °C. После первого оттаивания изготавливаются одноразовые аликвоты матрицы, чтобы избежать повторных циклов замораживания-оттаивания. Используются полипропиленовые или другие пробирки, совместимые с морозильными камерами, которые хранятся при температуре -70 °C или -20 °C. Следите за сроком годности партии/партии, который составляет 2 года с даты изготовления. - Перенесите сфероиды в мини-биореакторы и добавьте 6 мл среды B. Поместите мини-биореактор на орбитальный шейкер внутри инкубатора CO2 , настроенного на 37 °C с 5% CO2 и 100% влажностью и скоростью перемешивания 70-75 об/мин (рис. 1F).
- Меняйте среду еженедельно или по мере необходимости при истощении среды или изменении цвета кислотно-основного индикатора. Для этого дают сфероидам осесть под действием силы тяжести в пробирке объемом 15 мл, а затем аккуратно удаляют надосадочную жидкость. Добавьте в пробирку свежую среду B и перенесите сфероиды обратно в мини-биореакторы.
Результаты
Описанный протокол проиллюстрирован на рисунке 1. В данной методологии используются две различные питательные среды для дифференцировки иПСК в сфероиды хондроцитов в течение минимального периода времени в 1 месяц (рис. 2
Обсуждение
ИПСК представляют собой преобразующий инструмент в регенеративной медицине, предлагающий потенциал для создания специфических для пациента хондроцитов для восстановления хряща. Современные протоколы используют направленную дифференцировку через мезодермальные ...
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Исследование выполнено при финансовой поддержке Российского научного фонда #22-15-00250.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Ссылки
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены