Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yerçekimi ve Ev Yapımı Mini Biyoreaktörler Altında Düşük Yapışkan Koşullar Kullanılarak Çeşitli Kondrositlerden Sferoidlerin Üretilmesi
Bu Makalede
Özet
Bu çalışma, hücreleri yerçekimi kullanarak düşük yapışma koşulları altında sferoidler halinde toplayarak ve ardından elde edilen sferoidleri mini biyoreaktörlerde kültürleyerek kondrositik sferoidlerin üretilmesi için bir yöntemi açıklamaktadır.
Özet
Kronik eklem hastalıklarında kıkırdak onarımı, hasarlı dokuları etkili bir şekilde yenilemek için gelişmiş hücre bazlı tedaviler gerektirir. Bu protokol, indüklenmiş pluripotent kök hücreleri (iPSC'ler) kondrosit bazlı sferoidlere ayırmak için adım adım bir yöntem sağlayarak doku mühendisliği ve hücre tedavisi uygulamalarını destekler. Farklılaşma süreci, hücreleri farklılaşmanın kritik aşamaları boyunca sırayla yönlendiren belirli ortamlarda kültürlenen iPSC'lerden başlayarak, kondrojenik soy bağlılığını teşvik etmek için dikkatli bir şekilde yapılandırılmıştır. Başlangıçta, iPSC'ler, bir dizi tanımlanmış ortam değişikliği kullanılarak kondrojenik soylara doğru indüksiyondan önce optimal birleşmeye ulaşmak için genişletilir. 10. günde, hücreler, olgun kondrositlerin temel belirteçlerini ifade eden kondrosit benzeri hücrelerin oluşumunu artıran kondrogenezi teşvik eden bir ortama geçirilir. 96 oyuklu agaroz kaplı plakalarda daha fazla agregasyon, daha sonra hücre dışı matris (ECM) birikimini teşvik eden bir mikro ortamı simüle etmek için tasarlanmış özel mini biyoreaktörlerde kültürlenen üç boyutlu sferoidlerin oluşumuna yol açar. Bu yaklaşım, doğal kıkırdak özelliklerini taklit eden kondrosit sferoidlerinin ölçeklenebilir üretimini mümkün kılarak, kıkırdak defektleri için hücre bazlı tedaviler geliştirmek için umut verici, tekrarlanabilir bir çözüm sunar ve kas-iskelet sistemi rejeneratif tıbbında klinik ve araştırma uygulamaları için geniş fayda sağlar.
Giriş
Eklem hastalığının yaygınlığı, artan engelli hasta sayısı ve bakımları ile ilgili maliyetler nedeniyle önemli ekonomik yüklere yol açmaktadır. Hiyalin kıkırdak, sınırlı rejeneratif potansiyele sahip bir bağ avasküler dokusudur1. Bazı steroid olmayan antienflamatuar ilaçların (NSAID'ler), glukokortikoidlerin ve kemoterapi veya radyoterapinin uzun süreli kullanımı, kıkırdağın rejeneratif kapasitesini daha da azaltabilir ve iyileşme yeteneğini neredeyse ortadan kaldırabilir2. Bu, hücresel tedavi için otolog kıkırdak hücrelerinin elde edilmesini zorlaştırır.
Kondrositler de dahil olmak üzere üç boyutlu (3D) hücre yetiştirme teknolojisi, uzun zamandır önemli potansiyele sahip, gelişmekte olan bir araştırma alanı olarak kabul edilmektedir. Bu 3D yapılar hem temel biyolojik araştırmalar hem de rejeneratif tıptaki uygulamalar için incelenmektedir. Otolog kondrositlerden türetilen sferoidler, şu anda küresel olarak önemli ölçüde dikkat çeken bir durum olan kıkırdak dokusu dejenerasyonunu ele almak için terapötik vaatlerde bulunmaktadır3.
iPSC'lerden farklılaşan kondrositlerden türetilen sferoidler, kıkırdak onarımı için önemli avantajlar sunan primer kondrositlere umut verici bir alternatif oluşturur. iPSC'ler, kendini yenileme için neredeyse sınırsız bir kapasite sağlar ve geniş bir farklılaşma potansiyeline sahiptir, bu da hücre toplama için invaziv prosedürler olmadan klinik uygulamalar için yeterli miktarlarda kondrositlerin üretilmesine izin verir4. Ayrıca, geleneksel iki boyutlu (2B) kondrosit kültürlerinden kondrosferler gibi 3B kültür sistemlerine geçiş, fizyolojik olarak daha ilgili bir ortam yaratarak bu hücrelerin canlılığını ve işlevselliğini daha da artırır. Çalışmalar, 3D sferoidlerde kültürlenen kondrositlerin fenotiplerini daha iyi koruduğunu, daha düşük farklılaşma oranları ve kollajen tip II ve agrekan5 gibi temel hiyalin kıkırdak belirteçlerinin daha yüksek ekspresyon seviyeleri gösterdiğini göstermektedir.
iPSC'den türetilmiş kondrosferlerin potansiyeline rağmen, yüksek kaliteli kondrosferler üretmek için standartlaştırılmış protokoller sınırlı kalmaktadır. Çalışmalar arasındaki protokollerdeki değişkenlik genellikle kondrosit kalitesinde ve hücre dışı matriks bileşiminde tutarsızlıklara yol açar ve bu da terapötik kullanım için etkinliklerini etkiler6. Burada, uygun fiyatlı, özel yapım mini biyoreaktörler kullanarak iPSC'den türetilmiş kondrositlerden sferoid üretimini standartlaştıran rafine bir protokol sunulmaktadır. Mini biyoreaktör kültür fazı, besin dağılımını, ECM olgunlaşmasını ve küresel sıkıştırmayı7 optimize eden kontrollü, düşük yapışma ayarı sağladığı için çok önemlidir. Bu faz, doğal kıkırdağa çok benzeyen bir ECM bileşimi ile birlikte kollajen tip II, agrekan ve SOX9 dahil olmak üzere temel kondrosit belirteçlerinin sağlam ekspresyonunu destekler. Düzenli ortam değişiklikleri ve çevresel koşulların dikkatli bir şekilde kontrol edilmesi - sıcaklık, CO2 ve dönme hızı - kondrosit sferoidlerinin canlılığını ve olgunlaşmasını daha da sağlar. Bu protokol, kıkırdak onarımında araştırma ve klinik uygulamalar için uygun, uygun maliyetli ve ölçeklenebilir bir şekilde hiyalin kıkırdak belirteçlerinin güçlü ifadesine sahip yüksek kaliteli kondrosferler oluşturmak için optimize edilmiştir.
Protokol
Çalışma, LOPUKHIN FRCC PCM Etik Kurulu tarafından gözden geçirilmiş ve onaylanmıştır (9 Nisan 2019 tarihli 2019/02 sayılı protokol). Tüm donör örnekleri Helsinki Bildirgesi ilkelerine uygun olarak elde edildi. Tüm katılımcılardan ve/veya yasal vasilerinden bilgilendirilmiş onam alındı.
NOT: Protokol boyunca steril tekniği koruyun. Tüm kültür ortamlarını ve çözeltilerini hücrelere veya sferoidlere uygulamadan önce 37 °C'ye ısıtın. Hücreleri bir CO2 inkübatöründe 37 ° C'de,% 5 CO2 % 80 nem ile yetiştirin. Protokol şeması Şekil 1'de gösterilmiştir.
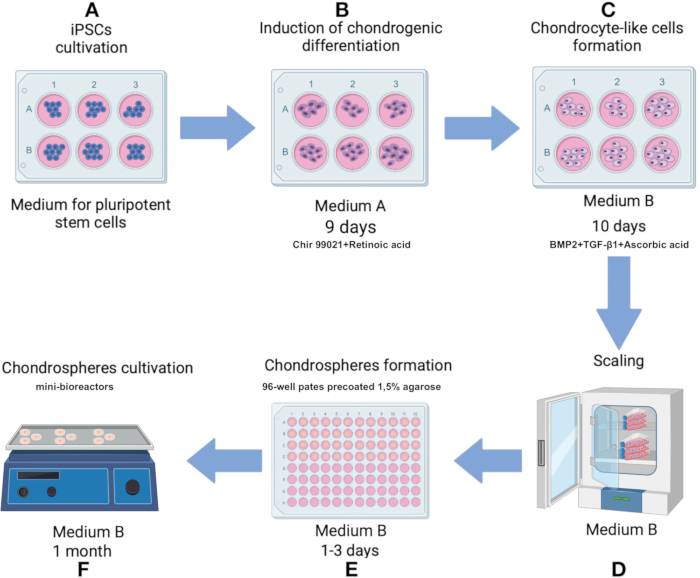
Şekil 1: iPSC hattından kondrosfer üretme protokolü IPSRG4S. (A) Başlangıçta, iPSC'ler% 80 birleşmeye ulaşılana kadar pluripotent kök hücre ortamında kültürlenir. (B) Kondrositik çizgiye doğru farklılaşmayı indüklemek için, iPSC'ler daha sonra 2 gün boyunca ortam A'da kültürlenir. Ortam daha sonra Chir 99021 ve Rho kinaz inhibitörü içermeyen bir formülasyonla değiştirilir ve hücreler her 2 günde bir orta değişikliklerle 6 gün daha kültürlenir. (C) Hücreler daha sonra sonraki 10 gün boyunca kondrogenezi teşvik etmek için B ortamına aktarılır. (D) Yeterli hücre sayısı elde edildiğinde, süreç sferoidlerin üretim aşamasına ilerler. (E) Hücreler, yerçekimi altında düşük yapışkan koşullarda sferoidler halinde toplanır. (F) Elde edilen sferoidler, orta B ile mini biyoreaktörlerde kültürlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Petri kaplarının mini biyoreaktörlere dönüştürülmesi
NOT: Ayrıntılar bir önceki makaledeyer almaktadır 5.
- Steril otoklav makası kullanarak santrifüj tüplerini 7-8 mm yüksekliğinde halkalar halinde dilimleyin (otoklav ayarları: 15 psi'de 121 °C (250 °F), 30 dakika ve otoklav sonrası 20 dakika kurutma).
- Düşük yapışma özelliğine sahip, işlenmemiş veya mikrobiyolojik Petri kaplarını küçük parçalara ayırın. Sıvı bir plastik çözelti oluşturmak için yaklaşık 1 g plastik parçacığı gece boyunca 10 mL kloroformda çözün. Bu prosedürü bir çeker ocakta gerçekleştirin.
- Sıvı plastiğin pipetleme için yeterince viskoz olduğunu doğrulayın. Damlacıkların yüzeye yayılmak yerine küresel bir şekli koruduğundan emin olun. Çözelti çok inceyse, genellikle 1-3 g gerektiren daha fazla plastik parçacık ekleyin. Çok kalınsa, genellikle 5 mL'ye kadar gerektiren ek kloroform ekleyin.
- Aşağıda özetlenen iki etkili yöntemden birini kullanarak steril, ultra düşük yapışma özelliğine sahip 60 mm'lik bir Petri kabının ortasında plastik bir düğme oluşturun.
- Seçenek 1: Otoklavlanmış plastik halkayı Petri kabının ortasına yerleştirin, ardından halkanın içine sıvı plastik uygulayın; bir damla yaklaşık 100-200 μL damla sıvı plastik gerektirecektir.
- Seçenek 2: Plastik halkayı kullanmadan aynı sayıda sıvı plastik damlasını doğrudan Petri kabının ortasına uygulayın.
- Bulaşıkların laminer akış başlığında 2-3 saat üstü açık olarak kurumasına izin verin. Kuruduktan sonra bulaşıkları 20-30 dakika ultraviyole radyasyona maruz bırakın.
2. Kültür yemeklerinin jelatin ile işlenmesi
- Toz jelatini 95 °C'de damıtılmış suda çözerek %0.1'lik bir jelatin çözeltisi hazırlayın. Çözeltiyi sırayla 0.45 μm ve 0.25 μm membran filtrelerden geçirin, ardından süzüntüyü 4 °C'de saklayın.
- Kondrosit yeniden tohumlamadan hemen önce, 3 mL jelatin solüsyonunu 25 cm2'lik şişeye uygulayın (T25 şişesi başına 15 g'a kadar kıkırdak dokusu önerilir). Oda sıcaklığında (RT) 30 dakika inkübe edin, jelatini çıkarın, PBS ile iki kez durulayın ve hücre tohumlamaya devam edin.
3. Kondrositlerin izolasyonu ve yetiştirilmesi
NOT: Kondrositler, total diz protezi yapılan hastalardan ağırlık taşımayan kıkırdak bölgelerinden izole edilir. Tüm örnekleri steril koşullar altında hasat edin ve 200 U / mL penisilin / streptomisin çözeltisi içeren DMEM ile doldurulmuş steril tüplerde saklayın. Kıkırdak dokusunu buzdolabında 2-8 °C'de saklayın.
- Kıkırdak alımından sonraki 2 gün içinde enzimatik tedaviye başlayın. 60 mm Petri kapları kullanarak Hankıç parçalarını Hanks solüsyonunda yıkayın, ardından kıkırdağı otoklavlanmış makas kullanarak yaklaşık 1-2 mm çapında parçalar halinde kesin.
- Kıkırdak parçalarını 15 mL'lik tüplere aktarın ve DMEM'de% 0.01 kollajenaz tip II çözeltisinde, 1 g kıkırdak başına yaklaşık 1 mL, 8-12 saat içinde% 5 CO2,% 100 nem ile 37 ° C'ye ayarlanmış bir CO2 inkübatörinde, 150-200 rpm'de bir orbital çalkalayıcı üzerinde sürekli çalkalama altında sindirin.
- Sindirimden sonra, kıkırdak parçalarını 15 mL'lik bir tüpe DMEM ekleyerek yıkayın, ardından 300 × g'da 10 dakika santrifüjleyin. Parçaları bir kondrosit kültür ortamında (Ek Tablo 1) yeniden süspanse edin ve bunları% 0.1 jelatin çözeltisi ile önceden kaplanmış yapışkan bir T25 şişesi üzerine tohumlayın.
- % 80'lik bir birleşik yoğunluk elde edildiğinde geçiş kondrositleri.
- Geçiş için, kondrositleri Hanks solüsyonu ile yıkayın, daha sonra hücreleri% 0.25 tripsin solüsyonu ile 37 ° C'de 5 dakika inkübe edin.
- Tripsini etkisiz hale getirmek için eşit miktarda DMEM +% 10 FBS ekleyin. Kondrositleri taze kültür ortamında yeniden süspanse edin, daha sonra 1cm2'de 20.000-30.000 hücre tohumlayarak 1: 3 oranında dağıtın.
- Kültür şişesini 37 °C'de, %5 CO2 ve %100 nem oranına sahip bir inkübatöre yerleştirin.
4. Pluripotent kök hücrelerin yetiştirilmesi
NOT: Moleküler Beyin Araştırma Grubu, Nörobiyoloji Anabilim Dalı Kök Hücre Laboratuvarı ile işbirliği içinde, A.I. Virtanen Enstitüsü, Doğu Finlandiya Üniversitesi, Kuopio, Finlandiya, bir iPSC hattı IPSRG4S, önceki bir çalışmada başarıyla oluşturulmuştur8.
- iPSC'leri, hücre dışı proteinler içeren bir matris ile önceden kaplanmış 6 oyuklu plakalarda yetiştirin ( Şekil 1A). Pluripotent kök hücreler için bir ortam kullanın (Ek Tablo 1).
- 1:4 oranını koruyarak (1cm2 başına 50.000-75.000 hücre) %80 birleşmede geçiş hücreleri. Ayrılmadan yaklaşık 2-3 saat önce, iPSC'leri 1 gün boyunca 1 μM'lik bir nihai konsantrasyonda Rho kinaz inhibitörü Y27632 içeren pluripotent kök hücreler için ortama aktarın.
- iPSC'leri Hanks solüsyonu ile yıkayın ve% 0.05 tripsin solüsyonu ile 37 ° C'de inkübe edin. Tripsini etkisiz hale getirmek için eşit miktarda DMEM +% 10 FBS ekleyin. Hücre süspansiyonunu 15 mL'lik tüplerde 5 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı atın ve hücreleri pluripotent kök hücreler için taze bir ortamda yeniden süspanse edin. Hücre canlılığını arttırmak için, Rho kinaz inhibitörü Y27632'yi 1 gün boyunca 1 μM'lik bir nihai konsantrasyonda ortama ekleyin. Kültür plakasını %5 CO2 ve %100 nem ile 37 °C'ye ayarlanmış bir CO2 inkübatöre yerleştirin.
5. iPSC'lerin kondrojenik farklılaşması
- İlk 2 gün boyunca Ortam A'daki (Ek Tablo 1) hücreleri kültürleyerek kondrositik soya doğru farklılaşmayı başlatın. 3. günde, Orta A'yı, diğer tüm bileşenleri değiştirmeden tutarken Chir 99021 ve Rho kinaz inhibitörünü içermeyen bir çözelti ile değiştirin. Ortamı 2 günde bir, 3 ila 9. günler arasında değiştirin (Şekil 1B).
- 10. günde, kondrosit benzeri hücreleri, kondrogenezi kolaylaştırmak için formüle edilmiş Orta B'ye (Ek Tablo 1) aktarın. Ortamı 10 gün boyunca her 2 günde bir değiştirin (Şekil 1C).
- Her bir kuyucuğu damıtılmış suda %1.5 agaroz ile kaplayarak önceden 96 oyuklu bir hücre süspansiyon kültürü plakası hazırlayın. Agarozu kaynayana kadar bir mikrodalgada eritin (700 W'ta yaklaşık 60-90 s). Agaroz sıvılaştırıldıktan sonra, her bir oyuğa 75 μL agaroz ekleyin ve RT'de sertleşmesine izin verin (yaklaşık 15 dakika).
- Her oyuğa 150 μL DMEM ortamı ekleyin ve plakayı bir CO2 inkübatörde en az 12 saat inkübe edin.
NOT: Hazırlanan plakalar, buharlaşmayı telafi etmek için her bir oyuktaki ortam doldurulursa, 37 ° C'de bir CO2 inkübatöründe 1 aya kadar saklanabilir. - 12. günde, kondrogenez ile ilişkili fenotipik değişiklikleri gözlemledikten sonra, üretilen kondrosit benzeri hücreleri kullanarak sferoid oluşumunu başlatın.
NOT: Bu aşamada, iPSC'lerin başarılı kondrojenik farklılaşmasını doğrulamak için 2-ΔΔCT yöntemi9 kullanılarak immünositokimya (ICC) ve kantitatif polimeraz zincir reaksiyonu (qPCR) ile anahtar kondrositik belirteçlerin ekspresyonunun analiz edilmesi tavsiye edilir. 6 oyuklu plakadan 75cm2'lik bir hücre kültürü şişesine geçiş sırasında, hücrelerin küçük bir kısmı, analiz edilecek işaretleyici sayısıyla eşleşen 48 oyuklu bir plakaya ekilebilir. Gen ekspresyonunu doğrulamak için bu numuneler üzerinde ICC analizi yapın.
6. Kondrosit benzeri iPSC'den türetilmiş hücrelerden sferoidlerin oluşumu
- Kondrosit benzeri türevler elde edildikten sonra,% 80 birleşme hızında hücreler geçit sağlar. % 0.05'lik bir tripsin çözeltisi kullanarak hücreleri 6 oyuklu plakalardan ayırın. Tripsini inaktive etmek için, eşit hacimde DMEM +% 10 FBS ekleyin ve daha sonra hücreleri 15 mL'lik bir tüpe aktarın ve 5 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı çıkarın, hücreleri 1 mL Ortam B'de yeniden süspanse edin ve% 0.1 jelatin çözeltisi ile önceden kaplanmış 75cm2'lik bir hücre kültürü şişesine aktarın (Şekil 1D). Hücreler tek tabaka olarak% 80 birleşmeye ulaştığında, hücreleri tekrar tripsin ile ayırın ve tarif edildiği gibi Ortam B'de yeniden süspanse edin.
- Hücreleri, oyuk başına 100.000 hücre yoğunluğunda% 1.5 agaroz ile kaplanmış 96 oyuklu bir plakaya aktarın. Kuyucuk başına 150 μL tam ortam ekleyerek Orta B'de yetiştirin (Şekil 1D, 3A).
- % 1.5 agaroz ile kaplanmış 96 oyuklu plakadaki hücreleri, sferoidler oluşana kadar en az 1 gün ve en fazla 3 gün koruyun (Şekil 2B). Kesilmiş uçlu 1 mL'lik bir pipet ucu kullanarak sferoidleri kuyucuklardan aktarın, ardından 15 mL'lik bir tüpe aktarın. Sferoidlerin 2-3 dakika oturmasına izin verin ve süpernatanı çıkarın.
- Sferoidleri 4 °C'de tutulan taze çözülmüş, seyreltilmemiş bazal membran matris çözeltisine daldırın. 30 dakika sonra, 15 mL'lik bir tüpte pasif sedimantasyon veya 1 dakika boyunca 100 x g'da hafif santrifüjleme ile sferoidleri toplayın.
NOT: Matris, 2-8 ° C'lik bir buzdolabında gece boyunca buz üzerinde çözülmelidir. İlk çözülmeden sonra, tekrarlanan donma-çözülme döngülerini önlemek için matrisin tek kullanımlık alikotları yapılır. Polipropilen veya diğer dondurucuya uyumlu tüpler -70 °C veya -20 °C'de kullanılır ve saklanır. Üretim tarihinden itibaren 2 yıl olan partinin/partinin son kullanma tarihine dikkat edin. - Sferoidleri mini biyoreaktörlere aktarın ve 6 mL Ortam B ekleyin. Mini biyoreaktörü, %5 CO2 ve %100 nem ve 70-75 rpm çalkalama hızı ile 37 °C'ye ayarlanmış bir CO2 inkübatörünün içindeki bir orbital çalkalayıcı üzerine yerleştirin (Şekil 1F).
- Ortamı haftalık olarak veya asit-baz göstergesinin orta derecede tükenmesi veya renk değişiminin gerektirdiği şekilde değiştirin. Bunu yapmak için, sferoidlerin yerçekimi ile 15 mL'lik bir tüpe yerleşmesine izin verin ve ardından süpernatanı dikkatlice çıkarın. Tüpe taze Orta B ekleyin ve sferoidleri mini biyoreaktörlere geri aktarın.
Sonuçlar
Belirtilen protokol Şekil 1'de gösterilmiştir. Bu metodoloji, iPSC'lerin en az 1 aylık bir süre boyunca kondrosit sferoidlerine farklılaşmasını sağlamak için iki farklı kültür ortamı kullanır (Şekil 2). Farklılaşma süreci, iPSC'ler %75-%90 birleşme sağladığında başlatılır (Şekil 1B). Kondrojenik farklılaşmanın erken göstergeleri, kond...
Tartışmalar
iPSC'ler, rejeneratif tıpta dönüştürücü bir araçtır ve kıkırdak onarımı için hastaya özgü kondrositler üretme potansiyeli sunar. Mevcut protokoller, kondrositik soy bağlılığını destekleyen TGF-β ve BMP-2 gibi anahtar sinyal molekülleri ile mezodermal yollar yoluyla yönlendirilmiş farklılaşmadan yararlanır. Bu yöntemler, fonksiyonel kıkırdak dokusu için gerekli olan kollajen tip II ve agrekan gibi hücre dışı matriks bileşenlerinin üretimini sağlaya...
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yapıldığını beyan ederler.
Teşekkürler
Araştırma, Rusya Bilim Vakfı tarafından #22-15-00250 nolu tahsisat ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Referanslar
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır