É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de esferoides a partir de vários condrócitos usando condições de baixa aderência sob gravidade e mini-biorreatores caseiros
Neste Artigo
Resumo
Este estudo descreve um método para produzir esferoides condrocíticos agregando células em esferoides sob condições de baixa adesão usando gravidade, seguido de cultura dos esferoides resultantes em mini-biorreatores.
Resumo
O reparo da cartilagem em doenças articulares crônicas exige terapias avançadas baseadas em células para regenerar os tecidos danificados de forma eficaz. Este protocolo fornece um método passo a passo para diferenciar células-tronco pluripotentes induzidas (iPSCs) em esferoides baseados em condrócitos, apoiando aplicações de engenharia de tecidos e terapia celular. O processo de diferenciação é cuidadosamente estruturado para promover o comprometimento da linhagem condrogênica, começando com iPSCs cultivadas em meios específicos que guiam sequencialmente as células por estágios críticos de diferenciação. Inicialmente, as iPSCs são expandidas para atingir a confluência ideal antes da indução à linhagem condrogênica usando uma série de mudanças de mídia definidas. No dia 10, as células são transferidas para um meio promotor de condrogênese que aumenta a formação de células semelhantes a condrócitos que expressam marcadores-chave de condrócitos maduros. A agregação adicional em placas revestidas de agarose de 96 poços leva à formação de esferóides tridimensionais, que são então cultivados em minibiorreatores personalizados projetados para simular um microambiente que estimula a deposição de matriz extracelular (ECM). Ao permitir a produção escalável de esferoides de condrócitos que imitam as características da cartilagem nativa, essa abordagem oferece uma solução promissora e reprodutível para o desenvolvimento de tratamentos baseados em células para defeitos de cartilagem, fornecendo ampla utilidade para aplicações clínicas e de pesquisa em medicina regenerativa musculoesquelética.
Introdução
A prevalência de doenças articulares leva a encargos econômicos significativos devido ao número crescente de pacientes com deficiência e aos custos associados aos seus cuidados. A cartilagem hialina é um tecido avascular conjuntivo com potencial regenerativo limitado1. O uso prolongado de certos anti-inflamatórios não esteroidais (AINEs), glicocorticóides e quimioterapia ou radioterapia pode diminuir ainda mais a capacidade regenerativa da cartilagem, quase eliminando sua capacidade de cicatrização2. Isso torna difícil obter células de cartilagem autólogas para terapia celular.
A tecnologia de cultivo de células tridimensionais (3D), incluindo condrócitos, é reconhecida há muito tempo como uma área de pesquisa emergente com potencial significativo. Essas estruturas 3D estão sendo estudadas para aplicações em pesquisa biológica fundamental e medicina regenerativa. Os esferoides derivados de condrócitos autólogos são uma promessa terapêutica para tratar a degeneração do tecido cartilaginoso, uma condição que atualmente recebe considerável atenção global3.
Os esferoides derivados de condrócitos diferenciados de iPSCs representam uma alternativa promissora aos condrócitos primários, oferecendo vantagens significativas para o reparo da cartilagem. As iPSCs fornecem uma capacidade quase ilimitada de auto-renovação e possuem um amplo potencial de diferenciação, o que permite a produção de condrócitos em quantidades suficientes para aplicações clínicas sem procedimentos invasivos de coleta de células4. Além disso, a transição de culturas tradicionais de condrócitos bidimensionais (2D) para sistemas de cultura 3D, como condrosferas, aumenta ainda mais a viabilidade e a funcionalidade dessas células, criando um ambiente fisiologicamente mais relevante. Estudos mostram que condrócitos cultivados em esferoides 3D mantêm melhor seu fenótipo, exibindo menores taxas de desdiferenciação e maiores níveis de expressão dos principais marcadores de cartilagem hialina, como colágeno tipo II e agrecan5.
Apesar do potencial das condrosferas derivadas de iPSC, os protocolos padronizados para gerar condrosferas de alta qualidade permanecem limitados. A variabilidade nos protocolos entre os estudos geralmente leva a inconsistências na qualidade dos condrócitos e na composição da matriz extracelular, afetando sua eficácia para uso terapêutico6. Aqui, é apresentado um protocolo refinado que padroniza a geração de esferoides a partir de condrócitos derivados de iPSC usando mini-biorreatores acessíveis e personalizados. A fase de cultura do mini-biorreator é essencial, pois fornece uma configuração controlada e de baixa adesão que otimiza a distribuição de nutrientes, a maturação da MEC e a compactação do esferóide7. Esta fase promove a expressão robusta de marcadores essenciais de condrócitos, incluindo colágeno tipo II, agrecan e SOX9, juntamente com uma composição de ECM que se assemelha muito à cartilagem nativa. Mudanças regulares de meio e controle cuidadoso das condições ambientais - temperatura, CO2 e velocidade de rotação - garantem ainda mais a viabilidade e maturação dos esferoides de condrócitos. Este protocolo foi otimizado para criar condroesferas de alta qualidade com forte expressão de marcadores de cartilagem hialina de maneira econômica e escalável, adequada para pesquisas e aplicações clínicas em reparo de cartilagem.
Protocolo
O estudo foi revisado e aprovado pelo Comitê de Ética do LOPUKHIN FRCC PCM (protocolo nº 2019/02 de 9 de abril de 2019). Todas as amostras de doadores foram obtidas de acordo com os princípios da Declaração de Helsinque. O consentimento informado foi obtido de todos os participantes e/ou seus responsáveis legais.
NOTA: Mantenha a técnica estéril durante todo o protocolo. Aquecer todos os meios de cultura e soluções a 37 °C antes de os aplicar nas células ou esferoides. Cultive células em uma incubadora de CO2 a 37 °C, com 5% de CO2 a 80% de umidade. O esquema do protocolo é mostrado na Figura 1.
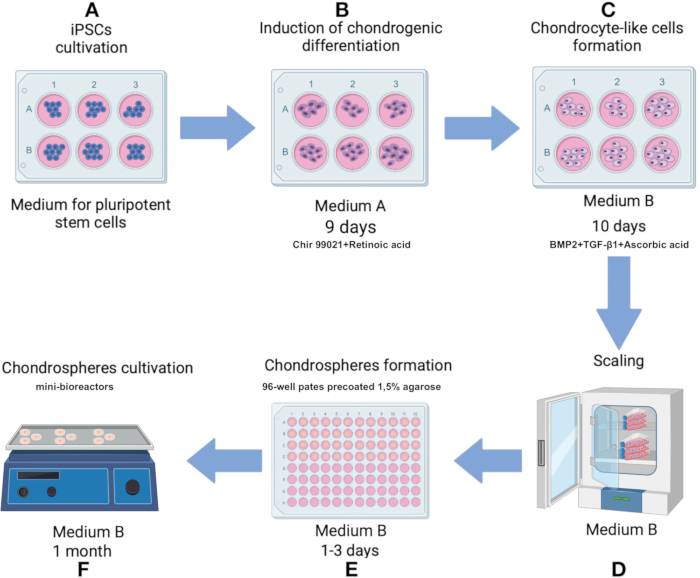
Figura 1: Protocolo para produção de condrosferas a partir da linha iPSC IPSRG4S. (A) Inicialmente, as iPSCs são cultivadas em meio de células-tronco pluripotentes até que 80% de confluência seja atingida. (B) Para induzir a diferenciação em direção à linhagem condrocítica, as iPSCs são então cultivadas em meio A por 2 dias. O meio é posteriormente substituído por uma formulação sem Chir 99021 e inibidor de Rho quinase, e as células são cultivadas por mais 6 dias com trocas de meio a cada 2 dias. (C) As células são então transferidas para o meio B para promover a condrogênese pelos próximos 10 dias. (D) Uma vez que um número de células suficiente é alcançado, o processo avança para o estágio de produção de esferoides. (E) As células são agregadas em esferóides em condições de baixa aderência sob gravidade. (F) Os esferóides resultantes são cultivados em mini-biorreatores com meio B. Clique aqui para ver uma versão maior desta figura.
1. Transformação de placas de Petri em mini-biorreatores
NOTA: Detalhes em um artigo anterior5.
- Corte os tubos da centrífuga em anéis de 7-8 mm de altura usando uma tesoura de autoclave estéril (configurações de autoclave: 121 ° C (250 ° F) a 15 psi, 30 min e secagem pós-autoclave por 20 min).
- Esmague placas de Petri de baixa adesão, não tratadas ou microbiológicas em pedaços pequenos. Dissolva aproximadamente 1 g de partículas de plástico em 10 mL de clorofórmio durante a noite para criar uma solução plástica líquida. Efectue este procedimento numa hotte.
- Verifique se o plástico líquido é suficientemente viscoso para pipetagem. Certifique-se de que as gotículas mantenham uma forma esférica em vez de se espalharem na superfície. Se a solução for muito fina, adicione mais partículas de plástico, geralmente exigindo 1-3 g. Se for muito grosso, adicione clorofórmio adicional, geralmente exigindo até 5 mL.
- Forme um botão de plástico no centro de uma placa de Petri estéril e de adesão ultrabaixa de 60 mm usando um dos dois métodos eficazes descritos abaixo.
- Opção 1: Coloque o anel de plástico autoclavado no centro da placa de Petri e, em seguida, aplique plástico líquido dentro do anel; uma gota exigirá cerca de 100-200 μL de plástico líquido.
- Opção 2: Aplique o mesmo número de gotas de plástico líquido diretamente no centro da placa de Petri sem usar o anel de plástico.
- Deixe a loiça secar descoberta durante 2-3 h numa coifa de fluxo laminar. Após a secagem, exponha a louça à radiação ultravioleta por 20-30 min.
2. Tratamento de placas de cultura com gelatina
- Prepare uma solução de gelatina a 0,1% dissolvendo a gelatina em pó em água destilada a 95 °C. Passar a solução sequencialmente através de filtros de membrana de 0,45 μm e 0,25 μm e, em seguida, armazenar o filtrado a 4 °C.
- Imediatamente antes da nova semeadura de condrócitos, aplique 3 mL de solução de gelatina no frasco de 25 cm2 (recomenda-se até 15 g de tecido cartilaginoso por frasco T25). Incube em temperatura ambiente (RT) por 30 min, remova a gelatina, enxágue duas vezes com PBS e prossiga com a semeadura celular.
3. Isolamento e cultivo de condrócitos
NOTA: Os condrócitos são isolados de regiões de cartilagem sem suporte de peso de pacientes submetidos à artroplastia total do joelho. Colha todas as amostras em condições estéreis e armazene-as em tubos estéreis cheios de DMEM contendo 200 U / mL de solução de penicilina / estreptomicina. Armazene o tecido da cartilagem na geladeira a 2-8 °C.
- Comece o tratamento enzimático dentro de 2 dias após a colheita da cartilagem. Lave os pedaços de cartilagem na solução de Hanks usando placas de Petri de 60 mm e, em seguida, corte a cartilagem em fragmentos de aproximadamente 1-2 mm de diâmetro usando uma tesoura autoclavada.
- Transfira os pedaços de cartilagem para tubos de 15 mL e digeri-los em solução de colagenase tipo II a 0,01% em DMEM, aproximadamente 1 mL por 1 g de cartilagem, dentro de 8-12 h em uma incubadora de CO2 ajustada para 37 ° C com 5% de CO2, 100% de umidade, sob agitação contínua em um agitador orbital a 150-200 rpm.
- Após a digestão, lave os fragmentos de cartilagem adicionando DMEM a um tubo de 15 mL e centrifugue a 300 × g por 10 min. Ressuspenda os fragmentos em um meio de cultura de condrócitos (Tabela Suplementar 1) e semeie-os em um frasco adesivo T25 pré-revestido com solução de gelatina a 0,1%.
- Passagem de condrócitos quando uma densidade confluente de 80% é alcançada.
- Para a passagem, lave os condrócitos com solução de Hanks e, em seguida, incube as células com solução de tripsina a 0,25% a 37 ° C por 5 min.
- Para inativar a tripsina, adicione um volume igual de DMEM + 10% de FBS. Ressuspenda os condrócitos em meio de cultura fresco e distribua-os na proporção de 1:3, semeando 20.000-30.000 células por 1 cm2.
- Colocar o balão de cultura numa incubadora a 37 °C com 5% de CO2 e 100% de humidade.
4. Cultivo de células-tronco pluripotentes
NOTA: Em colaboração com o Laboratório de Células-Tronco do Grupo de Pesquisa do Cérebro Molecular, Departamento de Neurobiologia, Instituto A.I. Virtanen, Universidade da Finlândia Oriental, Kuopio, Finlândia, uma linha de iPSCs IPSRG4S foi gerada com sucesso em um estudo anterior8.
- Cultive iPSCs em placas de 6 poços pré-revestidas com uma matriz contendo proteínas extracelulares ( Figura 1A). Use um meio para células-tronco pluripotentes (Tabela Suplementar 1).
- Células de passagem a 80% de confluência, mantendo uma proporção de 1:4 (50.000-75.000 células por 1cm2). Aproximadamente 2-3 h antes do descolamento, transfira iPSCs para o meio para células-tronco pluripotentes contendo inibidor de Rho quinase Y27632 em uma concentração final de 1 μM por 1 dia.
- Lave as iPSCs com solução de Hanks e incube a 37 °C com solução de tripsina a 0,05%. Para inativar a tripsina, adicione um volume igual de DMEM + 10% de FBS. Centrifugue a suspensão celular a 200 x g por 5 min em tubos de 15 mL.
- Rejeitar o sobrenadante e ressuspender as células num meio fresco para as células estaminais pluripotentes. Para aumentar a viabilidade celular, adicione o inibidor de Rho quinase Y27632 ao meio a uma concentração final de 1 μM por 1 dia. Colocar a placa de cultura numa incubadora de CO2 regulada para 37 °C com 5% de CO2 e 100% de humidade.
5. Diferenciação condrogênica de iPSCs
- Inicie a diferenciação em direção à linhagem condrocítica cultivando células no meio A (Tabela Suplementar 1) nos primeiros 2 dias. No dia 3, substitua o meio A por uma solução que exclua Chir 99021 e inibidor de Rho quinase, mantendo todos os outros componentes inalterados. Troque o meio a cada 2 dias dos dias 3 a 9 (Figura 1B).
- No dia 10, transfira células semelhantes a condrócitos para o meio B (Tabela Suplementar 1), formulado para facilitar a condrogênese. Troque o meio a cada 2 dias por 10 dias (Figura 1C).
- Prepare uma placa de cultura de suspensão celular de 96 poços com antecedência, revestindo cada poço com 1,5% de agarose em água destilada. Derreta a agarose no micro-ondas até ferver (cerca de 60-90 s a 700 W). Uma vez liquefeita a agarose, adicione 75 μL de agarose a cada poço e deixe-o endurecer em RT (aproximadamente 15 min).
- Adicione 150 μL de meio DMEM a cada poço e incube a placa em uma incubadora de CO2 por pelo menos 12 h.
NOTA: As placas preparadas podem ser armazenadas por até 1 mês em uma incubadora de CO2 a 37 °C se o meio em cada poço for reabastecido para compensar a evaporação. - No dia 12, após observar as mudanças fenotípicas associadas à condrogênese, inicie a formação de esferoides usando as células semelhantes a condrócitos geradas.
NOTA: Nesta fase, é aconselhável analisar a expressão dos principais marcadores condrocíticos com imunocitoquímica (ICC) e reação em cadeia da polimerase quantitativa (qPCR) usando o método 2-ΔΔCT 9 para confirmar a diferenciação condrogênica bem-sucedida de iPSCs. Durante a passagem da placa de 6 poços para um frasco de cultura de2 células de 75 cm, uma pequena porção de células pode ser semeada em uma placa de 48 poços, correspondendo ao número de marcadores a serem analisados. Realize a análise ICC nessas amostras para verificar a expressão gênica.
6. Formação de esferóides a partir de células derivadas de iPSC semelhantes a condrócitos
- Após a obtenção de derivados semelhantes a condrócitos, células de passagem a 80% de confluência. Separe as células das placas de 6 poços usando uma solução de tripsina a 0,05%. Para inativar a tripsina, adicione um volume igual de DMEM + 10% de FBS e, em seguida, transfira as células para um tubo de 15 mL e centrifugue a 200 x g por 5 min.
- Remova o sobrenadante, ressuspenda as células em 1 mL de meio B e transfira para um frasco de cultura de2 células de 75 cm pré-revestido com solução de gelatina a 0,1% (Figura 1D). Quando as células atingirem 80% de confluência como monocamada, desprenda as células novamente com tripsina e ressuspenda no meio B conforme descrito.
- Transfira as células para uma placa de 96 poços revestida com 1,5% de agarose a uma densidade de 100.000 células por poço. Cultive em meio B, adicionando 150 μL de meio completo por poço (Figura 1D, 3A).
- Mantenha as células na placa de 96 poços revestidas com agarose a 1,5% por um mínimo de 1 dia e um máximo de 3 dias até que os esferóides sejam formados (Figura 2B). Transfira os esferóides dos poços usando uma ponta de pipeta de 1 mL com uma extremidade aparada e, em seguida, transfira para um tubo de 15 mL. Deixe os esferóides assentarem por 2-3 min e remova o sobrenadante.
- Mergulhar os esferóides em solução de matriz de membrana basal recém-descongelada e não diluída, mantida a 4 °C. Após 30 min, colete os esferóides por sedimentação passiva em um tubo de 15 mL ou por centrifugação suave a 100 x g por 1 min.
NOTA: A matriz deve ser descongelada durante a noite no gelo em uma geladeira de 2-8 °C. Após o primeiro descongelamento, alíquotas de uso único da matriz são feitas para evitar ciclos repetidos de congelamento e descongelamento. Tubos de polipropileno ou outros compatíveis com freezer são usados e armazenados a -70 °C ou -20 °C. Fique atento à data de validade do lote/lote, que é de 2 anos a partir da data de fabricação. - Transfira os esferóides para mini-biorreatores e adicione 6 mL de Meio B. Coloque o mini-biorreator em um agitador orbital dentro de uma incubadora de CO2 ajustada para 37 ° C com 5% de CO2 e 100% de umidade e uma velocidade de agitação de 70-75 rpm (Figura 1F).
- Altere o meio semanalmente ou conforme necessário pela depleção do meio ou mudança de cor do indicador ácido-base. Para fazer isso, permita que os esferoides se depositem por gravidade em um tubo de 15 mL e, em seguida, remova cuidadosamente o sobrenadante. Adicione o meio B fresco ao tubo e transfira os esferóides de volta para os minibiorreatores.
Resultados
O protocolo descrito é ilustrado na Figura 1. Esta metodologia emprega dois meios de cultura distintos para conduzir a diferenciação de iPSCs em esferoides de condrócitos durante uma duração mínima de 1 mês (Figura 2). O processo de diferenciação é iniciado quando as iPSCs atingem 75% -90% de confluência (Figura 1B). Os primeiros indicadores de diferencia...
Discussão
As iPSCs representam uma ferramenta transformadora na medicina regenerativa, oferecendo o potencial de gerar condrócitos específicos do paciente para reparo da cartilagem. Os protocolos atuais alavancam a diferenciação direcionada por meio de vias mesodérmicas, com moléculas sinalizadoras importantes como TGF-β e BMP-2 promovendo o comprometimento da linhagem condrocítica. Esses métodos visam replicar o desenvolvimento da cartilagem embrionária, possibilitando a produção de c...
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
A pesquisa foi apoiada com a alocação # 22-15-00250 pela Fundação Russa de Ciência.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Referências
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados