A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת ספרואידים מכונדרוציטים שונים בתנאי הדבקה נמוכה תחת כוח הכבידה ומיני ביוריאקטורים תוצרת בית
In This Article
Summary
מחקר זה מתאר שיטה לייצור ספרואידים כונדרוציטיים על ידי צבירת תאים לספרואידים בתנאי הדבקה נמוכה באמצעות כוח הכבידה, ולאחר מכן תרבית את הספרואידים המתקבלים במיני-ביוריאקטורים.
Abstract
תיקון סחוס במחלות מפרקים כרוניות דורש טיפולים מתקדמים מבוססי תאים כדי לחדש רקמות פגועות ביעילות. פרוטוקול זה מספק שיטה שלב אחר שלב להבחנה של תאי גזע פלוריפוטנטיים מושרים (iPSCs) לספרואידים מבוססי כונדרוציטים, התומכים בהנדסת רקמות וביישומי תרפיה תאית. תהליך ההתמיינות בנוי בקפידה כדי לקדם מחויבות לשושלת כונדרוגנית, החל מתאי גזע פלוריפוטנטיים מושרים בתרבית במדיה ספציפית המנחים תאים ברצף בשלבים קריטיים של התמיינות. בתחילה, iPSCs מורחבים כדי להגיע למפגש אופטימלי לפני אינדוקציה לקראת שושלת כונדרוגנית באמצעות סדרה של שינויי מדיה מוגדרים. ביום ה-10, התאים עוברים למדיום מקדם כונדרוגנזה, המשפר את היווצרותם של תאים דמויי כונדרוציטים המבטאים סמנים מרכזיים של כונדרוציטים בוגרים. צבירה נוספת בלוחות מצופים באגרוז 96 בארות מובילה להיווצרות ספרואידים תלת-ממדיים, אשר לאחר מכן מתורבתים במיני-ביוריאקטורים מותאמים אישית שנועדו לדמות מיקרו-סביבה המעודדת שקיעת מטריצה חוץ-תאית (ECM). על ידי מתן אפשרות לייצור מדרגי של כונדרוציטים ספרואידים המחקים את מאפייני הסחוס הטבעיים, גישה זו מציעה פתרון מבטיח ובר שחזור לפיתוח טיפולים מבוססי תאים לפגמים בסחוס, ומספקת תועלת רחבה ליישומים קליניים ומחקריים ברפואה רגנרטיבית של שרירים ושלד.
Introduction
שכיחות מחלות המפרקים גורמת לנטל כלכלי משמעותי בשל מספרם ההולך וגדל של חולים נכים והעלויות הכרוכות בטיפול בהם. סחוס היאלין הוא רקמת חיבור אווסקולרית בעלת פוטנציאל התחדשות מוגבל1. שימוש ממושך בתרופות נוגדות דלקת לא סטרואידיות מסוימות (NSAIDs), גלוקוקורטיקואידים וכימותרפיה או הקרנות יכול להפחית עוד יותר את יכולת ההתחדשות של הסחוס, וכמעט לבטל את יכולתו לרפא2. זה עושה את זה מאתגר להשיג תאי סחוס אוטולוגיים לטיפול תאי.
הטכנולוגיה של גידול תאים תלת מימדי (3D), כולל chondrocytes, כבר זמן רב מוכר כאזור מחקר מתפתח עם פוטנציאל משמעותי. מבנים תלת-ממדיים אלה נחקרים ליישומים הן במחקר ביולוגי בסיסי והן ברפואה רגנרטיבית. ספרואידים שמקורם בכונדרוציטים אוטולוגיים טומנים בחובם הבטחה טיפולית לטיפול בניוון רקמת הסחוס, מצב הזוכה כיום לתשומת לב עולמית רבה3.
ספרואידים שמקורם בכונדרוציטים המובחנים מתאי גזע פלוריפוטנטיים מושרים מהווים חלופה מבטיחה לכונדרוציטים ראשוניים, ומציעים יתרונות משמעותיים לתיקון סחוס. תאי גזע פלוריפוטנטיים מושרים מספקים יכולת כמעט בלתי מוגבלת להתחדשות עצמית ובעלי פוטנציאל התמיינות רחב, המאפשר ייצור כונדרוציטים בכמויות המספיקות ליישומים קליניים ללא הליכים פולשניים לאיסוף תאים4. יתר על כן, המעבר מתרביות כונדרוציטים דו-ממדיות מסורתיות (2D) למערכות תרבית תלת-ממדיות, כגון כונדרוספרה, משפר עוד יותר את הכדאיות והפונקציונליות של תאים אלה על ידי יצירת סביבה רלוונטית יותר מבחינה פיזיולוגית. מחקרים מראים כי כונדרוציטים שגודלו בתרבית בספרואידים תלת-ממדיים שומרים טוב יותר על הפנוטיפ שלהם, ומציגים שיעורים נמוכים יותר של דה-דיפרנציאציה ורמות ביטוי גבוהות יותר של סמני סחוס היאלין מרכזיים, כגון קולגן מסוג II ואגרקן5.
למרות הפוטנציאל של כונדרוספירות שמקורן ב-iPSC, פרוטוקולים סטנדרטיים לייצור כונדרוספירות באיכות גבוהה נותרו מוגבלים. שונות בפרוטוקולים בין מחקרים מובילה לעתים קרובות לחוסר עקביות באיכות הכונדרוציטים ובהרכב המטריצות החוץ תאיות, מה שמשפיע על יעילותם לשימוש טיפולי6. כאן, מוצג פרוטוקול מעודן המתקן את ייצור הספרואידים מכונדרוציטים שמקורם ב- iPSC באמצעות מיני ביוריאקטורים במחיר סביר ומותאם אישית. שלב תרבית המיני-ביוריאקטור הוא חיוני, שכן הוא מספק הגדרה מבוקרת ובעלת היצמדות נמוכה הממטבת את חלוקת החומרים המזינים, הבשלת ECM ודחיסת כדוריד7. שלב זה מקדם ביטוי חזק של סמנים כונדרוציטים חיוניים, כולל קולגן מסוג II, אגרקן ו-SOX9, יחד עם הרכב ECM הדומה מאוד לסחוס טבעי. שינויי מדיה קבועים ובקרה קפדנית של תנאי הסביבה - טמפרטורה,CO2 ומהירות סיבוב - מבטיחים עוד יותר את הכדאיות וההבשלה של כדורואידים כונדרוציטים. פרוטוקול זה עבר אופטימיזציה ליצירת כונדרוספירות באיכות גבוהה עם ביטוי חזק של סמני סחוס היאלין באופן חסכוני ומדרגי, המתאים למחקר וליישומים קליניים בתיקון סחוס.
Protocol
המחקר נבדק ואושר על ידי ועדת האתיקה של LOPUKHIN FRCC PCM (פרוטוקול מס' 2019/02 מיום 9 באפריל 2019). כל דגימות התורמים התקבלו בהתאם לעקרונות הצהרת הלסינקי. הסכמה מדעת התקבלה מכל המשתתפים ו/או האפוטרופוסים החוקיים שלהם.
הערה: שמור על טכניקה סטרילית לאורך כל הפרוטוקול. יש לחמם את כל חומרי התרבית והתמיסות לטמפרטורה של 37°C לפני החלתם על תאים או ספרואידים. לטפח תאים באינקובטור CO2 ב 37 ° C, עם 5% CO2 על 80% לחות. סכימת הפרוטוקולים מוצגת באיור 1.
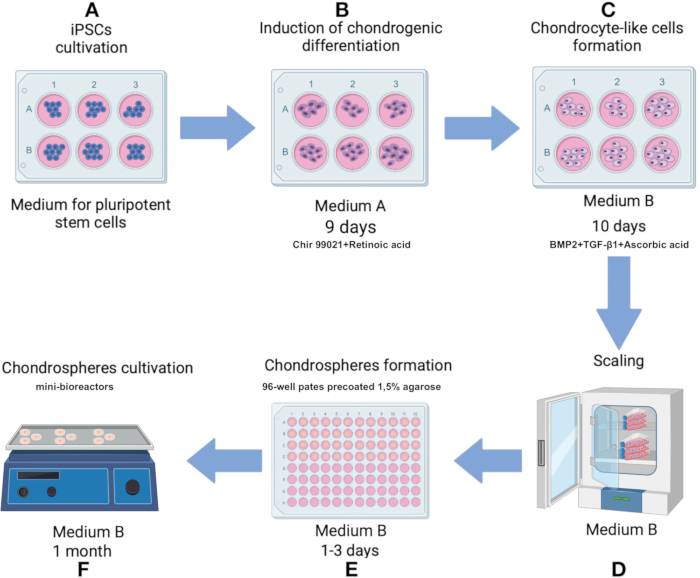
איור 1: פרוטוקול לייצור כונדרוספירות מקו iPSC IPSRG4S. (A) בתחילה, תאי גזע פלוריפוטנטיים מושרים בתרבית במצע תאי גזע פלוריפוטנטיים עד שמגיעים למפגש של 80%. (B) כדי לגרום להתמיינות כלפי השושלת הכונדרוציטית מגדלים תאי גזע פלוריפוטנטיים מושרים בתרבית בתווך A למשך יומיים. המדיום מוחלף לאחר מכן בפורמולציה חסרה Chir 99021 ומעכב Rho kinase, והתאים מתורבתים במשך 6 ימים נוספים עם שינויים בינוניים כל יומיים. (C) התאים מועברים לאחר מכן למדיום B כדי לקדם כונדרוגנזה במשך 10 הימים הבאים. (D) ברגע שמושג מספר תאים מספיק, התהליך מתקדם לשלב ייצור הספרואידים. (E) התאים מצטברים לספרואידים בתנאי הדבקה נמוכה תחת כוח הכבידה. (F) הספרואידים המתקבלים מתורבתים במיני-ביוריאקטורים בעלי תווך B. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. הפיכת צלחות פטרי למיני-ביוריאקטורים
הערה: פרטים במאמר קודם5.
- פורסים צינורות צנטריפוגות לטבעות בגובה 7-8 מ"מ באמצעות מספריים סטריליים של אוטוקלאבה (הגדרות אוטוקלאב: 121°C (250°F) ב-15 psi, 30 דקות, וייבוש לאחר אוטוקלאבה למשך 20 דקות).
- כתשו צלחות פטרי בעלות הדבקה נמוכה, לא מטופלות או מיקרוביולוגיות לחתיכות קטנות. יש להמיס כ-1 גרם של חלקיקי פלסטיק ב-10 מ"ל כלורופורם למשך הלילה כדי ליצור תמיסת פלסטיק נוזלית. בצע הליך זה במכסה אדים.
- ודא כי פלסטיק נוזלי הוא צמיג מספיק עבור pipetting. ודא שהטיפות שומרות על צורה כדורית ולא מתפשטות על פני השטח. אם התמיסה דקה מדי, הוסיפו עוד חלקיקי פלסטיק, בדרך כלל דורשים 1-3 גרם. אם הוא סמיך מדי, להוסיף כלורופורם נוסף, בדרך כלל דורש עד 5 מ"ל.
- יוצרים ידית פלסטיק במרכזו של צלחת פטרי סטרילית ובעלת הדבקה נמוכה במיוחד בקוטר 60 מ"מ באמצעות אחת משתי השיטות היעילות המתוארות להלן.
- אפשרות 1: מניחים את טבעת הפלסטיק האוטומטית במרכז צלחת הפטרי, ואז מורחים פלסטיק נוזלי בתוך הטבעת; טיפה אחת תדרוש כ 100-200 μL טיפות של פלסטיק נוזלי.
- אפשרות 2: יש למרוח את אותו מספר טיפות של פלסטיק נוזלי ישירות למרכז צלחת הפטרי מבלי להשתמש בטבעת הפלסטיק.
- הניחו לכלים להתייבש ללא כיסוי במשך 2-3 שעות במכסה מנוע זרימה למינרי. לאחר הייבוש, לחשוף את הכלים לקרינה אולטרה סגולה במשך 20-30 דקות.
2. טיפול בתבשילי תרבית עם ג'לטין
- הכינו תמיסת ג'לטין 0.1% על ידי המסת אבקת ג'לטין במים מזוקקים בטמפרטורה של 95°C. העבירו את התמיסה ברצף דרך מסנני ממברנות של 0.45 מיקרומטר ו-0.25 מיקרומטר, ולאחר מכן אחסנו את התסנין בטמפרטורה של 4°C.
- מיד לפני הזריעה מחדש chondrocyte, להחיל את 3 מ"ל של פתרון ג 'לטין על בקבוק25 ס"מ 2 (עד 15 גרם של רקמת סחוס לכל בקבוק T25 מומלץ). יש לדגור בטמפרטורת החדר (RT) למשך 30 דקות, להסיר את הג'לטין, לשטוף פעמיים עם PBS ולהמשיך בזריעת תאים.
3. בידוד וטיפוח של chondrocytes
הערה: כונדרוציטים מבודדים מאזורי סחוס שאינם נושאים משקל מחולים שעברו החלפת ברך מלאה. קצרו את כל הדגימות בתנאים סטריליים ואחסנו אותן בצינורות סטריליים מלאים ב-DMEM המכילים 200 U/mL פניצילין/תמיסת סטרפטומיצין. יש לאחסן את רקמת הסחוס במקרר בטמפרטורה של 2-8 מעלות צלזיוס.
- יש להתחיל טיפול אנזימטי תוך יומיים מקציר הסחוס. שוטפים חתיכות סחוס בתמיסה של הנקס באמצעות צלחות פטרי בקוטר 60 מ"מ, ואז חותכים את הסחוס לשברים בקוטר של כ-1-2 מ"מ באמצעות מספריים אוטוקלאביות.
- מעבירים חתיכות סחוס לתוך צינורות 15 מ"ל ומעכלים אותם בתמיסת 0.01% collagenase type II ב- DMEM, בערך 1 מ"ל לכל 1 גרם סחוס, תוך 8-12 שעות באינקובטור CO2 המוגדר ל 37 ° C עם 5% CO2, 100% לחות, תחת תסיסה מתמשכת על שייקר מסלול ב 150-200 סל"ד.
- לאחר העיכול, לשטוף את שברי הסחוס על ידי הוספת DMEM צינור 15 מ"ל, ולאחר מכן צנטריפוגה ב 300 × גרם במשך 10 דקות. השהה מחדש את השברים בתווך תרבית כונדרוציטים (טבלה משלימה 1) וזרע אותם על בקבוק דבק T25 מצופה מראש בתמיסת ג'לטין 0.1%.
- מעבר chondrocytes כאשר צפיפות confluent של 80% מושגת.
- למעבר, לשטוף chondrocytes עם הפתרון של הנקס, ולאחר מכן לדגור תאים עם 0.25% תמיסת טריפסין ב 37 ° C במשך 5 דקות.
- כדי להשבית טריפסין, הוסף נפח שווה של DMEM + 10% FBS. מרחפים מחדש כונדרוציטים בתווך תרבית טרי, ואז מפיצים אותם ביחס של 1:3, וזורעים 20,000-30,000 תאים לכל 1 ס"מ2.
- מניחים את בקבוק התרבית באינקובטור ב 37 ° C עם 5% CO2 ו 100% לחות.
4. טיפוח תאי גזע פלוריפוטנטיים
הערה: בשיתוף פעולה עם מעבדת תאי גזע של קבוצת המחקר המולקולרי של המוח, המחלקה לנוירוביולוגיה, מכון A.I. Virtanen, אוניברסיטת מזרח פינלנד, קופיו, פינלנד, קו iPSCs IPSRG4S, נוצר בהצלחה במחקר קודם8.
- טפחו תאי גזע פלוריפוטנטיים מושרים בצלחות בנות 6 בארות מצופות מראש במטריצה המכילה חלבונים חוץ-תאיים ( איור 1A). השתמש בתווך עבור תאי גזע פלוריפוטנטיים (טבלה משלימה 1).
- תאי מעבר במפגש של 80%, תוך שמירה על יחס של 1:4 (50,000-75,000 תאים לס"מ2). כ 2-3 שעות לפני הניתוק, להעביר iPSCs למדיום עבור תאי גזע פלוריפוטנטיים המכילים מעכב Rho קינאז Y27632 בריכוז סופי 1 מיקרומטר למשך יום אחד.
- שטפו את תאי גזע פלוריפוטנטיים מושרים בתמיסת Hanks ודגרו בטמפרטורה של 37°C עם תמיסת טריפסין 0.05%. כדי להשבית טריפסין, הוסף נפח שווה של DMEM + 10% FBS. צנטריפוגה את מתלה התא ב 200 x גרם במשך 5 דקות צינורות 15 מ"ל.
- השליכו את הסופרנאטנט והשהו מחדש את התאים בתווך טרי לקבלת תאי גזע פלוריפוטנטים. כדי לשפר את יכולת הקיום של התא, הוסף מעכב Rho קינאז Y27632 למדיום בריכוז סופי של 1 מיקרומטר למשך יום אחד. הניחו את צלחת התרבית באינקובטור CO2 לטמפרטורה של 37°C עם 5%CO2 ו-100% לחות.
5. התמיינות כונדרוגנית של iPSCs
- ליזום התמיינות לקראת השושלת הכונדרוציטית על ידי תרבית תאים במדיום A (טבלה משלימה 1) במשך היומיים הראשונים. ביום השלישי, החלף את Medium A בתמיסה שאינה כוללת את Chir 99021 ומעכב Rho kinase תוך שמירה על כל שאר הרכיבים ללא שינוי. שנו את המדיום כל יומיים מימים 3 עד 9 (איור 1B).
- ביום ה-10, העבירו תאים דמויי כונדרוציטים למדיום B (טבלה משלימה 1), שנוסחה כדי להקל על כונדרוגנזה. שנו את המדיום כל יומיים במשך 10 ימים (איור 1C).
- הכינו מראש צלחת תרבית תרחיף של 96 בארות על ידי ציפוי כל באר ב-1.5% אגרוז במים מזוקקים. ממיסים את האגרוז במיקרוגל עד לרתיחה (כ 60-90 שניות ב 700 W). לאחר שהאגרוז נוזלי, מוסיפים 75 מיקרוליטר אגרוז לכל באר ומאפשרים לו להתקשות ב-RT (כ-15 דקות).
- הוסף 150 μL של מדיום DMEM לכל באר ודגר את הצלחת באינקובטור CO2 במשך 12 שעות לפחות.
הערה: צלחות מוכנות ניתן לאחסן עד 1 חודש באינקובטור CO2 ב 37 ° C אם המדיום בכל באר מתחדש כדי לפצות על אידוי. - ביום ה-12, לאחר התבוננות בשינויים פנוטיפיים הקשורים לכונדרוגנזה, יש להתחיל ביצירת ספרואידים באמצעות תאים דמויי כונדרוציטים שנוצרו.
הערה: בשלב זה, מומלץ לנתח את הביטוי של סמנים כונדרוציטיים מרכזיים עם אימונוציטוכימיה (ICC) ותגובת שרשרת פולימראז כמותית (qPCR) באמצעות שיטת 2-ΔΔCT 9 כדי לאשר התמיינות כונדרוגנית מוצלחת של iPSCs. במהלך המעבר מצלחת 6 בארות לצלוחית תרביתתאים בגודל 75 ס"מ, ניתן לזרוע חלק קטן של תאים לתוך צלחת של 48 בארות, התואמת את מספר הסמנים שיש לנתח. בצע ניתוח ICC על דגימות אלה כדי לאמת ביטוי גנים.
6. היווצרות ספרואידים מתאים דמויי כונדרוציטים שמקורם ב-iPSC
- לאחר קבלת נגזרות דמויות כונדרוציטים, תאי מעבר במפגש של 80%. נתקו תאים מלוחות 6 בארות באמצעות תמיסת טריפסין 0.05%. כדי להשבית טריפסין, הוסף נפח שווה של DMEM + 10% FBS, ולאחר מכן להעביר תאים לצינור 15 מ"ל וצנטריפוגה ב 200 x גרם במשך 5 דקות.
- הסירו את הסופרנטנט, השהו מחדש את התאים ב-1 מ"ל של מדיום B, והעבירו לבקבוק תרבית תאיםבגודל 75 ס"מ 2 מצופה מראש בתמיסת ג'לטין 0.1% (איור 1D). ברגע שהתאים מגיעים למפגש של 80% כחד-שכבתי, יש לנתק שוב את התאים עם טריפסין ולהשהות מחדש במדיום B כמתואר.
- מעבירים תאים לצלחת בת 96 בארות המצופה ב-1.5% אגרוז בצפיפות של 100,000 תאים לבאר. טפחו במדיום B, והוסיפו 150 מיקרוליטר של מדיום שלם לכל באר (איור 1D, 3A).
- שמרו על תאים בצלחת בת 96 בארות המצופים ב-1.5% אגרוז למשך יום אחד לפחות ומקסימום 3 ימים עד להיווצרות ספרואידים (איור 2B). מעבירים ספרואידים מהבארות באמצעות קצה פיפטה 1 מ"ל עם קצה גזוז, ואז מעבירים לצינור 15 מ"ל. תנו לספרואידים להסתפק ב-2-3 דקות והוציאו את הסופרנטנט.
- טבלו את הספרואידים בתמיסת מטריצת קרום מרתף טרייה מופשרת ולא מדוללת המתוחזקת בטמפרטורה של 4°C. לאחר 30 דקות, לאסוף spheroids על ידי שקיעה פסיבית בצינור 15 מ"ל או על ידי צנטריפוגה עדינה ב 100 x גרם במשך 1 דקה.
הערה: יש להפשיר את המטריקס למשך הלילה על קרח במקרר בטמפרטורה של 2-8 מעלות צלזיוס. לאחר ההפשרה הראשונה, aliquots חד פעמי של המטריצה נעשים כדי למנוע מחזורי הקפאה-הפשרה חוזרים. פוליפרופילן או צינורות תואמי מקפיא אחרים משמשים ומאוחסנים ב -70 ° C או -20 ° C. שימו לב לתאריך התפוגה של האצווה/לוט, שהוא שנתיים מתאריך הייצור. - העבירו ספרואידים למיני-ביוריאקטורים והוסיפו 6 מ"ל של מדיום B. הניחו את המיני-ביוריאקטור על שייקר אורביטלי בתוך אינקובטור CO2 המוגדר ל-37°C עם 5% CO2 ו-100% לחות ומהירות תסיסה של 70-75 סל"ד (איור 1F).
- שנה את המדיום מדי שבוע או לפי הצורך על ידי דלדול בינוני או שינוי צבע של מחוון בסיס החומצה. כדי לעשות זאת, לאפשר spheroids להתיישב על ידי כוח הכבידה בצינור 15 מ"ל, ולאחר מכן בזהירות להסיר את supernatant. הוסיפו מדיום B טרי לצינור, והעבירו ספרואידים בחזרה למיני-ביוריאקטורים.
תוצאות
הפרוטוקול המתואר מתואר באיור 1. מתודולוגיה זו משתמשת בשתי תרביות נפרדות כדי להניע את ההתמיינות של תאי גזע פלוריפוטנטיים מושרים לכדורואידים של כונדרוציטים במשך תקופה מינימלית של חודש אחד (איור 2). תהליך ההתמיינות מתחיל כ?...
Discussion
תאי גזע פלוריפוטנטיים מושרים מייצגים כלי טרנספורמטיבי ברפואה רגנרטיבית, המציע פוטנציאל לייצר כונדרוציטים ספציפיים למטופל לתיקון סחוס. הפרוטוקולים הנוכחיים ממנפים התמיינות מכוונת דרך מסלולים מזודרמליים, עם מולקולות איתות מרכזיות כמו TGF-β ו- BMP-2 המקדמות מחויבות לשושלת ?...
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים פוטנציאלי.
Acknowledgements
המחקר נתמך בהקצאה #22-15-00250 על ידי קרן המדע הרוסית.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
References
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved