このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
重力下での低接着条件と自家製ミニバイオリアクターを用いた種々の軟骨細胞からのスフェロイド作製
要約
本研究では、重力を利用して低接着条件下で細胞をスフェロイドに凝集させ、得られたスフェロイドをミニバイオリアクターで培養することにより、軟骨球性スフェロイドを作製する方法について述べています。
要約
慢性関節疾患における軟骨修復には、損傷した組織を効果的に再生するための高度な細胞ベースの治療法が必要です。このプロトコールは、人工多能性幹細胞(iPSC)を軟骨細胞ベースのスフェロイドに分化させるための段階的な方法を提供し、組織工学および細胞治療のアプリケーションをサポートします。分化プロセスは、軟骨形成系譜の関与を促進するために慎重に構成されており、まず、特定の培地で培養されたiPS細胞が細胞を分化の重要な段階に順次誘導します。最初に、iPSCは、一連の定義された培地変更を使用して軟骨原性系統への誘導前に最適なコンフルエンシーに達するように拡張されます。10日目までに、細胞は軟骨形成促進培地に移行し、成熟軟骨細胞の主要なマーカーを発現する軟骨細胞様細胞の形成を促進します。96ウェルのアガロース被覆プレートでさらに凝集すると、三次元スフェロイドが形成され、細胞外マトリックス(ECM)の沈着を促進する微小環境をシミュレートするように設計されたカスタムミニバイオリアクターで培養されます。このアプローチは、天然の軟骨特性を模倣した軟骨細胞スフェロイドのスケーラブルな生産を可能にすることにより、軟骨欠損の細胞ベースの治療法を開発するための有望で再現性のあるソリューションを提供し、筋骨格再生医療の臨床および研究アプリケーションに幅広い有用性を提供します。
概要
関節疾患の有病率は、障害のある患者の数の増加と彼らのケアに関連する費用により、大きな経済的負担につながります。硝子軟骨は、再生能力が限られている結合無血管組織です1.特定の非ステロイド性抗炎症薬(NSAID)、グルココルチコイド、化学療法または放射線療法の長期使用は、軟骨の再生能力をさらに低下させ、治癒能力をほぼ失う可能性があります2。そのため、細胞治療のための自家軟骨細胞の入手が困難です。
軟骨細胞を含む3次元(3D)細胞培養の技術は、大きな可能性を秘めた新たな研究分野として長い間認識されてきました。これらの3D構造は、基礎生物学研究と再生医療の両方への応用が検討されています。自家軟骨細胞に由来するスフェロイドは、現在世界的に大きな注目を集めている軟骨組織の変性に対処するための治療効果が期待されています3。
iPS細胞から分化した軟骨細胞由来のスフェロイドは、初代軟骨細胞の有望な代替手段であり、軟骨修復に大きな利点をもたらします。iPS細胞は、ほぼ無限の自己複製能力を持ち、幅広い分化の可能性を秘めているため、細胞採取のための侵襲的な手順を必要とせずに、臨床応用に十分な量の軟骨細胞を産生することができます4。さらに、従来の二次元(2D)軟骨細胞培養から軟骨球などの3D培養システムへの移行は、より生理学的に関連性のある環境を作り出すことにより、これらの細胞の生存率と機能性をさらに向上させます。研究によると、3Dスフェロイドで培養した軟骨細胞は、表現型をよりよく維持し、脱分化率が低く、II型コラーゲンやアグリカン5などの主要な硝子軟骨マーカーの発現レベルが高いことが示されています。
iPS細胞由来の軟骨球の可能性にもかかわらず、高品質の軟骨球を生成するための標準化されたプロトコルは依然として限られています。研究間でのプロトコルのばらつきは、しばしば軟骨細胞の品質と細胞外マトリックス組成の不一致につながり、治療使用に対する有効性に影響を及ぼします6。ここでは、手頃な価格のカスタムメイドのミニバイオリアクターを使用して、iPSC由来軟骨細胞からのスフェロイドの生成を標準化する洗練されたプロトコルを紹介します。ミニバイオリアクターの培養段階は、栄養素の分布、ECMの成熟、およびスフェロイドの圧縮を最適化する制御された低接着設定を提供するため、不可欠です7。このフェーズでは、コラーゲンII型、アグリカン、SOX9などの必須軟骨細胞マーカーの強力な発現と、天然軟骨によく似たECM組成物の発現が促進されます。定期的な培地交換と環境条件(温度、CO2、回転速度)の慎重な制御により、軟骨細胞スフェロイドの生存率と成熟がさらに確実になります。このプロトコルは、硝子軟骨マーカーを強力に発現する高品質の軟骨球をコスト効率よくスケーラブルな方法で作成するように最適化されており、軟骨修復の研究および臨床応用に適しています。
プロトコル
この研究は、LOPUKHIN FRCC PCM の倫理委員会によってレビューされ、承認されました (プロトコル番号 2019/02 2019 年 4 月 9 日)。すべてのドナーサンプルは、ヘルシンキ宣言の原則に従って取得されました。インフォームド コンセントは、すべての参加者および/またはその法定後見人から得られました。
注:プロトコル全体を通して滅菌技術を維持します。すべての培地と溶液を37°Cに温めてから、細胞またはスフェロイドに適用してください。37°CのCO2 インキュベーターで、湿度80%に対して5%のCO2 で細胞を培養します。プロトコル スキームを 図 1 に示します。
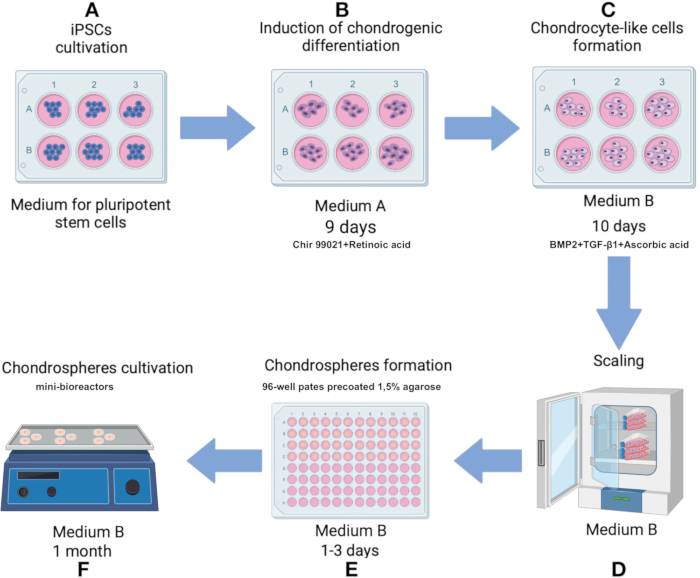
図1:iPS細胞株から軟骨球を作製するためのプロトコール IPSRG4S. (A) 最初に、iPS細胞は多能性幹細胞培地で80%のコンフルエント度に達するまで培養されます。(B)軟骨細胞系譜への分化を誘導するために、iPS細胞を培地Aで2日間培養します。その後、培地をChir 99021およびRhoキナーゼ阻害剤を欠損した製剤に交換し、細胞をさらに6日間培養し、2日ごとに培地を交換します。(C)次に、細胞を培地Bに移し、次の10日間、軟骨形成を促進します。(D)十分な細胞数が得られると、プロセスはスフェロイド産生段階に進みます。(E)細胞は、重力下で低接着状態でスフェロイドに凝集します。(F)得られたスフェロイドは、媒体Bのミニバイオリアクターで培養されます。 この図の拡大版を見るには、ここをクリックしてください。
1. シャーレのミニバイオリアクターへの変換
注:詳細は前の記事5を参照してください。
- 滅菌オートクレーブハサミを使用して、遠心分離チューブを高さ7〜8mmのリングにスライスします(オートクレーブ設定:15psiで121°C(250°F)、30分、オートクレーブ乾燥後20分)。
- 接着力の低い、未処理の、または微生物学的なシャーレを細かく砕きます。約1gのプラスチック粒子を10mLのクロロホルムに一晩溶かし、液体プラスチック溶液を作ります。この手順はドラフトで行ってください。
- 液体プラスチックがピペッティングに十分な粘性があることを確認します。液滴が表面に広がるのではなく、球形を維持していることを確認します。溶液が薄すぎる場合は、通常1〜3g必要なプラスチック粒子を追加します。濃すぎる場合は、クロロホルムを追加で追加し、通常は最大5mL必要とします。
- 以下に概説する2つの効果的な方法のいずれかを使用して、滅菌済みの超低接着60mmペトリ皿の中央にプラスチックノブを形成します。
- オプション1:オートクレーブ処理されたプラスチックリングをペトリ皿の中央に置き、リングの内側に液体プラスチックを塗布します。1滴には、約100〜200μLの液体プラスチックが必要です。
- オプション2:プラスチックリングを使用せずに、同じ数の液体プラスチックをペトリ皿の中央に直接塗布します。
- 皿を蓋をせずに、層流フードで2〜3時間乾かします。乾燥後、皿を紫外線に20〜30分間さらします。
2.ゼラチンによる培養皿の処理
- 粉末ゼラチンを蒸留水95°Cに溶解して、0.1%ゼラチン溶液を調製します。 溶液を0.45 μmおよび0.25 μmのメンブレンフィルターに順次通し、濾液を4°Cで保存します。
- 軟骨細胞の再播種直前に、3mLのゼラチン溶液を25cm2 フラスコに塗布します(T25フラスコあたり最大15gの軟骨組織が推奨されます)。室温(RT)で30分間インキュベートし、ゼラチンを除去し、PBSで2回すすぎ、細胞播種を進めます。
3. 軟骨細胞の単離と培養
注:軟骨細胞は、人工膝関節全置換術を受けている患者の非体重負荷軟骨領域から分離されます。すべての検体を滅菌条件下で採取し、200 U/mL ペニシリン/ストレプトマイシン溶液を含む DMEM を充填した滅菌チューブに保管します。軟骨ティッシュは2〜8°Cの冷蔵庫で保存してください。
- 軟骨採取後2日以内に酵素治療を開始してください。60mmのシャーレを使用してハンクス溶液で軟骨片を洗浄し、オートクレーブはさみを使用して軟骨を直径約1〜2mmの断片に切断します。
- 軟骨片を15mLチューブに移し、DMEM中の0.01%コラゲナーゼII型溶液(軟骨1gあたり約1mL)で、37°C、5%CO2、湿度100%に設定されたCO2インキュベーターで、150〜200rpmのオービタルシェーカーで連続的に攪拌しながら、8〜12時間以内に消化します。
- 消化後、15 mLチューブにDMEMを加えて軟骨断片を洗浄し、300 × g で10分間遠心分離します。断片を軟骨細胞培養培地(補足表1)に再懸濁し、0.1%ゼラチン溶液でプレコートした接着剤T25フラスコに播種します。
- 80%のコンフルエント密度が達成されたときの軟骨細胞の継代。
- 継代では、軟骨細胞をハンクス溶液で洗浄し、0.25%トリプシン溶液で細胞を37°Cで5分間インキュベートします。
- トリプシンを不活性化するには、等量のDMEM + 10%FBSを追加します。.軟骨細胞を新鮮な培地に再懸濁し、次に1:3の比率で分配し、1 cm2あたり20,000〜30,000個の細胞を播種します。
- 培養フラスコを37°C、5%のCO2 、湿度100%のインキュベーターに入れます。
4. 多能性幹細胞の培養
注:Molecular Brain Research Group, Department of Neurobiology, A.I. Virtanen Institute, University of Eastern Finland, Kuopio, Finlandの幹細胞研究室と共同で、iPS細胞系統IPSRG4Sが先行研究で成功裏に作製されました8。
- 細胞外タンパク質を含むマトリックスでプレコートされた6ウェルプレートでiPS細胞を培養します( 図1A)。多能性幹細胞用の培地を使用してください(補足表1)。
- 細胞を80%の密度で継代し、1:4の比率(1 cm2あたり50,000〜75,000細胞)を維持します。剥離の約2〜3時間前に、Rhoキナーゼ阻害剤Y27632を含む多能性幹細胞の培地にiPS細胞を最終濃度1μMで1日間移します。
- iPS細胞をハンクス溶液で洗浄し、0.05%トリプシン溶液と37°Cでインキュベートします。トリプシンを不活性化するには、等量のDMEM + 10%FBSを追加します。.細胞懸濁液を200 x g で15 mLチューブ中で5分間遠心分離します。
- 上清を捨て、多能性幹細胞用の新しい培地に細胞を再懸濁します。細胞生存率を高めるには、Rhoキナーゼ阻害剤Y27632を最終濃度1 μMで1日間培地に添加します。培養プレートを37°Cにセットし、5%のCO2と100%の湿度でCO2インキュベーターに入れます。
5. iPS細胞の軟骨形成分化
- 最初の2日間、培地A(補足表1)で細胞を培養することにより、軟骨細胞系譜への分化を開始します。3日目に、培地AをChir 99021とRhoキナーゼ阻害剤を除外した溶液に置き換え、他のすべての成分は変更しません。3日目から9日目まで2日ごとに培地を交換します(図1B)。
- 10日目に、軟骨細胞様細胞を軟骨形成を促進するように製剤化された培地B(補足表1)に移します。2日ごとに10日間、培地を交換します(図1C)。
- 96ウェルの細胞懸濁培養プレートを事前に調製し、各ウェルに1.5%アガロースを蒸留水でコーティングします。アガロースを電子レンジで沸騰するまで溶かします(700Wで約60〜90秒)。アガロースが液化したら、各ウェルに75 μLのアガロースを加え、RTで硬化させます(約15分)。
- 各ウェルに150 μLのDMEM培地を加え、プレートをCO2 インキュベーターで少なくとも12時間インキュベートします。
注:調製したプレートは、蒸発を補うために各ウェル内の培地を補充する場合、37°CのCO2 インキュベーターで最大1か月間保存できます。 - 12日目に、軟骨形成に伴う表現型の変化を観察した後、生成された軟骨細胞様細胞を用いてスフェロイド形成を開始する。
注:この段階では、2-ΔΔCT 法9 を使用して免疫細胞化学(ICC)および定量的ポリメラーゼ連鎖反応(qPCR)で主要な軟骨細胞マーカーの発現を分析し、iPS細胞の軟骨形成分化が成功したことを確認することをお勧めします。6ウェルプレートから75 cm2 細胞培養フラスコへの継代中に、解析するマーカーの数と一致する48ウェルプレートに細胞のごく一部を播種できます。これらのサンプルでICC解析を行い、遺伝子発現を確認します。
6. 軟骨細胞様iPS細胞由来細胞からのスフェロイド形成
- 軟骨細胞様誘導体を得た後、細胞を80%の密度で継代する。0.05%トリプシン溶液を使用して、6ウェルプレートから細胞を分離します。トリプシンを不活化するには、等量のDMEM + 10% FBSを添加し、細胞を15 mLチューブに移し、200 x g で5分間遠心分離します。
- 上清を取り除き、細胞を1 mLの培地Bに再懸濁し、0.1%ゼラチン溶液でプレコートした75 cm2 細胞培養フラスコに移します(図1D)。細胞が単分子膜として80%のコンフルエントに達したら、トリプシンで細胞を再び剥離し、説明したように培地Bに再懸濁します。
- 1.5%アガロースでコーティングされた96ウェルプレートに細胞を1ウェルあたり100,000細胞の密度で移します。培地Bで培養し、ウェルあたり150 μLの完全培地を加えます(図1D、 3A)。
- 1.5%アガロースでコーティングした96ウェルプレートで細胞を、スフェロイドが形成されるまで最低1日間、最長3日間保持します(図2B)。端がトリミングされた1 mLピペットチップを使用してウェルからスフェロイドを移し、15 mLチューブに移します。スフェロイドが2〜3分間落ち着くのを待ち、上清を取り除きます。
- スフェロイドを、4°Cに維持された解凍したばかりの原液の基底膜マトリックス溶液に浸します。 30分後、15 mLチューブに不動態沈降するか、100 x g で1分間穏やかに遠心分離することにより、スフェロイドを回収します。
注:マトリックスは、2〜8°Cの冷蔵庫で氷上で一晩解凍する必要があります。最初の融解後、凍結融解サイクルの繰り返しを避けるために、マトリックスの使い捨てアリコートが作成されます。ポリプロピレンまたはその他の冷凍庫互換チューブを使用し、-70°Cまたは-20°Cで保管します。 製造日から2年間であるバッチ/ロットの有効期限に注意してください。 - スフェロイドをミニバイオリアクターに移し、6 mLの培地Bを加えます。ミニバイオリアクターを、5%のCO2と100%の湿度と70-75 rpmの攪拌速度で37°Cに設定されたCO2インキュベーター内のオービタルシェーカーに置きます(図1F)。
- 媒体は毎週、または中程度の枯渇または酸塩基インジケーターの色の変化に応じて交換します。これを行うには、スフェロイドを重力によって15 mLチューブに沈殿させた後、上清を慎重に取り除きます。新しい培地Bをチューブに加え、スフェロイドをミニバイオリアクターに戻します。
結果
概説されたプロトコルを 図 1 に示します。この方法論では、2つの異なる培地を使用して、iPS細胞の軟骨細胞スフェロイドへの分化を最短1か月で推進します(図2)。分化プロセスは、iPS細胞が75%〜90%のコンフルエンシーを達成したときに開始されます(図1B)。軟骨形成分化の初?...
ディスカッション
iPS細胞は、再生医療における変革的なツールであり、軟骨修復のための患者特異的な軟骨細胞を生成する可能性を提供します。現在のプロトコルは、TGF-βやBMP-2などの主要なシグナル伝達分子が軟骨細胞系譜の関与を促進する中胚葉経路による指向性分化を活用しています。これらの方法は、胚性軟骨の発生を再現し、機能的な軟骨組織に不可欠なII型コラーゲンや?...
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。
謝辞
この研究は、ロシア科学財団による割り当て#22-15-00250の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
参考文献
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved