Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération de sphéroïdes à partir de divers chondrocytes à l’aide de conditions à faible adhérence sous gravité et de mini-bioréacteurs faits maison
Dans cet article
Résumé
Cette étude décrit une méthode de production de sphéroïdes chondrocytaires en agrégeant des cellules en sphéroïdes dans des conditions de faible adhésion à l’aide de la gravité, suivie de la culture des sphéroïdes résultants dans des mini-bioréacteurs.
Résumé
La réparation du cartilage dans les maladies articulaires chroniques nécessite des thérapies cellulaires avancées pour régénérer efficacement les tissus endommagés. Ce protocole fournit une méthode étape par étape pour différencier les cellules souches pluripotentes induites (iPSC) en sphéroïdes à base de chondrocytes, soutenant ainsi les applications d’ingénierie tissulaire et de thérapie cellulaire. Le processus de différenciation est soigneusement structuré pour favoriser l’engagement de la lignée chondrogénique, en commençant par des iPSC cultivées dans des milieux spécifiques qui guident séquentiellement les cellules à travers les étapes critiques de la différenciation. Initialement, les iPSC sont élargies pour atteindre une confluence optimale avant l’induction vers la lignée chondrogénique à l’aide d’une série de changements de milieux définis. Au 10e jour, les cellules sont passées à un milieu favorisant la chondrogenèse qui améliore la formation de cellules de type chondrocytes exprimant des marqueurs clés des chondrocytes matures. Une agrégation supplémentaire dans des plaques recouvertes d’agarose à 96 puits conduit à la formation de sphéroïdes tridimensionnels, qui sont ensuite cultivés dans des mini-bioréacteurs personnalisés conçus pour simuler un microenvironnement qui encourage le dépôt de matrice extracellulaire (MEC). En permettant la production évolutive de sphéroïdes chondrocytaires qui imitent les caractéristiques natives du cartilage, cette approche offre une solution prometteuse et reproductible pour le développement de traitements cellulaires pour les défauts du cartilage, offrant une large utilité pour les applications cliniques et de recherche en médecine régénérative musculo-squelettique.
Introduction
La prévalence des maladies articulaires entraîne des charges économiques importantes en raison du nombre croissant de patients handicapés et des coûts associés à leurs soins. Le cartilage hyalin est un tissu avasculaire conjonctif avec un potentiel de régénération limité1. L’utilisation prolongée de certains anti-inflammatoires non stéroïdiens (AINS), de glucocorticoïdes et de la chimiothérapie ou de la radiothérapie peut diminuer davantage la capacité de régénération du cartilage, éliminant presque sa capacité à guérir2. Il est donc difficile d’obtenir des cellules cartilagineuses autologues pour la thérapie cellulaire.
La technologie de la culture cellulaire tridimensionnelle (3D), y compris les chondrocytes, est reconnue depuis longtemps comme un domaine de recherche émergent au potentiel important. Ces structures 3D sont étudiées pour des applications à la fois dans la recherche biologique fondamentale et la médecine régénérative. Les sphéroïdes dérivés de chondrocytes autologues sont prometteurs sur le plan thérapeutique pour lutter contre la dégénérescence du tissu cartilagineux, une maladie qui fait actuellement l’objet d’une attention mondialeconsidérable 3.
Les sphéroïdes dérivés de chondrocytes différenciés des iPSC représentent une alternative prometteuse aux chondrocytes primaires, offrant des avantages significatifs pour la réparation du cartilage. Les iPSC offrent une capacité d’auto-renouvellement presque illimitée et possèdent un large potentiel de différenciation, ce qui permet la production de chondrocytes en quantités suffisantes pour des applications cliniques sans procédures invasives de collecte de cellules4. De plus, la transition des cultures de chondrocytes bidimensionnelles (2D) traditionnelles vers des systèmes de culture 3D, tels que les chondrosphères, améliore encore la viabilité et la fonctionnalité de ces cellules en créant un environnement plus pertinent sur le plan physiologique. Des études montrent que les chondrocytes cultivés dans des sphéroïdes 3D conservent mieux leur phénotype, affichant des taux de dédifférenciation plus faibles et des niveaux d’expression plus élevés des principaux marqueurs du cartilage hyalin, tels que le collagène de type II et l’aggrécane5.
Malgré le potentiel des chondrosphères dérivées d’iPSC, les protocoles standardisés pour générer des chondrosphères de haute qualité restent limités. La variabilité des protocoles d’une étude à l’autre conduit souvent à des incohérences dans la qualité des chondrocytes et la composition de la matrice extracellulaire, ce qui affecte leur efficacité à des fins thérapeutiques6. Ici, un protocole raffiné est présenté qui normalise la génération de sphéroïdes à partir de chondrocytes dérivés d’iPSC à l’aide de mini-bioréacteurs abordables et fabriqués sur mesure. La phase de culture du mini-bioréacteur est essentielle, car elle fournit un réglage contrôlé à faible adhérence qui optimise la distribution des nutriments, la maturation de l’ECM et le compactage des sphéroïdes7. Cette phase favorise l’expression robuste des marqueurs chondrocytaires essentiels, notamment le collagène de type II, l’aggrécan et le SOX9, ainsi qu’une composition ECM qui ressemble étroitement au cartilage natif. Des changements réguliers de milieu et un contrôle minutieux des conditions environnementales - température, CO2 et vitesse de rotation - garantissent en outre la viabilité et la maturation des sphéroïdes chondrocytaires. Ce protocole a été optimisé pour créer des chondrosphères de haute qualité avec une forte expression de marqueurs cartilagineux hyalins de manière rentable et évolutive, adaptée à la recherche et aux applications cliniques dans la réparation du cartilage.
Protocole
L’étude a été examinée et approuvée par le Comité d’éthique du LOPUKHIN FRCC PCM (protocole n° 2019/02 du 9 avril 2019). Tous les échantillons prélevés par le donneur ont été prélevés conformément aux principes de la Déclaration d’Helsinki. Le consentement éclairé a été obtenu de tous les participants et/ou de leurs tuteurs légaux.
REMARQUE : Maintenez la technique stérile tout au long du protocole. Réchauffez tous les milieux de culture et les solutions à 37 °C avant de les appliquer sur des cellules ou des sphéroïdes. Cultivez des cellules dans un incubateur de CO2 à 37 °C, avec 5 % de CO2 à 80 % d’humidité. Le schéma de protocole est illustré à la figure 1.
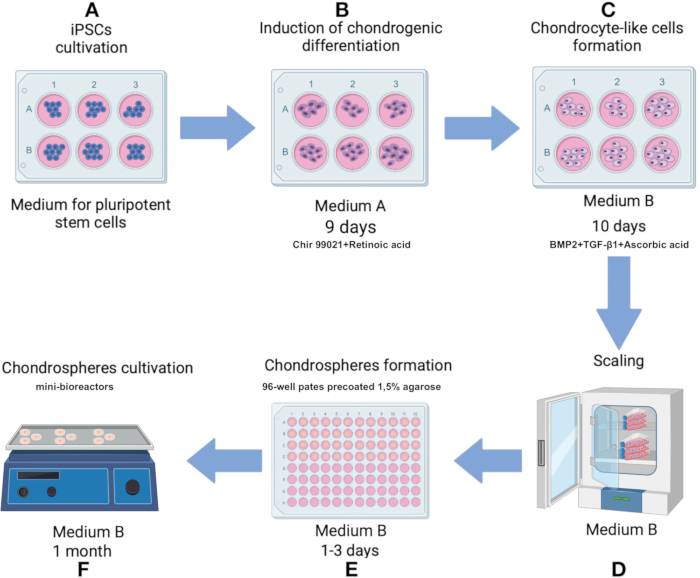
Figure 1 : Protocole de production de chondrosphères à partir de la lignée IPSRG4S d’iPSC. (A) Initialement, les iPSC sont cultivées dans des milieux de cellules souches pluripotentes jusqu’à ce que 80 % de confluence soit atteinte. (B) Pour induire la différenciation vers la lignée chondrocytaire, les iPSC sont ensuite cultivées dans le milieu A pendant 2 jours. Le milieu est ensuite remplacé par une formulation dépourvue de Chir 99021 et d’inhibiteur de la Rho kinase, et les cellules sont cultivées pendant 6 jours supplémentaires avec des changements de milieu tous les 2 jours. (C) Les cellules sont ensuite transférées dans le milieu B pour favoriser la chondrogenèse pendant les 10 jours suivants. (D) Une fois qu’un nombre suffisant de cellules est atteint, le processus passe à l’étape de production des sphéroïdes. (E) Les cellules sont agrégées en sphéroïdes dans des conditions de faible adhérence sous l’effet de la gravité. (F) Les sphéroïdes résultants sont cultivés dans des mini-bioréacteurs avec le milieu B. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Transformation de boîtes de Pétri en mini-bioréacteurs
REMARQUE : Détails dans un article précédent5.
- Coupez les tubes de centrifugation en anneaux de 7 à 8 mm de haut à l’aide de ciseaux d’autoclave stériles (réglages de l’autoclave : 121 °C (250 °F) à 15 psi, 30 min et séchage post-autoclave pendant 20 min).
- Écrasez les boîtes de Pétri à faible adhérence, non traitées ou microbiologiques en petits morceaux. Dissoudre environ 1 g de particules de plastique dans 10 ml de chloroforme pendant la nuit pour créer une solution plastique liquide. Effectuez cette procédure dans une hotte.
- Vérifiez que le plastique liquide est suffisamment visqueux pour le pipetage. Assurez-vous que les gouttelettes conservent une forme sphérique plutôt que de se propager à la surface. Si la solution est trop liquide, ajoutez plus de particules de plastique, nécessitant généralement 1 à 3 g. S’il est trop épais, ajoutez du chloroforme supplémentaire, nécessitant généralement jusqu’à 5 ml.
- Formez un bouton en plastique au centre d’une boîte de Pétri stérile de 60 mm à très faible adhérence en utilisant l’une des deux méthodes efficaces décrites ci-dessous.
- Option 1 : Placez l’anneau en plastique autoclavé au centre de la boîte de Pétri, puis appliquez du plastique liquide à l’intérieur de l’anneau ; une goutte nécessitera environ 100 à 200 gouttes de plastique liquide.
- Option 2 : Appliquez le même nombre de gouttes de plastique liquide directement au centre de la boîte de Pétri sans utiliser l’anneau en plastique.
- Laissez sécher la vaisselle à découvert pendant 2-3 h dans une hotte à flux laminaire. Après séchage, exposez la vaisselle aux rayons ultraviolets pendant 20 à 30 min.
2. Traitement des boîtes de culture avec de la gélatine
- Préparez une solution de gélatine à 0,1 % en dissolvant la gélatine en poudre dans de l’eau distillée à 95 °C. Passez la solution séquentiellement à travers des filtres à membrane de 0,45 μm et 0,25 μm, puis stockez le filtrat à 4 °C.
- Immédiatement avant le réensemencement des chondrocytes, appliquer les 3 mL de solution de gélatine dans la fiole de 25 cm2 (jusqu’à 15 g de tissu cartilagineux par fiole T25 sont recommandés). Incuber à température ambiante (RT) pendant 30 min, retirer la gélatine, rincer deux fois avec du PBS et procéder à l’ensemencement cellulaire.
3. Isolement et culture des chondrocytes
REMARQUE : Les chondrocytes sont isolés dans les régions cartilagineuses non portantes de patients subissant une arthroplastie totale du genou. Prélever tous les échantillons dans des conditions stériles et les conserver dans des tubes stériles remplis de DMEM contenant une solution de pénicilline/streptomycine de 200 U/mL. Conservez le tissu cartilagineux au réfrigérateur à une température de 2 à 8 °C.
- Commencer le traitement enzymatique dans les 2 jours suivant le prélèvement du cartilage. Lavez les morceaux de cartilage dans la solution de Hanks à l’aide de boîtes de Pétri de 60 mm, puis coupez le cartilage en fragments d’environ 1 à 2 mm de diamètre à l’aide de ciseaux autoclavés.
- Transférez les morceaux de cartilage dans des tubes de 15 mL et digérez-les dans une solution de collagénase de type II à 0,01 % dans du DMEM, environ 1 mL pour 1 g de cartilage, en 8 à 12 h dans un incubateur de CO2 réglé à 37 °C avec 5 % de CO2, 100 % d’humidité, sous agitation continue sur un agitateur orbital à 150-200 tr/min.
- Après la digestion, laver les fragments de cartilage en ajoutant du DMEM dans un tube de 15 mL, puis centrifuger à 300 × g pendant 10 min. Remettre les fragments en suspension dans un milieu de culture de chondrocytes (tableau supplémentaire 1) et les semer dans une fiole adhésive T25 pré-enduite d’une solution de gélatine à 0,1 %.
- Passage des chondrocytes lorsqu’une densité confluente de 80 % est atteinte.
- Pour le passage, laver les chondrocytes avec la solution de Hanks, puis incuber les cellules avec une solution de trypsine à 0,25 % à 37 °C pendant 5 min.
- Pour inactiver la trypsine, ajoutez un volume égal de DMEM + 10 % FBS. Remettre les chondrocytes en suspension dans un milieu de culture frais, puis les distribuer dans un rapport de 1:3, en ensemenceant de 20 000 à 30 000 cellules par 1cm2.
- Placez le ballon de culture dans un incubateur à 37 °C avec 5 % de CO2 et 100 % d’humidité.
4. Culture de cellules souches pluripotentes
REMARQUE : En collaboration avec le Laboratoire de cellules souches du Groupe de recherche moléculaire sur le cerveau, Département de neurobiologie, Institut A.I. Virtanen, Université de Finlande orientale, Kuopio, Finlande, une lignée d’iPSC IPSRG4S, a été générée avec succès dans une étude précédente8.
- Cultivez des iPSC dans des plaques à 6 puits pré-enrobées d’une matrice contenant des protéines extracellulaires ( Figure 1A). Utiliser un milieu pour les cellules souches pluripotentes (tableau supplémentaire 1).
- Cellules de passage à 80 % de confluence, en maintenant un rapport de 1:4 (50 000-75 000 cellules par 1cm2). Environ 2 à 3 h avant le détachement, transférer les iPSC dans le milieu pour les cellules souches pluripotentes contenant l’inhibiteur de la Rho kinase Y27632 à une concentration finale de 1 μM pendant 1 jour.
- Laver les iPSC avec la solution de Hanks et incuber à 37 °C avec une solution de trypsine à 0,05 %. Pour inactiver la trypsine, ajoutez un volume égal de DMEM + 10 % FBS. Centrifuger la suspension cellulaire à 200 x g pendant 5 min dans des tubes de 15 mL.
- Jetez le surnageant et remettez les cellules en suspension dans un milieu frais pour les cellules souches pluripotentes. Pour améliorer la viabilité cellulaire, ajoutez l’inhibiteur de la Rho kinase Y27632 au milieu à une concentration finale de 1 μM pendant 1 jour. Placez la plaque de culture dans un incubateur de CO2 réglé à 37 °C avec 5 % de CO2 et 100 % d’humidité.
5. Différenciation chondrogénique des iPSC
- Amorcer la différenciation vers la lignée chondrocytaire en cultivant des cellules dans le milieu A (tableau supplémentaire 1) pendant les 2 premiers jours. Le jour 3, remplacez le milieu A par une solution qui exclut le Chir 99021 et l’inhibiteur de la kinase Rho, tout en gardant tous les autres composants inchangés. Changez de milieu tous les 2 jours du 3e au 9e jour (figure 1B).
- Le 10e jour, transférez les cellules de type chondrocytes vers le milieu B (tableau supplémentaire 1), formulé pour faciliter la chondrogenèse. Changez de support tous les 2 jours pendant 10 jours (Figure 1C).
- Préparez à l’avance une plaque de culture en suspension cellulaire de 96 puits en enrobant chaque puits d’agarose à 1,5 % dans de l’eau distillée. Faites fondre l’agarose au micro-ondes jusqu’à ébullition (environ 60-90 s à 700 W). Une fois l’agarose liquéfié, ajouter 75 μL d’agarose dans chaque puits et laisser durcir à RT (environ 15 min).
- Ajouter 150 μL de milieu DMEM dans chaque puits et incuber la plaque dans un incubateur de CO2 pendant au moins 12 h.
REMARQUE : Les plaques préparées peuvent être stockées jusqu’à 1 mois dans un incubateur de CO2 à 37 °C si le milieu de chaque puits est réapprovisionné pour compenser l’évaporation. - Le 12e jour, après avoir observé les changements phénotypiques associés à la chondrogenèse, initier la formation de sphéroïdes à l’aide des cellules de type chondrocytes générées.
REMARQUE : À ce stade, il est conseillé d’analyser l’expression des marqueurs chondrocytaires clés par immunocytochimie (ICC) et réaction en chaîne par polymérase quantitative (qPCR) en utilisant la méthode 2-ΔΔCT 9 pour confirmer la différenciation chondrogénique réussie des iPSC. Lors du passage d’une plaque à 6 puits à une fiole de culture cellulaire de75 cm 2 , une petite partie des cellules peut être ensemencée dans une plaque à 48 puits, correspondant au nombre de marqueurs à analyser. Effectuez une analyse ICC sur ces échantillons pour vérifier l’expression des gènes.
6. Formation de sphéroïdes à partir de cellules dérivées d’iPSC de type chondrocytes
- Après avoir obtenu des dérivés chondrocytaires, les cellules de passage à 80 % de confluence. Détachez les cellules des plaques à 6 puits à l’aide d’une solution de trypsine à 0,05 %. Pour inactiver la trypsine, ajoutez un volume égal de DMEM + 10 % de FBS, puis transférez les cellules dans un tube de 15 mL et centrifugez à 200 x g pendant 5 min.
- Retirer le surnageant, remettre les cellules en suspension dans 1 mL de milieu B et les transférer dans une fiole de culture cellulaire de75 cm 2 préalablement enduite d’une solution de gélatine à 0,1 % (figure 1D). Une fois que les cellules atteignent 80 % de confluence en tant que monocouche, détachez à nouveau les cellules avec de la trypsine et mettez-les en suspension dans le milieu B comme décrit.
- Transférez les cellules dans une plaque de 96 puits recouverte de 1,5 % d’agarose à une densité de 100 000 cellules par puits. Cultiver dans le milieu B, en ajoutant 150 μL de milieu complet par puits (figures 1D, 3A).
- Maintenir les cellules dans la plaque à 96 puits recouverte d’agarose à 1,5 % pendant au moins 1 jour et au maximum 3 jours jusqu’à ce que des sphéroïdes se forment (figure 2B). Transférez les sphéroïdes des puits à l’aide d’une pointe de pipette de 1 mL avec une extrémité coupée, puis transférez-les dans un tube de 15 mL. Laissez les sphéroïdes se décanter pendant 2-3 minutes et retirez le surnageant.
- Immerger les sphéroïdes dans une solution de matrice de membrane basale fraîchement décongelée et non diluée maintenue à 4 °C. Après 30 min, recueillir les sphéroïdes par sédimentation passive dans un tube de 15 mL ou par centrifugation douce à 100 x g pendant 1 min.
REMARQUE : La matrice doit être décongelée pendant la nuit sur de la glace dans un réfrigérateur de 2 à 8 °C. Après le premier dégel, des aliquotes à usage unique de la matrice sont faites pour éviter les cycles répétés de gel-dégel. Des tubes en polypropylène ou d’autres tubes compatibles avec les congélateurs sont utilisés et stockés à -70 °C ou -20 °C. Faites attention à la date d’expiration du lot, qui est de 2 ans à compter de la date de fabrication. - Transvasez les sphéroïdes dans des mini-bioréacteurs et ajoutez 6 mL de milieu B. Placez le mini-bioréacteur sur un agitateur orbital à l’intérieur d’un incubateur de CO2 réglé à 37 °C avec 5 % de CO2 et 100 % d’humidité et une vitesse d’agitation de 70 à 75 tr/min (figure 1F).
- Changez le milieu chaque semaine ou au besoin par épuisement du milieu ou changement de couleur de l’indicateur acide-base. Pour ce faire, laissez les sphéroïdes se déposer par gravité dans un tube de 15 ml, puis retirez soigneusement le surnageant. Ajoutez du milieu B frais dans le tube et transférez les sphéroïdes dans les mini-bioréacteurs.
Résultats
Le protocole décrit est illustré à la figure 1. Cette méthodologie utilise deux milieux de culture distincts pour favoriser la différenciation des CSPi en sphéroïdes chondrocytaires sur une durée minimale de 1 mois (Figure 2). Le processus de différenciation est lancé lorsque les iPSC atteignent une confluence de 75 % à 90 % (Figure 1B). Les premiers indic...
Discussion
Les iPSC représentent un outil transformateur en médecine régénérative, offrant la possibilité de générer des chondrocytes spécifiques au patient pour la réparation du cartilage. Les protocoles actuels exploitent la différenciation dirigée par les voies mésodermiques, avec des molécules de signalisation clés comme le TGF-β et le BMP-2 favorisant l’engagement de la lignée chondrocytaire. Ces méthodes visent à reproduire le développement du cartilage embryonnaire, per...
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
La recherche a été soutenue par l’allocation #22-15-00250 de la Fondation russe de la science.
matériels
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Références
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267 (2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536 (2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948 (2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987 (2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009 (2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185 (2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806 (2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon