Method Article
Pression atmosphérique imagerie moléculaire des tissus biologiques et biofilms par spectrométrie de masse LAESI
Dans cet article
Résumé
Electrospray ionisation laser ablation (LAESI) est une source d'ions à pression atmosphérique pour la spectrométrie de masse. Dans le mode d'imagerie, une sonde laser à infrarouge moyen des distributions de molécules à travers une section de tissu ou d'un biofilm. Cette technique présente une nouvelle approche pour les diverses études bioanalytiques réalisées dans le cadre natif des conditions expérimentales.
Résumé
Méthodes d'ionisation en spectrométrie de masse ambiante permettre des investigations analytiques pour être effectuée directement sur un tissu ou un biofilm sous-natifs, comme des conditions expérimentales. Electrospray ionisation laser ablation (LAESI) est un tel développement et est particulièrement bien adapté pour l'enquête de l'eau contenant des spécimens. LAESI utilise un faisceau laser dans l'infrarouge moyen (2,94 um de longueur d'onde) pour exciter les molécules d'eau de l'échantillon. Lorsque le seuil d'ablation influence est dépassée, l'échantillon est expulsé sous forme de matières particulaires et ces projectiles de voyage à des dizaines de millimètres au-dessus de la surface de l'échantillon. En LAESI, ce panache d'ablation est intercepté par des gouttelettes hautement chargées de capter une fraction de l'échantillon éjecté et convertir ses constituants chimiques en phase gazeuse des ions. Un spectromètre de masse équipé d'une interface à pression atmosphérique source d'ions est employé pour analyser et enregistrer la composition des ions libérés originaires de la zone sondée (pixel) de l'échantillon. Une interrogation systématique sur un tableau de pixels ouvre une voie pour l'imagerie moléculaire dans le mode analyse à la microsonde. Un aspect unique de l'imagerie par spectrométrie de masse est LAESI profils en profondeur qui, en combinaison avec l'imagerie latérale, permet en trois dimensions (3D) d'imagerie moléculaire. Avec actuelle des résolutions latérales et en profondeur de ~ ~ 100 um et 40 um, respectivement, l'imagerie par spectrométrie de masse LAESI permet d'explorer la structure moléculaire des tissus biologiques. Ici, nous passons en revue les principaux éléments d'un système de LAESI et fournir des directives pour une expérience d'imagerie réussie.
Protocole
Le protocole suivant décrit les principales étapes de l'ionisation électrospray ablation laser (LAESI) expérimenter et fournit des exemples représentatifs des latéraux et en trois dimensions (3D) d'imagerie pour animaux et des échantillons de tissus végétaux. D'autres détails expérimentaux et technique peuvent être obtenus auprès d'ailleurs 1-6.
1. Préparation des tissus et de montage
- Si la coupe est nécessaire, utilisez un cryomicrotome à la section du tissu dans 10 à 100 um d'épaisseur à -10 à -20 ° C, sauf indication recommandée pour un type de tissu particulier.
- Mont sections sur une surface plane (par exemple, chimiquement lame de verre pré-nettoyés) directement, sans modificateurs chimiques. Pour les tissus sectionnés, dégel monter les sections et fixer le support de l'échantillon à une étape de refroidissement Peltier immédiatement après le dégel de montage pour maintenir le tissu congelé en tout temps durant l'analyse. Cette étape est nécessaire pour minimiser / éviter la migration moléculaire dans la section.
- Si nécessaire, utilisez un dissipateur thermique équipé d'un ventilateur de faible puissance pour faciliter l'élimination de la chaleur à partir du stade de Peltier pour maintenir le tissu congelé.
- Dans un environnement humide pendant une période prolongée de temps (1-2 heures), inspecter pour la condensation de l'eau ou de glace sur la surface du tissu. Condensation d'eau sur le tissu affecte négativement les performances d'imagerie dans des expériences LAESI 1.
- Si nécessaire, utilisez un déshumidificateur pièce ou un endroit de l'échantillon refroidi dans une chambre environnementale rempli d'un gaz inerte (par exemple, du gaz azote sec) pour éviter la condensation. 1
2. Optimisation de la source d'ions LAESI
La source d'ions LAESI compose d'un laser infrarouge moyen, une série d'éléments optiques pour la direction légère et se concentrer ainsi que des porte-échantillons supplémentaires, des composants de refroidissement, les étapes de la traduction, et un système de distribution du solvant. La figure 1 montre l'arrangement typique de ces éléments par rapport à l'entrée de la source d'ions à pression atmosphérique d'un spectromètre de masse.
- Comme l'illustre la figure 1, la position de l'échantillon de 15 à 20 mm en dessous de l'orifice du cône d'échantillonnage spectromètre de masse (d ou-PF).
- Fonctionner un laser infrarouge à la mi-longueur d'onde 2,94 um et 10 Hz taux de répétition. Atténuer la sortie du laser à ~ 100 μJ / impulsion d'énergie.
- Utiliser une combinaison de miroirs d'or et une lentille de focalisation transparente à la longueur d'onde laser (par exemple, un plan-convexe CaF 2 ou ZnSe lentille) de coupler l'énergie d'impulsion laser dans l'échantillon à incidence normale (voir l'angle d'incidence droite par rapport à la surface de l'échantillon dans la figure 1).
- Position de la mi-infrarouge axe du faisceau de 5-8 mm de l'avant de l'orifice du cône d'échantillonnage spectromètre de masse.
- Ajustez la position et la lentille de focalisation de l'énergie d'impulsion du faisceau laser pour réaliser l'enlèvement de tissus dans la tache focale. Les dimensions du volume ablation déterminer le pixel (ou voxel dans l'imagerie tridimensionnelle) de taille pour les applications d'imagerie.
- Position d'un émetteur nanospray en ligne avec l'axe d'entrée du spectromètre de masse et à une distance pointe orifice-émetteur d'environ 10 mm (voir figure 1).
- Pour l'électrospray, préparer la solution de méthanol à 50% avec de l'acide acétique à 0,1% ou 0,1% d'additif acétate d'ammonium pour le mode d'ions positifs ou négatifs, respectivement. Selon l'échantillon, d'autres solvants organiques, tels que l'acétonitrile, isopropanol, etc, peut remplacer le méthanol à des concentrations appropriées pour la tâche analytique. La stabilité de l'électrospray est cruciale pour l'imagerie de succès. Selon le choix du solvant, le débit et la tension de pulvérisation doivent être ajustés pour obtenir de pulvérisation stable.
- Pour réactive LAESI 6 dans les applications de l'imagerie, la solution peut contenir electrosprayed réactifs.
- Utiliser une pompe seringue pour fournir la solution d'électronébulisation travers l'émetteur electrospray à un débit d'environ 300 Nl / min.
- Si l'orifice du spectromètre de masse est maintenu à une basse tension (<500 V mesurée par rapport au sol), de générer electrospray en appliquant une tension élevée directement à l'émetteur par électronébulisation (par exemple, 3000 V) ou par un syndicat de la métallurgie. Sinon, sol directement de l'émetteur ou par l'intermédiaire d'électronébulisation syndicat de la métallurgie à établir électrospray.
- Actionner la source électrospray dans le cône de pulvérisation à jet mode pour la génération d'ions les plus efficaces par LAESI. Pour l'effet des variables d'exploitation sur les modes de pulvérisation et leur effet sur les spectres de masse, voir les discussions ailleurs. 5,7,8
- Ajustez soigneusement les distances relatives de la configuration LAESI pour optimiser le rendement LAESI ions tout en gardant le faisceau laser, l'émetteur, et les axes orifice dans le même plan. S'il vous plaît trouver des instructions détaillées ailleurs. 5
- Avec un microscope optique, de déterminer les dimensions latérales du cratère d'ablation de l'échantillon.
- Pour en trois dimensions des expériences d'imagerie LAESI, effectuer l'ablation d'impulsions individuelles et de déterminer la profondeur d'un voxel en utilisant, par exemple, le mode Z-stack en microscopie optique. 3
3. Imagerie moléculaire et l'analyse de données
Dans l'expérience d'imagerie, l'échantillon de tissu est déplacé dans le plan focal du laser dans les directions X et Y avec des tailles de pas plus grand que ou égal à la dimension de la tache de l'ablation. La résolution spatiale est limitée par la focalisation du faisceau laser incident.
- Sélectionnez la zone d'intérêt sur la surface de l'échantillon et d'obtenir les (X, Y) les coordonnées des limites correspondantes.
- Choisissez un algorithme de maillage (par exemple, la grille adaptative, l'imagerie région sélectionnée, grille rectangulaire, motif en spirale, Z numérisation, etc) avec lequel raster surface de l'échantillon avec un certain temps d'arrêt sur chaque pixel sur la zone à imager.
- Utilisez une platine de translation à trois axes et le logiciel qui est capable de tramage de l'échantillon en fonction de la grille préétablie.
- Calculez le temps total nécessaire pour l'imagerie.
- Désactiver le délai d'acquisition des données du spectromètre de masse. Si cela n'est pas possible, fixer le délai d'acquisition de données à la valeur calculée imagerie en temps.
- Démarrer la source laser infrarouge moyen à un taux de répétition correcte de produire suffisamment de signal-bruit dans le spectre de masse dans le temps de séjour à chaque pixel d'effectuer une expérience d'imagerie LAESI latérale. Pour l'imagerie moléculaire en 3D, l'utilisation d'un taux d'acquisition de spectre plus élevé que le taux de redoublement source laser au succès de masse analyser les ions générés au sein d'une seule impulsion laser. Attendez le signal START pour lancer la séquence de l'ablation.
- Allumez la source électrospray. Assurez-vous qu'il ya assez de solution pour le temps plein requis pour l'imagerie.
- Simultanément lancer l'acquisition des spectres de masse, l'ablation laser mi-IR, et le balayage de surface.
- Lorsque l'exécution d'imagerie est terminée, arrêter le balayage de surface, le laser mi-IR, et l'acquisition de données.
- Désactiver la source laser.
- Éteignez la haute tension.
- Eteindre la pompe seringue.
- Régler le spectromètre de masse en mode veille.
- Éteignez l'électronique Peltier-refroidissement.
- Fermer flux de gaz inerte s'il est utilisé.
- Utilisez un logiciel de corréler les coordonnées absolues des pixels de l'imagerie latérale ou les voxels dans l'analyse 3D avec les spectres correspondants.
- Tracer le signal d'intensité d'ions sélectionnés pour une valeur m / z contre les coordonnées absolues d'analyse pour obtenir des images 3D latérale et moléculaire.
4. Les résultats représentatifs
La figure 2 donne des résultats représentatifs pour certains types de tissus majeurs et les modalités d'imagerie. Panel A représente un cas pour une coupe de tissu animal qui a été gelé pendant l'expérience pour éviter la déshydratation. 1 En outre, l'échantillon a été localisé dans un environnement de gaz azote sec pour éviter les vapeurs de l'eau ambiante de condensation sur la surface de l'échantillon. Une section de 100 um d'épaisseur coronale d'un cerveau de rat (Rattus norvegicus) est latéralement imagées avec LAESI. Les régions anatomiques du cerveau (voir image optique dans le panneau A) montrent une bonne corrélation avec l'image moléculaires obtenues pour le PC plasmalogènes (O-33: 3) et / ou PE (O-36: 3) avec m / z 728,559.
Groupe B montre l'imagerie 3D LAESI d'une usine de Zebra (Aphelandra squarrosa) tissus de la feuille. Parce que les feuilles possèdent un mécanisme de défense naturelle contre la déshydratation, l'échantillon pourrait être interrogé dans le milieu ambiant. 3 Les images 3D obtenues moléculaire a révélé une variété de modèles de distribution pour les métabolites primaires et secondaires. Entre autres, acacetin avec m / z 285,076 a été détectée à compte d'ions élevés dans les secteurs de jaune de la deuxième et troisième couches par le haut avec une répartition homogène dans les autres. Cette distribution d'accord avec le modèle de la panachure vu dans l'image optique.

Figure 1. Schéma du système LAESI (ES, pointe émetteur électronébulisation; OU, l'orifice du cône de prélèvement du spectromètre de masse; Floride, la lentille de focalisation; PF, point focal; P, refroidissement par effet Peltier étape; du SH, dissipateur de chaleur). Une partie de la matière particulaire expulsés pendant la mi-IR d'ablation (points rouges) fusionne avec l'electrospray à céder gouttelettes chargées ensemencé avec des molécules et des ions de l'échantillon (points verts). Les ions libérés par ces gouttelettes sont analysés et enregistrés par le spectromètre de masse.
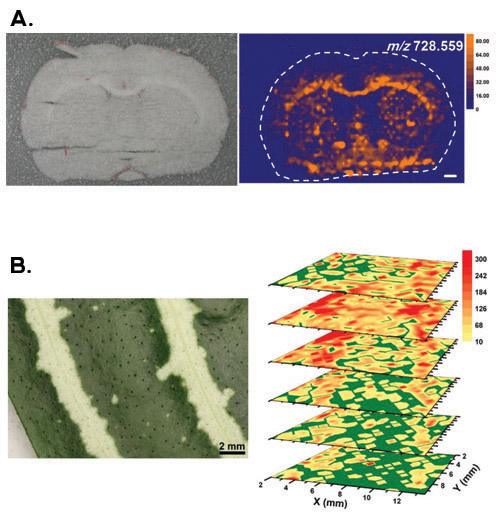
Figure 2. Les résultats représentatifs pour les latérales et 3D imagination. ng avec LAESI spectrométrie de masse (A) Le panneau supérieur représente l'image optique d'un cerveau de rat (Rattus norvegicus) coupe coronale et l'image moléculaires obtenues pour le PC plasmalogènes (O-33: 3) et / ou PE (O-36 : 3) avec m / z 728,559. La barre d'échelle blanche correspond à 1 mm. Adapté avec la permission de (référence 1). Copyright 2010 American Chemical Society. (B) Le panneau du bas montre l'imagerie 3D d'une feuille d'un panaché des plantes Zebra (Aphelandra squarrosa). Acacetin avec m / z 285,076 a été détectée à compte d'ions élevés dans les secteurs de jaune de la deuxième et troisième couches par le haut avec une répartition homogène dans les autres. Reproduit avec la permission de (référence 3). Copyright 2009 American Chemical Society.
Discussion
Différents types de tissus présentent des contenus différents de l'eau et de résistance à la traction, ce qui, à son tour, peut affecter les caractéristiques d'ablation des échantillons. 9 Afin d'atténuer ces effets, il est souhaité que les protocoles de la fluence laser, la manipulation des échantillons et l'analyse seront révisées lors du changement entre types de tissus majeurs.
Pour seule cellule ou d'enquêtes à plus haute résolution, la lumière infrarouge moyen peut être couplée dans une fibre optique aiguisé au lieu d'une lentille de focalisation 10. En positionnant la pointe de la fibre à proximité des cellules sélectionnées dans un tissu, d'analyse LAESI peut être effectuée sur un niveau unicellulaire.
Comme une étiquette sans source d'ions pour la spectrométrie de masse à ionisation ambiante, 11 LAESI a montré un grand potentiel pour l'étude des processus biochimiques dans les tissus. Avec l'avantage supplémentaire d'une analyse directe, d'imagerie latérale et 3D, LAESI est un nouvel outil de bioanalyse pour le profilage ainsi que les applications d'imagerie.
Déclarations de divulgation
Remerciements
Les auteurs sont reconnaissants pour le soutien financier de ce travail par la US National Science Foundation Grant No. 0719232 sous, par le US Department of Energy (DEFG02-01ER15129), et par Protea Biosciences, Inc (Morgantown). Les auteurs souhaitent également remercier Jessica A. Stolee pour son aide lors de l'enregistrement vidéo de ce protocole.
matériels
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Mass spectrometer | Waters Co. (Milford, MA) | Q-TOF Premier | ||
| Mid-IR laser | Opotek Inc. (Carlsbad, CA) | Vibrant IR |
Références
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous Imaging of Small Metabolites and Lipids in Rat Brain Tissues at Atmospheric-Pressure by Laser Ablation Electrospray Ionization Mass Spectrometry. Anal Chem. 82, 982-988 (2010).
- Nemes, P., Vertes, A. Laser ablation electrospray ionization for atmospheric-pressure, in vivo, and imaging mass spectrometry. Anal Chem. 79, 8098-8106 (2007).
- Nemes, P., Barton, A. A., Vertes, A. Three-dimensional imaging of metabolites in tissues under ambient conditions by laser ablation electrospray ionization mass spectrometry. Anal Chem. 81, 6668-6675 (2009).
- Nemes, P., Barton, A. A., Li, Y., Vertes, A. Ambient molecular imaging and depth profiling of live tissue by infrared laser ablation electrospray ionization mass spectrometry. Anal Chem. 80, 4575-4582 (2008).
- Nemes, P., Vertes, A., Nemes, S. S., Rubakhin, J. V. Laser ablation electrospray ionization for atmospheric-pressure molecular imaging mass spectrometry. Mass Spectrometry Imaging. Methods in Molecular Biology. , (2010).
- Shrestha, B. Direct analysis of lipids and small metabolites in mouse brain tissue by AP IR-MALDI and reactive LAESI mass spectrometry. Analyst. 135, 751-758 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal Chem. 79, 3105-3116 (2007).
- Nemes, P., Goyal, S., Vertes, A. Conformational and noncovalent complexation changes in proteins during electrospray ionization. Anal Chem. 80, 387-395 (2008).
- Vertes, A. Molecular imaging by Mid-IR laser ablation mass spectrometry. Appl Phys A-Mater Sci Process. 93, 885-891 (2008).
- Shrestha, B., Vertes, A. In situ metabolic profiling of single cells by laser ablation electrospray ionization mass spectrometry. Anal Chem. 81, 8265-8271 (2009).
- Cooks, R. G., Ouyang, Z., Takats, Z., Wiseman, J. M. Ambient mass spectrometry. Science. 311, 1566-1570 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon