Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode pour l'étiquetage dans les vaisseaux sanguins souris embryonnaires
Dans cet article
Résumé
Cet article décrit une méthode pour l'étiquetage de peau embryonnaire et les vaisseaux sanguins du thymus.
Résumé
La mise en place d'un réseau de vaisseaux sanguins fonctionnelle est une partie essentielle de l'organogenèse, et est requis pour la fonction des organes optimale. Par exemple, dans la formation adéquate vascularisation du thymus et de structuration est indispensable pour l'entrée dans l'organe thymocytes matures et les cellules T de sortie vers la périphérie. La disposition spatiale des vaisseaux sanguins dans le thymus est dépendante des signaux du micro-environnement local, à savoir les cellules épithéliales thymiques (TEC). Plusieurs rapports récents suggèrent que la perturbation de ces résultats signaux dans la cuve 1,2 thymus défauts sang. Des études précédentes ont décrit les techniques utilisées pour étiqueter les 1,2 vascularisation néonatale et adulte du thymus. Nous démontrons ici une technique de marquage des vaisseaux sanguins dans le thymus embryonnaire. Cette méthode combine l'utilisation de FITC-dextran ou Griffonia (Bandeiraea) lectine Simplicifolia I (GSL 1 - isolectine B 4) injections veine faciale et CD31 coloration des anticorps pour identifier les structures vasculaires du thymus et PDGFR-β à l'étiquette du thymus périvasculaire mésenchyme 3-5. L'option d'utiliser cryocoupes ou sections vibratome est également fourni. Ce protocole peut être utilisé pour identifier les défauts du thymus vasculaire, ce qui est essentiel pour définir les rôles des molécules dérivées de TCE dans la formation des vaisseaux sanguins du thymus. Comme la méthode des étiquettes de la vascularisation entier, il peut aussi être utilisée pour analyser les réseaux vasculaires dans de multiples organes et de tissus dans l'embryon, y compris la peau et le cœur 6-10.
Protocole
1. Marqué à la fluorescéine dextrane et GSL I-isolectine B 4 injections veine faciale à l'étiquette vascularisation embryonnaire
- Préparer FITC-dextran (50ug/mL) en tampon phosphate salin (PBS) ou GSL 1 - isolectine B 4 (20ug/200uL) dans du PBS dans un tube Eppendorf de 1,5 ml et chaud à 37 ° C. Ajouter 100 ul de stock 1,25 vert rapide / PBS à la solution de FITC-dextran (volume total 1 ml) et 180uL de stock 1,25 Fast Green / PBS à l'une GSL - isolectine B 4 (200uL volume total), de sorte que la solution est visiblement bleu.
- Disséquer E14.5 E18.5-embryons et le sac vitellin, en laissant le pédoncule allantoïdien (artère ombilicale et la veine) intacte.
- Transfert des embryons à un nouveau plat Petrie (60 X 15 mm) et les plonger dans du PBS à température ambiante.
- Position de l'embryon de fournir une vue sagittale de la tête / le visage. Utiliser la micro pince à disséquer délicatement saisir l'embryon, à la tête.
- Utiliser une aiguille 30G, injecter 50ul FITC-dextran (50ug/mL) ou GSL 1 - isolectine B 4 (20ug de 200uL PBS) dans la veine faciale pointant l'aiguille vers l'arrière de la tête.
- Lorsque le colorant est visible dans la veine ombilicale, retirez l'aiguille et séparer l'embryon de la tige allantoïdien (artère ombilicale et la veine).
- Après injection, permettent de rester dans l'embryon du PBS à température ambiante pendant 2-3 minutes afin que le colorant circule dans tout l'embryon.
2. Whole-Mont d'analyse de la vascularisation cutanée
- Après avoir laissé le colorant de circuler dans tout l'embryon, prélever des échantillons de peau provenant de régions des membres, le dos et l'estomac, etc 8,9.
- Laver la peau de l'échantillon dans du PBS froid, et de fixer à 4% PFA / PBS pendant 2 heures 8,9. Lavez 3 fois pendant 10 minutes dans chacune des 4 ml flacon transparent avec 2 ml de PBS froid.
- Échantillon de peau Placer sur un microscope de diapositives et ajouter 100 l de montage de médias à chaque diapositive et un couvercle en verre.
- Autoriser diapositives à sécher dans un espace de rangement sombre.
- Passez à l'étape la section «Acquisition d'image» 2.
3. Multi-couleur étiquetage du thymus et de la vascularisation du cœur et des cellules périvasculaires cryocoupes (Continuer à partir de la section 1, l'étape 7)
- Embryon de toute «Flash geler» dans l'azote liquide. Les embryons peuvent être conservés et à -80 ° C jusqu'à l'analyse.
- Alternativement, disséquer le thymus, les rincer dans du PBS 4 ° C, et fixer dans 2 ml de paraformaldéhyde à 4% (PFA) / PBS pendant 2 heures. Lavez 3 fois pendant 10 minutes dans du PBS froid, placez thymidine dans les PTOM, et de geler et de stocker jusqu'à utilisation à -80 ° C.
- Pour cryosectioning, répartis dans les PTOM sur «bloquer» une section et monter l'embryon ou les organes disséqués / tissus pour la coupe.
- Couper les tissus congelés en 10 um d'épaisseur et de recueillir des sections sur des lames.
- Fixer des sections dans l'acétone pendant 5-10 minutes. Lavez 3 fois dans le froid du SCT.
- Bloc de 10% de sérum d'âne / SCT dans une chambre humide à température ambiante.
- Incuber pendant 1 heure sections-nuit avec 100 pi d'anticorps primaires dans une chambre humide à 4 ° C: dans cet exemple, nous utilisons rat anti-souris CD31 (1:100) à l'endothélium étiquette, et de chèvre anti-souris PDGFR-β (1:100) pour marquer les cellules périvasculaires. Il est utile pour couvrir les diapositives avec des bandes de Parafilm couper individuellement afin de s'assurer que l'anticorps est réparti uniformément sur toute la section.
- Après incubation avec l'anticorps primaire, se laver les sections 3 fois dans le froid du SCT. Incuber avec 100 pi d'anticorps appropriés secondaire pendant 30 minutes minimum.
- Lavez 3 fois dans le froid du SCT. Ajouter 100 ul de montage des médias à chaque diapositive et un couvercle en verre.
- Autoriser diapositives à sécher dans un espace de rangement sombre.
- Passez à la section «Acquisition d'image».
4. Multi-couleur étiquetage du thymus et de la vascularisation des cellules périvasculaires pour les sections vibratome (Continuer à partir de la section 1, l'étape 7)
- Disséquer les lobes du thymus de l'embryon et les rincer dans du PBS froid.
- Fix thymus dans 4% PFA / PBS à température ambiante pendant 2 heures.
- Laver dans du PBS-Triton X (0,15%) 3 fois, 10 minutes et thymidine place dans une cartouche en plastique petit et plongez dans 4% à faible fondre agarose / PBS (~ 4 ° C). Le thymus doit être en contact avec le fond de la cartouche.
- Autoriser agarose à solidifier sur la glace (3-5 minutes). Utilisez une lame de rasoir pour couper l'excès d'agarose. Ajoutez de la colle sur le bloc vibratome et adhérer au bloc de l'échantillon.
- Ajouter PBS froid à bain d'eau jusqu'à ce vibratome l'échantillon et la lame sont immergés.
- Réglez la vitesse et l'amplitude (amplitude élevée et à faible vitesse modérée est idéal pour les mous sections du thymus). L'amplitude doit être réduite si les articles rupture due à une agitation excessive.
- Coupez 50 sections um.
- Utiliser un pinceau, de recueillir des sections dans une microplaque de 24 puits dans du PBS froid.
- Bloc sections dans 500 pl de sérum d'âne de 10% dans du PBS-Triton X (0,15%) pendant 30 minutes.
- Sections Incuber pendant 8 heures à une nuit avec l'anticorps primaire, comme les anti-CD31 et anti-PDGFR-β, Dans un endroit couvert de 24 puits de microplaques.
- Lavez 3 fois en PBS-Triton X (0,15%) sur un total de 8 heures à 4 ° C.
- Sections de bloc dans le sérum d'âne de 10% dans du PBS-Triton X (0,15%) pendant 30 minutes.
- Incuber sections pendant 8 heures pour une nuit à 4 ° C avec les anticorps appropriés secondaire.
- Lavez 3 fois en PBS-Triton X (0,15%) sur un total de 8 heures à 4 ° C.
- Re-fixer les échantillons dans 4% des PFA / PBS pendant 30 minutes sur la glace.
- Lavez 3 fois en PBS-Triton X (0,15%) de plus de 30 minutes sur la glace.
- Déshydrater les échantillons à travers un gradué MeOH / PBS-Triton série X: 25% de MeOH, MeOH 50%, 75% MeOH, et 100% de MeOH à 10 minutes pour chaque étape. Remplacer MeOH 100% avec MeOH frais après 10 minutes et incuber pendant 1 heure à température ambiante.
- Dans un récipient en verre, mélanger Babb (Benzyl Alcool: Benzyl Benzoate) dans un rapport 1:2. Combinez BABB avec MeOH pour une concentration finale de 50% et BABB MeOH 50%. Incuber l'échantillon à Babb: MeOH pendant 10-15 minutes.
- Transférer l'échantillon dans un récipient en verre à 100% et BABB incuber pendant 10-15 minutes ou jusqu'à ce que dégagé, à température ambiante.
- Remplissez glisser la dépression (0,7 mm de profondeur) avec BABB 100% frais et déguster le transfert vers le côté. Ajouter couvercle en verre (n ° 1.5) et sceller avec 2-3 couches de vernis à ongles. Laisser durcir le vernis à ongles dans le noir à température ambiante, puis stocker l'échantillon à 4 ° C.
Remarque: Les diapositives doivent être complètement scellé avant l'acquisition de l'image confocale. Les images doivent être acquises dans les 12-24 heures, comme des colorants fluorescents peuvent s'estomper à Babb. - Passez à la section «Acquisition d'image».
5. L'acquisition des images
- Image 10 um coupes congelées avec un microscope confocal à l'aide du Plan-Apochromat 20X/0.8 objectif (512 x 512 pixels) avec 488 - (FITC-dextran/GSL 1 - isolectine B 4), 543 -, et des lignes laser 633-nm.
- Acquérir confocale z-sections de la peau monter l'ensemble et 50 um d'agarose-embedded sections en utilisant le Plan-Apochromat 10X/0.4 objectif (512 x 512 pixels) avec 488 - (FITC-dextran/GSL 1 - isolectine B 4), 543 -, et 633 nm lignes laser. Serial Z-sections doivent être prélevés de manière séquentielle au 1-micron pour chaque canal respectif.
- Reconstruire série Z-sections à l'aide Zeiss AxioVision 4.6 ou d'autres logiciels d'analyse d'image.
6. Les résultats représentatifs:
Marquage efficace de la vascularisation embryonnaire, est essentielle pour évaluer les défauts des vaisseaux sanguins chez des souris embryonnaire. La figure 1 montre un marquage spécifique des vaisseaux sanguins E16.5 thymus (1A-B) et co-marquage avec CD31 (1B), en plus de la coloration des ventricules droit et gauche (1E-F), respectivement. Le GSL I-B 4 isolectine protocole pour cryocoupes comme décrit dans les sections 1, 3 et 5 a été utilisée dans ces expériences. Whole-Mont étiquetage du réseau vaisseau sanguin cutané sur la souris E16.5, en utilisant les protocoles décrits dans les sections 1, 2 et 5 est représentée à la figure 1C-D.
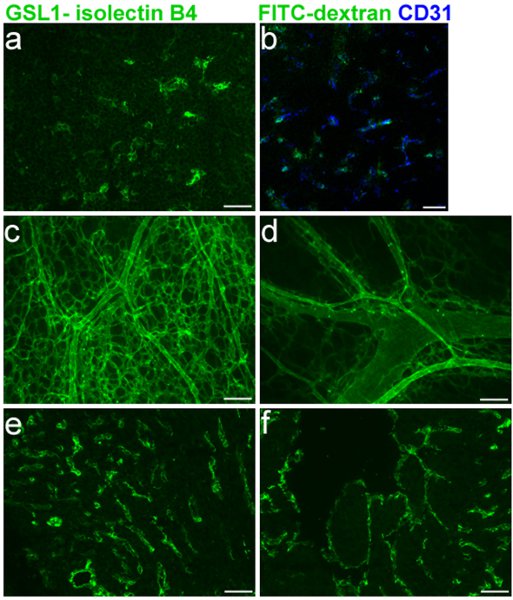
Figure 1 Légende. FITC GSL I - isolectine B 4 injections veine faciale dans E16.5 embryons de souris. a. Cryosection du thymus embryonnaire suivant l'injection. b. Fusion de CD31 co-marquage avec isolectine B 4. C. et D. entiers de montage de l'injection de la peau vascularisation embryonnaire suivant. e. et f. Cryosection d'embryon coeur e. (à droite ventricule) f. (ventricule gauche) après l'injection.
Discussion
Whole-monter et PECAM-1 (CD31) sur la coloration des sections sont les méthodes classiques pour l'étiquetage de la vascularisation de souris embryonnaires. Ces méthodes nécessitent l'utilisation d'immunofluorescence directe et / ou indirects, et des détergents pour perméabiliser les tissus de la souris. Cela s'avère un processus plutôt rapide. Ici, nous avons employé FITC-dextran ou isolectine B 4 injections veine faciale pour marquer directement la vascularisation embryonnaire, élim...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par numéros de subvention et de R01AI055001 R01AI082127 du NIAID à la GRN et le Prix SREB bourse de thèse à JLB.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| FITC-dextran | Sigma | FD150S-1G | |
| Marqué à la fluorescéine GSL 1 - isolectine B 4 | Vector Laboratories | FL-1201 | |
| Fast Green | MP Biomédical | 195178 | |
| PFA | Fluka | 76240 | |
| Sérum de veau fœtal | Atlanta Biologicals | S11550 | |
| Optimal composé température de coupe (PTOM | VWR | 25608-930 | |
| L'acétone | JT Baker | 9006-33 | |
| Sérum âne | Jackson | 017-000-121 | |
| rat anti-souris CD31, | BD Pharmingen | 558736 | |
| chèvre anti-souris PDGFR-β | R & D Systems | AF1042 | |
| d'âne anti-CD31 de rat Alexa 647 (Invitrogen) | Biolegend | 102516 | |
| d'âne anti-chèvre Alexa 594 (Invitrogen) | Invitrogen | A11058 | |
| Triton X -100 | Sigma-Aldrich | X-100 | |
| Low Melt agarose / PBS | Sigma-Aldrich | A9414-25G | |
| Méthanol | Fisher Scientific | A413-4 | |
| Alcool benzylique | Acros scientifique | 148390010 | |
| Benzoate de benzyle | Acros scientifique | 105860010 | |
| Dépression diapositives | Fisher Scientific | S175201 | |
| Fluorogel | Sciences Electron Microscopy | 17985-10 | |
| Couverture en verre (22x22) -1,5 | Thermo Scientific | 152222 | |
| Zeiss LSM 510 Meta microscope confocal | Zeiss | ||
| Micro pince à disséquer | Roboz | RS-5135 | |
| Parafilm n ° OM992 | Fisher Scientific | 13-374-16 | |
| 12 et 24 ainsi microplaques | Evergreen Scientific | 222-8044-01F | |
| Lames de microscope Superfrost / Plus | Fisher Scientific | 12-550-15 | |
| 4mL flacons clairs | Scientifique national | B7800-2 |
Références
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon