JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
배아 마우스에 Vasculature을 라벨링하는 방법
요약
이 문서는 배아 피부와 thymus 혈관을 라벨에 대한 방법을 설명합니다.
초록
기능성 혈관 네트워크의 설립 organogenesis의 필수적인 부분이며, 최적의 장기의 기능이 필요합니다. 예를 들어, thymus 적절한 vasculature 형성과 patterning에있는 기관 및 주변에 성숙한 T 세포 출구로 thymocyte 입학 필수적입니다. thymus에서 혈관의 공간적 배열은 로컬 microenvironment의 신호, 즉 상피 세포 thymic (TEC)에 의존적일 수 밖에 없습니다. 몇 가지 최근의 보고서는 thymus 혈관 결함 1,2에서 이러한 신호 결과의 중단을 제안한다. 이전 연구는 신생아와 성인의 thymus vasculature 1,2 레이블을하는 데 사용되는 기술을 설명합니다. 우리는 여기서 배아 thymus에서 혈관을 라벨에 대한 기술을 보여줍니다. 이 방법은 FITC - dextran 또는 Griffonia (Bandeiraea) Simplicifolia 렉틴 I (GSL 1 - isolectin B 4)의 사용을 결합한 얼굴 정맥 주사 및 CD31 항체 얼룩 thymus 혈관 구조와 thymic perivascular mesenchyme 3-5 라벨 PDGFR - β를 식별할 수 있습니다. cryosections 또는 vibratome 섹션을 사용할 수있는 옵션도 제공됩니다. 이 프로토콜은 thymus 혈관 형성에 TEC - 파생 분자의 역할을 정의하는 것이 중요합니다 thymus 혈관 결함을 식별하는 데 사용할 수 있습니다. 방법은 전체 vasculature를 레이블로, 그것은 또한 피부와 마음 60-10 포함한 배아에 걸쳐 여러 기관과 조직에 혈관 네트워크를 분석하는 데 사용할 수 있습니다.
프로토콜
1. 플루오레신는 dextran과 GSL I - isolectin B 네 얼굴 정맥 주사가 배아 vasculature를 라벨에 표시
- isolectin B 1.5mL Eppendorf 튜브에 PBS에서 4 (20ug/200uL) 37에 따뜻한 ° C. - 인산에 FITC - dextran (50ug/mL)를 준비 식염수 (PBS) 또는 GSL 1 버퍼 그린 / PBS GSL 1 FITC - dextran 솔루션 (총 볼륨 1mL) 및 주식 1.25mM 빨리 180uL 주식 1.25mM 빠른 그린 / PBS의 100uL 추가 - isolectin 솔루션은되도록 B 4 (총 볼륨 200uL) 눈에 파란색.
- allantoic 스토킹 (제대 동맥과 정맥)은 그대로두고, 함께 E14.5 - E18.5 배아와 난황을 해부하다.
- 새로운 petrie 요리 (60 X 15mm)로 배아를 전송하고 실온에서 PBS에 젖어.
- 머리 / 얼굴의 화살보기를 제공하기 위해 배아를 놓습니다. 부드럽게 머리에있는 배아를 파악하기 위해 마이크로 해부 집게를 사용하십시오.
- 30G 바늘을 사용 50uL FITC - dextran (50ug/mL) 또는 GSL 1 삽입 - isolectin B 4 (200uL PBS에서 20ug)를 머리 뒤쪽 방향으로 바늘을 가리키는 얼굴 정맥에.
- 염료가 제대 정맥에서 볼 때, 바늘을 제거하고 allantoic 스토킹 (제대 동맥과 정맥)에서 배아를 구분한다.
- 주사 다음, 배아는 염료가 배아를 통해 순환되도록 2~3분에 대한 실온에서 PBS에 남아있을 수 있습니다.
2. 피부 vasculature 전체 마운트 분석
- 염료는 배아에 걸쳐 순환 수 있도록 후, 다시, 사지의 지역에서 피부 샘플을 제거하고 복부 등 8,9.
- 차가운 PBS의 피부 샘플을 씻고, 그리고 이시간 8,9에 대한 4% PFA / PBS에 수정. 십분 2mL 차가운 PBS로 4mL 명확 약병에 각각에 대해 3 번 씻으십시오.
- 현미경에 놓습니다 스킨 샘플 100 각 슬라이드에 미디어를 장착의 μl와 커버 유리 슬라이드 및 추가합니다.
- 슬라이드는 어두운 저장 영역에서 건조하도록 허용합니다.
- 2 '이미지 수집'섹션 단계로 진행합니다.
3. thymus와 심장 vasculature 및 cryosections에 대한 perivascular 세포의 멀티 컬러 라벨은 (제 1, 7 단계에서 계속)
- 액체 질소에서 '플래시 프리즈'전체 배아. 공룡의 태아가되며 -80 ° C에서 분석까지 저장할 수 있습니다.
- 또는, thymus을 해부하다 4 ° C PBS로 씻어, 2 시간 동안 2mL 4 % Paraformaldehyde (PFA) / PBS에 수정. -80에서 사용 ° C. 때까지 차가운 PBS, 10에서 개최 thymi하고, 동결 및 상점에서 10 분 동안 3 번 씻으십시오
- cryosectioning 들어, 섹션에서 '블록'에 OCT를 확산하고 sectioning에 대한 배아 또는 해부 기관 / 티슈를 탑재합니다.
- 10 μm의 두께는 섹션으로 냉동 조직을 잘라 슬라이드에 수집합니다.
- 50~10분위한 아세톤의 섹션을 수정. 추운 TBS에서 3 번 씻으십시오.
- 실온에서 습도 챔버에서 10 % 당나귀 혈청 / TBS에 차단합니다.
- 4 습도 챔버의 주요 항체 100 μl 1 1 시간 하루에 대한 섹션을 품어 ° C : 예제에서, 우리는 쥐의 반 마우스 CD31 (1:100) 라벨 내피하고, 염소 반 마우스 PDGFR - β를 사용하여 (1:100) perivascular 세포를 분류합니다. 이것은 항체가 균일 섹션에 걸쳐 확산되도록하기 위해 개별적으로 절단 Parafilm 스트립과 함께 슬라이드를 커버하는 데 유용합니다.
- 주요 항체와 부화 다음, 차가운 TBS에서 섹션에게 3 회 씻는다. 최소 30 분 적절한 보조 항체의 100 μl로 품어.
- 추운 TBS에서 3 번 씻으십시오. 100 각 슬라이드에 미디어를 장착의 μl와 덮개 유리를 추가합니다.
- 슬라이드는 어두운 저장 영역에서 건조하도록 허용합니다.
- '이미지 수집'섹션을 참조하십시오.
4. thymus vasculature 및 vibratome 섹션에 대한 perivascular 세포의 멀티 컬러 라벨은 (제 1, 7 단계에서 계속)
- 배아로부터 thymus 엽 (叶)을 해부하다 차가운 PBS로 린스.
- 2 시간 동안 실온에서 4% PFA / PBS에 thymus을 수정.
- 용융 낮은 4%의 작은 플라스틱 카트리지와 잠수함의 PBS - 트리톤 X (0.15 %) 3 시간, 10 분 장소 thymi에 씻으 아가로 오스 / PBS (~ 4 ° C). thymus은 카트리지의 하단에 접촉해야합니다.
- 아가로 오스는 얼음 (3~5분)에 응고 수 있습니다. 초과 아가로 오스를 잘라하기 위해 면도날을 사용합니다. vibratome 블록에 접착제를 추가하고 차단하는 샘플을 준수합니다.
- 샘플 및 블레이드가 포장되어 때까지 vibratome 물을 욕조에 차가운 PBS를 추가합니다.
- 속도와 진폭을 (높은 진폭과 낮은 중간 속도 소프트 thymus 섹션에 이상적입니다) 설정합니다. 섹션 초과 교반으로 인해 헤어질 경우 진폭은 감소한다.
- 50 음 섹션을 잘라 버릴거야.
- 붓을를 사용 차가운 PBS에 24 잘 microplate에 섹션을 수집합니다.
- 30 분 동안 PBS - 트리톤 X에서 10 % 당나귀 혈청 (0.15 %) 500 μl의 블록 섹션.
- 같은 차 항체와 함께 하루를 8 시간에 대해 품어 섹션 안티 CD31 및 안티 - PDGFR - β, 대상 24 잘 microplate 인치
- 4 8 시간 총 ° C.여 PBS - 트리톤 X 3 회 (0.15 %)를 씻으십시오
- 30 분 동안 PBS - 트리톤 X에서 10 % 당나귀 혈청 (0.15 %)에서 블록 섹션.
- 4 ° C와 함께 적절한 보조 항체에 하루에 8 시간 섹션을 품어.
- 4 8 시간 총 ° C.여 PBS - 트리톤 X 3 회 (0.15 %)를 씻으십시오
- 다시 수정 샘플 4%에 PFA / 얼음에 30 분 PBS.
- 얼음 30 분 이상의 PBS - 트리톤 X 3 회 (0.15 %)를 씻으십시오.
- 25% MeOH, 50 % MeOH, 75 % MeOH, 각 단계를위한 10 분 100 % MeOH : 등급 MeOH / PBS - 트리톤 X 시리즈를 통해 샘플을 탈수. 십분 후에 신선한 MeOH로 100 % MeOH를 교체하고 실온에서 1 시간 품어.
- 유리 용기에서 혼합 BABB (벤질 알코올 : 벤질 벤조 산) 1시 2분 비율 인치 50 % BABB와 50 % MeOH의 최종 농도에 대한 MeOH와 BABB을 결합합니다. 10-15분에 대한 MeOH : BABB에서 샘플을 품어.
- 상온에서, 10-15 분 또는 정리 할때까지 백퍼센트 BABB과 부화로 유리 용기 샘플을 전송합니다.
- 측면으로 신선한 100 % BABB 및 전송 샘플과 우울증 슬라이드 (0.7mm 깊이)를 입력합니다. 매니큐어로부터 2-3 코트와 유리 (제 1.5) 및 인감을 커버 추가합니다. 상온에서 어둠의 강화 매니큐어가 손톱 허용 후 4 샘플을 저장 ° C.
참고 : 슬라이드가 완전히 공촛점 이미지 수집하기 전에 봉인해야합니다. 형광 염료가 BABB에 페이드 수있는 이미지는 12~24시간 이내에 취득해야합니다. - '이미지 수집'섹션을 참조하십시오.
5. 이미지 수집
- 이미지 10 488과 계획 - 고차 색지움 20X/0.8 목표를 (512 X 512 픽셀)를 사용 공촛점 현미경으로 μm의 냉동 섹션 - (FITC-dextran/GSL 1 - B 사 isolectin), 543 -, 그리고 633 - NM 레이저 라인.
- 공촛점 취득 전체 마운트 피부 및 50 μm의 488과 계획 - 고차 색지움 10X/0.4 목표를 (512 X 512 픽셀)를 사용하여 아가로 오스 - 임베디드 섹션의 Z - 섹션 - (FITC-dextran/GSL 1 - B 사 isolectin), 543 - 와 633 - nm의 레이저 라인. 시리얼 Z - 부분은 각 각 채널에 대해 1 미크론에서 순차적으로 수령해야합니다.
- 자이스 혈구 Axiovision 4.6이나 기타 이미지 분석 소프트웨어를 사용하여 Z - 섹션을 직렬 재구성.
6. 대표 결과 :
배아 vasculature의 효율적인 라벨링은 배아 생쥐에서 혈관 결함을 평가하기위한 중요합니다. 그림 1은 각각 좌우 심실의 얼룩 (1E - F) 이외에 E16.5 thymus 혈관 (1A - B)와 CD31 (1B)와 함께 공동 상표, 특정 라벨을 보여줍니다. GSL I - isolectin B와 같은 섹션 1, 3, 5에 설명된 cryosections 4 프로토콜은 이러한 실험에 사용되었다. 전체 마운트 E16.5 생쥐의 피부 혈관 네트워크의 레이블, 섹션 1, 2에서 설명된 프로토콜을 사용하여, 5은 그림 1C - D에 표시됩니다.
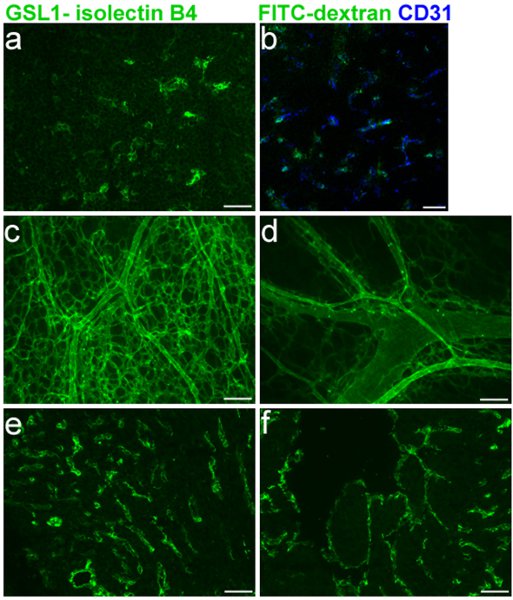
한 전설을 그림. FITC GSL I - E16.5 마우스 배아에 isolectin B 네 얼굴 정맥 주사. 배아 피부 vasculature 다음 주입의 주입 다음 배아 thymus의 A.의 Cryosection. isolectin B 4 CD31 공동 상표의 B. 병합합니다. C.와 D. 전체 마운트. E. 및 배아 심장의 E. F.의 Cryosection (오른쪽 뇌실) F. (뇌실 왼쪽) 다음과 같은 분사.
토론
섹션에서 전체 마운트 및 PECAM - 1 (CD31) 얼룩은 배아 생쥐에서 vasculature을 라벨에 대한 종래의 방법입니다. 이 방법은 직접 및 / 또는 간접 immunofluorescence와 마우스 조직을 permeabilize하기 위해 세제의 사용을 필요로합니다. 이것은 다소 적시에 처리하는 증명한다. 여기, 우리는 FITC - dextran 또는 isolectin B 사 안면 정맥 주사 직접함으로써 항체 라벨 단계에 대한 요구를 제거, 배아 vasculature 레이?...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 NIAID에서 NRM 및 JLB에 SREB의 논문의 화목 상을 부여하는 번호 R01AI055001 및 R01AI082127 지원했다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
|---|---|---|---|
| FITC - dextran | 시그마 | FD150S - 1G | |
| isolectin B 4 - 플루오레신는 GSL 1 분류 | 벡터 연구소 | FL - 1201 | |
| 빠른 그린 | MP의 Biomedicals | 195,178 | |
| PFA | Fluka | 76,240 | |
| 태아 소 혈청 | 애틀랜타 체액 | S11550 | |
| 최적의 절삭 온도 컴파 운드 (OCT | VWR | 25608-930 | |
| 아세톤 | JT 베이커 | 9006-33 | |
| 당나귀 세럼 | 잭슨 | 017-000-121 | |
| 쥐 방지 마우스 CD31, | BD Pharmingen | 558,736 | |
| 염소 안티 마우스 PDGFR - β | R & D 시스템 | AF1042 | |
| 당나귀 안티 쥐 CD31 알렉사 647 (Invitrogen) | Biolegend | 102,516 | |
| 당나귀 안티 염소 알렉사 594 (Invitrogen) | Invitrogen | A11058 | |
| 트리톤 X -100 | 시그마 - 올드 리치 | X - 100 | |
| 낮은 용융 아가로 오스 / PBS | 시그마 - 올드 리치 | A9414 - 25G | |
| 메탄올 | 피셔 과학 | A413 - 4 | |
| 벤질 알코올 | Acros 과학 | 148,390,010 | |
| 벤질 벤조 산 | Acros 과학 | 105,860,010 | |
| 우울증 슬라이드 | 피셔 과학 | S175201 | |
| Fluorogel | 전자 현미경 과학 | 17985-10 | |
| 커버 유리 (22X22) -1.5 | 써모 과학 | 152,222 | |
| 자이스 혈구 LSM 510 메타 공촛점 현미경 | 자이스 혈구 | ||
| 마이크로 해부 포셉 | Roboz | RS - 5135 | |
| Parafilm 번호 OM992 | 피셔 과학 | 13-374-16 | |
| 12 24 잘 microplates | 에버그린 과학 | 222-8044 - 01F | |
| Superfrost / 플러스 현미경 슬라이드 | 피셔 과학 | 12-550-15 | |
| 4mL 맑은 튜브 | 국립 과학 | B7800 - 2 |
참고문헌
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유