É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método para Etiquetagem Vascularização no embrião do rato
Neste Artigo
Resumo
Este artigo descreve um método para a rotulagem de pele embrionária e vasos sanguíneos do timo.
Resumo
O estabelecimento de uma rede funcional dos vasos sanguíneos é uma parte essencial da organogênese, e é necessário para a função do órgão ideal. Por exemplo, na formação adequada vascularização do timo e padronização é essencial para a entrada timócito no órgão e saída de células T maduras para a periferia. O arranjo espacial dos vasos sanguíneos no timo é dependente de sinais a partir do microambiente local, ou seja, células epiteliais tímicas (TEC). Vários relatórios recentes sugerem que a interrupção desses resultados no timo sinais de sangue 1,2 defeitos navio. Estudos anteriores descreveram técnicas usadas para rotular os 1,2 vasculatura neonatal e adulto timo. Nós demonstramos aqui uma técnica para a rotulagem dos vasos sanguíneos no timo embrionárias. Este método combina o uso de FITC-dextran ou Griffonia (Bandeiraea) Simplicifolia Lectina I (GSL 1 - isolectin B 4) injeções veia facial e coloração de anticorpos CD31 para identificar timo estruturas vasculares e PDGFR-β para rotular tímica perivascular mesênquima 3-5. A opção de usar ou seções criosecções vibratome também é fornecido. Este protocolo pode ser usado para identificar defeitos do timo vascular, que é crítico para a definição dos papéis dos TEC derivadas moléculas na formação do timo dos vasos sanguíneos. Como o método de rótulos toda a vasculatura, ele também pode ser usado para analisar as redes vascular em vários órgãos e tecidos em todo o embrião, incluindo pele e do coração 60-10.
Protocolo
1. Fluoresceína rotulados dextran e GSL I-isolectin B 4 injeções veia facial para rotular vasculatura embrionárias
- Prepare FITC-dextran (50ug/mL) em tampão fosfato salino (PBS) ou GSL 1 - isolectin B 4 (20ug/200uL) em PBS em um tubo Eppendorf 1,5 ml e aquecer a 37 ° C. Adicionar 100uL de estoque 1,25 mM Fast Green / PBS para a solução FITC-dextran (volume total de 1ml) e 180uL de estoque 1,25 mM Fast Green / PBS a um GSL - isolectin B 4 (200uL volume total), de modo que a solução é visivelmente azul.
- E14.5-E18.5 dissecar embriões e saco vitelino juntos, deixando o talo alantóide (artéria e veia umbilical) intacta.
- Transferência de embriões para um prato novo Petrie (60 X 15 mm) e mergulha-as na PBS em temperatura ambiente.
- Posição do embrião para fornecer uma visão sagital da cabeça / face. Use uma pinça de dissecação micro suavemente para entender o embrião na cabeça.
- Usando uma agulha 30G, injetar 50uL FITC-dextran (50ug/mL) ou GSL 1 - isolectin B 4 (20ug em 200uL PBS) na veia facial apontando a agulha para a parte traseira da cabeça.
- Quando a tintura é visível na veia umbilical, retire a agulha e separar o embrião do talo alantóide (artéria e veia umbilical).
- Após as injeções, permitem embrião permanecer em PBS à temperatura ambiente por 2-3 minutos para que o corante circula por todo o embrião.
2. Todo-mount análise da vascularização da pele
- Depois de permitir que o corante para circular por todo o embrião, retire amostras de pele das regiões dos membros, costas e estômago, etc 8,9.
- Lavar amostra de pele no frio PBS, e fixar em 4% PFA / PBS por 2 horas 8,9. Lavar 3 vezes durante 10 minutos cada, em frasco com 2 ml clara 4mL frio PBS.
- Colocar a amostra de pele em um microscópio de slides e adicione 100 ml de montagem de mídia para cada slide e uma tampa de vidro.
- Permitir slides para secar em uma área de armazenamento.
- Vá para a Etapa seção "Aquisição de Imagem" 2.
3. Multi-cor rotulagem de timo e vascularização do coração e células perivascular para criosecções (Continue da Seção 1, Passo 7)
- Embrião 'Flash congelar "todo em nitrogênio líquido. Embriões podem ser e armazenadas a -80 ° C até a análise.
- Alternativamente, dissecar timo, enxágüe em 4 ° C PBS, e fixar em 2 mL paraformaldeído 4% (PFA) / PBS por 2 horas. Lavar 3 vezes durante 10 minutos no frio PBS, thymi lugar em outubro, e congelar e armazenar até usar a -80 ° C.
- Para cryosectioning, espalhados em outubro 'block' uma seção e montar o embrião ou órgãos dissecados / tecidos para corte.
- Corte de tecido congelado em 10 mM de espessura e recolher em slides.
- Fix seções em acetona por 5-10 minutos. Lavar 3 vezes em TBS frio.
- Bloco em 10% de soro de burro / TBS em uma câmara de umidade em temperatura ambiente.
- Incubar seções de 1 hora durante a noite com 100 ul de anticorpos primários em câmara úmida a 4 ° C: neste exemplo, usamos ratos anti-rato-CD31 (1:100) ao endotélio rótulo, e de cabra anti-rato PDGFR β- (1:100) para rotular as células perivascular. É útil para cobrir slides com tiras cortadas individualmente Parafilm para garantir que o anticorpo é uniformemente distribuídos em toda a seção.
- Após a incubação com o anticorpo primário, lave seções 3 vezes em TBS frio. Incube com 100 ul de anticorpos secundários apropriada por 30 minutos mínimo.
- Lavar 3 vezes em TBS frio. Adicione 100 ml de montagem de mídia para cada slide e uma tampa de vidro.
- Permitir slides para secar em uma área de armazenamento.
- Vá para a seção "Aquisição de Imagem".
4. Multi-cor rotulagem de timo vascularização e células perivascular para seções vibratome (Continue da Seção 1, Passo 7)
- Dissecar lobos do timo, do embrião e enxaguar em água fria PBS.
- Fix timo em 4% PFA / PBS em temperatura ambiente por 2 horas.
- Lavar em PBS-Triton X (0,15%) 3 vezes, 10 minutos e thymi lugar em um cartucho de plástico pequeno e submergir em 4% baixo derreter agarose / PBS (~ 4 ° C). Timo deve estar em contato com a parte inferior do cartucho.
- Permitir agarose para solidificar em gelo (3-5 minutos). Use uma lâmina de barbear para cortar o excesso de agarose. Adicionar cola no bloco vibratome e aderir ao bloco de amostra.
- Adicionar frio PBS para vibratome banho-maria até que a amostra ea lâmina estão imersos.
- Definir a velocidade e amplitude (amplitude de alta e baixa velocidade moderada é ideal para o soft seções timo). A amplitude deve ser reduzida se as seções quebrar devido à agitação em excesso.
- Corte de 50 seções um.
- Usando um pincel, recolher seções em uma microplaca de 24 poços no frio PBS.
- Seções de bloco em 500 l de soro de burro de 10% em PBS-Triton X (0,15%) por 30 minutos.
- Seções incubar por 8 horas durante a noite com o anticorpo primário, tais como anti-CD31 e anti-PDGFR-β, Em uma coberta de microplacas de 24 poços.
- Lavar 3 vezes em PBS-Triton X (0,15%) sobre um total de 8 horas a 4 ° C.
- Seções de bloco no soro de burro de 10% em PBS-Triton X (0,15%) por 30 minutos.
- Incubar seções de oito horas durante a noite a 4 ° C com anticorpos secundários apropriado.
- Lavar 3 vezes em PBS-Triton X (0,15%) sobre um total de 8 horas a 4 ° C.
- Re-fix amostras em PFA 4% / PBS por 30 minutos no gelo.
- Lavar 3 vezes em PBS-Triton X (0,15%) mais de 30 minutos no gelo.
- Desidratar as amostras através de um classificado MeOH / PBS-Triton X série: 25% MeOH, MeOH 50%, 75% MeOH, MeOH e 100% menos 10 minutos para cada etapa. Substituir MeOH 100% com MeOH fresco depois de 10 minutos e incubar por 1 hora em temperatura ambiente.
- Em um recipiente de vidro, misture Babb (Benzyl Álcool: benzoato de benzila) em uma proporção de 1:2. Combine Babb com MeOH para uma concentração final de Babb 50% e MeOH 50%. Incubar a amostra em Babb: MeOH por 10-15 minutos.
- Transferência da amostra para um recipiente de vidro com 100% de Babb e incubar por 10-15 minutos ou até eliminado, em temperatura ambiente.
- Preencha deslize depressão (0,7 milímetros de profundidade) com Babb 100% frescos e de transferência de amostra para o lado. Adicionar tampa de vidro (n º 1.5) e selar com 2-3 camadas de unha polonês. Permitir unha polonês para endurecer no escuro à temperatura ambiente, em seguida, armazenar amostras a 4 ° C.
Nota: Os slides devem ser completamente selados antes da aquisição da imagem confocal. As imagens devem ser adquiridas dentro de 12-24 horas, como corantes fluorescentes podem desaparecer em Babb. - Vá para a seção "Aquisição de Imagem".
5. Aquisição de imagem
- Imagem 10 mM cortes congelados com um microscópio confocal utilizando o Plano de Apochromat-20X/0.8 objetivo (512 X 512 pixels) com 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 -, e as linhas 633-nm laser.
- Adquirir confocal z-seções da pele montagem inteira e 50 mm de agarose-embedded seções usando o Plano Apochromat-10X/0.4 objetivo (512 X 512 pixels) com 488 - (FITC-dextran/GSL 1 - isolectin B 4), 543 -, e 633 nm linhas laser. Série Z-seções devem ser coletadas sequencialmente em 1-micron para cada respectivo canal.
- Reconstruir série Z-seções usando Zeiss Axiovision 4.6 ou software de análise de imagem.
6. Resultados representativos:
Rotulagem eficiente da vasculatura embrionárias é fundamental para avaliar os defeitos dos vasos sanguíneos em ratos embrionárias. A Figura 1 mostra a rotulagem específica de E16.5 vasos sanguíneos timo (1A-B) e co-rotulagem com CD31 (1B), além da coloração dos ventrículos direito e esquerdo (1E-F), respectivamente. A GSL I-B 4 isolectin protocolo para criosecções conforme descrito nas seções 1, 3 e 5 foi usado nesses experimentos. Todo-mount rotulagem da rede navio pele sangue em ratos E16.5, utilizando os protocolos descritos nos pontos 1, 2 e 5 é mostrado na Figura 1C-D.
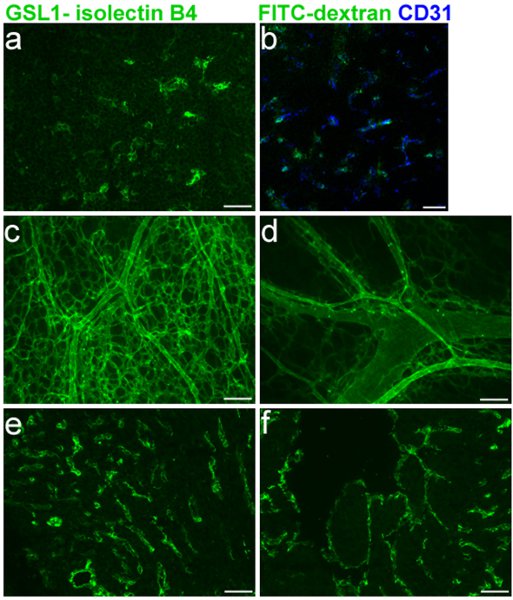
Figura 1 Legend. FITC GSL I - isolectin B 4 injeções em veia facial E16.5 embriões de camundongos. a. Cryosection do timo embrionárias após a injecção. b. direta de CD31 co-rotulagem com B isolectin 4. c. e d. Whole-mount da injeção embrionárias da pele vasculatura seguinte. e. e f. Cryosection embrionárias de coração e. (à direita ventrículo) f. (ventrículo esquerdo) após a injecção.
Discussão
Todo o monte e PECAM-1 (CD31) coloração em cortes são os métodos convencionais para a rotulagem da vasculatura embrionárias em camundongos. Estes métodos requerem o uso de imunofluorescência direta e / ou indireta, e detergentes para permeabilizar o tecido mouse. Isso prova a ser um processo bastante oportuna. Aqui, nós empregamos FITC-dextran ou isolectin B 4 injeções veia facial diretamente rótulo a vasculatura embrionárias, eliminando a exigência de rotulagem passos de anticorpos. Além disso,...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi apoiado por números conceder R01AI055001 e R01AI082127 de NIAID a NRM e Award Fellowship SREB Dissertação de JLB.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
|---|---|---|---|
| FITC-dextran | Sigma | FD150S-1G | |
| Fluoresceína rotulados GSL 1 - B isolectin 4 | Vector Laboratories | FL-1201 | |
| Verde rápido | Biomedicals MP | 195178 | |
| PFA | Fluka | 76240 | |
| Soro fetal bovino | Atlanta Biologicals | S11550 | |
| Composto Temperatura ideal de corte (OCT | VWR | 25608-930 | |
| Acetona | JT Baker | 9006-33 | |
| Donkey Serum | Jackson | 017-000-121 | |
| rato anti-CD31 do mouse, | BD PharMingen | 558736 | |
| cabra anti-rato PDGFR β- | R & D Systems | AF1042 | |
| donkey anti-CD31 rato Alexa 647 (Invitrogen) | Biolegend | 102516 | |
| burro anti-cabra Alexa 594 (Invitrogen) | Invitrogen | A11058 | |
| Triton X -100 | Sigma-Aldrich | X-100 | |
| Baixo derreter agarose / PBS | Sigma-Aldrich | A9414-25G | |
| Metanol | Fisher Scientific | A413-4 | |
| Álcool benzílico | Acros Scientific | 148390010 | |
| Benzoato de benzila | Acros Scientific | 105860010 | |
| Slides depressão | Fisher Scientific | S175201 | |
| Fluorogel | Microscopia Eletrônica de Ciências | 17985-10 | |
| Cobertura de vidro (22x22) -1,5 | Thermo Scientific | 152222 | |
| Zeiss LSM 510 Meta Microscópio Confocal | Zeiss | ||
| Micro pinça de dissecação | Roboz | RS-5135 | |
| Parafilm No. OM992 | Fisher Scientific | 13-374-16 | |
| 12 e 24 microplacas bem | Scientific Evergreen | 222-8044-01F | |
| Superfrost / Plus Lâminas de Microscopia | Fisher Scientific | 12-550-15 | |
| 4mL frascos claros | Científica Nacional | B7800-2 |
Referências
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados