このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス胎児の血管系を標識する方法
要約
この記事では、胚性皮膚や胸腺、血管を標識する方法を説明します。
要約
機能的な血管のネットワークの設立は、器官形成の本質的な部分であり、そして最適な臓器の機能に必要です。例えば、胸腺適切な血管の形成とパターニングに臓器と周辺への成熟T細胞の出口への胸腺細胞のエントリには不可欠です。胸腺の血管の空間的な配置は、局所微小環境からの信号、すなわち胸腺上皮細胞(TEC)に依存します。いくつかの最近の報告では、胸腺血管の欠陥の1,2にこれらの信号の結果のその中断を示唆している。これまでの研究では、新生児と成人の胸腺の血管系の1,2にラベルを付けるために使用されるテクニックを説明してきました。ここでは、胎児胸腺内の血管を標識するためのテクニックを示しています。このメソッドは、FITC -デキストランまたはGriffonia(Bandeiraea)SimplicifoliaレクチンI(GSL 1 -イソレクチンB 4)の使用を組み合わせて顔の静脈注射とCD31抗体染色胸腺血管構造と胸腺の血管周囲の間充織3-5をラベル付けするためにPDGFR -βを識別する。凍結切片またはビブラトームセクションを使用するオプションも用意されています。このプロトコルは、胸腺血管形成にTEC -由来分子の役割を定義するために重要な胸腺血管の欠陥を、識別するために使用することができます。メソッドが全体の血管をラベルとして、それはまた、皮膚や心臓60から10を含む胚全体の複数の臓器や組織に血管のネットワークを分析するために使用することができます。
プロトコル
1。フルオレセインデキストランとGSL I -イソレクチンB 4顔面静脈注射は胎児の血管系にラベルを付けるラベルが付い
- 生理食塩水(PBS)またはGSL 1リン酸緩衝FITC -デキストランを(50ug/mL)の準備- 1.5mlのエッペンドルフチューブにPBSでイソレクチンB 4(20ug/200uL)と37℃くらいまで温めC. FITC -デキストラン溶液(総体積1mLの)と株式1.25ファストグリーンの180uL / PBSにGSL 1株1.25ファストグリーン/ PBSの100uL追加-ソリューションが小さくなるようにイソレクチンB 4(合計ボリューム200uL)を、目に見えて青。
- 尿膜茎(臍動脈と静脈が)そのままにして、一緒にE14.5 - E18.5胚と卵黄嚢を解剖。
- 新しいペトリ皿(60 × 15 mm)に胚を移し、室温でPBSでそれらを浸す。
- 頭/顔の矢ビューを提供するために胚を置きます。優しく頭で胚を把握するためにマイクロ解剖ピンセットを使用してください。
- 30Gの針を使用して、50UL FITC -デキストラン(50ug/mL)またはGSL 1を注入する-イソレクチンB 4(200uLのPBS中20ug)を頭の後ろに向かって針を指す顔面静脈に。
- 染料は、臍静脈に表示されているときに、針を除去し、尿膜茎(臍動脈と静脈)から胚を分離。
- 注射後、胚は、色素が胚全体に循環するように2〜3分間室温でPBS中に残さないように。
2。皮膚の血管系のホールマウントの解析
- 色素が胚全体に循環させた後、バック、手足の地域から皮膚サンプルを削除し、胃、など8,9。
- 冷PBSで皮膚のサンプルを洗浄し、2時間8,9を4%PFA / PBSで固定してください。 2mLの冷PBSで4mlの透明なバイアルで10分間ずつ3回洗浄する。
- 顕微鏡スライド上に皮膚のサンプルを配置し、各スライドとカバーガラスにマウントメディアの100μlを加える。
- スライドは暗い記憶領域に乾燥することができます。
- 2'イメージの取得"セクションに進みます。
3。凍結切片のための胸腺および心臓血管系と血管周囲細胞のマルチカラーラベル(セクション1、手順7から続行)
- 液体窒素で"フラッシュフリーズ"全胚。胚は、分析するまでになると-80℃で保存できます。
- また、、胸腺をばらばらにする4℃のPBSですすぎ、そして2時間2mLの4%パラホルムアルデヒド(PFA)/ PBSで固定してください。冷PBS、OCTでの場所thymusの複数形、および-80℃で使用するまで凍結保存℃で10分間3回洗浄
- cryosectioningの場合は、セクション"ブロック"にOCTを広げ、セクショニングの胚や解剖の臓器/組織をマウントします。
- 厚さ10μmのセクションに凍結組織を切り取り、スライド上に収集する。
- 5〜10分間アセトンでセクションを修正。冷たいTBSで3回洗浄する。
- 室温で湿度チャンバ内の10%ロバ血清/ TBSでブロックする。
- 4℃湿度チャンバ内の一次抗体を100μlで1時間、一晩のためのセクションをインキュベート° C:この例では、我々は、ラット抗マウスCD31(1:100)ラベルの内皮へ、そしてヤギ抗マウスPDGFR -βを使用してください(1:100)血管周囲細胞を標識する。それは抗体が均一にセクションにまたがっていることを保証するために個別にカットパラフィルムストリップではスライドをカバーするために有用です。
- 一次抗体とのインキュベーション後、切片を冷たいTBSで3回洗浄する。最短で30分のための適切な二次抗体を100μlとインキュベートする。
- 冷たいTBSで3回洗浄する。各スライドとカバーガラスにマウントメディアの100μlを追加します。
- スライドは暗い記憶領域に乾燥することができます。
- "画像取り込み"セクションに進んでください。
4。ビブラトームセクションの胸腺血管と血管周囲細胞のマルチカラーラベル(セクション1、手順7から続行)
- 胚から胸腺葉を摘出し、冷PBSでリンス。
- 2時間、室温で4%PFA / PBSで胸腺を修正。
- アガロース/ PBS(〜4℃)溶融低い4%の小さなプラスチック製のカートリッジと水没のPBS -トリトンX(0.15%)3回、10分および場所のthymusの複数形で洗う。胸腺は、カートリッジの底部に接触している必要があります。
- アガロースが氷(3〜5分)で固化することができます。余分なアガロースを遮断するカミソリの刃を使用。ビブラトームブロックに接着剤を追加し、ブロックするためにサンプルを付着する。
- サンプルとブレードが浸されるまでビブラトームの水浴に冷PBSを追加。
- 速度を設定し、振幅(高振幅、低中程度の速度はソフト胸腺のセクションに理想的です)。のセクションでは、過剰な攪拌による解散場合振幅が低減されるべきである。
- 50人のUMセクションをカット。
- 絵筆を使って、冷PBSで24ウェルマイクロプレートのセクションを収集する。
- 30分間PBS -トリトンX(0.15%)の10%ロバ血清を500μlのブロックのセクション。
- などの一次抗体と一晩に8時間、切片をインキュベート抗CD31および抗PDGFR -β、覆われた24ウェルマイクロプレートインチ
- 4℃8時間の合計℃以上PBS -トリトンX(0.15%)で3回洗浄する
- 30分間PBS -トリトンX(0.15%)の10%ロバ血清中のブロックのセクションを参照してください。
- 4℃との適切な二次抗体で一晩に8時間のためのセクションをインキュベートする。
- 4℃8時間の合計℃以上PBS -トリトンX(0.15%)で3回洗浄する
- 4%PFA / PBSで再修正のサンプルを氷上で30分間。
- 氷上で30分間にわたってPBS -トリトンX(0.15%)で3回洗浄する。
- 25パーセントメタノール、50%メタノール、75%メタノール、および各ステップのための10分で100%のメタノール:等級メタノール/ PBS -トリトンXシリーズを通して試料を脱水する。 10分後に新鮮なメタノールと100%のメタノールを交換し、室温で1時間インキュベートします。
- 1:2の比率で:ガラス容器、ミックスBABB(安息香酸ベンジルベンジルアルコール)で。 50%のBABBと50%のメタノールの最終濃度MeOHでBABBを組み合わせる。 10〜15分のMeOH:BABBのサンプルをインキュベートする。
- 室温で、10〜15分間またはクリアされるまで100パーセントBABBとインキュベートしたガラス容器にサンプルを移す。
- 新鮮な100%BABBでうつ病のスライド(0.7ミリメートルの深さ)を記入し、側にサンプルを移す。マニキュアの2-3コートとガラス(第1.5)とシールをカバーに追加します。室温で暗所で固めるにマニキュア爪を許可し、4でサンプルが格納℃に
注:スライドが完全に共焦点画像の取得前に封印されている必要があります。蛍光色素はBABBでフェードインできるように画像は、12〜24時間以内に取得しておく必要があります。 - "画像取り込み"セクションに進んでください。
5。画像の取得
- 画像10μmの488プラン-アポクロマート20X/0.8目標(512 × 512ピクセル)を使用して共焦点顕微鏡で凍結切片- (FITC-dextran/GSL 1 -イソレクチンB 4)、543 - 、、633 nmのレーザーラインが。
- 共焦点取得全体のマウントの皮膚と50μmの488プラン-アポクロマート10X/0.4目的を(512 × 512ピクセル)を使用してアガロース包埋切片のzセクション- (FITC-dextran/GSL 1 - B 4イソレクチン)、543 - 、 、633 nmのレーザーライン。シリアルZ -セクションは、それぞれのチャネルに対して1ミクロンで連続して収集する必要があります。
- ツァイスAxioVisionの4.6または他の画像解析ソフトウェアを使用してシリアルZ -セクションを再構築。
6。代表的な結果:
胚の血管系の効率のよいラベリングには、マウス胎児の血管の欠陥を評価するために重要です。図1は、それぞれ、右と左心室(1E - F)の染色に加えて、CD31(1B)で特定のE16.5胸腺の血管(1A - B)のラベルとの共同ラベルを示しています。 GSL I -イソレクチンBなどのセクション1,3、および5に記載された凍結切片のための4プロトコルは、これらの実験で使用されていた。ホールマウントのE16.5マウスの皮膚の血管のネットワークのラベル、セクション1、2に記載されているプロトコルを使用して、そして5は図1C - Dに示されています。
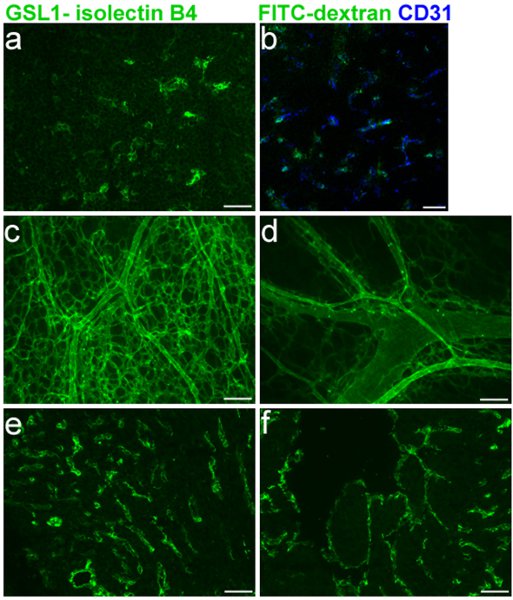
1凡例を示しています。 FITC GSL I - E16.5マウス胚にイソレクチンB 4顔面静脈注射。胎児の皮膚の血管系は、次の注射の注射後の胚の胸腺のA.の凍結切片。イソレクチンB 4とCD31の共ラベルのB.マージします。c.及び d.ホールマウント。E.と胎児心eのfの凍結切片(右心室)F.(左心室)、次の注入。
ディスカッション
セクションの全体のマウントおよびPECAM - 1(CD31)染色は、マウス胎児の血管系を標識するための従来の方法です。これらのメソッドは、直接および/または間接免疫蛍光法、およびマウスの組織を透過性に洗剤を使用する必要があります。これはかなりタイムリーなプロセスであることが分かる。ここで、我々はそれによって抗体のラベリング手順の必要性を取り除きました、B 4顔面...
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、NIAIDからNRMとJLBにSREBの博士論文フェローシップ賞への助成金番号R01AI055001とR01AI082127によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| FITC -デキストラン | シグマ | FD150S - 1G | |
| GSL 1のラベルフルオレセイン-イソレクチンB 4 | ベクターラボラトリーズ | FL - 1201 | |
| 速いグリーン | MPのバイオメディカル | 195178 | |
| PFA | フルカ | 76240 | |
| ウシ胎仔血清 | アトランタバイオ | S11550 | |
| 最適な切削温度化合物(OCT | VWR | 25608-930 | |
| アセトン | JTベーカー | 9006〜33 | |
| ロバ血清 | ジャクソン | 017-000-121 | |
| ラット抗マウスCD31、 | BD Pharmingen社 | 558736 | |
| ヤギ抗マウスPDGFR -β | R&Dシステムズ | AF1042 | |
| ロバ抗ラットCD31アレクサ647(Invitrogen社) | Biolegend | 102516 | |
| ロバ抗ヤギアレクサ594(Invitrogen社) | インビトロジェン | A11058 | |
| トリトンX -100 | シグマアルドリッチ | X - 100 | |
| 低融点アガロース/ PBS | シグマアルドリッチ | A9414 - 25G | |
| メタノール | フィッシャーサイエンティフィック | A413 - 4 | |
| ベンジルアルコール | アクロスサイエンティフィック | 148390010 | |
| 安息香酸ベンジル | アクロスサイエンティフィック | 105860010 | |
| うつ病のスライド | フィッシャーサイエンティフィック | S175201 | |
| Fluorogel | 電子顕微鏡学 | 17985〜10 | |
| カバーガラス(22X22)-1.5 | サーモサイエンティフィック | 152222 | |
| ツァイスLSM 510メタ共焦点顕微鏡 | ツァイス | ||
| ミクロ解剖鉗子 | Roboz | RS - 5135 | |
| パラフィルム番号OM992 | フィッシャーサイエンティフィック | 13-374-16 | |
| 12および24ウェルマイクロプレート | エバーグリーンサイエンティフィック | 222 - 8044 - 01F | |
| Superfrost /プラス顕微鏡スライド | フィッシャーサイエンティフィック | 12-550-15 | |
| 4mlの透明バイアル | 国立科学 | B7800 - 2 |
参考文献
- Cuddihy, A. R. VEGF-mediated cross-talk within the neonatal murine thymus. Blood. 113, 2723-2731 (2009).
- Muller, S. M. Gene targeting of VEGF-A in thymus epithelium disrupts thymus blood vessel architecture. Proc. Natl. Acad. Sci. U. S. A. 102, 10587-10592 (2005).
- Muller, S. M. Neural crest origin of perivascular mesenchyme in the adult thymus. J. Immunol. 180, 5344-5351 (2008).
- Foster, K. Contribution of neural crest-derived cells in the embryonic and adult thymus. J. Immunol. 180, 3183-3189 (2008).
- Liu, C. Coordination between CCR7- and CCR9-mediated chemokine signals in prevascular fetal thymus colonization. Blood. 108, 2531-2539 (2006).
- Lavine, K. J. Fibroblast growth factor signals regulate a wave of Hedgehog activation that is essential for coronary vascular development. Genes Dev. 20, 1651-1666 (2006).
- Lavine, K. J., Kovacs, A., Ornitz, D. M. Hedgehog signaling is critical for maintenance of the adult coronary vasculature in mice. J. Clin Invest. 118, 2404-2414 (2008).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Murphy, P. A. Endothelial Notch4 signaling induces hallmarks of brain arteriovenous malformations in mice. Proc. Natl. Acad. Sci. U. S. A. 105, 10901-10906 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved