Method Article
Workflow השלם עבור ניתוח שלאחר translational שינויים היסטון שימוש מלמטה למעלה ספקטרומטריית מסה: מתוך הפקת היסטון כדי ניתוח נתונים
In This Article
Summary
פרוטוקול זה מתאר עבודה משולבת במלואם לאפיון היסטון שלאחר translational שינויים באמצעות ספקטרומטריית מסה (MS). זרימת העבודה כוללת טיהור היסטון מן בתרביות תאים או רקמות, היסטון derivatization ועיכול, ניתוח MS באמצעות כרומטוגרפיה נוזלית ננו זרימה והוראות לניתוח נתונים. הפרוטוקול מיועד להשלמה בתוך 2 - 3 ימים.
Abstract
נוקלאוזום הוא יחידת המבנה הקטנה ביותר של הכרומטין, מורכבת 147 זוגות בסיסים של DNA עטופים סביב octamer של חלבונים היסטון. פונקצית היסטון מתווכת על ידי שינוי שלאחר translational נרחב על ידי מספר עצום של חלבונים גרעיניים. שינויים אלה הם קריטיים עבור שלמות גרעינית כפי שהם מווסתים אנזימי מבנה ולגייס הכרומטין מעורב ויסות גנים, תיקון DNA ועיבוי כרומוזום. למרות חלק גדול של הקהילה המדעית מאמץ טכניקות מבוססות נוגדנים לאפיין שפע PTM היסטון, הגישות הללו הן תפוקה נמוכה ומוטה נגד חלבוני hypermodified, כמו epitope עלול להיות חסומים על ידי שינויים בסביבה. פרוטוקול זה מתאר את השימוש של כרומטוגרפיה נוזלית ננו (nLC) ו ספקטרומטריית מסה (MS) כימות מדויק של שינויים היסטון. שיטה זו נועדה לאפיין מגוון רחב של PTMs היסטון ואת השפע היחסי של היסטון כמה גרסאות בתוך יםingle מנתח. בפרוטוקול זה, ההיסטונים הם derivatized עם אנהידריד propionic ואחריו עיכול עם טריפסין לייצר פפטידים של 5 - 20 aa באורך. לאחר העיכול, N-Termini שנחשפו מחדש פפטידים היסטון הם derivatized לשפר השמירה chromatographic במהלך nLC-MS. שיטה זו מאפשרת כימות היחסית של PTMs היסטון פורש ארבעה סדרי גודל.
Introduction
אפיגנטיקה מוגדרת בחקר שינויים תורשתיים בביטוי גנים המתעוררים על ידי מנגנונים אחרים מאשר לשנות את רצף ה- DNA הבסיסי 1. תקנה אפיגנטיים היא קריטית במהלך פיתוח כמו האורגניזם עובר פנוטיפי דרמטית משנה למרות תוכן DNA שלו לא משתנה. ישנם מספר מרכיבים קריטיים הדרושים לתחזוקה אפיגנטיים, ובכלל זה שינויים היסטון שלאחר translational (PTMs), גרסאות היסטון, RNAs ללא קידוד, מתילציה DNA וגורמים DNA מחייבת, שכל אחד מהם משפיעים על ביטוי גנים באמצעות מנגנונים שונים 2. לדוגמא, בעוד מתילציה DNA הוא שינוי מאוד יציב שמדכא תרגום גן 3, גרסות היסטון ו PTMs היסטון הם הרבה יותר דינמי יכול להשפיע הכרומטין במגוון דרכים 4.
PTMs היסטון בעיקר הם נקודתיים על זנבות N-terminal, כפי שהם באזור החשוף ביותר וגמיששל החלבון. עם זאת, הליבה הנוקלאוזום גם היא שונה בכבדות לעומת חלבונים ממוצעים 5. למרות סימני היסטון מתאפיינים בהרחבה בעשור האחרון, קישורים רבים בין סימני היסטון ידועים ותפקודם עדיין אינם ברורים. זהו בעיקר בשל העובדה שרוב PTMs היסטון לא עובד לבד, אלא פונקציה בד בבד עם אחרים PTMs ( "צולב לדבר") לשנות תהליך מסוים כגון שעתוק 6,7. למשל, H3S10K14ac סימן קומבינטורית על p21 הגן מפעיל שעתוק שלה, אשר לא יתרחש עם רק אחד משני PTMs 8. מחזק HP1 חלבון הכרומטין ידי הכרת H3K9me2 / ME3 והפצת ששינוי נוקלאוזום הסמוך. עם זאת, HP1 לא יכול להיקשר H3K9me2 / 3 כאשר S10 הסמוך עובר פוספורילציה 9. Acetylation של H3K4 מעכב המחייב של spChp1 חלבון H3K9me2 / ME3 ב שמר החלוקה 10. יתר על כן, ד ליזין היסטוןemethylase PHF8 יש את היעילות מחייב הנוקלאוזום הגבוהה ביותר כששלושה PTMs H3K4me3, K9ac, ו K14ac נוכחים 11. דוגמאות אלה מדגישים את החשיבות של השגת סקירה עולמית של שינויי PTM היסטון במקום להתמקד שינויים יחידים.
הנוכחות של רצף וריאנטים גם מגדילה את המורכבות של ניתוח היסטון, כמו isotypes היסטון בדרך כלל יש רצפים דומים מאוד, אך לרוב יש תפקידים שונים הכרומטין. לדוגמה, H2A.x יש רצף מסוף-C אשר פוספורילציה יותר בקלות על נזק לדנ"א לעומת H2A הקנונית 12, והוא נדרש עבור איון של כרומוזומי המין ב המיוזה עכבר זכר 13; באופן דומה, CENP-תחליפים H3 היסטון קנוני צנטרומר 14. למרות הפונקציות השונות שלהם, הגירסות אלה חולקים חלק גדול של רצף החומצות האמיניות שלהם עם היסטון הקנונית בהתאמה, מה שהופך אותו קשה לזהות ולכמת אותם בנפרד.
נוגדן מבוסס טכניקות כגון מערבי סופג אומצו באופן נרחב כדי לאפיין היסטונים. עם זאת, גישות המבוססים על נוגדנים מוגבלות מהסיבות הבאות: (i) הם יכולים רק לאשר את קיומו של שינוי ולא יכולים לזהות PTMs הידוע; (Ii) הם מוטים בשל נוכחותם של סימנים קיימים שיתוף, אשר יכול להשפיע על זיקה מחייבת; (iii) הם לא יכולים לזהות סימני קומבינטורית, כפי שרק מעטים מאוד נוגדנים זמינים למטרה זו וכן (iv) הם צולבים להגיב בין וריאנטים היסטון דומים מאוד או PTMs הדומה (למשל, דוּ ו trimethylation של שאריות ליזין). Egelhofer et al. תאר כי יותר מ -25% של נוגדנים מסחריים להיכשל בדיקות סגוליות ידי כתם נקודה או כתם מערבי, ובקרב נוגדנים ספציפיים יותר מ -20% נכשלים בניסויי immunoprecipitation הכרומטין 15. ספקטרומטריית מסה (MS) היא כיום כלי אנליטי המתאים ביותר ללמוד PTMs הרומן ו / או קומבינטורית,וזה יושם בהרחבה עבור חלבונים היסטון (הנסקרת ב 16). זהו בעיקר בשל רגישות גבוהה ודיוק המוני של MS, והאפשרות לבצע בקנה מידה גדול מנתח.
האסטרטגיה מלמטה למעלה היא אסטרטגית פרוטאומיקה MS המבוססת הנפוצה ביותר לאפיון היסטון ו PTMs שלהם, שבו החלבון השלם מתעכל enzymatically לתוך פפטידים קצרים (5 - 20 aa). אכול זו מאפשר לשני הפרדת LC וזיהוי MS. מיסות בטווח של 600 - 2,000 Da הן בדרך כלל יותר ש'ליינן והזדהו עם דיוק מסה גבוה יותר ורזולוציה מ המונים גדולים. פיצול MS / MS הוא גם שפר, פפטידים קצרים הם בדרך כלל מתאימים היטב דיסוציאציה מושרה התנגשות (CID). עם זאת, היסטונים מציבים אתגר בפני MS מלמטה למעלה כפי שהם מועשרים ב שאריות חומצת אמינו בסיסיות, כלומר ליזין ארגינין. לכן, עיכול טריפסין מוביל לדור של פפטידים כי הם גם SMכל עבור החזקת LC ולוקליזציה חד משמעית של PTMs. כדי לעקוף בעיה זו, הפרוטוקול שלנו כולל כימי ליזין פפטיד N- המסוף derivatization 17. שימוש אנהידריד propionic מומלץ עבור derivatization הכימי היעיל לעומת חומרים כימיים אחרים 18. כזה בלוקים derivatization הקבוצות-אמינו ɛ של שאריות ליזין ללא שינוי ו monomethyl, המאפשר טריפסין לבצע proteolysis רק על C-terminal של שאריות ארגינין. אמיני derivatized לא יכולים להחליף פרוטונים עם הפתרון ובכך פפטידים באופן כללי בלבד כפליים או טעונים פי שלושה, הקלת MS ו- MS / MS זיהוי. יתר על כן, N-terminal derivatization מגביר הידרופוביות פפטיד ובכך שמירת chromatographic התהפך פאזי. כאן אנו מתארים את זרימת העבודה כדי לטהר היסטונים ולהכינם ניתוח PTM דרך פרוטאומיקה מלמטה למעלה (איור 1). אסטרטגיה זו משיגה כימות של סימני היסטון יחידים וסימני קומבינטורית fאו PTMs היסטון כי הם קרובים יחסית של רצף החומצות האמיניות.
Protocol
1. איסוף של תאים מן התרבות
- אם התאים גדלו ב השעיה, לאסוף תאים על ידי צנטריפוגה ב 300 RCF למשך 5 דקות. אם חסיד, לשאוב וזורקים המדיום הסלולרי. שוטף את התאים המצורפים עם PBS ללא Ca 2 + ו Mg 2+ (המכונה PBS הולך קדימה). דגירת תאי טריפסין או או טריפסין-EDTA (0.025% - 0.5% בהתאם לקו התא) עם נפח מספיק כדי לכסות את פני השטח של הצלחות ב 37 מעלות צלזיוס עד תאי לנתק (זמן משתנה עבור שורות תאים שונות).
- איסוף תאים על ידי צנטריפוגה ב 300 RCF למשך 5 דקות. שטפו תאים פעמיים נוספות PBS ולאסוף ידי צנטריפוגה.
- לאמוד את היקף התא ארוז כ מן הסיום הלימודים המסומנים על צינורות חרוטים 1.8 מיליליטר הצינורות או 15 מיליליטר.
הערה: תאי מתרבות ניתן snap-קפוא בחנקן נוזלי מאוחסן ב -80 ° C ללא הגבלה זמן בשלב זה.
בידוד 2. של גרעינים מ תאים שלמים
- תאים להפשיר על הקרח.
- חיץ בידוד גרעיני ההפשרה (NIB, טבלה 1).
- הכן כ 5 מ"ל חיץ NIB (טבלה 1) עבור כל נפח תא ארוז 100 μl. עבור כל חיץ 1 מ"ל NIB, להוסיף מעכבי פרוטאז וסוכני מייצב כדלקמן: 1 μl של 1 M DTT, 2.5 μl של 200 מ"מ AEBSF, 2 μl של 2.5 מיקרומטר microcystin ו -2 μl של בוטיראט נתרן 5 M. NIB עם מעכבי יהיה המכונה NIB מכאן ולהבא.
הערה: אם זירחון היסטון נלמד, כולל פרוטאז קוקטייל מעכב phosphatase חינם EDTA. - הסר נפח החמישי של חיץ NIB ובכך הכין ולהוסיף NP-40 אלטרנטיבית (טבלה 1) לריכוז סופי של 0.2%. היקף ארבעה והחמישה הנותרים ישמש לשטיפה.
- תא גלול לשטוף תא גלול 01:10 כדי NIB ללא יחס אלטרנטיבי NP-40 (V / V). הסר supernatant על ידי צנטריפוגה ב 700 RCF למשך 5 דקות.
- Lyse cell גלולה ידי הצבתו על קרח והוספת תא גלול 01:10 כדי NIB עם 0.2% NP-40 אלטרנטיביים (v / v).
- אם חילוץ דגימות רקמה, homogenize באמצעות homogenizers ובמכתש או dounce. יכול להיות הומוגני תאים בתרבית על ידי pipetting עדין.
- דגירת תאים הומוגני על קרח למשך 5 - 10 דקות. התאים יהיה lyse ולשחרר את הגרעינים.
- צנטריפוגה ב 1000 RCF עבור 5 - 10 דקות ב 4 ° C. גלולה המכילה בעיקר לתא גרעינים, בעוד supernatant מכיל בעיקר רכיבים cytoplasmic. שמור את חלק cytoplasmic אם תרצה בכך.
- שטפו את הכדור גרעינים ידי resuspending אותו בעדינות 1:10 (V / V) NIB ללא אלטרנטיבי NP-40.
הערה: שלב זה לשטוף היא אך ורק כדי להסיר עקבות של חומרי ניקוי לפני לחילוץ היסטונים מגרעינים. - צנטריפוגה ב 1000 RCF במשך 5 דקות ב 4 ° C ולהסיר supernatant.
- חזור על שלב 2.10 - 2.11 לפחות פעמיים כדי להסיר לחלוטין אלטרנטיבי NP-40. הסרת NP-40 אלטרנטיבית הוא ניכרזה pipetting העדין במהלך שלב הכביסה כבר לא מהווה בועות.
- עבור חילוץ היסטון מרקמות:
- לשטוף רקמות קפואות או מופשר ב NIB קר כקרח.
- העברת רקמות צלחת פטרי ממוקמת על קרח עם NIB, רק מספיק כדי לשמור על הרקמה רטובה.
- קוביות לחתיכות קטנות (<1 מ"מ) עם סכין גילוח להגדיל הקשר משטח בידוד גרעינים.
- העברת רקמות טחון על homogenizer מראש צונן ולשטוף NIB ידי pipetting למעלה ולמטה.
- הסר חוצץ על ידי צנטריפוגה ב 300 RCF למשך 5 דקות.
- להוסיף NIB המכיל אלטרנטיבי NP-40 התאים תאים: חיץ יחס של 1:10 (V / V) ו homogenize ידי 5 - 10 משיכות.
- בדוק תמוגה התא וחזור המגון לפי הצורך. אינדיקטור טוב כי התאים כבר lysed היא הפחתה של נפח גלולה. הגלולה צריכה לכלול גרעינים בלבד.
- צנטריפוגות ב 700 RCF למשך 5 דקות ולשמור גלולה. גלולה זו ניתן לחלץ 1 - 2 יותר זמןים ב 1:10 (V / V) של NIB המכיל NP-40 אלטרנטיבית; בשלב זה, ההיסטונים המחולצים מתוך הכרומטין הגלול התכווץ באופן משמעותי.
- לשטוף פעמיים עם 2 - 3 מ"ל של NIB ללא אלטרנטיבי NP40 כדי להסיר עקבות של חומר ניקוי.
הערה: נקודת עצירת ביניים: לדוגמא ניתן resuspended בהיקף המינימאלי של גליצרול NIB + 5%, ומאוחסנת ב -80 מעלות צלזיוס.
הפקת 3. טיהור של היסטונים מגרעינים
הערה: היסטונים עשירים מאוד שאריות חומצת אמינו בסיסיות, ומאפשר להם אינטראקציה הדוקה עם עמוד השדרה חומצה זרחתית של DNA. ההיסטונים הם בין החלבונים הבסיסיים ביותר בגרעין, ובכך מאפשרים להם להיות חילוץ בחומצה גופרתית קר כקרח (0.2 MH 2 SO 4) עם זיהום מינימאלי מחלבונים שאינם היסטון, אשר לזרז בחומצה חזקה. TCA בריכוז גבוה (לריכוז סופי של 33%) לאחר מכן ניתן להשתמש כדי לזרז היסטונים מן גופרתיחוּמצָה. TCA מאוחסן 100% בבקבוק חום על 4 מעלות צלזיוס.
- גרעינים תא גלולה ב 1: 5 (v / v) מקורר 0.2 MH 2 SO 4 (טבלה 1) על ידי pipetting עדין.
- דגירה המדגם עם רוטציה קבועה או רעד עדין במשך 2 - HR 4 ב 4 ° C.. בדרך כלל, עבור דגימות עם יותר מ -500 תא גלול μl, עקירת 2 hr מספיקה כדי לחלץ היסטונים; דגירה כבר עלולה לגרום חילוץ של חלבונים בסיסיים אחרים. כדורים גרעיניים קטנים (<200 μl), מיצוי hr 4 מספק תשואה טובה יותר.
- צנטריפוגה ב 3,400 RCF ב 4 מעלות צלזיוס למשך 5 דקות.
- מעבירים את supernatant לצינור חדש.
- חזור על שלבים 3.3 - 3.4 להסיר כל חומר מסיס.
- כדי לזרז את ההיסטונים, להוסיף TCA 100% מצונן (טבלה 1) כדי supernatant שנאסף (עכשיו היסטונים מכיל) יחס של 1: 3 (v / v), על מנת להשיג ריכוז TCA הסופי של 33%. מערבבים על ידי צינור היפוך כמה tIMEs.
הערה: הדגימות תהפוכנה מעוננות על תוספת של TCA, המעידות על הנוכחות של היסטונים. - דגירה את התערובת על קרח למשך שעה 1 לפחות. עבור גדלי גלולת התחלה קטנים, מומלץ ממטרי הלילה.
- צנטריפוגות ב 3,400 RCF למשך 5 דקות. המעיל היסטונים בצידי צינורות וגם להפקיד בתחתית. גלולה מסיס לבן מהווה גם בתחתית של התחתית, אשר רובם מכיל חלבונים שאינם היסטון ביומולקולות אחרים. הסר supernatant על ידי שאיפה, בזהירות מבלי השורטים את דפנות או גלולה.
- באמצעות פיפטה פסטר זכוכית, ולשטוף את הצינור עם אצטון קר כקרח + 0.1% HCl (טבלה 1) כך שיכסו את החלבונים זירז ציפוי הצדדים והתחתון.
- צנטריפוגות ב 3,400 RCF 2 דקות ואת לשאוב supernatant, בזהירות מבלי השורטים את דפנות או גלולה.
- חזור על שלבים 3.9 - 3.10 באמצעות 100% אצטון קר כקרח.
- גלולה יבשה עם זרימת אוויר או עם vacuאממ צנטריפוגות, או סתם על ידי השארת הצינור פתוח. אצטון מתאדה במהירות.
- ממיסים את ההיסטונים עם DDH 2 O (מים מזוקקים פעמיים) בנפח המינימלי האפשרי כדי להמיס את השכבה הלבנה לגמרי. ההיסטונים הם מסיסים בקלות במים. כדורי צינור 1.5 מ"ל microcentrifuge, 100 μl DDH 2 O הוא בדרך כלל מספיק כדי לאסוף היסטונים.
- צנטריפוגות ב 3,400 RCF 2 דקות ולהעביר את supernatant לצינור חדש.
הערכת 4. של ריכוז חלבון וטוהר
- למדידת ריכוז חלבון, השתמש BCA, שיטה ברדפורד או ניתוח חומצת אמינו (AAA). אין להשתמש בטכניקות כי לאמץ ספיגה ב 280 ננומטר, כמו ההיסטונים הם עניי שאריות חומצת אמינו ארומטיות.
- בדוק את הטוהר של היסטונים שחולצו על ידי ניתוח SDS-PAGE עם ג'ל acrylamide 15% ו Coomassie מכתים (אופציונלי).
- אם וריאנטים היסטון היחיד גבוהה טוהרים רצויים, ממשיך חלוקת HPLC-UV שלוריאנטים היסטון (סעיף 5). אם לא, דלג ישירות לדגום הכנה לניתוח PTM מלמטה למעלה היסטון (סעיף 6).
5. הפרדת גרסאות היסטון ידי היפוך פאזיים HPLC (אופציונלי)
הערה: גרסות היסטון טוהרות גבוהה ניתן להשיג על ידי פיצוח תערובת היסטון הגולמית באמצעות HPLC השלב התהפך מצמיד את גלאי UV. היסטונים מטוהרים אלה שימושיים עבור מחקרים הדורשים רגישות וטוהר גבוהים. עם זאת, לאפיון PTM היסטון רגיל, שלב זה ניתן לדלג משום שהניתוח הוא רגיש מספיק וממצה. חלוקה של היסטון שלם וריאנטים אידיאליים דורשת לפחות 100 - 300 מיקרוגרם של חומר מוצא.
- חבר טור 18 5 מיקרומטר C הולם של HPLC תלוי בריכוז היסטון החל: כ -100 מיקרוגרם של היסטונים, השתמש 2.1 מ"מ x 250 מ"מ טור עם שיעור זרימה של 0.2 mL / min; עם ההיסטונים כ -300 מיקרוגרם, השתמש בעמודה 4.6 x 250 מ"מ עםזרימה-בשיעור של 0.8 מ"ל / דקה. כן ההצפה A ו- B באמצעות כלי זכוכית ייעודיות כדלהלן:
- כן הצפה: 5% אצטוניטריל HPLC כיתה, 0.1% TFA במי כיתת HPLC.
- כן ההצפה B: 95% אצטוניטריל כיתת HPLC, 0.1% TFA במי כיתת HPLC.
- חבר את העמודה לגלאי UV, ולהגדיר את ספיגת 210 - 220 ננומטר.
- לחומצת מדגם היסטון מומס במים עם 100% TFA כדי להשיג ריכוז סופי של 0.1-1% TFA.
- לאזן את העמודה עם חיץ 100% במשך 15 דקות לפחות בקצב הזרימה-המומלץ, אשר מבטא בקירוב בשלושה כרכי טור. השתמש איתותים כדי להגדיר את הרמה אפס הספיגה של גלאי UV.
- הכן צינורות בגודל המתאים לאסוף שברים באופן ידני או אספן מדגם אוטומטי.
- להזריק מדגם בריכוז של כ 1 מיקרוגרם / μl ומעלה. דוגמאות מומסות ובהיקפים גדולים עשויות לשנות את האיזון של העמוד duטעינת טבעת להוביל החזקה נמוכה.
- הפעל את השיפוע, מתוכנת כדלקמן: בין 0 ל -30% ב -1 דקות, 30 עד 60% B ב 90 דק ', ו -60 עד 90% B ב 1 דקות.
- אסוף שברים (הכרומתוגרמה בדוגמה המוצגת באיור 2) ב 1 במרווחים min באמצעות אספן חלק אוטומטי. אסוף שברי צינורות בגודל מתאים כדי להכיל את כל הנפח.
- לייבש את דגימות מופרדות בתוך concentrator ואקום.
הערה: נקודת עצירה ביניים: שברים היסטון יבשים ניתן לאחסן בטמפרטורת החדר לפרקי זמן קצרים (1 - 2 ימים) או במקפיא -80 מעלות צלזיוס במשך תקופות ארוכות-טווח.
6. כימית derivatization של ההיסטונים באמצעות אנהידריד propionic עבור ניתוח מלמטה למעלה
- ממיסים דגימות היסטון ב 40 μl של 50 מ"מ NH 4 HCO 3, pH 8.0 (מומלץ כמות: 50 - 100 מיקרוגרם). אם דגימות היו ב DDH טהור 2 O, להוסיף מרוכז NH 4 HCO 3 לפצות 50 מ"מ, pH 8.0.
- להרטיב קצה פיפטה P10 לתוך המדגם כדי לבדוק את ה- pH באמצעות רצועות אינדיקטור pH ללא פסדים מדגמים. NH 4 OH וחומצה פורמית ניתן להשתמש כדי להתאים את ה- pH ל 8.0.
הערה: החלק הבא של פרוטוקול (שלבים 6.3 - 6.7) צריך להיעשות בקבוצות של מקסימום שלושה עד ארבעה דוגמאות, על מנת לשמור propionic אנהידריד תגובתי. - השתמש במנדף עבור השלבים הבאים שם אנהידריד propionic משמש. הכן מגיב propionylation טרי ידי ערבוב אנהידריד propionic עם אצטוניטריל ביחס 1: 3 (v / v). הוסף מגיב propionylation לדגום ב 1: 4 (v / v). במשך 40 היסטונים μl, להוסיף 10 מגיב propionylation μl.
הערה: אפשר לצפות פסולת לבנה בשלב זה. עם זאת, זה בעיקר מכיל מלחים וחומצה propionic, וכך מבלי לבצע פעולה ספציפית צריך לקחת. - להוסיף במהירות NH 4 OH להקים מחדש pH 8.0 הפתרון. הערה: אנהידריד propionic מגיב עם אמינים חינם של פפטידים מייצר אבזרחומצה יונית כי ירידות pH. בדרך כלל, הוספת NH 4 OH המדגם עם יחס של 1: 5 (v / v) ראוי להקים מחדש pH 8.0; למשל, 8 μl של NH 4 OH 40 μl של המדגם.
- מערבבים מיד על ידי vortexing.
- בדוק pH עם אותו הליך כמו שלב 6.2.
זהירות: כאשר ה- pH גדול מ 10.0, תיוג של שאריות חומצת אמינו אחרות עם pKa הגבוה אפשרי. - דגירה דגימות בטמפרטורת החדר למשך 15 דקות.
- חזור על שלבים 6.3 - 6.7, ביצוע התגובה להקפיד על לא יותר מ -3 או 4 דגימות לכל אצווה של מגיב propionylation.
- דגימות יבשות עד 10 - 20 μl בתוך concentrator ואקום. זה מתאדה אנהידריד propionic unreacted, אצטוניטריל, חומצה אצטית גז אמוניה שוחרר מ- NH 4 OH. אם דגימות להתייבש לחלוטין, ללא הפסדים מדגמים משמעותיים להתרחש.
הערה: Isopropanol יכול לשמש במקום אצטוניטריל. עם זאת, אצטוניטריל יש מתח פנים נמוך ולכן יותראידוי מהיר. - דגימות גלולות או לדלל עם DDH 2 O עד 40 μl של נפח סופי מושגת.
- חזור על שלבים 6.2 - 6.9. סבב כפול של propionylation היסטון מבטיח> 95% של השלמת התגובה.
- מלאו בקבוק אנהידריד propionic עם גז ארגון כדי למנוע היווצרות של חומצה אצטית במגע עם לחות בבקבוק.
הערה: נקודת עצירת ביניים: לדוגמא ניתן לאחסן ב -80 ° C מחדש DDH 2 O או מיובש.
7. עיכול פרוטאוליטים עם טריפסין
- ההיסטונים גלולה ב 50 מ"מ NH 4 HCO 3 להשיג ריכוז אופטימלי של 1 מיקרוגרם / μl ומעלה. עוד דוגמאות מדוללות להוביל להפחית יעילות טריפסין.
הערה: היסטונים בשלב זה צריך להיות ב- pH 8.0 אם זה עדיין חומצי, ולאחר מכן להוסיף NH 4 HCO 3 מלח לדגום באמצעות טיפ pipet. - להוסיף טריפסין קטעים היסטון ביחס 1:10 (wt / wt).
- אינקובטוריםטה ב 37 מעלות צלזיוס במשך 6 - 8 שעות.
- עצור את מערכת העיכול על ידי הקפאת -80 מעלות צלזיוס.
- לייבש את המדגם כדי 10 - 20 μl בתוך concentrator ואקום.
הערה: נקודת עצירת ביניים: לדוגמא ניתן לאחסן ב -80 מעלות צלזיוס.
8. Propionylation של פפטידים היסטון ב N-טרמיני
הערה: סעיף זה מתאר את derivatization של פפטיד N-Termini המופק טריפסין לעכל. הליך כזה משפר שמירת HPLC של פפטידים הקצר (למשל, חומצות אמיניות 3 - 8 מתוך היסטון H3), כקבוצת propionyl מגבירות הידרופוביות פפטיד.
- דגימות Resuspend ב 30 μl של 100 מ"מ NH 4 HCO 3.
- חזור על שלבים 6.1 - 6.9.
הערה: זה נורמלי כי ייבוש של דגימות בריק לוקח זמן רב יותר בשלב זה. - גלולה או לדלל דגימות עם 50 - 100 μl DDH 2 O + או 0.1% TFA או 0.5% חומצה אצטית. הערה: חומצה אצטית מומלצת לאחסון ארוך, כמו TFA facilitates חמצון מתיונין בטווח הארוך. מצד השני, TFA מומלץ אם בשלב-tipping (סעיף 9) מתבצע באותו היום, כפי TFA מסייעת שמירת chromatographic טוב יותר.
הערה: נקודת עצירת ביניים: לדוגמא ניתן לאחסן ב -80 מעלות צלזיוס.
9. Desalting לדוגמא עם-טיפים שלב
הערה: בשלב זה, יש כיום מלח במדגם. מלחים לעכב ניתוח HPLC-MS כי הם ליינן במהלך electrospray, דיכוי האות מ פפטידים. מלחים יכולים גם ליצור adducts היוני על פפטידים, הפחתת עוצמת האות לייצור הפפטיד הלא adducted. כמו הפפטיד adducted תהיה מסה שונה, הפפטיד לא יזוהה כראוי או לכימות.
- באמצעות קצה פיפטה P1000, אגרוף דיסק של חומר C 18 מדיסק מיצוי שלב מוצק. דחוף את minidisk מתוך קצה P1000 באמצעות סיליקה התמזגו נימי והפקדת minidisk לתחתית קצה פיפטה P100 / 200. ודא כי דISK הוא תקוע מאובטח בתחתית הקצה (איור 3).
הערה: טיפ P1000 יש חור קטן למדי אגרוף הדיסק 18 C. מן ראוי לגזור הסנטימטר האחרון של הקצה על מנת לקבל חור בקוטר גדול יותר. - השתמש בשתי C 18 אגרופים קצה באותו P100 / P200 אם desalting מעל 25 מיקרוגרם של המדגם.
- השתמש במתאם צנטריפוגות להחזיק-טיפים הבמה במקום ב 1.5 מ"ל או 2 צינורות microcentrifuge מ"ל. השתמש איטי (300 - 400 RCF) סיבוב; הממסים בדרך כלל לעבור דרך השרף בפחות מדקה.
- שטוף את שרף על ידי ספינינג עם 50 μl של אצטוניטריל 100% על מנת להפעיל את חומר C 18 ולהסיר זיהומים פוטנציאליים.
- לאזן דיסק ידי שטיפה 80 μl של 0.1% TFA ידי צנטריפוגה איטי.
- לחומצה המדגם 4.0 pH או נמוך עם חומצה אצטית. בדוק את ה- pH עם רצועות ה- pH כדי להקטין את איבוד המדגם. טען מדגם על הדיסק על ידי צנטריפוגה איטי.
- לִשְׁטוֹףמדגם ידי שטיפה 70 - 80 μl של 0.1% TFA ידי צנטריפוגה איטי.
- Elute המדגם על ידי שטיפה 70 μl 75% אצטוניטריל וחומצה אצטית 0.5% על ידי צנטריפוגה איטי. אסוף המדגם צינור 1.5 מ"ל.
- מדגם יבש בתוך concentrator ואקום.
הערה: נקודת עצירת ביניים: לדוגמא ניתן לאחסן ב -80 מעלות צלזיוס.
10. ניתוח של פפטידים היסטון
הערה: פלטפורמת nLC-MS יש להגדיר כפי שנעשו ניתוח פפטיד מסורתי. השימוש של 200 - 300 טור זרימת NL (75 מיקרומטר מזהה עמודה אנליטיים, C 18 חלקיקים) מומלץ, כפי שהם פשרה מעולה בין רגישות ויציבות. שיטת רכישת MS יכולה להיות שילוב של רכישת נתונים תלויים (DDA) עם סריקות ממוקדות 19 או רכישה עצמית-נתונים (DIA) 20,21, הן מתוארות נציג תוצאות ואיור 4.
- כן מאגרי HPLC - A: 0.1% חומצה פורמית במי HPLC כיתה; B: חומצה פורמית 0.1% ב אצטוניטריל HPLC כיתה.
- לתכנת את שיטת HPLC כדלקמן: בין 0 ל B חיץ 30% ב 30 דקות, מ -30 ל -100% B במשך 5 הדקות הבאות ב- B 100% isocratic במשך 8 דקות. אם HPLC לא מתוכן עבור איזון טור אוטומטי לפני טעינת מדגם, ואז לכלול את הפרטים הבאים: השיפוע 100 ל -0% ב '1 דק' ותזרים isocratic ב- B 0% במשך 10 דקות. הגדר את קצב הזרימה של הניתוח 250 - 300 NL / min.
- לתכנת את שיטת הרכישה MS לבצע גם DDA בשילוב עם סריקות ממוקדות 19 או 20,21 DIA (איור 4). ודא כי מחזור עבודת MS מאפשר MS מלא לסרוק כל ~ 2 שניות, כדי שתהיינה נקודות מספיק נתונים כדי ברחבי שיא chromatographic, המאפשר כימות מדויק יותר. הערה: עם כרומטוגרפיה 18 C, רוחב שיא בסיס הממוצע הוא כ -30 שניות עבור ההדרגה שתוארה לעיל.
- טען כ 1 מיקרוגרם של המדגם על ג HPLColumn.
- להפעיל את שיטת HPLC-MS / MS כפי מתוכנת.
הערה: בפרוטוקול אינו ממליץ פרטים של עמודות, מכשירי MS או פרטי פרמטר MS, כמו כל הגדרה אופטימלית כי מעבדת חקר חלבונים אישית שהתפתחה תהיה מתאימה לשיטה. מעבדות פרוטאומיקה צריכות להשתמש ההתקנה אופטימיזציה שלהם, מאז פפטידים היסטון להפריד כמו פפטידים מסורתי.
ניתוח 11. נתונים
- לייבא את הקבצים גלם MS לתוך התוכנה לבצע אינטגרציה אזור השיא. הערה: EpiProfile 22 מומלץ, כפי שהוא מותאם במיוחד פפטידים היסטון; על ידי שימוש בידע זמן שמירה של elution chromatographic הוא מבצע חילוץ אזור השיא אמין של פפטידים היסטון ידועים. לחלופין, סקייליין 23 עוד תוכנה אידיאלית למטרה זו.
- חשב את השפע היחסי של פפטיד נתון על ידי חלוקת שטח ידי השטח הכולל של פפטיד זה בכל צורותיה השונות שלה. הערה: במקרה של analy גילויאחותי קמע מומלץ לזהות ספקטרום של פפטידים היסטון שונים. הביצועים של הכלי הזה תוארו 24 לאחרונה. כל מנועי חיפוש נתונים אחרים עבור חקר חלבונים הם גם שמישים, אבל על הבדיקות שלנו הם ספקו ביצועים נמוכים.
תוצאות
כדוגמה, ניתחנו ההיסטונים המופקים מתאי גזע עובריים אנושיים (hESCs) עם ובלי חומצה רטינואית (RA) גירוי, החל עם 200 כדורי תא μl. נוכחות של RA תרבית תאים מוביל בידול ESC. מתוך התא גלול, על 50 - 100 מיקרוגרם של היסטונים חולצו, וזה יותר מאשר מספיק כדי לבצע זריקות LC-MS מרובים של פפטידים היסטון. לאחר derivatization, עיכול, desalting, דגימות הועמסו על עמודה 75 מיקרומטר x 15 ס"מ C 18 (קוטר החלקיקים 3 מיקרומטר, גודל הנקבוביות 300 א) במצב סדרתי עם מערכת כרומטוגרפיה ננו נוזלי בעל ביצועים גבוהים עם שבבי microfluidic מצמידים quadrupole מלכודת ליניארי היברידית - ספקטרומטר מסה orbitrap. רכישת MS בוצעה באמצעות DIA. במקביל, דגימות נותחו גם עם שיטת DDA באמצעות UHPLC ננו-זרימה מצמיד את ספקטרומטר מסת מלכודת orbitrap יון היברידי (מידע לא מוצג). בכל מחזור, בוצע orbitrap האיתור מלא MS אחד עם טווח הסריקה של 290 עד 1,400 מ '/ z, ברזולוציה של 60,000 (200 מ' / z) AGC 10 6. לאחר מכן, במצב רכישת נתונים תלוי יושם עם דינמיקה הדרת 30 שניות. סריקות MS / MS היו במעקב על יוני הורה מאלה האינטנסיביים ביותר. יונים עם מדינה אחראית אחד לא נכללו MS / MS. חלון בידוד של 2 מ '/ z היה בשימוש. יונים היו מקוטעים באמצעות דיסוציאציה מושרה התנגשות (CID) עם אנרגית התנגשות של 35%. זיהוי מלכודת יון שמש עם מצב טווח סריקה נורמלי קצב סריקה רגיל עם AGC 10 4.
נתונים גולמיים MS נותחו אימוץ תוכנה להפקת chromatograms מבשר שבר יון, כלומר Skyline 23 ו EpiProfile 22. EpiProfile עבר אופטימיזציה עבור פפטידים היסטון, כפי שהוא משתלב החילוץ אזור השיא אינטליגנטי בשל הידע הקודם של עידודזמן שמירה גא. מצד שני, קו רקיע הוא מותאם במיוחד DIA מנתח, וכך הדמויות DIA מוצג (איורים 4 ו -5 א) הם צילומי מסך מתוכנה זו. מן הכרומתוגרמה יון חילוץ, את השטח מתחת לעקומה מאוחזר, וזה משמש כדי להעריך את השפע של כל פפטיד. שטח שיא chromatographic חושבה עבור [M + H] + [M + 2H] 2 +, ו [3H M +] 3+ יונים מאותו פפטיד, למרות שברוב המקרים [2H M +] 2+ הייתה הצורה השכיחה. זה מספק שפע הגלם של צורה שונה נתונה של פפטיד. על מנת להשיג את השפע היחסי של PTMs, סכום כל הצורות השונות השונות של פפטיד היסטון נחשב 100%, ואת השטח של הפפטיד בפרט מחולק ע"י השטח הכולל לאותה פפטיד היסטון בכל צורותיה השונות שלה .
פפטידים היסטון נוכחים בתוך va riety של צורות isobaric (איור 5). פפטידים Isobaric, למשל, K18ac ו K23ac, ניתן לכמת רק ברמת MS / MS, שבו היונים שהברים הייחודיים שלהם משמשים כדי לקבוע את היחס בין מיני isobaric (איור 5 א ו 5 ב). יחס זה משמש לחלק את השטח של שיא chromatographic בין שני המינים. בעת שימוש DDA, צורות isobaric אלה נכללו ברשימת המונים ממוקדים, כי הפפטידים האלה צריכים להיבחר פיצול דרך elution כולו שלהם, אשר לא יתרחש ניסוי DDA סטנדרטי. האפליה של השפע היחסי של מינים isobaric מכן מבוצעת על ידי ניטור פרופיל elution של יונים שבר. סוג של רכישה מצד שני, DIA אינו דורש שום מרשימת כלילה. עם זאת, זה סוג של שיטת רכישה אינו עולה בקנה אחד עם חיפוש מסד נתונים מסורתי, ולכן עשוי למנוע גילוי פפטידים שונה ידוע.
התחת = "jove_content" FO: keep-together.within-page = "1"> acetylation ליזין (+ 42.011 Da) היה מופלים מן trimethylation כמעט isobaric (+ 42.047 Da) באמצעות ברזולוציה גבוהה רכישת MS (> 30,000). יתר על כן, acetylation יותר הידרופובי מ trimethylation, שמוביל elution של פפטידים acetylated יאוחר אלה trimethylated בהתאמה. הצורה ללא שינוי מאותו פפטיד elutes אפילו מאוחר יותר, בשל העובדה כי ליזין הוא propionylated. לסיכום, בסדר גודל של הידרופוביות עבור פפטיד עם האתר לשינוי אחד הוא דוּ ו trimethylated
hESCs הראה ירידה ברורה של פפטידים acetylated כאשר מגורה לבידול (איור 6 א ו 6 ב). הדבר לא היה מפתיע, כמו תוצאות קודמות דיווחו acetylation גבוהה ESCs לעומת אלה המבדילים 25,המשקף את האופי המתירני בדרך של הכרומטין פלוריפוטנטיים. על ידי התמקדות H3 היסטון, 35 צורות שונות שונות כומתו (איור 6 ג). עם זאת, כל proteoforms היסטון שניתן לחקור עם גישה זו יותר מ -200, כולל כל הגרסאות היסטון ושינויים שפע נמוך (מידע לא מוצג). יתר על כן, הניתוח שלנו הראה כי שחזור גבוה ניתן להשיג בין משכפל הטכני, כפי שמעיד גדליו הקטנים של ברי השגיאה (מייצג ± סטיית תקן). יחדיו, סעיף זה מתאר כיצד לחלץ את השפע היחסי של פפטידים שונה היסטון באמצעות נתונים nLC-MS.
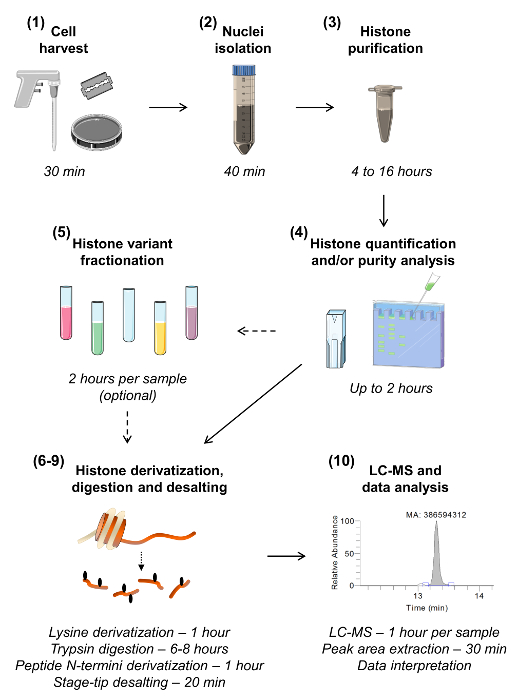
איור 1:. Workflow עבור ניתוח מלמטה למעלה MS / MS היסטון עשרת השלבים לניתוח היסטון נראים לעין, כולל הערכה של הזמן הנדרש לכל שלב. מספר הסעיף ניתן בסוגריים כמו הווה בכתב היד. סעיף 5, מתאר חלוקת מדגם לבודד את גרסות היסטון השונות, ניתן להשמיט, אלא אם יש צורך בניתוח רגישות הגבוהה של גרסה נתונה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
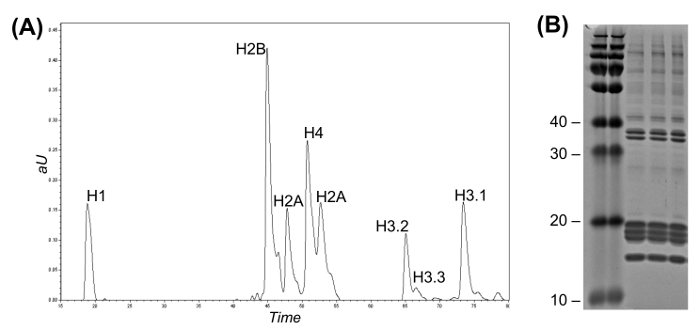
איור 2: הפוך-השלב הגבוה זרימת LC עבור היסטון Variant חלוק ו Coomassie ג'ל (א) chromatogram LC-UV מייצג הפרדה היסטון ללא פגע.. וריאנטים היסטון H3 יכול להיות מופלים זה מזה בהתאם לזמן elution שלהם. שברים ניתן לאסוף באופן ידני או באמצעות אספן חלק אוטומטי. (ב) Coomassie ג'ל של שלושה משכפל של טיהור היסטון.= "Https://www.jove.com/files/ftp_upload/54112/54112fig2large.jpg" target = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3:. ביצוע של שלב-tipping תקע עם קצה פיפטה P1000, אגרוף בלוח עגול עשוי C 18 חומר מדיסק מיצוי שלב מוצק (הפאנל השני). Minidisk שייחקק הקצה (הפנל באמצע), כך שהוא יכול להיות דוחף החוצה אל קצה פיפטה P100 הקטן / 200 באמצעות כל סוג של נימים קטנות. בדוגמא זו, השתמשנו צינורות סיליקה התמזגה קוטר חיצוני 700 מיקרומטר. Minidisk צריך להידחף לתחתית של קצה פיפטה P100 / 200, עד שלא תוכל ללכת יותר (הפאנל האחרון). הטיפ הבמה מוכן desalting היסטון, שכן יש קיבולת מספקת כדי לשמור על חומר מדגם מספיק משכפל רב. באופן ספציפי, minidisk אחת מספיקה עבור 15 - 20 מיקרוגרם של sample. אם יותר מדגם נדרש, מספר דיסקים יכול להיות ארוזים על אחד אחר. נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
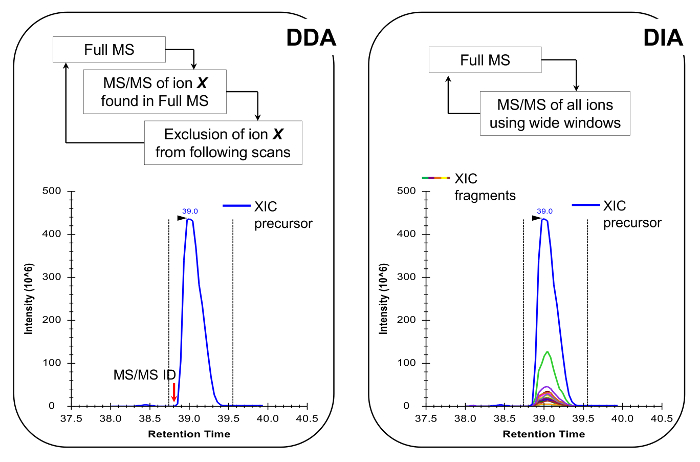
איור 4:. ייצוג סכמטי של שיטות DDA ו DIA בעת שימוש DDA, מחזור סריקת MS מאופיין מבחר רציפים של יונים מבשרים על פיצול MS / MS פי ועוצמתם ומדינת תשלום. פעם יון מבשר כבר מקוטע זה מושם לתוך רשימת הוצאה מן הכלל, כדי למנוע בחירה חוזרת ונשנית של אותו פפטיד, כך MS יכול "לחפור" לאותות פחות בשפע. שיטת הרכישה זוהי טכניקה של בחירה פרוטאומיקה עבור למצב גילוי. כימות מושגת על ידי שילוב אות הסריקה המלאה של יון נתון ליד MS המזוהית /ספקטרום MS. ב DIA, טווח m / z כולו מקוטע בכל מחזור סריקה. גישה זו היא פחות מתאימה למצב גילוי, אבל זה מייצר פרופיל chromatographic של כל היונים, מבשרים ומוצרים. זה מוביל בטוח יותר כימות ואפליה של צורות isobaric. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
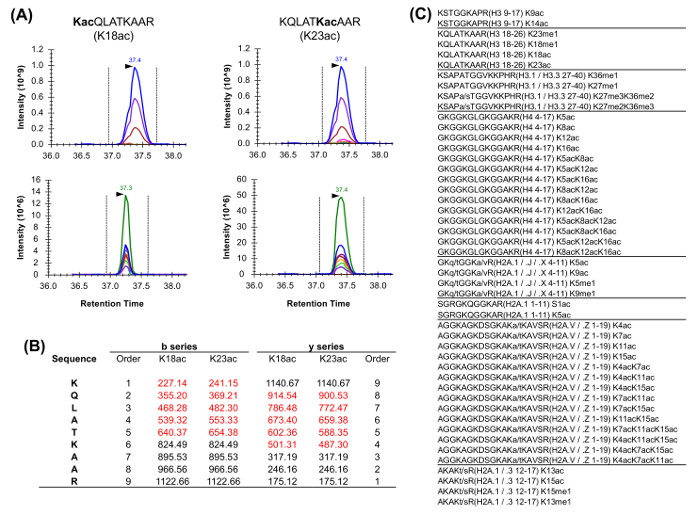
איור 5: כימות פפטידים Isobaric (א) דוגמה של שני פפטידים isobaric נפוץ בשפע ניתוח היסטון.. הכרומתוגרמה יון החילוץ (XIC) מסת מקדימם איזוטופים יחסית (מעל) זהה. עם זאת, XIC של יוני המוצר (להלן) מאפשר אפליה של שתי צורות isobaric. יש לציין, יונים ייחודיים שבר רק צריכים להיות לנוed להעריך את השפע היחסי של שני המינים. (ב) ייצוג של יונים שברים הייחודיים עבור שני פפטידים תארו (המסומן באדום). (ג) רשימה של פפטידים נתחו נפוץ ההומו ספיינס שיש לפחות שווה ערך isobaric אחד. רצף גרסאות בין פפטידים היסטון המפורטים מסומנים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
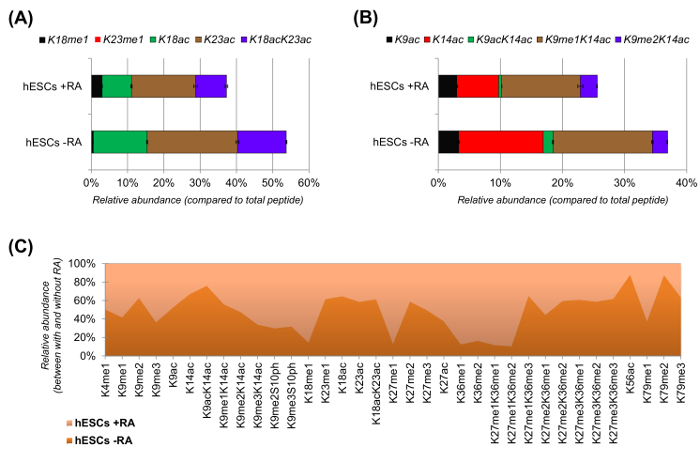
איור 6: תוצאות נציג של בתאי גזע עובריים אנושיים עם ובלי החומצה הרטינואית הטיפול (א) כימות יחסית של הפפטיד H3 היסטון KQLATKAAR (אא 18 - 26) בכל proteoforms שונה שלה.. השפע היחסי נאמד באמצעות כל proteoforms כמו 100% (את relאחוז ative של הפפטיד ללא שינוי אינו מוצג) (B) כימות יחסית של הפפטיד H3 היסטון KSTGGKAPR (אא 9 -.. 17) (ג) השפע היחסי של פפטידים זוהה עבור H3 היסטון הקנונית עם ובלי טיפול בתאי עם החומצה הרטינואית. הנתון מציין באיזה משני טיפולי השינויים הנתונים הם עשירים יותר (> 50%). בסך הכל, אנו מראים כי acetylation היסטון H3 יורד ברוב של השאריות ליזין על אינדוקציה של התמיינות תאים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| פתרון # | הרכב | ||||||
| 1 | מאגר בידוד גרעיני (NIB) המניות נעשית כדלקמן ומאוחסנים קפוא כמו aliquots 100 מ"ל ב -20 ° C; מופשרNIB יכול להיות מאוחסן על 4 מעלות צלזיוס במשך כמה שבועות: 15 מ"מ טריס, 60 KCl מ"מ, 15 מ"מ NaCl, 5 מ"מ 2 MgCl, 1 מ"מ CaCl 2, ו -250 סוכרוז מ"מ. ה- pH של המאגר מותאם 7.5 עם HCl. | ||||||
| 2 | מעכבי פרוטאז (להוסיף טרי מאגרים לפני השימוש): 1 M Dithiothreitol (DTT) ב DDH 2 O (1,000x); 200 מ"מ AEBSF DDH 2 O (400x) | ||||||
| 3 | מעכב phosphatase (להוסיף טרי מאגרים לפני השימוש): 2.5 מיקרומטר Microcystin ב 100% אתנול (500x) | ||||||
| 4 | מעכב HDAC (להוסיף טרי מאגרים לפני השימוש): 5 M בוטיראט נתרן, שנעשו על ידי טיטרציה של חומצה 5 M בוטירית באמצעות NaOH ל -7.0 pH (500x) | ||||||
| 5 | NP-40 האלטרנטיבי: / v 10% נ ב DDH 2 O | ||||||
| 6 | 0.2 MH 2 SO 4 ב DDH 2 O | ||||||
| 7 | חומצה Trichloroacetic (TCA): 100% w / v ב DDH 2 O | ||||||
| 8 | אצטון + 0.1% חומצה הידרוכלורית (HCl): 0.1% v / v HCl אצטון | ||||||
לוח 1. פתרונות.
Discussion
הפרוטוקול המתואר כאן הוא מותאם בהתחשב עלויות, זמן, וביצועים. תכשירים אחרים אפשריים, אך יש להם מגבלות, במיוחד במקרה של צימוד עם ניתוח MS. למשל, פרוטוקול מיצוי גבוהה מלח יכול לשמש כדי לטהר היסטונים 26 במקום ממטרים TCA (סעיף 3). פרוטוקול גבוהה מלח הוא עניין מתון, כפי שהוא אינו משתמש חומצה חזקה. זו שומרת PTMs חומצה-יציבה ומגדילה את התשואה של היסטונים חילוץ, כמו ממטרי TCA שיתוף משקעים רבים חלבונים מחייבי אחרים הכרומטין. עם זאת, מיצוי גבוהה מלח מוביל דגימות המכילות מלח מרוכז מדי עבור HPLC-MS / MS. בשנת הכנה חלופית, עיכול היסטון יכול להתבצע ללא propionylation (סעיף 6 - 8), למשל על ידי צמצום זמן דגירת טריפסין ויחס אנזים / מצע 27 או באמצעות argc כמו אנזים עיכול 28-30. עם זאת, derivatization עם אנהידריד propionic מומלץ, כפי שאניt מוביל לדור של פפטידים הידרופובי יותר, אשר נשמרים טובים יותר במהלך כרומטוגרפיה נוזלית.
עבור derivatization הכימי, מגוון פטאליק חומצה אורגני הוערך ו לגופן נדון באופן מקיף 18. אף על פי כן, אנהידריד propionic הוכיח את הפשרה הטובה ביותר בין מוצרי צד יעילים, ממוזער הידרופוביות פפטיד משופרות. פוטנציאלית, אנהידריד propionic ניתן לרכוש בצורה שכותרתו isotopically; זה מאפשר ניתוח ריבוב בשל האפשרות של ערבוב דוגמאות רבות ולהפלות אותם ברמת MS מבוססת על המסות השונות הנחילו מההתוויה הכבדה. עם זאת, ניתוח זה מוביל מורכב גובר של chromatogram LC-MS ומפחית את כמות המדגם כי ניתן להזריק עבור כל תנאי יחיד.
בהקשר זה, כמה היבטים קריטיים של הפרוטוקול צריכים להיות מודגשים. ראשי הפרקים שלהלן אמורים לשמש checklist למצוא טעויות ביצוע ההליך במקרה תוצאות שליליות מתקבלות. ראשית, לאחר ממטרי גרעינים הגלולים יש לשטוף היטב עם NIB ללא NP-40 אלטרנטיבי (סעיף 2.10) עד להסרה מוחלטת של חומרי הניקוי (מורגש על ידי חוסר הבועות במהלך ערבוב). אם לא יעשה זאת יפגע חילוץ היסטון עם חומצות. שנית, לאחר ממטרים היסטון עם TCA (סעיף 3.9) שוטף של הגלולה עם אצטון הוא קריטי. נוכחות של חומצה מרוכזת תפגע בשלב הבא אם propionylation ועיכול (סעיף 6.1) מתבצעים בחלקם ישירות. זה יהיה לא בעייתי חלוקה היסטון במקרה מתבצע (סעיף 5). שלישית, זה הכרחי כי תגובת propionylation מתבצעת במהירות (סעיף 6.3 - 6.7). לשם כך, יש להימנע משימוש באותו תמהיל propionylation (אנהידריד propionic + אצטוניטריל) במשך יותר מ 3 - 4 דגימות רצופות. בנוסף, pH הוא ההיבט החשוב ביותר של מערכת העיכול טריפסין (סעיף 7). אם לאסביב 8.0 (7.5 - 8.5) לעיכול יהיה יעיל. זה יכול לקרות, כמו המדגם יהיה עשיר בחומצת propionic בשלב זה. ניתן להוסיף NH 4 OH עד לשימוש בהן. כמו כן, לחוקרים מכירים זרימות עבודת פרוטאומיקה זה ירגיש נורמלי להפוך לחומצה המדגמת לסיים עיכול טריפסין. זה לא צריך להיעשות, כפי שהוא יסכן את התגובה הבאה, כלומר, propionylation של פפטיד N-טרמיני (סעיף 8.1). לבסוף, באותו גיליון, חשוב לזכור לניתוח נתונים כי פפטידים ללא שינוי הם לא באמת ללא שינוי; כל שאריות ליזין ו- N-Termini חינם תהיינה תפוסות על ידי propionylation (56.026 Da). לכן, ביצוע כרומטוגרפיה יון לחילוץ של המסה המתאימה באופן ייחודי על רצף הפפטיד יוביל ללא תוצאות.
המגבלות של השיטה הן בעיקר קשורים לחוסר היכולת של גילוי PTMs קומבינטורית, בשל רצף הפפטידים הקצר, ואת ההטיות בהשגת abun נכוןריקוד של שינוי, בשל העובדה כי פפטידים בצורות שונות שונות עשויים ליינן עם יעילות שונה. הנושא הראשון ניתן לפתור על ידי שילוב טכניקה זו עם מטה-באמצע או גישה מלמעלה למטה (הנסקרת ב 16). סוג זה של ניתוח, גם אם מאתגר יותר מבחינה טכנית, הוא אידיאלי עבור לומדי תדרים-קיום של שינויים. יתר על כן, היא מאפשרת אפליה טובה יותר של וריאנטים היסטון, אשר לא ניתן להשיג תמיד עם מלמטה למעלה מאז פפטידים מסוימים יש את אותו רצף גרסאות היסטון שונים. הנושא השני, הקשורים יעילות יינון, ניתן לפתור באמצעות ספריה של פפטידים סינתטיים 31. גישה זו מבטיחה הערכה מדויקת יותר של השפע היחסי של PTMs היסטון. עם זאת, ברוב הניסויים, התוצאה הרצויה היא השינויים ביחס של שינויים נתונים בין תנאים מנותחים. במקרה זה, תיקון כזה אינו הכרחי, בשל העובדה כי יש כל הדגימות באותו BIAים.
לסיכום, פרוטוקול זה מאפשר ניתוח של PTMs היסטון שיכולה להסתיים בתוך 3 ימים באמצעות nLC מצמידים טנדם MS. השוואות עם טכניקות אחרות מאשר MS, כלומר, באמצעות אסטרטגיות מבוססות נוגדנים כפי שפורט במבוא, אינם מתאימים, כמו שהם לא יכולים להשיג אפילו כמעט רמה זו של תפוקה. בנוסף, טכניקות המבוססים נוגדן לא תאפשרנה הגילוי של שינויי רומן, אבל הם מבוססים אך ורק על אישור וכימות סימני חזה. כך אנו משערים כי פרוטאומיקה מלמטה למעלה על פפטידים היסטון יהיה לצבור פופולריות במעבדות חקר חלבונים בשל היתרונות אינטואיטיבי לדעת הסדרת סימני היסטון, שהן גיבורים בביטוי גנים טיונינג ובכך להשפיע על הרגולציה של proteome. יתר על כן, פרוטוקול המתואר כולל השיפורים האחרונים בהכנת מדגם ותוכנות לניתוח נתונים, ההופכים ניתוח היסטון טריוויאלי יותר גם עבור laboraהטורים כי מעולם לא חוו אפיון של סוג זה של פפטידים hypermodified.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מימון ממענקים NIH (DP2OD007447, R01GM110174 ו R01AI118891).
Materials
| Name | Company | Catalog Number | Comments |
| Trypsin 0.25% EDTA | Invitrogen | 25200056 | For harvesting cells |
| PBS | Invitrogen | 14200075 | |
| Tris | Roche | 77-86-1 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Sodium Chloride | Sigma | S9888 | |
| Magnesium Chloride hexahydrate | Sigma | M9272 | |
| Calcium Chloride, anhydrous | Sigma | C1016 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| DTT | Invitrogen | 15508-013 | |
| AEBSF | EMD Millipore Corp | 101500 | |
| Microcystin | Sigma | M4194 | |
| Sodium Butyrate | Sigma | B5887 | |
| Halt Protease and Phosphatase Inhibitor Cocktail, EDTA-free (100x) | Fisher Scientific | 78445 | |
| NP- 40 Alternative | CALBIOCHEM | 492016 | |
| Sulfuric Acid, ACS grade | Fisher Chemical | 7664-93-9 | |
| Trichloroacetic acid | Sigma | T6399 | |
| Acetone | Sigma | 179124 | |
| HCl | Fisher Chemical | A144-500 | |
| Bradford reagent | Biorad | 500-0006 | |
| 30% acrylamide/bis 29:1 — 500 ml | Biorad | 1610156 | |
| Coomassie | Fisher Scientific | 20278 | |
| C18 Column (5 µm) 2.1 mm x 250 mm | Grace | 218TP52 | |
| C18 Column (5 µm) 4.6 mm x 250 mm | Grace | 218TP54 | |
| HPLC grade acetonitrile | Fisher Chemical | A955-4 | |
| HPLC grade water | Fisher Scientific | W6 4 | |
| TFA | Fisher Scientific | A11650 | |
| Ammonium Bicarbonate | Sigma | A6141 | |
| ammonium hydroxide | Sigma | 338818 | |
| propionic anhydride | Sigma | 240311 | |
| Sequencing grade modified trypsin | Promega | PRV5113 | For digesting histones for MS |
| Acetic Acid | Sigma | 49199 | |
| C18 extraction disk | Empore | 2215 | |
| Formic Acid | Sigma | F0507 |
References
- Waddington, C. H. Canalization of development and the inheritance of acquired characters. Nature. 150, 563-565 (1942).
- Sharma, S., Kelly, T. K., Jones, P. A. Epigenetics in cancer. Carcinogenesis. 31 (1), 27-36 (2010).
- Reik, W., Dean, W., Walter, J. Epigenetic reprogramming in mammalian development. Science. 293 (5532), 1089-1093 (2001).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128 (4), 693-705 (2007).
- Tessarz, P., Kouzarides, T. Histone core modifications regulating nucleosome structure and dynamics. Nat Rev Mol Cell Bio. 15 (11), 703-708 (2014).
- Fischle, W., Wang, Y. M., Allis, C. D. Histone and chromatin cross-talk. Curr Opin Cell Biol. 15 (2), 172-183 (2003).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Simboeck, E., et al. A Phosphorylation Switch Regulates the Transcriptional Activation of Cell Cycle Regulator p21 by Histone Deacetylase Inhibitors. J Biol Chem. 285 (52), 41062-41073 (2010).
- Hirota, T., Lipp, J. J., Toh, B. H., Peters, J. M. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature. 438 (7071), 1176-1180 (2005).
- Xhemalce, B., Kouzarides, T. A chromodomain switch mediated by histone H3 Lys 4 acetylation regulates heterochromatin assembly. Genes Dev. 24 (7), 647-652 (2010).
- Vermeulen, M., et al. Quantitative interaction proteomics and genome-wide profiling of epigenetic histone marks and their readers. Cell. 142 (6), 967-980 (2010).
- van Attikum, H., Gasser, S. M. Crosstalk between histone modifications during the DNA damage response. Trends Cell Biol. 19 (5), 207-217 (2009).
- Fernandez-Capetillo, O., et al. H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis. Dev Cell. 4 (4), 497-508 (2003).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. Embo J. 28 (17), 2511-2531 (2009).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Sidoli, S., Cheng, L., Jensen, O. N. Proteomics in chromatin biology and epigenetics: Elucidation of post-translational modifications of histone proteins by mass spectrometry. J Proteomics. 75 (12), 3419-3433 (2012).
- Plazas-Mayorca, M. D., et al. One-Pot Shotgun Quantitative Mass Spectrometry Characterization of Histones. J Proteome Res. 8 (11), 5367-5374 (2009).
- Sidoli, S., et al. Drawbacks in the use of unconventional hydrophobic anhydrides for histone derivatization in bottom-up proteomics PTM analysis. Proteomics. 15 (9), 1459-1469 (2015).
- Lin, S., Garcia, B. A. Examining histone posttranslational modification patterns by high-resolution mass spectrometry. Methods Enzymol. 512, 3-28 (2012).
- Sidoli, S., et al. SWATH Analysis for Characterization and Quantification of Histone Post-translational Modifications. Mol Cell Proteomics. , (2015).
- Krautkramer, K. A., Reiter, L., Denu, J. M., Dowell, J. A. Quantification of SAHA-Dependent Changes in Histone Modifications Using Data-Independent Acquisition Mass Spectrometry. J Proteome Res. , (2015).
- Yuan, Z. F., et al. EpiProfile Quantifies Histone Peptides With Modifications by Extracting Retention Time and Intensity in High-resolution Mass Spectra. Mol Cell Proteomics. 14 (6), 1696-1707 (2015).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Yuan, Z. F., Lin, S., Molden, R. C., Garcia, B. A. Evaluation of proteomic search engines for the analysis of histone modifications. J Proteome Res. 13 (10), 4470-4478 (2014).
- Tan, Y., Xue, Y., Song, C., Grunstein, M. Acetylated histone H3K56 interacts with Oct4 to promote mouse embryonic stem cell pluripotency. Proc Natl Acad Sci U S A. 110 (28), 11493-11498 (2013).
- Vonholt, C., et al. Isolation and Characterization of Histones. Methods Enzymol. 170, 431-523 (1989).
- Zhang, K. L., et al. Identification of acetylation and methylation sites of histone H3 from chicken erythrocytes by high-accuracy matrix-assisted laser desorption ionization-time-of-flight, matrix-assisted laser desorption ionization-postsource decay, and nanoelectrospray ionization tandem mass spectrometry. Anal. Biochem. 306 (2), 259-269 (2002).
- Jufvas, A., Stralfors, P., Vener, A. V. Histone Variants and Their Post-Translational Modifications in Primary Human Fat Cells. Plos One. 6 (1), e15960(2011).
- Bonaldi, T., Imhof, A., Regula, J. T. A combination of different mass spectroscopic techniques for the analysis of dynamic changes of histone modifications. Proteomics. 4 (5), 1382-1396 (2004).
- Zhao, X. L., et al. Comparative Proteomic Analysis of Histone Post-translational Modifications upon Ischemia/Reperfusion-Induced Retinal Injury. J Proteome Res. 13 (4), 2175-2186 (2014).
- Lin, S., et al. Stable-isotope-labeled histone peptide library for histone post-translational modification and variant quantification by mass spectrometry. Mol Cell Proteomics. 13 (9), 2450-2466 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved