Method Article
ヒストンの抽出からデータ解析まで:ボトムアップ質量分析法を用いてヒストンの翻訳後修飾の解析のための完全なワークフロー
要約
このプロトコルは、質量分析(MS)を用いて、ヒストンの翻訳後修飾を特徴付けるための完全に統合されたワークフローの概要を説明します。ワークフローは、ナノ流液体クロマトグラフィーおよびデータ分析のための命令を使用して、細胞培養物または組織、ヒストン誘導体、消化、MS分析から、ヒストンの精製を含みます。 3日 - プロトコルは2以内に完了するために設計されています。
要約
ヌクレオソームはヒストンタンパク質の八量体に巻き付けDNAの147塩基対で構成されるクロマチンの最小構造単位です。ヒストン関数は核タンパク質の無数によって広範な翻訳後修飾によって媒介されます。それらは、クロマチン構造を調節し、遺伝子調節、DNA修復および染色体凝縮に関与する酵素を補充するように、これらの修飾は、核の完全性のために重要です。科学界の大部分は、ヒストンPTMの豊富さを特徴づけるために抗体ベースの技術を採用しているにもかかわらず、エピトープは近くの変更によって妨害されるかもしれないように、これらのアプローチは、低スループットとhypermodifiedタンパク質に対するバイアスされています。このプロトコルは、ヒストン修飾の正確な定量化のためのナノ液体クロマトグラフィー(NLC)および質量分析(MS)の使用を記載しています。この方法は、ヒストンのPTMの多種多様な、いくつかのヒストンの相対量を特徴付けるために設計されている秒以内にバリアントイングル分析します。長さが20アミノ酸 - このプロトコルでは、ヒストン5のペプチドを生成するために、トリプシンで消化し、続いて無水プロピオン酸を用いて誘導体化されています。消化後、ヒストンペプチドの新たに露出したN末端は、NLC-MS時のクロマトグラフィー保持を改善するために誘導体化されます。この方法は、4桁に及ぶヒストンのPTMの相対的な定量を可能にします。
概要
エピジェネティクスは、基礎となるDNA配列1を変更する以外のメカニズムによって生じる遺伝子発現の遺伝の変化の研究として定義されています。エピジェネティック制御は、生物がそのDNA内容が変更されないにもかかわらず、劇的な表現型の変化を受けるように開発中に重要です。異なる機構2を介して遺伝子発現に影響を与えるこれらの各々は、ヒストンの翻訳後修飾(PTMを)、ヒストン変異体、非コードRNA、DNAメチル化およびDNA結合因子を含む、適切なエピジェネティックな維持のために必要ないくつかの重要なコンポーネントがあります。 DNAメチル化は、遺伝子変換3を抑制する高安定変形であるが、例えば、ヒストン変異体とヒストンのPTMは、より動的であり、方法4の様々なクロマチンに影響を与えることができます。
それらは最も露出し、柔軟な領域であるとして、ヒストンのPTMは、主に、N末端尾部に局在していますタンパク質の。しかし、ヌクレオソームコアも重く平均タンパク質5に比べて変更されます。ヒストンマークが広く10年で特徴づけられているにもかかわらず、既知のヒストンマークとその機能との間には多くのリンクは依然として不明です。これは、ほとんどのヒストンのPTMは、転写6,7のような特定のプロセスを変更するために他のPTM(「クロストーク」)と並行して、むしろ機能を単独で動作しますが、ないという事実によるところが大きいです。例えば、遺伝子p21の上の組合せマークH3S10K14acは2のPTM 8の一方だけでは発生しないであろうその転写を活性化します。タンパク質HP1はH3K9me2を/ ME3を認識し、近くのヌクレオソームへの変更を広げることによってクロマチンを圧縮します。隣接S10は9リン酸化されるときしかし、HP1はH3K9me2を/ 3をバインドすることはできません。 H3K4のアセチル化は、 分裂酵母 10でH3K9me2を/ ME3へのタンパク質spChp1の結合を阻害します。さらに、ヒストンリジンDemethylase PHF8は3のPTM H3K4me3と、K9ac、およびK14acが11存在している最高のヌクレオソーム結合効率を有します。これらの例は、ヒストンPTM変更のグローバルな概要を達成するのではなく、単一の修正に焦点を当てたことの重要性を強調しています。
配列の存在はまた、変異体は、ヒストンアイソタイプは、一般的に非常に類似した配列を持っているように、ヒストン分析の複雑さを増大させるが、しばしばクロマチンで異なる役割を持っています。例えば、H2A。Xは、より簡単に正規のH2A 12と比較して、DNA損傷時にリン酸化されるC末端配列を有し、それは男性のマウスの減数分裂13における性染色体の不活性化のために必要とされます。同様に、CENP-Aはセントロメア14で標準的なヒストンH3を代入します。それらの異なった機能にもかかわらず、これらの変異体を同定し、それらを別々に定量化することが困難になる、それぞれの正規化ヒストンとのアミノ酸配列の大部分を共有します。
例えば、ウェスタンブロッティングなどの抗体ベースの技術は広範囲にヒストンを特徴付けるために採用されています。しかし、抗体ベースのアプローチは、次の理由で制限されています:(ⅰ)彼らが唯一の変更の有無を確認することができ、未知のPTMを識別することはできません。 (ii)は、それらが原因の結合親和性に影響を与えることが共存マークの存在にバイアスされています。ごく少数の抗体がそのような目的のために利用可能であり、(iv)は、彼らは非常に類似したヒストン変異体または類似のPTM( 例えば 、ジ-およびリジン残基のトリメチル)との間で交差反応として(iii)の彼らは、コンビナトリアルマークを識別することはできません。 Egelhofer ら 。市販の抗体の25%以上が、ドットブロットまたはウェスタンブロットによって特異性試験に失敗していることを説明し、かつ特異的な抗体の間で20%以上は、クロマチン免疫沈降実験15で失敗します。質量分析(MS)は、現在、新規および/または組み合わせのPTMを研究するための最も適切な分析ツールです、それは広範囲に(16に概説)ヒストンタンパク質のために実装されています。これは、主に高感度とMSの質量精度によるものであり、大規模に実行する可能性を分析します。
( - 20 AA 5)ボトムアップ戦略は、無傷のタンパク質は、酵素的に短いペプチドに消化されたヒストンの特性評価とそのPTMを、のための最も一般的に使用されるMSベースのプロテオミクス戦略です。この消化はLC分離とMS検出の両方を容易にします。 600の範囲で大衆 - 2000 Daが、一般的に、より容易にイオン化され、より大きな塊よりも高い質量精度と分解能で識別されます。 MS / MS断片化はまた、短いペプチドは、一般に衝突誘起解離(CID)のために適している、改善されています。彼らは高度に塩基性アミノ酸残基、すなわち、リジンおよびアルギニンに富んでいるようしかし、ヒストンは、ボトムアップ型MSのための課題を提示します。そのため、トリプシン消化があまりにもSMであるペプチドの生成につながりますすべてのLC保持とのPTMの明確な局在化のため。この問題を回避するために、我々のプロトコルは、リジンおよびペプチドN末端 の化学的誘導体17を含んでいます 。プロピオン酸無水物の使用は、他の試薬18と比較して効率的な化学誘導体化のために推奨されます。トリプシンのみアルギニン残基のC末端側でタンパク質分解を実行することができ、このような誘導体化ブロックの非修飾およびモノリシン残基のɛアミノ基を、。誘導体化されたアミンは、溶液とプロトンを交換することができないので、ペプチドは、MSおよびMS / MS検出を容易にする、一般的にのみ、二重または三重に荷電されています。また、N末端の誘導体化は、ペプチドの疎水性、従って、逆相クロマトグラフィーの保持を増大させます。ここでは、ヒストンを精製し、ボトムアッププロテオミクス( 図1)を介して、PTM分析のためにそれらを準備するためのワークフローを説明します。この戦略は、単一のヒストンマークと組合せマークfの定量化を実現しますアミノ酸配列の比較的近いまたはヒストンのPTM。
プロトコル
文化からの細胞の1コレクション
- 細胞を懸濁液中で成長させた場合に、5分間、300 RCFでの遠心分離によって細胞を収集します。付着した場合、吸引および細胞培地を捨てます。 Ca 2+およびMg 2+を含まないPBSで付着した細胞を洗浄(PBSは、今後とも呼ばれます)。細胞は、(時間が異なる細胞株について異なる)デタッチするまで、37℃でプレートの表面を被覆するのに十分な量で - (0.5%は、細胞株に応じて0.025%)トリプシン又はトリプシンEDTAのいずれかで細胞をインキュベートします。
- 5分間300 RCFの遠心分離によって細胞を収集します。 PBSで細胞を2回洗浄し、遠心分離によって収集します。
- 卒業から約パック細胞容積を推定1.8ミリリットルチューブまたは15ミリリットルコニカルチューブにマーク。
注:培養物から細胞を液体窒素中でスナップ凍結し、この段階で-80℃で無期限に保存することができます。
無傷の細胞からの核の2の単離
- 氷上で細胞を解凍します。
- 解凍核単離緩衝液(NIB、 表1)。
- すべての100μlのパック細胞容積は約5ミリリットルNIBバッファー( 表1)を準備します。 1 M DTTを1μl、200mMのAEBSF、2.5μMのミクロシスチンと5 M酪酸ナトリウムの2μlに2μlの2.5μLを次のようにすべての1ミリリットルNIBバッファのために、プロテアーゼ阻害剤を添加し、安定化剤。阻害剤とのNIBは、この時点からNIBと呼ぶことにします。
注:ヒストンのリン酸化が検討されている場合、EDTAフリープロテアーゼおよびホスファターゼ阻害剤カクテルを含みます。 - NIBバッファの第五の容量このようにして調製を削除し、0.2%の最終濃度にNP-40の代替( 表1)を追加します。残りの4つの五量は、洗浄のために使用されます。
- NP-40の代替率なしNIB 1:10細胞ペレットで洗浄細胞ペレット(v / v)です。 5分間700 RCFで遠心分離して上清を取り除きます。
- 溶解CEL氷の上に置き、0.2%NP-40の代替とNIB 1:10細胞ペレットを添加することにより、Lペレット(v / v)です。
- 組織サンプルから抽出する場合は、乳鉢と乳棒またはダウンスホモジナイザーを用いてホモジナイズします。培養細胞を穏やかなピペッティングにより均質化することができます。
- 10分 - 5のために氷上でホモジナイズした細胞をインキュベートします。細胞は核を溶解し、解放します。
- 4℃で10分 - 5 1,000 RCFで遠心分離します。上清は、主に細胞質成分が含まれていながら、ペレットは、主に細胞核に含まれています。所望であれば、細胞質画分を保存します。
- 優しくNP-40の代替なし1:10(v / v)のNIBでそれを再懸濁することにより核ペレットを洗浄。
注:この洗浄工程の前核からヒストンを抽出する界面活性剤の痕跡を除去するためだけです。 - 4°Cで5分間千RCFで遠心分離し、上清を除去します。
- 繰り返しステップ2.10から2.11に少なくとも2回完全NP-40の代替を除去します。 NP-40の代替の除去は明らかaは洗浄工程は、もはや気泡を形成中に、穏やかにピペッティングしね。
- 組織からのヒストンの抽出のための:
- 氷のように冷たいNIB新鮮なまたは解凍した凍結組織をすすぎます。
- ウェットティッシュを維持するだけの十分な、NIBと氷の上に置いたペトリ皿に組織を転送します。
- 核の単離のための表面接触を増加させるためにカミソリの刃を有する最小個(<1 mm)の中にダイス。
- 予備冷却ホモジナイザーに細分化した組織を移し、ピペッティングによりNIBで洗います。
- 5分間300 RCFで遠心分離することにより、バッファを削除してください。
- 細胞中の細胞にNIB含むNP-40の代替を追加します:1時10分の比率をバッファ(v / v)であり、5によって均質化 - 10ストローク。
- 細胞溶解を確認し、必要に応じて均質化を繰り返します。細胞が溶解されていることを示す良い指標は、ペレット容積の減少です。ペレットは、核のみを含める必要があります。
- 5分間700 RCFで遠心し、ペレットを保存します。 2より多くの時間 - このペレットは1を抽出することができますNP-40を含有する代替NIBの1:10(v / v)の中での、この段階で、ヒストンは、クロマチンから抽出され、ペレットが著しく収縮しています。
- 洗剤の痕跡を除去するためにNP40代替することなく、NIBの3ミリリットル - 2で2回洗浄します。
注:中間停止点:サンプルは、NIB + 5%グリセロールの最小体積で再懸濁し、-80℃で保存することができます。
核からのヒストンの3抽出および精製
注:ヒストンはしっかりとDNAのリン酸骨格と相互作用するそれらを可能にする、塩基性アミノ酸残基が非常に豊富です。ヒストンは、核内の最も基本的なタンパク質の一つである、従ってそれらを強酸で沈殿非ヒストンタンパク質からの最小限の汚染との氷冷硫酸(0.2 MH 2 SO 4)で抽出することを可能にします。 (33%の最終濃度まで)高濃度のTCAは、次いで硫酸からヒストンを沈殿させるために使用することができます酸。 TCAは、4℃で褐色瓶100%として格納されます。
- 1での再懸濁細胞核:5(V / V)を、穏やかにピペッティングにより0.2 MH 2 SO 4( 表1)を冷やし。
- 4℃で4時間 - 一定の回転または2のために穏やかに振盪しながらサンプルをインキュベートします。一般的に、500以上のμlの細胞ペレットを有するサンプルのために、2時間の抽出は、ヒストンを抽出するのに十分です。より長いインキュベーションは、他の塩基性タンパク質の抽出をもたらし得ます。小さい核ペレットについて(<200μl)を、4時間の抽出は、より良い歩留まりを提供します。
- 5分間、4℃で3400 RCFで遠心分離します。
- 上清を新しいチューブに移します。
- 任意の不溶性物質を除去するために3.4 - 手順3.3を繰り返します。
- ヒストンを沈殿させ、1の比で(現在ヒストンを含む)を回収した上清に冷却した100%TCA( 表1)を追加:3(v / v)で、33%の最終TCA濃度を得るために。チューブを数トンを転倒混和IME。
注:サンプルは、ヒストンの存在を示す、TCAのほかに曇っなります。 - 少なくとも1時間氷上で混合物をインキュベートします。小さい出発ペレットサイズの場合、一晩沈殿が推奨されます。
- 5分間3400 RCFで遠心分離します。また、チューブの側面と底に堆積ヒストンコート。白い不溶性ペレットはまた、主に非ヒストンタンパク質および他の生体分子が含まれているチューブの一番下に形成しています。慎重に両側またはペレットを掻き取ることなく、吸引により上清を取り除きます。
- 側面および底面を被覆する沈殿したタンパク質を覆うようにガラスパスツールピペットを用いて、氷冷アセトン+ 0.1%のHCl( 表1)を用いてチューブをリンス。
- 慎重に両側またはペレットを掻き取ることなく、2分を吸引上清のための3400 RCFで遠心分離します。
- 100%の氷冷アセトンを用いて、3.10 - 手順に3.9を繰り返します。
- 空気の流れを伴うまたはバキュとドライペレットええと、または単に開いたチューブを残すことによって遠心します。アセトンは急速に蒸発します。
- 完全白色層を溶解することが可能で、最小容量でのddH 2 O(蒸留水)とヒストンを溶解します。ヒストンは、水に容易に溶解します。 1.5ミリリットルマイクロ遠心チューブ内のペレットを100μlのddH 2 Oの場合は、通常、ヒストンを収集するのに十分です。
- 2分間3400 RCFで遠心分離し、上清を新しいチューブに移します。
タンパク質濃度および純度の4推定
- タンパク質濃度を測定するため、BCA、Bradfordタンパク質アッセイまたはアミノ酸分析(AAA)を使用します。ヒストンは、芳香族アミノ酸残基に劣っているように、280nmの吸光度を採用して技術を使用しないでください。
- 15%アクリルアミドゲル及びクマシー染色(オプション)とのSDS-PAGE分析によって抽出されたヒストンの純度を確認してください。
- 高純度の単一ヒストン変異体が望ましい場合、のHPLC-UV分画に進みヒストンバリアント(第5節)。ない場合は、ボトムアップヒストンPTM解析(セクション6)のための準備をサンプリングするために直接進んでください。
逆相HPLCによるヒストンバリアントの5.分離(オプション)
注:高純度ヒストン変異体は、UV検出器に結合された逆相HPLCを用いて粗ヒストン混合物を分画することにより得ることができます。これらの精製されたヒストンは、より高い感度と純度を必要とする研究に有用です。分析は十分な感度と網羅あるのでしかし、標準的なヒストンPTMの特徴付けのために、このステップをスキップすることができます。出発物質の300μgの - 無傷のヒストンの分別は、理想的には少なくとも100を必要とする変異体です。
- 、約100μgヒストンのと0.2ミリリットル/分の流速で2.1ミリメートル×250 mmカラムを使用します。:開始ヒストン濃度に応じてHPLCに適切なC 185μmのカラムを接続します約300μgのヒストンと、で4.6×250 mmカラムを使用0.8ミリリットル/分の流速。次のように専用のガラス器具を使用して、緩衝液AとBを準備します。
- HPLCグレードの水に5%のHPLCグレードのアセトニトリル、0.1%TFA:緩衝液Aを準備します。
- HPLC等級の水で95%、HPLCグレードのアセトニトリル、0.1%TFA:緩衝液Bを準備します。
- UV検出器にカラムを接続し、210に吸光度を設定 - 220 nmの。
- 0.1-1%TFAの最終濃度を達成するために、100%TFAを含む水に溶解したヒストンサンプルを酸性化。
- 3カラム体積にほぼ相当推奨流量、少なくとも15分間は100%緩衝液Aでカラムを平衡化します。 UV検出器のゼロ吸光度レベルを設定するには、この信号を使用します。
- 手動または自動サンプルコレクターで分画を収集するために適切なサイズのチューブを準備します。
- 約1μgの/μlの以上の濃度でサンプルを注入します。より大量に溶解したサンプルは、列デュの平衡を変化させる可能性があります下保持するリングロードとリード。
- 勾配を実行し、次のようにプログラムされた:1分で0〜30%のB、90分で30〜60%のB、1分で60〜90%Bから。
- 自動フラクションコレクターを使用して、1分間隔で(例えば、クロマトグラムを図2に示す)の画分を収集します。ボリューム全体を含むように適切なサイズのチューブ内の画分を収集します。
- 真空濃縮器で分画したサンプルを下に乾燥させます。
注:中間停止点:乾燥ヒストン画分短い期間室温で貯蔵することができる - 長期期間(1~2日)または-80℃の冷凍庫です。
ボトムアップ分析のための無水プロピオン酸を用いたヒストンの6化学誘導体化
- 50mMのNH 4 HCO 3の40μlのヒストンサンプルを溶解し、pHを8.0(推奨量:50から100μgの)。サンプルは純粋なのddH 2 Oであった場合は、50 mMの、pHが8を構成するために濃NH 4 HCO 3を追加します。0。
- サンプルの損失なしpH指示薬ストリップを用いてpHをチェックするために試料中にP10ピペットチップを濡らします。 NH 4 OHとギ酸を8.0にpHを調整するために使用することができます。
注:プロトコル(6.3ステップ - 6.7)の以下の部分は、反応性無水プロピオン酸を維持するために、最大3〜4のサンプルのバッチで行われるべきです。 - プロピオン酸無水物が使用され、後続のステップのためのドラフトチャンバーを使用してください。比1アセトニトリルと無水プロピオン酸を混合することによって新鮮プロピオニル試薬を調製する:3(v / v)です。 1でサンプリングするプロピオニル試薬を加える:4(v / v)です。 40μlのヒストンは、10μlのプロピオニル試薬を追加します。
注:このステップで白色破片を観察することが可能です。しかし、これはほとんどの塩およびプロピオン酸を含み、従って、特定のアクションが取られる必要はありません。 - 迅速にソリューションを再確立pHを8.0にNH 4 OHを追加します。注:ペプチドの遊離アミンと反応プロピオン酸無水物は、小道具を生成pH値を低下させるイオン酸。通常、1の比でサンプルにNH 4 OHを加える:5(v / v)の再確立pHを8.0に適切であり、 例えば、サンプルを40μlのNH 4 OHの8μlの。
- ボルテックスですぐに混ぜます。
- ステップ6.2と同様の手順を用いてpHを確認してください。
注意:pHが10.0よりも大きい場合に、より高いpKaを有する他のアミノ酸残基の標識が可能です。 - 室温で15分間サンプルをインキュベートします。
- 厳密プロピオニル試薬のバッチ当たりなし以上3以下または4のサンプルについて反応を行う、6.7 - 手順6.3を繰り返します。
- 真空濃縮器で20μlの - 10までドライサンプル。これはNH 4 OHから遊離の未反応無水プロピオン酸、アセトニトリル、酢酸とアンモニアガスを蒸発させます。サンプルが完全に乾燥した場合、有意なサンプル損失が生じません。
注:イソプロパノールの代わりにアセトニトリルを使用することができます。しかしながら、アセトニトリルは、より低い表面張力を有し、従って、より多くの急速な蒸発。 - 最終容量40μlのが達成されるまでのddH 2 Oでサンプルを再懸濁または希釈します。
- 6.9 - 手順6.2を繰り返します。ヒストンプロピオニルの二重丸は、反応完了の> 95%を保証します。
- 瓶中の水分と接触した酢酸の形成を防止するために、アルゴンガスとプロピオン酸無水物のボトルを充填します。
注:中間停止点:サンプルのddH 2 Oまたは乾燥中に再構成し-80℃で保存することができます。
トリプシン7.タンパク質分解消化
- 50mMのNH 4 HCO 3で再懸濁し、ヒストンを、1μg/μlの以上の最適濃度を達成します。より希釈された試料は、トリプシンの効率を低下させるために導きます。
注:この段階でヒストンは、それはまだ酸性、その後、ピペットチップを使用してサンプリングするために、NH 4 HCO 3、塩を追加した場合はpH8.0であることが必要です。 - 1:10(重量/重量)でヒストンサンプルにトリプシンを追加します。
- Incuba8時間 - 6 37℃でTE。
- -80℃で凍結することによって消化を停止します。
- 真空濃縮器で20μlの - 10にサンプルをドライダウン。
注:中間停止ポイント:サンプルを-80℃で保存することができます。
N末端でのヒストンペプチドの8プロピオニル
注:このセクションでは、トリプシン消化物から生成されたN末端ペプチドの誘導体化を説明しています。プロピオニル基は、ペプチドの疎水性を増加させるように、 -そのような手順は、(ヒストンH3の8 例えば、アミノ酸3)最短のペプチドのHPLC保持を改善します。
- 100mMのNH 4 HCO 330μlの再懸濁サンプル。
- 6.9 - 手順6.1を繰り返します。
注:真空中のサンプルの乾燥は、この段階で時間がかかるのが普通です。 - 再懸 濁または50でサンプルを希釈- 100μlののddH 2 O + 0.1%TFAまたは0.5%酢酸のいずれかすること。注意:酢酸は長い間ストレージのために推奨され、TFA facilitatとして長期的にはメチオニン酸化をES。 TFAは、より良いクロマトグラフィー保持を支援するようにステージ転倒(セクション9)は、同じ日に行われる一方、TFAをお勧めします。
注:中間停止ポイント:サンプルを-80℃で保存することができます。
ステージ-ヒント9.サンプル・脱塩
注:この段階では、試料中に存在する塩があります。それらは、エレクトロの間にイオン化するため、塩は、ペプチドからの信号を抑制し、HPLC-MS分析を妨げます。塩はまた、非付加ペプチドに対する信号強度を低下させる、ペプチドのイオン性付加物を形成することができます。付加ペプチドは異なる質量を持つことになりますように、ペプチドは、適切に識別または定量化されることはありません。
- P1000のピペットチップを用いて、固相抽出ディスクからC 18の材料のディスクパンチ。溶融シリカキャピラリーを使用してP1000チップの外にミニディスクを押してP100 / 200ピペットチップの底にミニディスクを堆積させます。 Dていることを確認してくださいISKを確実に先端部( 図3)の底部に押し込まれます。
注:P1000の先端がC 18のディスクをパンチするために、むしろ小さな穴があります。より大きな直径の穴を有するために、先端の最後のセンチを切断することが適切です。 - サンプルの25μgの上で脱塩ならば、同じP100 / P200チップ内の2つのC 18のパンチを使用してください。
- 1.5ミリリットルまたは2ミリリットルマイクロ遠心チューブ内の所定の位置にステージのヒントを保持するために遠心アダプターを使用してください。 ; - (400 RCF 300)の回転が遅いを使用します溶媒は、通常、1分も経たないうちに樹脂を通過します。
- C 18材料を活性化し、潜在的な汚染を除去するために、100%アセトニトリル50μlの紡糸することによって、樹脂をフラッシュします。
- 低速遠心分離によって0.1%TFAの80μLをフラッシュすることによってディスクを平衡化します。
- pHが4.0または酢酸で下にサンプルを酸性化。サンプルの損失を最小限にするためのpHストリップでpHを確認してください。低速遠心分離することにより、ディスク上にロードしたサンプル。
- ウォッシュ低速遠心分離によって0.1%TFA80μlの - 70を洗い流すことにより、サンプル。
- 低速遠心分離によって70μlの75%アセトニトリルおよび0.5%酢酸をフラッシュすることによって試料を溶出します。 1.5mlチューブ内のサンプルを収集します。
- 真空濃縮器で乾燥したサンプル。
注:中間停止ポイント:サンプルを-80℃で保存することができます。
ヒストンペプチドの10解析
注:従来のペプチド分析で行われるようにNLC-MSプラットフォームを設定する必要があります。 200の使用-彼らは感度と安定性との間に良好な妥協点であるとして300 nlのフローカラム(内径75μm分析カラム、C 18粒子)が、推奨されます。 MS取得方法は、ターゲットを絞ったスキャン19またはデータに依存しないアクイジション(DIA)20,21、代表的な結果と、図4で説明したの両方でデータ依存取得(DDA)の組み合わせのいずれかであることができます。
- HPLCバッファを準備 - A:0.1%ギ酸でHPLCグレードの水; B:HPLCグレードのアセトニトリル中0.1%ギ酸。
- 0から30%緩衝液Bへの30分間で、30から次の5分間100%Bにし、8分間のアイソクラチック100%Bで次のようにHPLC法をプログラムします。 10分間の0%Bで1分およびイソクラティックフローの100%から0%のBの勾配:HPLCは試料装填する前に自動化されたカラム平衡化のためにプログラムされていない場合は、以下のものを含みます。 300 NL /分 - 250に解析の流量を設定します。
- プログラムのターゲットを絞ったスキャン19またはDIA 20,21( 図4)と組み合わせるDDAのいずれかを実行するには、MS取得方法。 MSのデューティ・サイクルは、より正確な定量を可能にする、クロマトグラフピークを横切るに十分なデータポイントを持つために、1の完全なMSは毎〜2秒をスキャンできることを確認してください。注:C 18クロマトグラフィーにより、平均ベースライン、ピーク幅は、上述した勾配は約30秒です。
- 負荷HPLC C上に試料約1μgのolumn。
- プログラムされたようにHPLC-MS / MS法を実行します。
注:個々のプロテオミクス研究室が開発した任意の最適なセットアップが方法のために適しているであろうようなプロトコルでは、列、MS機器やMSパラメータの詳細の詳細をお勧めしません。ヒストンペプチドは従来のペプチドとして分離するのでプロテオミクス研究所は、その最適化された設定を使用する必要があります。
11.データ解析
- ピーク面積積分を実行するためのソフトウェアにMS RAWファイルをインポートします。注:EpiProfile 22が推奨され、それがヒストンペプチド用に最適化されています。クロマトグラフィーの溶出の保持時間の知識を使って、既知のヒストンペプチドの信頼性のあるピーク領域抽出を行います。また、スカイライン23は、目的のために別の理想的なソフトウェアです。
- その修飾された形態の全てにおいて、そのペプチドの全面積で、その領域を分割し、所定のペプチドの相対量を計算します。注:ディスカバリーANALYの場合sisのマスコットは、修正されたヒストンペプチドのスペクトルを識別することをお勧めします。このツールの性能は、最近24に記載されています。プロテオミクスのための他のすべてのデータベースの検索エンジンも使用可能であるが、我々のテスト時に、彼らは低いパフォーマンスを提供しました。
結果
例として、我々は200μlの細胞ペレットから始まるとし、レチノイン酸(RA)刺激なしヒト胚性幹細胞(ヒトES細胞)から抽出されたヒストンを分析しました。細胞培養におけるRAの存在は、ESCの分化につながります。ヒストンペプチドの複数のLC-MSの注入を実行するのに十分以上であるヒストン100μgの抽出された、 - 細胞ペレットを、約50から。誘導体化、消化、脱塩後、サンプルを75ミクロン×15 cmのC 18カラム(粒径3ミクロン、孔径300オングストローム)に結合されたマイクロ流体チップを高速液体ナノクロマトグラフィーシステムでシリアル・モードで上にロードしました。ハイブリッドリニアトラップ四重極 - オービトラップ質量分析計。 MSの取得はDIAを用いて行きました。並行して、サンプルは、ハイブリッドイオントラップオービトラップ質量分析計に結合されたナノフローUHPLCを用いたDDA法で分析した(データは示さず)。に各サイクルは、1フルMSオービトラップ検出は、1400メートル/ zの 、6。そして、データ依存取得モードを動的に適用された10の60,000 AGC( のm / z 200で)との解像度に290のスキャン範囲で行いました30秒の除外。 MS / MSスキャンは、最も強いものから親イオンに追跡しました。 1の電荷状態を有するイオンは、MS / MSから除外しました。 2 のm / zの分離ウィンドウを使用しました。イオンは、35%の衝突エネルギーで衝突誘起解離(CID)を使用して断片化しました。イオントラップ検出は10 4のAGCの通常走査範囲モードおよび通常の走査速度で使用しました。
生のMSデータは、前駆体およびフラグメントイオンクロマトグラム、すなわちスカイライン23とEpiProfile 22の抽出のためのソフトウェアを採用して分析しました。それが原因で、PEPの以前の知識にインテリジェントピーク領域抽出を統合するようEpiProfileは、ヒストンペプチドのために最適化されています潮の保持時間。一方、スカイラインはDIA分析用に最適化されるので、表示されたDIAの数字( 図4、図 5(a))は、このソフトウェアからのスクリーンショットです。抽出イオンクロマトグラムから、曲線の下の面積が取得され、これは、各ペプチドの存在量を推定するために使用されます。クロマトグラフィーピークの面積は、同じペプチドの3+イオンで もほとんどの場合、[M + 2H]ただし、[M + H] +、[M + 2H] 2+について計算し、[M + 3H]れました2+は、一般的な形態でした。これは、ペプチドの与えられた修飾された形態の生の豊かさを提供します。 PTMの相対存在量を達成するために、ヒストンペプチドのすべての異なる修飾された形態の合計を100%とした、特定のペプチドの領域は、その修飾された形態の全てにおいて、そのヒストンペプチドを総面積で割りました。
ヒストンペプチドはVAに存在しています同重体の形態のriety( 図5)。同重体ペプチド、 例えば、K18ac及びK23acは、唯一独自のフラグメントイオンは、アイソバリック種( 図5A及び5B)の比を決定するために使用されるMS / MSのレベルで定量することができます。この比率は、二つの種の間でのクロマトグラフィーピークの面積を分割するために使用されます。 DDAを使用する場合、これらのペプチドは、標準的なDDA実験において生じない、その全体の溶出を介して断片化のために選択する必要があるため、これらの同重体形態は、標的の質量のリストに含まれていました。等圧の種の相対的存在量の判別は、次いでフラグメントイオンの溶出プロファイルを監視することによって行われます。一方、買収のDIA型は、任意の包含リストを必要としません。しかし、取得方法のこのタイプは、従来のデータベース検索との互換性がないので、未知の修飾ペプチドの発見を妨げる可能性があります。
リジンのアセチル化(+ 42.011ダ)は、高分解能MSの買収(> 30,000)を使用して、ほぼ同重体トリメチル(+ 42.047ダ)と区別されました。また、アセチル化は後でそれぞれのトリメチルのものよりもアセチル化ペプチドの溶出につながる、トリメチルよりも疎水性です。同じペプチドの未修飾形態が原因リジンがプロピオニルされているという事実にも後で溶出します。要約すると、1変更可能サイトを有するペプチドのための疎水性の順序は、ジ - およびトリメチル<アセチル化(プロピオニル)<変更されていない<(プロピオニル)モノメチル。
分化( 図6Aおよび6B)のために刺激されたときのhESCは、アセチル化ペプチドの明らかな減少を示しました。以前の結果は、分化のもの25と比較して、ESCは、より高いアセチル化を報告し、これは、驚くべきことではなかったです多能性クロマチンの一般的許容性を反映しています。ヒストンH3を中心に、35種類の改変形態は、( 図6C)を定量化しました。しかしながら、この方法で調べることができるすべてのヒストンproteoformsすべてのヒストン変異体と少量の修正(データは示していない)を含む、200以上です。さらに、我々の分析は、(±標準偏差を表す)エラーバーのサイズが小さいことによって証明されるように、高い再現性が、技術的複製物間で得られることが示されました。まとめると、このセクションでは、NLC-MSデータを用いて、ヒストン修飾ペプチドの相対量を抽出する方法について説明します。
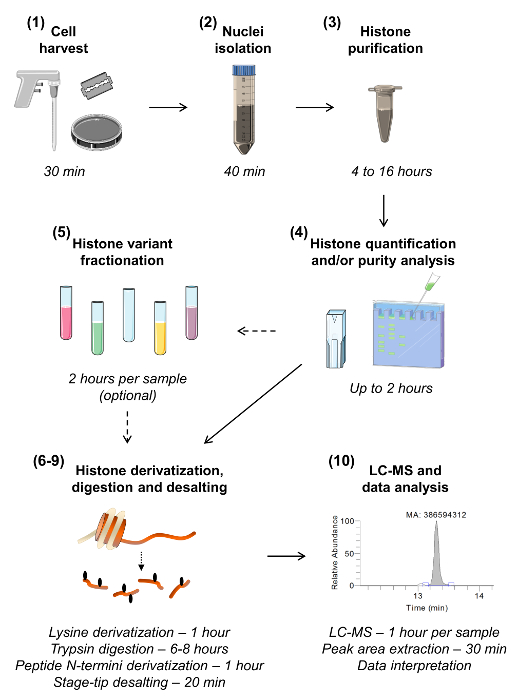
図1: ボトムアップMS / MSヒストン分析のためのワークフローは、ヒストン分析のための10のステップは、各工程に要する時間の推定を含め、示されています。セクション番号は、原稿に存在するように括弧内に与えられています。指定されたバリアントの高感度分析が必要とされない限り、様々なヒストン変異体を単離するためのサンプル分画を記述する第5節では、省略することができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
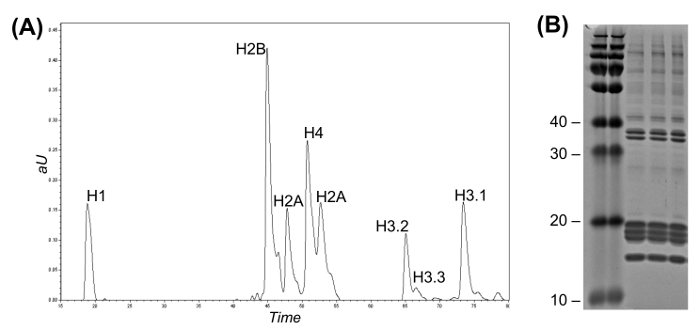
図2: ヒストンバリアント分別し、クーマシージェルのための逆相ハイフローLC(A)、無傷のヒストン分離を表すLC-UVクロマトグラム。ヒストンH3変異体は、それらの溶出時間に応じて、互いに区別することができます。画分を手動または自動フラクションコレクターを用いて回収することができる。ヒストンの精製の3つの複製の(B)クマシーゲル。= "https://www.jove.com/files/ftp_upload/54112/54112fig2large.jpg"ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:ステージ-転倒プラグのメイキングは、P1000のピペットチップを使用すると、C 18固相抽出ディスクからの物質(第2パネル)製のディスクをパンチ。それは小さな毛細血管の任意の種類を使用して、より小さなP100 / 200ピペットチップに押し出すことができるように、ミニディスクは、先端部(中央のパネル)に固執します。この例では、700μmの外径を溶融シリカ管を使用しました。ミニディスクは、それはそれ以上(最後のパネルを)行くことができないまで、P100 / 200ピペットチップの底部にプッシュする必要があります。それは、多数の反復のために十分なサンプル材料を保持するのに十分な容量を有するようにステージ先端は、ヒストン脱塩のために準備ができています。 SAの20μgの - 具体的には、1ミニディスクは15のために十分ですmple。より多くのサンプルが必要な場合は、複数のディスクは、互いの上にパックすることができます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
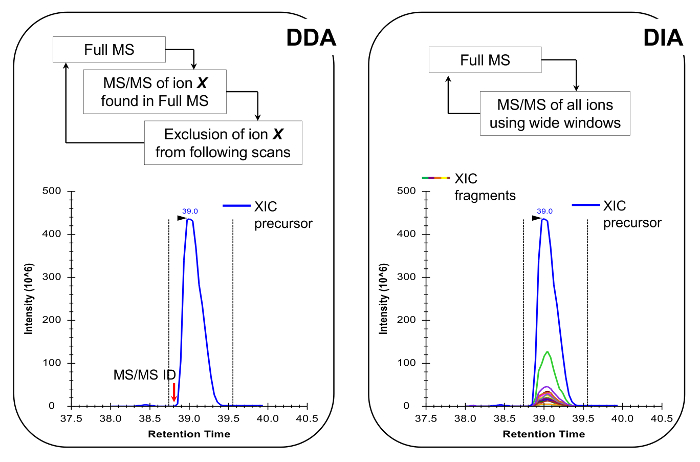
図4:DDAを使用する場合DDAとDIA方法の略図は 、MSスキャンサイクルは、その強度及び充電状態に応じてMS / MS断片化のための前駆体イオンを順次選択することを特徴とします。前駆イオンが断片化された後、MSがあまり豊富信号に「掘り下げる」ことができるように、同じペプチドの繰り返しの選択を回避するために、除外リストに入れられます。この取得方法は、検出モードのためのプロテオミクスで選択する手法です。定量は、識別されたMSの隣に与えられたイオンのフルスキャン信号を積分することによって達成されます/MSスペクトル。 DIAでは、全体のm / z範囲は、すべての走査サイクルでフラグメント化されています。このアプローチは、発見モードにはあまり適しているが、それは全てのイオン、前駆体および製品のクロマトグラフィープロフィールを生成します。これは、より多くの自信を持って定量および同重体の形態の差別につながる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
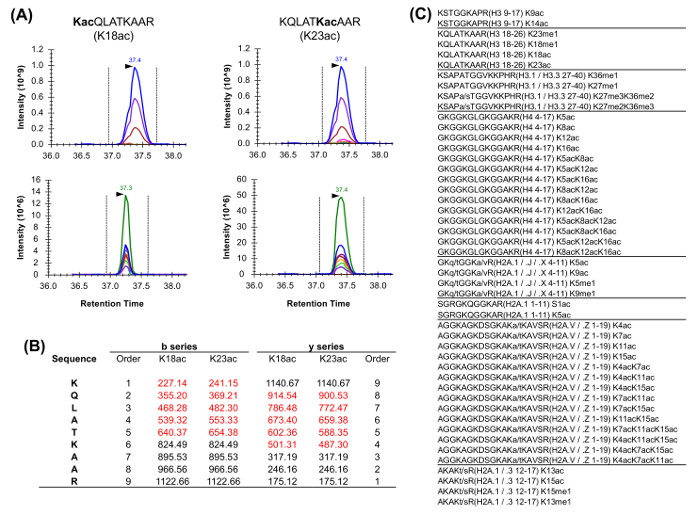
図5: 同重体ペプチドの定量化ヒストン分析で一般的に豊富な2同重体ペプチドの(A)の例。。その前駆質量と相対的な同位体(上記)の抽出イオンクロマトグラム(XIC)は同じです。しかし、生成物イオンのXIC(下記)は、2つのアイソバリック形の識別を可能にします。特に、唯一のユニークなフラグメントイオンは、私たちでなければなりません2種の相対量を推定する。(赤で強調表示)2に記載されたペプチドのためのユニークなフラグメントイオンの(B)の表現を。少なくとも一つの同重体同等を持つホモサピエンスで一般的に分析したペプチドの(C)のリストを編。シーケンスが記載されているヒストンペプチドが示されている間に変異体である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
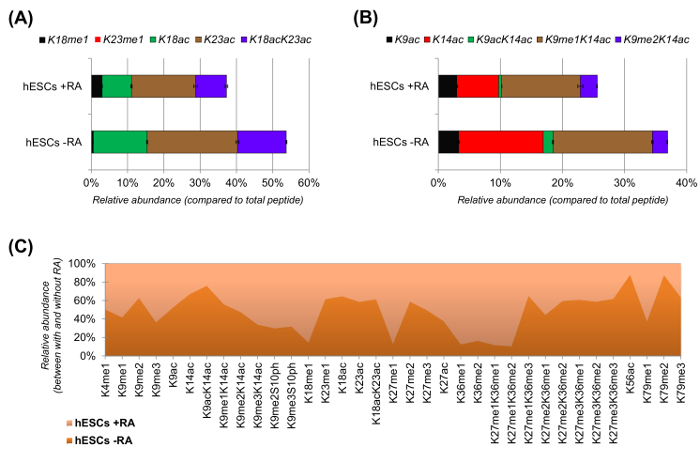
図6: レチノイン酸処理とないヒト胚性幹細胞の代表的な結果 (A)、ヒストンH3ペプチドKQLATKAAR(アミノ酸18から26)の相対定量その変形proteoformsのすべてインチ 。相対的存在量は、100%(相対としてすべてproteoformsを用いて推定しました。未修飾ペプチドのティブ割合)が示され、ヒストンH3ペプチドKSTGGKAPR(アミノ酸9の(B)相対定量化されていません- 。17)(C)とし、レチノイン酸による細胞処理なしの標準的なヒストンH3のために検出されたペプチドの相対的な豊かさ。図は、与えられた修正が(> 50%)より豊富である2つの処理のどちらで示しています。全体的に、我々は、ヒストンH3のアセチル化は、細胞分化の誘導時にリジン残基のほとんどで減少することを示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 溶液# | 組成 | ||||||
| 1 | 核の単離緩衝液(NIB)の株価は、以下のように作製し、-20℃で100ミリリットルのアリコートとして凍結保存されています。解凍15mMのトリス、60mMの塩化カリウム、15mMの塩化ナトリウム、5mMのMgCl 2、1mMのCaCl 2、250mMのスクロース:NIBは、数週間4℃で保存することができます。緩衝液のpHをHClで7.5に調整します。 | ||||||
| 2 | プロテアーゼ阻害剤(使用する前にバッファに新鮮な追加):1 Mジチオスレイトール(DTT)のddH 2 O(1,000倍)で、 ddH 2 O中の200mMのAEBSF(400×) | ||||||
| 3 | ホスファターゼ阻害剤(使用する前にバッファに新鮮な追加):100%エタノール中で2.5μMのミクロシスチン(500X) | ||||||
| 4 | HDAC阻害剤(使用する前にバッファに新鮮な追加):5 M酪酸ナトリウム、pHは7.0(500X)にNaOHを用いて5 M酪酸の滴定によって作ら | ||||||
| 5 | NP-40の代替:のddH 2 O中10%v / vの | ||||||
| 6 | ddH 2 O中0.2 MH 2 SO 4 | ||||||
| 7 | トリクロロ酢酸(TCA):100%のddH 2 Oでw / vの | ||||||
| 8 | アセトン+ 0.1%塩酸(HCl):0.1%v / vのHClをアセトン中 | ||||||
表1.ソリューション。
ディスカッション
ここで説明するプロトコルは、コスト、時間、およびパフォーマンスを考慮して最適化されています。特にMS分析と結合した場合に、他の調製物も可能であるが、それらは制限があります。例えば、高塩抽出プロトコルは、ヒストン26の代わりに、TCA沈殿(セクション3)を精製するために使用することができます。それは強酸を使用していないような高塩プロトコルは、本質的により軽度です。これは、酸に不安定なPTMを保存し、TCA沈殿は、他の多くのクロマチン結合タンパク質を同時析出物として、抽出されたヒストンの収量を増加させます。しかしながら、高塩抽出は、HPLC-MS / MSのためにあまりに濃厚塩を含有するサンプルをもたらします。トリプシンインキュベーション時間および酵素/基質比27または消化酵素28-30としてARGCを使用して還元することにより、例えば、 -代替的な調製において、ヒストンの消化は、プロピオニル(8項6)なしで行うことができます。しかし、無水プロピオン酸による誘導体化は、私のように、推奨されますtはより良い液体クロマトグラフィーの間に保持されるより疎水性ペプチドの生成につながります。
化学誘導体化のために、有機酸無水物の様々な評価されており、その利点は、包括的に18について議論しました 。それにもかかわらず、プロピオン酸無水物は、効率、最小化の副生成物および改善されたペプチドの疎水性との間で最良の妥協点を証明しました。潜在的には、プロピオン酸無水物は、同位体標識された形で購入することができます。これは、複数のサンプルを混合し、重い標識から与え異なる質量に基づいて、MSのレベルでそれらを区別する可能性に多重分析を可能にします。しかし、この分析は、LC-MSクロマトグラムの複雑化をもたらし、各々の単一の条件のために注入することができる試料の量を減少させます。
この点で、プロトコルのいくつかの重要な側面が強調されるべきです。以下はCHとして使用されるべきです陰性の結果が得られた場合の手順を実行する際にエラーを見つけることecklist。まず、核沈殿させた後、ペレットを注意深くNP-40の代替(混合中の気泡の欠如によって目立つ)、界面活性剤を完全に除去されるまで(セクション2.10)することなく、NIBで洗浄する必要があります。そうしないと、酸とヒストンの抽出を危うくします。第二に、TCAとヒストン沈殿(3.9節)とアセトンとペレットの洗浄液の後に非常に重要です。プロピオニルおよび消化(セクション6.1)を直接実行している場合は濃酸の存在は、次の工程を害することとなります。ヒストン分別が(第5節)を行う場合には、それは問題にならないだろう。 ( - 6.7セクション6.3)第三に、プロピオニル反応が迅速に行われることが不可欠です。 4つの連続したサンプル - そうするために、3つ以上に同じプロピオニルミックス(無水プロピオン酸+アセトニトリル)を使用しないでください。また、pHはトリプシン消化(セクション7)の最も重要な側面です。そうでない場合8.0(7.5から8.5)の周りに消化は無効になります。サンプルはこの段階でプロピオン酸が豊富になり、これは、発生する可能性があります。 NH 4 OHは、必要になるまで添加することができます。また、プロテオミクスのワークフローに精通している研究者のためには、トリプシン消化を終了するために、サンプルを酸性化するために異常を感じます。それは以下の反応、 すなわち、ペプチドのN末端 (セクション8.1)のプロピオニルを危うくしますので、これは、行われるべきではありません。最後に、同じ問題で、未修飾ペプチドが実際に変更されていないではない、データ解析のために覚えておくことが重要です。すべての遊離リジン残基およびN末端は、プロピオニル(56.026ダ)によって占有されます。従って、ペプチド配列に固有に相当する質量の抽出イオンクロマトグラフィーを行うことのない結果をもたらします。
この方法の制限は、短いペプチド配列による組合せのPTMを検出できないこと、および真abunを達成するのバイアスに主に関連しています別の改変された形態でのペプチドが異なる効率でイオン化する可能性があるという事実のため変更のダンス、。最初の問題は、ミドルダウンまたは(16件)トップダウンアプローチでこの技術を組み合わせることにより解決することができます。このタイプの分析でも、技術的に困難な場合は、変更の共存周波数を研究するための理想的です。また、いくつかのペプチドが異なるヒストン変異体と同じ配列を有しているので、常にボトムアップでは達成できないヒストン変異体のより良好な識別を可能にします。イオン化効率に関する第2の問題は、合成ペプチド31のライブラリを使用して解決することができます。このアプローチは、ヒストンのPTMの相対的存在量のより正確な推定を保証します。しかし、ほとんどの実験では、所望の結果は、分析条件の間に与えられた変更の相対的な変化です。この場合には、このような補正が原因すべてのサンプルが同じBIAを有するという事実のために、必要ではありません秒。
結論として、このプロトコルは、タンデムMSに結合されたNLCを使用して、3日間で完了することができ、ヒストンのPTMの分析を可能にします。彼らもほぼスループットのこのレベルを達成することができないとして、MS以外の技術、 すなわちとの比較では、はじめに説明したように、抗体ベースのストラテジーを使用して、適切ではありません。また、抗体ベースの技術は、新規修正の発見のために許可されていませんが、彼らは排他的に予測されたマークを確認し、定量化に基づいています。そこで我々は、ヒストンペプチド上のボトムアッププロテオミクスが原因で遺伝子発現を調整するに主人公であり、したがって、プロテオームのレギュレーションに影響を与えるヒストンマークの調節を知ることに直感的な利点のためにプロテオミクス研究室での人気を得ることができます推測しています。また、プロトコルはlaboraにもヒストン分析をより自明するデータ分析のためのサンプル調製およびソフトウェアにおける最近の改善を含み、記載しましたhypermodifiedペプチドのこのタイプの特徴付けを経験したことがない保守党。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
この作品は、NIHの助成金(DP2OD007447、R01GM110174とR01AI118891)からの資金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Trypsin 0.25% EDTA | Invitrogen | 25200056 | For harvesting cells |
| PBS | Invitrogen | 14200075 | |
| Tris | Roche | 77-86-1 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Sodium Chloride | Sigma | S9888 | |
| Magnesium Chloride hexahydrate | Sigma | M9272 | |
| Calcium Chloride, anhydrous | Sigma | C1016 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| DTT | Invitrogen | 15508-013 | |
| AEBSF | EMD Millipore Corp | 101500 | |
| Microcystin | Sigma | M4194 | |
| Sodium Butyrate | Sigma | B5887 | |
| Halt Protease and Phosphatase Inhibitor Cocktail, EDTA-free (100x) | Fisher Scientific | 78445 | |
| NP- 40 Alternative | CALBIOCHEM | 492016 | |
| Sulfuric Acid, ACS grade | Fisher Chemical | 7664-93-9 | |
| Trichloroacetic acid | Sigma | T6399 | |
| Acetone | Sigma | 179124 | |
| HCl | Fisher Chemical | A144-500 | |
| Bradford reagent | Biorad | 500-0006 | |
| 30% acrylamide/bis 29:1 — 500 ml | Biorad | 1610156 | |
| Coomassie | Fisher Scientific | 20278 | |
| C18 Column (5 µm) 2.1 mm x 250 mm | Grace | 218TP52 | |
| C18 Column (5 µm) 4.6 mm x 250 mm | Grace | 218TP54 | |
| HPLC grade acetonitrile | Fisher Chemical | A955-4 | |
| HPLC grade water | Fisher Scientific | W6 4 | |
| TFA | Fisher Scientific | A11650 | |
| Ammonium Bicarbonate | Sigma | A6141 | |
| ammonium hydroxide | Sigma | 338818 | |
| propionic anhydride | Sigma | 240311 | |
| Sequencing grade modified trypsin | Promega | PRV5113 | For digesting histones for MS |
| Acetic Acid | Sigma | 49199 | |
| C18 extraction disk | Empore | 2215 | |
| Formic Acid | Sigma | F0507 |
参考文献
- Waddington, C. H. Canalization of development and the inheritance of acquired characters. Nature. 150, 563-565 (1942).
- Sharma, S., Kelly, T. K., Jones, P. A. Epigenetics in cancer. Carcinogenesis. 31 (1), 27-36 (2010).
- Reik, W., Dean, W., Walter, J. Epigenetic reprogramming in mammalian development. Science. 293 (5532), 1089-1093 (2001).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128 (4), 693-705 (2007).
- Tessarz, P., Kouzarides, T. Histone core modifications regulating nucleosome structure and dynamics. Nat Rev Mol Cell Bio. 15 (11), 703-708 (2014).
- Fischle, W., Wang, Y. M., Allis, C. D. Histone and chromatin cross-talk. Curr Opin Cell Biol. 15 (2), 172-183 (2003).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Simboeck, E., et al. A Phosphorylation Switch Regulates the Transcriptional Activation of Cell Cycle Regulator p21 by Histone Deacetylase Inhibitors. J Biol Chem. 285 (52), 41062-41073 (2010).
- Hirota, T., Lipp, J. J., Toh, B. H., Peters, J. M. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature. 438 (7071), 1176-1180 (2005).
- Xhemalce, B., Kouzarides, T. A chromodomain switch mediated by histone H3 Lys 4 acetylation regulates heterochromatin assembly. Genes Dev. 24 (7), 647-652 (2010).
- Vermeulen, M., et al. Quantitative interaction proteomics and genome-wide profiling of epigenetic histone marks and their readers. Cell. 142 (6), 967-980 (2010).
- van Attikum, H., Gasser, S. M. Crosstalk between histone modifications during the DNA damage response. Trends Cell Biol. 19 (5), 207-217 (2009).
- Fernandez-Capetillo, O., et al. H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis. Dev Cell. 4 (4), 497-508 (2003).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. Embo J. 28 (17), 2511-2531 (2009).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Sidoli, S., Cheng, L., Jensen, O. N. Proteomics in chromatin biology and epigenetics: Elucidation of post-translational modifications of histone proteins by mass spectrometry. J Proteomics. 75 (12), 3419-3433 (2012).
- Plazas-Mayorca, M. D., et al. One-Pot Shotgun Quantitative Mass Spectrometry Characterization of Histones. J Proteome Res. 8 (11), 5367-5374 (2009).
- Sidoli, S., et al. Drawbacks in the use of unconventional hydrophobic anhydrides for histone derivatization in bottom-up proteomics PTM analysis. Proteomics. 15 (9), 1459-1469 (2015).
- Lin, S., Garcia, B. A. Examining histone posttranslational modification patterns by high-resolution mass spectrometry. Methods Enzymol. 512, 3-28 (2012).
- Sidoli, S., et al. SWATH Analysis for Characterization and Quantification of Histone Post-translational Modifications. Mol Cell Proteomics. , (2015).
- Krautkramer, K. A., Reiter, L., Denu, J. M., Dowell, J. A. Quantification of SAHA-Dependent Changes in Histone Modifications Using Data-Independent Acquisition Mass Spectrometry. J Proteome Res. , (2015).
- Yuan, Z. F., et al. EpiProfile Quantifies Histone Peptides With Modifications by Extracting Retention Time and Intensity in High-resolution Mass Spectra. Mol Cell Proteomics. 14 (6), 1696-1707 (2015).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Yuan, Z. F., Lin, S., Molden, R. C., Garcia, B. A. Evaluation of proteomic search engines for the analysis of histone modifications. J Proteome Res. 13 (10), 4470-4478 (2014).
- Tan, Y., Xue, Y., Song, C., Grunstein, M. Acetylated histone H3K56 interacts with Oct4 to promote mouse embryonic stem cell pluripotency. Proc Natl Acad Sci U S A. 110 (28), 11493-11498 (2013).
- Vonholt, C., et al. Isolation and Characterization of Histones. Methods Enzymol. 170, 431-523 (1989).
- Zhang, K. L., et al. Identification of acetylation and methylation sites of histone H3 from chicken erythrocytes by high-accuracy matrix-assisted laser desorption ionization-time-of-flight, matrix-assisted laser desorption ionization-postsource decay, and nanoelectrospray ionization tandem mass spectrometry. Anal. Biochem. 306 (2), 259-269 (2002).
- Jufvas, A., Stralfors, P., Vener, A. V. Histone Variants and Their Post-Translational Modifications in Primary Human Fat Cells. Plos One. 6 (1), e15960(2011).
- Bonaldi, T., Imhof, A., Regula, J. T. A combination of different mass spectroscopic techniques for the analysis of dynamic changes of histone modifications. Proteomics. 4 (5), 1382-1396 (2004).
- Zhao, X. L., et al. Comparative Proteomic Analysis of Histone Post-translational Modifications upon Ischemia/Reperfusion-Induced Retinal Injury. J Proteome Res. 13 (4), 2175-2186 (2014).
- Lin, S., et al. Stable-isotope-labeled histone peptide library for histone post-translational modification and variant quantification by mass spectrometry. Mol Cell Proteomics. 13 (9), 2450-2466 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved