Method Article
Полный рабочий процесс для анализа гистонов посттрансляционные модификации Использование снизу вверх Масс-спектрометрия: От Гистона добычи до анализа данных
В этой статье
Резюме
Этот протокол описывает полностью интегрированный рабочий процесс для определения характеристик гистонов посттрансляционных модификаций с использованием масс-спектрометрии (МС). Технологический процесс включает в себя очистку гистонов из клеточных культур, или тканей, гистонов дериватизации и пищеварение, МС-анализ с использованием жидкостной хроматографии нано-потока и инструкции для анализа данных. Протокол предназначен для завершения в течение 2 - 3 дней.
Аннотация
Нуклеосомы являются самыми маленькими структурной единицей хроматина, состоящая из 147 пар оснований ДНК, обернутых вокруг октамером гистонов белков. Функция гистонов опосредуется обширной пост-трансляционной модификации несметным ядерных белков. Эти изменения имеют решающее значение для ядерной целостности, поскольку они регулируют структуру хроматина и вербовать ферменты, участвующие в регуляции генов, репарации ДНК и конденсации хромосом. Даже при том, что большая часть научного сообщества принимает методы на основе антител, чтобы охарактеризовать гистонов PTM изобилие, эти подходы низкая пропускная способность и предубеждением hypermodified белков, так как эпитоп могут быть затруднен близлежащих модификаций. Этот протокол описывает использование нано жидкостной хроматографии (НЖК) и масс-спектрометрии (МС) для точного количественного определения модификаций гистонов. Этот метод предназначен для характеристики большое разнообразие гистонов PTMs и относительное обилие нескольких вариантов гистона в секИнгл анализ. В этом протоколе, гистоны модифицируют с пропионового ангидрида с последующим расщеплением трипсином для генерации пептидов из 5 - 20 ак в длину. После того, как переваривание, вновь подвергается N-концов гистонов пептиды модифицируют для улучшения хроматографическое удерживание в течение НЖК-МС. Этот метод позволяет относительного количественного гистонов PTMs охватывающих четыре порядка.
Введение
Эпигенетика определяется как изучение наследуемых изменений в экспрессии генов , которые возникают другие , чем изменяя основную последовательность ДНК 1 механизмов. Эпигенетическое регулирование имеет решающее значение в процессе развития, как организм претерпевает драматические фенотипические изменения, хотя его содержание ДНК не меняется. Есть несколько важных компонентов , необходимых для надлежащего эпигенетической обслуживания, в том числе гистонов пост-трансляционных модификаций (PTMs), варианты гистонов, некодирующих РНК, метилирование ДНК и ДНК - связывающих факторов, каждый из которых влияют на экспрессию генов через различные механизмы 2. Например, в то время как метилирование ДНК является высокостабильный модификацией , которая репрессирует ген перевод 3, варианты гистонов и гистон PTMs намного более динамичны и могут влиять на хроматин в различными способами 4.
Гистоновые PTMs в основном локализованы на N-терминальный хвостов, так как они в наибольшей степени подвержены и гибким областьбелка. Тем не менее, нуклеосомная ядро также сильно модифицирован по сравнению со средними белками 5. Несмотря на то, гистонов знаки были широко охарактеризованы в последнее десятилетие, многие связи между известными гистонов знаков и их функции до сих пор не ясны. Во многом это связано с тем , что большинство гистонов PTMs работают не в одиночку, а функцию в тандеме с другими PTMs ( "кросс-ток") , чтобы изменить конкретный процесс такой , как транскрипции 6,7. Например, комбинаторный метка H3S10K14ac на гене р21 активирует транскрипцию, которая не будет происходить только с одной из двух PTMs 8. Белок HP1 компакты хроматина путем признания H3K9me2 / ME3 и распространение модификации близлежащих нуклеосом. Однако HP1 не может связать H3K9me2 / 3 , когда соседний S10 фосфорилируется 9. Ацетилирование H3K4 ингибирует связывание белка spChp1 к H3K9me2 / ME3 в Schizosaccharomyces pombe 10. Кроме того, гистонов лизин demethylase PHF8 имеет самую высокую эффективность связывания нуклеосом , когда три PTMs H3K4me3, K9ac и K14ac присутствуют 11. Эти примеры подчеркивают важность достижения глобального обзора изменений PTM гистонов, а не концентрироваться на отдельных модификациях.
Наличие вариантов последовательностей также увеличивает сложность анализа гистонов, так как гистонов изотипы как правило, имеют весьма сходные последовательности, но часто имеют различные роли в хроматина. Например, H2A.x имеет С-концевую последовательность , которая является более легко фосфорилирует на повреждение ДНК по сравнению с каноническим H2A 12, и он необходим для инактивации половых хромосом у самцов мышей мейоз 13; Аналогичным образом , CENP-A подменяет канонический гистон H3 в центромерах 14. Несмотря на их различные функции, эти варианты разделяют большую часть их аминокислотной последовательности с соответствующим каноническим гистона, что делает его трудно определить и количественно оценить их по отдельности.
методы на основе антител, такие как вестерн-блоттинга были широко приняты для характеристики гистоны. Тем не менее, подходы на основе антител ограничены по следующим причинам: (I) они могут только подтвердить наличие модификации и не может идентифицировать неизвестные PTMs; (II), они смещены из-за наличия сосуществующих знаков, которые могут влиять на аффинность связывания; (III) они не могут идентифицировать комбинаторные знаки, так как только очень немногие антитела доступны для таких целей и (IV) , они перекрестно реагирующими между весьма похожими вариантами гистонов или аналогичными PTMs (например, ди- и триметилирование остатков лизина). Egelhofer и др. описано , что более 25% коммерческих антител неудачу специфичность тестов по дот - блот или вестерн - блоттинга, а среди специфических антител более чем на 20% терпят неудачу в хроматин иммунопреципитации экспериментов 15. Масс-спектрометрия (МС) в настоящее время является наиболее подходящим аналитическим инструментом для изучения новых и / или комбинаторные PTMs,и она широко реализована для белков гистонов (обзор в 16). В основном это связано с высокой чувствительностью и точностью массовой МС, а также возможность выполнять крупномасштабные анализы.
Стратегия снизу вверх является наиболее часто используемым протеомики МС на основе стратегии для гистона определения характеристик и их PTMs, в котором интактный белок ферментативно расщепленной на короткие пептиды (5 - 20 AA). Это облегчает пищеварение как разделение LC и обнаружение MS. Мессы в диапазоне 600 - 2000 Да, как правило, более легко ионизируется и идентифицированы с более высокой массовой точности и разрешающей способности, чем большие массы. фрагментация МС / МС также улучшается, поскольку короткие пептиды, как правило, хорошо подходят для столкновения индуцированной диссоциации (CID). Тем не менее, гистоны представляет собой проблему для снизу вверх MS, поскольку они сильно обогащены основных аминокислотных остатков, а именно лизин и аргинин. Таким образом, трипсин-переваривание приводит к образованию пептидов, которые слишком смвсе для удержания LC и однозначной локализации PTMs. Чтобы обойти эту проблему, наш протокол включает в себя лизин и пептид N-концевой химической дериватизации 17. Использование пропионового ангидрида рекомендуется для эффективной химической дериватизации , по сравнению с другими реагентами 18. Такие дериватизации блокирует ɛ-аминогрупп немодифицированных и монометиловых остатков лизина, позволяя трипсин выполнять протеолиз только на С-конце остатков аргинина. Производные амины не могут обмениваться протонами с раствором и, таким образом, пептиды, как правило, только двукратно или трехкратно заряжены, облегчая MS и обнаружение MS / MS. Кроме того, N-концевого пептида дериватизации повышает гидрофобность и, таким образом, с обращенной фазой хроматографического удерживания. Здесь мы опишем рабочий процесс для очистки гистоны и подготовить их для анализа с помощью PTM снизу вверх протеомики (рисунок 1). Эта стратегия обеспечивает количественную оценку отдельных марок гистонов и комбинаторных знаков Fили гистонов PTMs, которые относительно близки в аминокислотной последовательности.
протокол
1. Сбор клеток из культуры
- Если клетки выращивали в виде суспензии, собирают клетки центрифугированием при 300 RCF в течение 5 мин. Если единомышленником, аспирата и выбросьте средней ячейки. Промыть прикрепленные клетки с PBS без Са 2+ и Mg 2+ (упоминаемый как PBS , в будущем). Инкубируйте клетки в или трипсином или трипсин-ЭДТА (0,025% - 0,5% в зависимости от клеточной линии) с достаточным объемом, чтобы покрыть поверхность пластин при 37 ° С до тех пор, пока клетки не отделяться (время варьируется для различных клеточных линий).
- Собирают клетки центрифугированием при 300 RCF в течение 5 мин. Вымойте клеток еще два раза в PBS и собирают центрифугированием.
- Оценить гематокрита примерно с делениями, помеченных на 1,8 мл пробирки или 15 мл конические пробирки.
Примечание: Клетки из культуры могут быть быстро замораживали в жидком азоте и хранили при -80 ° С до бесконечности, на данном этапе.
2. Выделение ядер из неповрежденных клеток
- Оттепель клетки на льду.
- Оттепель изоляция буфера ядерных (NIB, таблица 1).
- Приготовьте примерно 5 мл NIB буфера (таблица 1) для каждого 100 мкл упакованного объема клеток. Для каждого 1 мл NIB буфера, добавляют ингибиторы протеазы и стабилизирующие агенты следующим образом: 1 мкл 1 М DTT, 2,5 мкл 200 мМ AEBSF, 2 мкл 2,5 мкМ Микроцистин и 2 мкл 5 М бутират натрия. НСБ с ингибиторами будет упоминаться как NIB с этого момента.
Примечание: Если гистонов фосфорилирования изучено, включают ЭДТА свободный протеазы и ингибитор фосфатазы коктейль. - Удалить пятый объем буфера ИБСЕ Приготовленный таким образом и добавить NP-40 Альтернативный вариант (таблица 1) до конечной концентрации 0,2%. Оставшийся объем четыре пятых будет использоваться для промывки.
- Промыть осадок клеток в 1:10 клеточному осадку до СИБ без Alternative отношение NP-40 (об / об). Удалить супернатант центрифугированием при 700 RCF в течение 5 мин.
- Лизировать челл гранул путем размещения его на льду и при добавлении 1:10 осадка клеток в СИБ с 0,2% NP-40 Альтернативные (об / об).
- Если извлечение из образцов тканей, гомогенизируют с помощью ступки и пестика или Доунса гомогенизаторы. Культивируемые клетки могут быть гомогенизируют осторожно пипеткой.
- Выдержите гомогенизированных клеток на льду в течение 5 - 10 мин. Клетки будут лизировать и освободить ядра.
- Центрифуга при 1000 RCF в течение 5 - 10 мин при температуре 4 ° С. Осадок содержит главным образом клетки ядра, в то время как супернатант содержит главным образом компоненты цитоплазмы. Сохранение цитоплазматической фракции при желании.
- Вымойте ядер гранул, осторожно ресуспендируя его в 1:10 (об / об) NIB без NP-40 Alternative.
Примечание: Этот шаг стирки исключительно для удаления следов моющих средств до экстракции гистонов из ядер. - Центрифуга при 1000 RCF в течение 5 мин при 4 ° С и удаления надосадочной жидкости.
- Повторите шаг 2.10 - 2.11, по крайней мере в два раза, чтобы полностью удалить NP-40 Alternative. Удаление NP-40 Альтернатива бросается в глазаS осторожно пипеткой во время стадии промывки больше не образует пузырьков.
- Для экстракции гистонов из тканей:
- Ополосните свежей или размороженной замороженной ткани в ледяной СИБ.
- Передача ткани в чашку Петри помещают на лед с СИБ, достаточно, чтобы держать ткань влажным.
- Плашек на мельчайшие кусочки (<1 мм) с лезвием бритвы, чтобы увеличить поверхность контакта для ядер изоляции.
- Передача измельченной ткани в предварительно охлажденный гомогенизатор и мыть в СИБ пипетированием вверх и вниз.
- Удалить буфер центрифугированием при 300 RCF в течение 5 мин.
- Добавить NIB, содержащую NP-40 Альтернатива клеток в клетках: буфер соотношении 1:10 (об / об) и гомогенизируют с помощью 5 - 10 ударов.
- Проверьте наличие лизиса клеток и повторить гомогенизацию по мере необходимости. Хорошим показателем того, что клетки были лизированы является уменьшение объема гранул. Осадок должен содержать только ядра.
- Центрифуга при 700 RCF в течение 5 мин и сохранить осадок. Этот осадок может быть извлечен 1 - 2 больше времениs в 1:10 (об / об) СИБ, содержащий NP-40 Alternative; На данном этапе, гистоны извлекаются из хроматина и осадок значительно сморщенные.
- Промыть два раза с 2 - 3 мл СИБ без NP40 Alternative, чтобы удалить следы моющего средства.
Примечание: Временные точки остановки: Образец может быть повторно суспендируют в минимальном объеме ИБСЕ + 5% глицерина и хранили при -80 ° С.
3. Выделение и очистка гистонов из ядер
Примечание: гистоны очень богат основных аминокислотных остатков, что позволяет им тесно взаимодействовать с позвоночником фосфорной кислоты ДНК. Гистоны являются одними из самых основных белков в ядре, таким образом , что позволяет им быть извлечены в охлажденном льдом серной кислоты (0,2 М H 2 SO 4) с минимальным загрязнением от НЕГИСТОНОВЫХ белков, которые осаждаются в сильной кислоте. Высококонцентрированный ТСА (до конечной концентрации 33%), а затем может быть использован для осаждения гистоны из сернойкислоты. ТСА хранится в виде 100% в коричневой бутылке при температуре 4 ° С.
- Ядра Ресуспендируют ячейка в 1: 5 (об / об) охлажденной 0,2 М H 2 SO 4 (таблица 1), осторожно пипеткой.
- Инкубируйте образца с постоянным вращением или осторожном встряхивании в течение 2 - 4 ч при температуре 4 ° С. Как правило, для образцов с более чем 500 мкл клеточного осадка, экстракции 2 ч достаточно для извлечения гистоны; больше инкубации может привести к извлечению других основных белков. Для небольших ядерных гранул (<200 мкл), 4 ч экстракции обеспечивает лучший выход.
- Центрифуга на 3,400 RCF при 4 ° С в течение 5 мин.
- Передача супернатант в новую пробирку.
- Повторите шаги 3.3 - 3.4 для удаления любого нерастворимого материала.
- Для осаждения гистонов, добавьте охлажденную 100% трихлоруксусной кислоты (таблица 1) к собранной супернатант (содержащий теперь гистонов) в соотношении 1: 3 (об / об), для того , чтобы получить конечную концентрацию ТСА 33%. Смешайте переворачивая пробирку несколько тРедакторы IME.
Примечание: Образцы будут мутнеть при добавлении TCA, что указывает на наличие гистонов. - Выдержите смесь на льду в течение по меньшей мере 1 часа. Для меньших размеров гранул исходных, рекомендуется в течение ночи осадков.
- Центрифуга при 3,400 RCF в течение 5 мин. Гистоны пальто стороны трубок, а также хранение на дне. Белый нерастворимый осадок образует также в самом низу трубки, которая в основном содержит НЕГИСТОНОВЫХ белки и другие биомолекулы. Удалить супернатант аспирацией, осторожно, не очищая стенки или гранул.
- С помощью стеклянной пипетки Пастера, промыть трубку с охлажденным льдом ацетон + 0,1% HCl (таблица 1) , с тем , чтобы покрыть осажденные белки для нанесения покрытий стенок и дна.
- Центрифуга при 3,400 RCF в течение 2 мин и аспирата супернатант, осторожно, не очищая стенки или гранул.
- Повторите шаги 3.9 - 3.10 с использованием 100% ледяной ацетон.
- Сухой осадок с потоком воздуха или с Vacuгм центрифуге, или просто оставляя трубку открытым. Ацетон быстро испаряется.
- Растворите гистонов с DDH 2 O (бидистиллированной воды) в минимальном объеме можно полностью растворить белый слой. Гистоны легко растворим в воде. Для получения гранул в 1,5 мл трубки микроцентрифужных, 100 мкл DDH 2 O, как правило , достаточно , чтобы собрать гистоны.
- Центрифуга при 3,400 RCF в течение 2 мин и переносят надосадочную жидкость в новую пробирку.
4. Оценка концентрации белка и чистоты
- Для измерения концентрации белка, используют ДСС, анализа Брэдфорда или аминокислотным анализом (AAA). Не следует использовать методы, которые применяют оптическую плотность при длине волны 280 нм, а гистоны бедны в ароматических аминокислотных остатков.
- Проверьте чистоту извлеченных гистонов путем анализа SDS-PAGE с гелем акриламид 15% и окрашивания кумасси (по желанию).
- Если высокочистые варианты одного гистонов желательны, продолжают ВЭЖХ-УФ фракционированияварианты гистонов (раздел 5). Если нет, то перейти непосредственно к подготовке образцов для анализа гистонов PTM снизу вверх (раздел 6).
5. Разделение гистона Варианты с помощью обращенно-фазовой ВЭЖХ (необязательно)
Примечание: варианты высокой чистоты гистонов может быть получен фракционированием гистонов смеси сырой использованием обращенно-фазовой ВЭЖХ, соединенный с УФ-детектором. Эти очищенные гистоны являются полезными для исследований, которые требуют более высокой чувствительности и чистоты. Тем не менее, для стандартного гистонов PTM характеристики, этот шаг может быть пропущен, поскольку анализ является достаточно чувствительным и исчерпывающим. Фракционирование неповрежденной гистона вариантов в идеале требует по меньшей мере 100 - 300 мкг исходного материала.
- Подключение соответствующий C 18 5 мкм колонку с ВЭЖХ в зависимости от исходной концентрации гистона: с приблизительно 100 мкг гистонов, используют 2,1 мм х 250 мм колонку с расходом 0,2 мл / мин; около 300 мкг гистонов, используйте колонку 4,6 х 250 мм сскорости потока 0,8 мл / мин. Готовят буфер А и В, с использованием выделенного стеклянную посуду следующим образом:
- Готовят буфер А: 5% ВЭЖХ ацетонитрил, 0,1% TFA в воде для ВЭЖХ.
- Готовят буфер Б: 95% ВЭЖХ ацетонитрил, 0,1% TFA в воде для ВЭЖХ.
- Подключите колонки к УФ-детектора, а также установить оптическую плотность на 210 - 220 нм.
- Подкислите образец гистонов, растворенный в воде с 100% TFA для достижения конечной концентрации 0,1-1% TFA.
- Равновесие колонку со 100% буфера А в течение по крайней мере 15 мин при рекомендуемой скорости потока, что соответствует примерно равным трем объемам колонки. С помощью этого сигнала, чтобы установить нулевой уровень поглощения УФ-детектора.
- Подготовка соответствующего размера трубы для сбора фракций либо вручную, либо в автоматическом коллекторе образца.
- Вводят образец в концентрации примерно 1 мкг / мкл или выше. Образцы, растворенные в больших объемах может изменить Уравновешивание колонки дюкольцо погрузка и приводят к более низкому удерживанию.
- Запуск градиент, запрограммирован следующим образом: от 0 до 30% В в течение 1 мин, от 30 до 60% B в течение 90 мин и от 60 до 90% В в течение 1 мин.
- Собирают фракции (пример хроматограммы , показанные на рисунке 2) с интервалом в 1 мин с использованием автоматического сборщика фракции. Сбор фракций в соответствующие пробирки размера, чтобы содержать весь объем.
- Сушат вниз фракционированных образцов в вакуумной концентратором.
Примечание: Временные точки остановки: высушенные гистонов фракции можно хранить при комнатной температуре в течение коротких периодов времени (1 - 2 дней) или в -80 ° C морозильнике в течение длительных периодов времени.
6. Химический дериватизации гистонов Использование пропионовой ангидридом для снизу вверх анализа
- Разведите образцы гистонов в 40 мкл 50 мМ NH 4 HCO 3, рН 8,0 (рекомендуемое количество: 50 - 100 мкг). Если образцы находились в чистом DDH 2 O, добавляют концентрированный NH 4 HCO 3 , чтобы компенсировать 50 мМ, рН 8.0.
- Смочите кончик P10 пипетки в образец для проверки рН с помощью рН индикаторных полосок без потерь образца. NH 4 OH и муравьиную кислоту можно использовать для доведения рН до 8,0.
Примечание: В следующей части протокола (шаги 6.3 - 6.7) должно быть сделано в партиях максимум трех до четырех образцов, с тем чтобы сохранить пропионовый ангидрид реактивными. - Использовать вытяжку для последующих стадий, где используется пропионовый ангидрид. Подготовка свежего реагента пропионилирования путем смешивания пропионовый ангидрид с ацетонитрилом в соотношении 1: 3 (об / об). Добавить пропионилирования реагента к образцу в соотношении 1: 4 (об / об). За 40 мкл гистонов, добавляют 10 мкл реагента пропионилирования.
Примечание: Можно наблюдать белый мусор на этом шаге. Тем не менее, это в основном содержит соли и пропионовую кислоту, и, таким образом, никаких конкретных действий не должно быть принято. - Быстрое добавление NH 4 OH повторно устанавливают рН 8,0 к раствору. Примечание: пропионовый ангидрид реагирует со свободными аминогруппами пептидов производит пропеллерионной кислоты, которая снижает рН. Как правило, при добавлении NH 4 OH в образце при соотношении 1: 5 (об / об) целесообразно повторно установить рН 8,0; например, 8 мкл NH 4 OH до 40 мкл образца.
- Смешайте немедленно встряхиванием.
- Проверьте рН с помощью той же процедуры, как на стадии 6.2.
Внимание: Когда рН превышает 10,0, маркировка других аминокислотных остатков с более высоким рКа возможно. - Инкубируйте образцы при комнатной температуре в течение 15 мин.
- Повторите шаги 6.3 - 6.7, строго выполняя реакцию в течение не более 3-х или 4-образцов на партию реагента пропионилирования.
- Сухие образцы размером до 10 - 20 мкл в вакуумном концентраторе. Это испаряет непрореагировавший пропионовый ангидрид, ацетонитрил, уксусную кислоту и аммиак газ , выделившийся из NH 4 OH. Если образцы полностью высохнет, никаких существенных потерь образца не происходит.
Примечание: Изопропиловый спирт может быть использован вместо ацетонитрила. Тем не менее, ацетонитрил имеет более низкое поверхностное натяжение и, следовательно, болеебыстрое испарение. - Ресуспендируют или разбавленные образцы с DDH 2 O до 40 мкл конечного объема не достигается.
- Повторите шаги 6.2 - 6.9. Двойной раунд гистона пропионилирования обеспечивает> 95% завершения реакции.
- Наполните пропионовую бутылочку ангидрида с газообразным аргоном, с тем, чтобы предотвратить образование уксусной кислоты в контакте с влагой в бутылке.
Примечание: Временные точки остановки: Образец можно хранить при температуре -80 ° С в восстановленном DDH 2 O или сушат.
7. протеолитическим расщеплением трипсином
- Ресуспендируют гистонов в 50 мМ NH 4 HCO 3 для достижения оптимальной концентрации 1 мкг / мкл или выше. Более разбавленные образцы приводят к снижению эффективности трипсина.
Примечание: гистоны на этом этапе должны быть при рН 8,0 Если он все еще кислая, а затем добавить NH 4 HCO 3 соли к образцу с помощью пипетки наконечник. - Добавить трипсина в образцах гистонов в соотношении 1:10 (вес / вес).
- ИнкубаторыТЕ при температуре 37 ° С в течение 6 - 8 часов.
- Остановить пищеварение путем замораживания в -80 ° C.
- Сушат вниз образец до 10 - 20 мкл в вакуумной концентратором.
Примечание: Временные точки остановки: Образец можно хранить при температуре -80 ° С.
8. пропионилирования гистона пептидов на N-концах
Примечание: В этом разделе описывается дериватизации пептида N-концами генерируемый из трипсина дайджеста. Такая процедура улучшает удерживани ВЭЖХ кратчайших пептидов (например, аминокислоты , 3 - 8 гистона H3), как группа пропионил увеличивает пептид гидрофобность.
- Образцы Ресуспендируют в 30 мкл 100 мМ NH 4 HCO 3.
- Повторите шаги 6.1 - 6.9.
Примечание: Это нормально, что сушка образцов в вакууме занимает больше времени на этом этапе. - Ресуспендируют или Образец с 50 - 100 мкл DDH 2 O + либо 0,1% ТФК или 0,5% -ной уксусной кислоты. Примечание: Уксусная кислота рекомендуется для длительного хранения, так как ТФК facilitatэс-метионин окисления в долгосрочной перспективе. С другой стороны, ТФК рекомендуется, если стадия опрокидывания (раздел 9) выполняется в тот же день, как и ТФК помогает лучший вариант хроматографического удерживания.
Примечание: Временные точки остановки: Образец можно хранить при температуре -80 ° С.
9. Образец обессоливания с Сценическое советами
Примечание: На этом этапе имеется соль присутствует в образце. Соли затрудняют анализ с помощью ВЭЖХ-МС, так как они ионизируют во время электрораспылением, подавления сигнала от пептидов. Соли также могут образовывать ионные аддукты на пептиды, снижая интенсивность сигнала для не-аддуктами пептида. По мере того как аддуктами пептид будет иметь различную массу, пептид не будет правильно идентифицированы или количественно.
- При использовании P1000 пипетки, пробивать диск C 18 материала из твердого диска экстракции фазы. Вставьте минидиск из кончика P1000 с помощью кварцевую капиллярную и депонировать минидиск к нижней части Р100 / 200 кончика пипетки. Убедитесь в том, что дИСК надежно зажатый в нижней части наконечника (рисунок 3).
Примечание: Наконечник P1000 имеет довольно небольшое отверстие , чтобы ударить C 18 диска в. Уместно разрезать последний сантиметр наконечника для того, чтобы иметь отверстие с большим диаметром. - Используйте две C 18 ударов в одном кончике P100 / P200 , если обессоливания более 25 мкг образца.
- Используйте адаптер центрифуг для хранения Сценическое советы на месте в 1,5 мл или 2 мл микропробирок. Используйте медленно (300 - 400 RCF) вращение; растворители обычно проходят через смолу в менее чем за минуту.
- Промывка смолы путем прядения с 50 мкл 100% ацетонитрила , чтобы активировать C 18 материала и удаления потенциальных загрязнений.
- Равновесие диск путем промывки 80 мкл 0,1% ТФУ путем медленного центрифугирования.
- Подкислите образца до рН 4,0 или ниже, с помощью уксусной кислоты. Проверяют рН с полосками рН, чтобы минимизировать потери образца. Образец нагрузки на диск путем медленного центрифугирования.
- мытьОбразец промывкой 70 - 80 мкл 0,1% ТФУ путем медленного центрифугирования.
- Элюции пробы путем промывки 70 мкл 75% ацетонитрила и 0,5% уксусной кислоты при медленном центрифугировании. Сбор образца в 1,5 мл пробирку.
- Сухой образец в вакуумной концентратором.
Примечание: Временные точки остановки: Образец можно хранить при температуре -80 ° С.
10. Анализ гистонов пептидами
Примечание: Платформа НЖК-MS должен быть установлен, как это сделано в традиционном анализе пептидов. Использование 200 - 300 нл колонке потока (75 мкм ID аналитической колонке, C 18 частиц) рекомендуется, так как они являются отличным компромисс между чувствительностью и стабильностью. Метод приобретения МС может быть либо комбинацией сбора данных зависящих от (DDA) с целенаправленными сканирований 19 или данных независимый от приобретения (АСВ) 20,21, как описано в репрезентативных результатов и фиг.4.
- Подготовка ВЭЖХ буферов - А: 0,1% муравьиной кислоты вВЭЖХ-класса воды; Б: 0,1% муравьиной кислоты в ВЭЖХ-сорт ацетонитрила.
- Программирование методом ВЭЖХ следующим образом: от 0 до 30% буфера B в течение 30 мин, от 30 до 100% B в течение следующих 5 мин и при изократическом 100% В в течение 8 мин. Если ВЭЖХ не запрограммирован для автоматического уравновешивания колонки до загрузки образца, а затем включают в себя следующее: градиент от 100 до 0% В в течение 1 мин и изократический поток при 0% В в течение 10 мин. Установите скорость потока анализа до 250 - 300 л / мин.
- Программирование метода приобретения MS для выполнения либо ДВР в сочетании с целенаправленными сканирований 19 или DIA 20,21 (рисунок 4). Убедитесь, что цикл MS долг позволяет полный MS сканировать каждый ~ 2 сек, чтобы иметь достаточное количество точек данных через хроматографического пика, что позволяет более точно количественно оценить. Примечание: С помощью хроматографии на C 18, средняя ширина базовой линии пика составляет около 30 сек для градиента , описанного выше.
- Нагрузка приблизительно 1 мкг образца на ВЭЖХ-Column.
- Запуск метода ВЭЖХ-МС / МС, как запрограммировано.
Примечание: В протоколе мы не рекомендуем специфику столбцов, MS инструментов или описание параметров MS, как и любой оптимальной настройке, что физическое лицо протеомика лаборатории разработана будет пригодна для метода. Proteomics лаборатории должны использовать свои оптимизированные настройки, поскольку гистонов пептиды отделяют как традиционные пептиды.
Анализ 11. Данные
- Импорт исходных файлов MS в программное обеспечение для выполнения пиковой интеграции области. Примечание: EpiProfile 22 рекомендуется, поскольку он оптимизирован для гистонов пептидов; используя время удерживания знания хроматографического элюирования выполняет надежное извлечение площади пика известных гистонов пептидов. В качестве альтернативы, Skyline 23 является еще одним идеальным программным обеспечением для этой цели.
- Вычислить относительное обилие данного пептида путем деления его площади на общую площадь этого пептида во всех его модифицированных формах. Примечание: В случае обнаружения Analyсестренка талисмана рекомендуется идентифицировать спектры модифицированных пептидов гистонов. Эффективность этого инструмента была описана недавно 24. Все другие поисковые базы данных двигателей для протеомики также можно использовать, но на наших тестах они обеспечивают более низкую производительность.
Результаты
В качестве примера, мы проанализировали гистоны, извлеченные из человеческих эмбриональных стволовых клеток (ЭСК) с и без ретиноевой кислоты стимуляции (RA), начиная с 200 мкл клеток гранул. Присутствие RA в культуре клеток приводит к ESC дифференциации. Из клеточного осадка, примерно 50 - 100 мкг гистонов были извлечены, что более чем достаточно для выполнения многократных инъекций LC-MS гистона пептидов. После дериватизации, пищеварение и обессоливания, образцы загружали на 75 мкм х 15 см С 18 колонке (диаметр частиц 3 мкм, размер пор 300 Å) , в последовательном режиме с системой жидкость нано - хроматографии высокоэффективной с микрофлюидальных чипов , соединенных с гибридом линейная ловушка квадрупольный - Orbitrap масс-спектрометр. приобретение МС проводили с использованием DIA. Параллельно с этим, образцы были также проанализированы с использованием метода ДВР с использованием UHPLC нано-потока, соединенный с ловушкой-Orbitrap масс-спектрометре гибридный ионным (данные не показаны). Вкаждый цикл, один полный обнаружение MS Orbitrap была выполнена с диапазоном сканирования 290 до 1400 м / г, с разрешением 60 000 (на 200 м / г) и AGC 10 6. Затем, режим регистрации зависит от данных был применен с динамическим исключение 30 сек. MS / MS сканирования следовали на родительских ионов из наиболее интенсивных из них. Ионы с зарядом состояния одного, были исключены из MS / MS. Использовали окно изоляция 2 м / г. Ионы фрагментированы с использованием столкновения индуцированной диссоциации (CID) с энергией столкновений 35%. Обнаружение ловушки Ion был использован при нормальном режиме сканирования диапазона и нормальной скорости сканирования с АРУ 10 4.
Были проанализированы данные Сырье MS принятия программного обеспечения для извлечения предшественников и ионов фрагментов хроматограмм, а именно Skyline 23 и EpiProfile 22. EpiProfile был оптимизирован для гистонов пептидов, как он интегрирует интеллектуальное извлечение площади пика в связи с предыдущим знанием бодрости духавремя удерживания прилива. С другой стороны, Skyline оптимизирован для DIA анализа, и , таким образом цифры АСВ отображаются (рисунки 4 и 5А) представлены скриншоты из этого программного обеспечения. Из добытой ионной хроматограммы, площадь под кривой извлекается, и это используется для оценки численности каждого пептида. Площадь хроматографического пика была рассчитана для [М + Н] +, [М + 2Н] 2+, и [М + 3Н] 3+ одного и того же пептида, хотя в большинстве случаев [М + 2Н] 2+ была преобладающей формой. Это обеспечивает необработанный обилие данной модифицированной форме пептида. Для достижения относительного содержания PTMs, сумма всех различных модифицированных форм гистона пептида рассматривалась как 100%, а площадь конкретного пептида была разделена на общую площадь для этого гистона пептида во всех его модифицированных формах ,
Гистоновые пептиды присутствуют в ваriety изобарических форм (рисунок 5). Изобарической пептиды, например, K18ac и K23ac, может быть количественно определена только на уровне МС / МС, где их уникальные фрагменты ионов , которые используются для определения соотношения изобарической видов (рис 5А и 5В). Это соотношение используют, чтобы разделить площадь хроматографического пика между двумя видами. При использовании DDA, эти изобарные формы были включены в список целевых масс, поскольку эти пептиды должны быть выбраны для фрагментации через всю их элюирования, которое не имело бы место в стандартном эксперименте ДДА. Дискриминация относительного обилия видов изобарическими затем осуществляется путем контроля профиль элюции осколочных ионов. С другой стороны, АСВ тип приобретения не требует какого-либо списка включений. Тем не менее, этот тип метода получения данных не совместим с традиционными поиска в базе данных, и, таким образом, может привести к тому открытию неизвестных модифицированных пептидов.
Лизин ацетилирования (+ 42,011 Da) был различен с почти изобарической триметилирования (+ 42,047 Da) с использованием высокого разрешения приобретение MS (> 30000). Кроме того, ацетилирование является более гидрофобным, чем триметилирования, что приводит к элюции ацетилированных пептидов позже, чем соответствующие trimethylated из них. Неизмененной форме одного и того же пептида элюируется даже позднее, в связи с тем, что лизин propionylated. Таким образом, порядок гидрофобность для пептида с одним изменяемого сайта ди- и trimethylated <ацетилированный <неизмененной (propionylated) <монометилированного (propionylated).
ЭСК показал явное снижение ацетилированного пептидов при стимуляции дифференцировки (рис 6A и 6B). И это не удивительно, так как предыдущие результаты сообщили о росте ацетилирование в ЭСК по сравнению с дифференцирующих из них 25,что отражает в целом весьма природу плюрипотентных хроматина. Сосредоточив внимание на гистона H3, 35 различных модифицированные формы количественно (6С). Тем не менее, все гистонов proteoforms, которые могут быть исследованы с этим подходом более чем 200, в том числе всех вариантов гистонов и низких модификаций изобилие (данные не показаны). Кроме того, анализ показал, что высокая степень воспроизводимости может быть получена между техническими повторах, о чем свидетельствует небольшой размер погрешностями (представляющих значение ± стандартное отклонение). Взятые вместе, в этом разделе описывается, как извлечь относительное обилие гистонов модифицирована пептидов с использованием данных НЖК-MS.
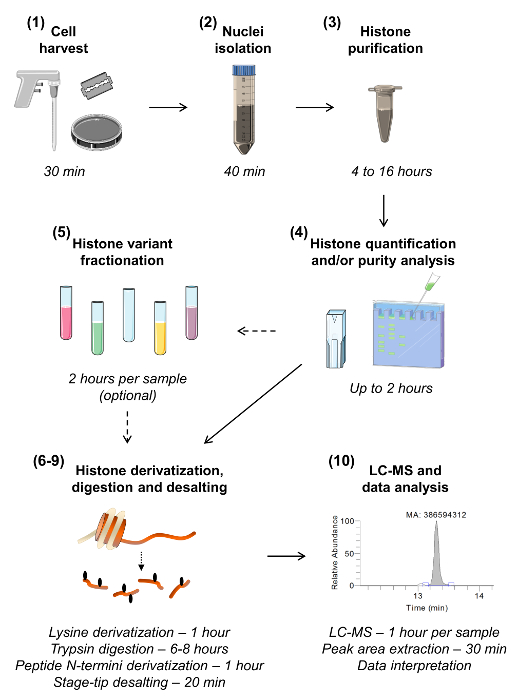
Рисунок 1:. Рабочий процесс снизу вверх MS / MS Гистона Анализ Десять шагов для анализа гистонов представлены, в том числе оценки времени , необходимого для каждого шага. Номер секции приводится в скобках, как присутствует в рукописи. Раздел 5, описывающий образец фракционирование , чтобы изолировать различные варианты гистонов, могут быть опущены , если нет необходимости для высокочувствительного анализа данного варианта. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
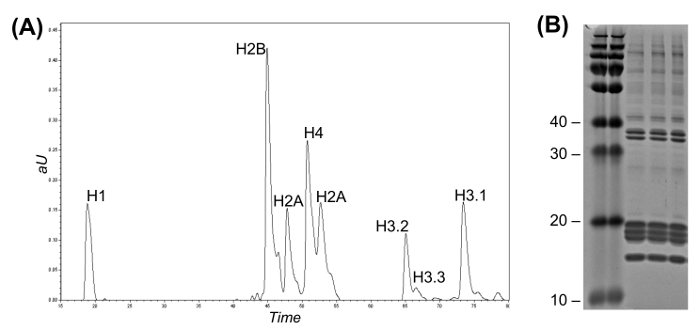
Рисунок 2: обращенно-фазовой High Flow LC для Гистона Вариант фракционирования и Кумасси гель (A) LC-UV хроматограмму , представляющий неповрежденную разделение гистонов.. Варианты гистона H3 можно отличить друг от друга в соответствии с их временем элюции. Фракции могут быть собраны либо вручную , либо с использованием автоматического коллектора фракций. (Б) кумасси гель из трех повторах очистки гистонов.= "Https://www.jove.com/files/ftp_upload/54112/54112fig2large.jpg" целевых = "_blank"> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рис . 3: Изготовление Сценическое опрокидывания штепселю P1000 наконечником пипетки, перфоратор диск , изготовленный из материала C 18 из твердого диска экстракции фазы (вторая панель). Минидиск вставит в наконечнике (средняя панель), так что она может быть вытеснена в кончике меньше Р100 / 200 пипеткой с использованием любого вида малого капилляра. В этом примере мы использовали 700 мкм внешний диаметр трубки из кварцевого стекла с. Минидиск должны быть прижаты к нижней части Р100 / 200 наконечника пипетки до тех пор, пока не может идти дальше (последняя панель). Кончик этап готов к гистона обессоливания, так как он имеет достаточный потенциал для сохранения достаточного количества материала образца для многочисленных повторах. В частности, один минидиск достаточно для 15 - 20 мкг саmple. Если требуется больше образца, несколько дисков могут быть упакованы друг на друга. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
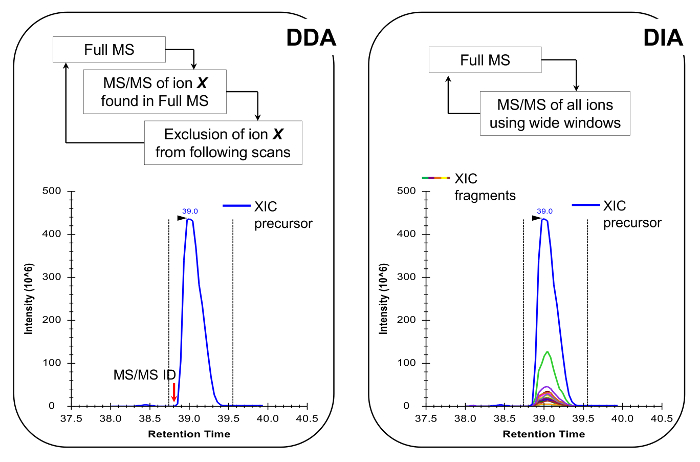
Рис . 4: Схематическое изображение DDA и АСВ методы При использовании ДВР, цикл сканирования MS характеризуется последовательной селекции ионов - предшественников для фрагментации MS / MS в зависимости от их интенсивности и состояния заряда. После того, как ион-предшественник был фрагментирован он помещен в список исключений, чтобы избежать повторного выбора одного и того же пептида, так что мобильная станция может "рыть" в меньшем количестве сигналов. Этот метод приобретение является методом выбора в протеомики режиме обнаружения. Количественное достигается за счет интеграции полного сигнала сканирования данного иона рядом с выявленными MS /Масс-спектр. В АСВ, весь диапазон м / з фрагментируется при каждом цикле сканирования. Такой подход менее подходящим для режима обнаружения, но он производит хроматографический профиль всех ионов, предшественников и продуктов. Это приводит к более уверенной количественной оценки и дискриминации изобарических форм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
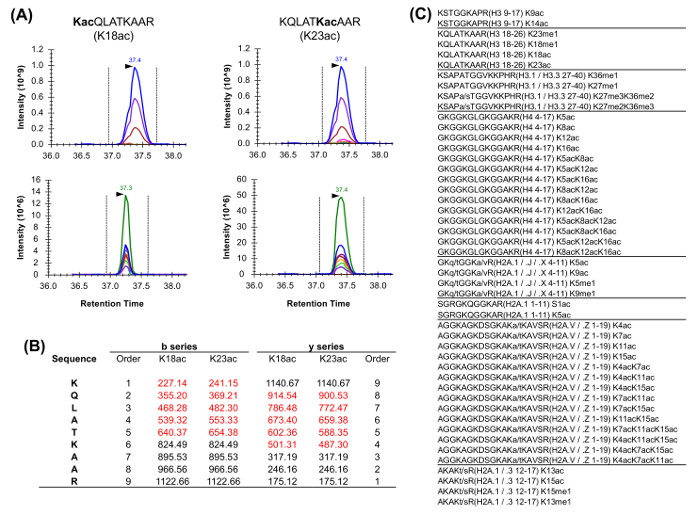
Рисунок 5: Количественная изобарической пептидами (А) Пример двух изобарных пептидов , обычно обильных в анализе гистонов.. Извлеченный ионная хроматограмма (XIC) их массы предшественника и относительных изотопов (выше) одинакова. Тем не менее, XIC ионов продукта (ниже) допускает дискриминации двух изобарных форм. Примечательно, что только уникальный фрагмент ионы должны быть намие изд для оценки относительной численности этих двух видов. (B) Представление уникальных осколочных ионов для двух описанных пептидов (выделены красным цветом). (C) Список наиболее часто анализируемых пептидов в гомо сапиенс , имеющих по меньшей мере один изобарную эквивалент. Последовательность вариантов между перечисленными гистонов пептиды обозначены. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
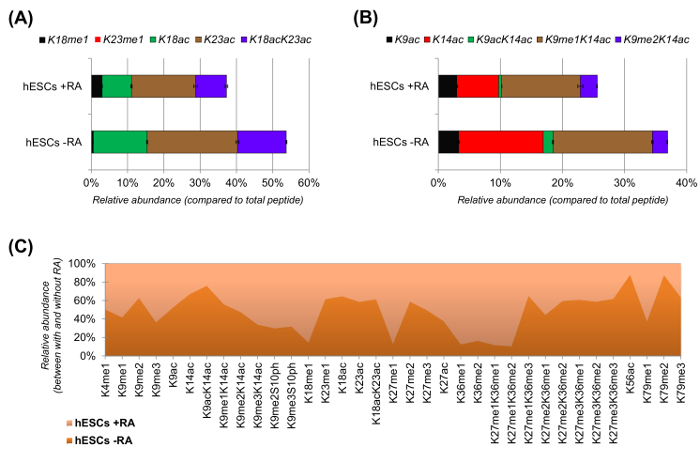
Рисунок 6: Типичные результаты эмбриональных стволовых клеток человека с и без кислотной обработки ретиноевой (A) Относительное количественное определение гистона H3 пептида KQLATKAAR (аа 18 - 26) во всех его модифицированных proteoforms.. Относительное содержание оценивалось с использованием всех proteoforms как 100% (в отнтельной процент немодифицированного пептида не показан) (В) Относительное количественное определение гистона H3 пептида KSTGGKAPR (аа 9 -.. 17) (C) Относительная численность обнаруженных пептидов для канонического гистона Н3 с и без обработки клеток с ретиноевой кислотой. Как видно из рисунка, в каком из двух видов лечения данные изменения более распространены (> 50%). В целом, мы показали , что гистона H3 ацетилирования уменьшается в большинстве остатков лизина при индукции дифференцировки клеток. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Решение # | Состав | ||||||
| 1 | Ядерная Изоляция буфера (NIB) акций производится следующим образом и хранят в замороженном виде в аликвотах 100 мл при -20 ° C; оттаивалиНСБ можно хранить при температуре 4 ° С в течение нескольких недель: 15 мМ Трис, 60 мМ KCl, 15 мМ NaCl, 5 мМ MgCl 2, 1 мМ CaCl 2 и 250 мМ сахарозы. Значение рН буфера доводят до 7,5 с помощью HCl. | ||||||
| 2 | Ингибиторы протеаз (добавить в свежем виде буферов перед использованием): 1 М дитиотреитола (ДТТ) в DDH 2 O (1,000x); 200 мМ AEBSF в DDH 2 O (400x) | ||||||
| 3 | ингибитор фосфатазы (добавить в свежем виде буферов перед использованием): 2,5 мкМ Микроцистин в 100% этаноле (500x) | ||||||
| 4 | ингибитор HDAC (добавить свежие буферы перед использованием): 5 бутират натрия M, изготовленные путем титрования 5 М масляной кислоты с использованием NaOH до рН 7,0 (500x) | ||||||
| 5 | NP-40 Альтернатива: 10% об / об в DDH 2 O | ||||||
| 6 | 0,2 М H 2 SO 4 в DDH 2 O | ||||||
| 7 | Трихлоруксусной кислоты (ТСА): 100% вес / объем в DDH 2 O | ||||||
| 8 | Ацетон + 0,1% соляную кислоту (HCl): 0,1% об / об HCl в ацетоне | ||||||
Таблица 1. Решения.
Обсуждение
Протокол, описанный здесь, оптимизирован с учетом затрат, времени и производительности. Другие препараты возможны, но они имеют свои ограничения, особенно в случае сочетания с МС-анализ. Например, протокол экстракции высокой соли может быть использована для очистки гистоны 26 вместо осаждения ТСА (раздел 3). Протокол сильносолевым свойственно более мягким, поскольку он не использует сильную кислоту. Это сохраняет кислотно-лабильных PTMs и увеличивает выход извлекаемых гистонов, как осаждение TCA со-осаждается много других связывающих белков хроматина. Тем не менее, извлечение высокой соли приводит к образцам, содержащим слишком концентрированный соль для ВЭЖХ-МС / МС. В альтернативном приготовлении гистона переваривание может быть выполнена без пропионилирования (раздел 6 - 8), например , за счет сокращения времени инкубации и трипсин соотношение фермент / субстрат 27 или с использованием в качестве ARGC переваривания фермента 28-30. Тем не менее, дериватизации с пропионового ангидрида рекомендуется, так как ят приводит к образованию большего количества гидрофобных пептидов, которые лучше сохраняются при жидкостной хроматографии.
Для химической дериватизации, различные ангидриды органических кислот были оценены и их достоинства были всесторонне обсуждены 18. Тем не менее, пропионовый ангидрид оказался наилучший компромисс между эффективностью, сведен к минимуму побочных продуктов и улучшенным пептидной гидрофобность. Потенциально, пропионовый ангидрид можно приобрести в изотопно меченой форме; это позволяет мультиплексирование анализа в связи с возможностью смешивания нескольких проб и дискриминировать их на уровне MS на основе различных масс привиты от тяжелой этикетке. Тем не менее, этот анализ приводит к увеличению сложности на хроматограмме ЖХ-МС и уменьшает количество пробы, которые могут быть инъецированы для каждого отдельного состояния.
В связи с этим следует выделить некоторые важные аспекты протокола. Далее следует использовать в качестве глecklist, чтобы найти ошибки при выполнении процедуры в случае получены отрицательные результаты. Во-первых, после того, как зародышей осаждения Таблетку следует тщательно промывают СИБ без NP-40 Alternative (раздел 2.10) до полного удаления моющего средства (заметному отсутствием пузырьков во время перемешивания). Несоблюдение этого правила может поставить под угрозу добычу гистонов с кислотами. Во-вторых, после осаждения гистона с ТСА (раздел 3.9) промывками гранул с ацетоном имеет решающее значение. Наличие концентрированной кислоты будет вредить следующий шаг, если пропионилирования и пищеварение (раздел 6.1) непосредственно выполняются. Было бы не проблематично в случае гистона фракционирования выполняется (раздел 5). В-третьих, необходимо, чтобы реакция пропионилирования выполняется быстро (раздел 6.3 - 6.7). Для этого, во избежание используя тот же пропионилирования смеси (пропионовый ангидрид + ацетонитрил) в течение более 3 - 4 последовательных образцов. Кроме того, рН является наиболее важным аспектом трипсина пищеварения (раздел 7). Если неоколо 8.0 (7.5 - 8.5) пищеварение будет неэффективным. Это может произойти, как образец будет богат пропионовой кислоты на этой стадии. NH 4 OH , могут быть добавлены , пока это необходимо. Кроме того, для исследователей, знакомых с протеомики рабочих процессов он будет чувствовать себя нормально, чтобы подкислить образец прекратить трипсин пищеварение. Это не должно быть сделано, поскольку это поставит под угрозу следующую реакцию, т.е. пропионилирования пептида N-концами (раздел 8.1). И, наконец, в том же номере, важно помнить, для анализа данных, что немодифицированные пептиды не являются фактически неизмененной; все остатки лизина и свободный N-концы будут заняты пропионилирования (56,026 Da). Таким образом, выполняя извлекающий ионной хроматографии массы однозначно соответствующее пептидной последовательности привела бы к результатов.
Ограничения метода, в основном связаны с невозможностью обнаружения комбинаторные PTMs, из-за коротких пептидных последовательностей, и перекосы в достижении истинного abunтанец модификации, в связи с тем, что пептиды в различных модифицированных формах, возможно ионизировать с различной эффективностью. Первая проблема может быть решена путем объединения эту технику со средним вниз или сверху вниз (обзор 16). Этот тип анализа, даже если технически более сложным, идеально подходит для изучения сосуществования частоты модификаций. Кроме того, оно позволяет лучше дискриминации вариантов гистонов, которые не всегда могут быть достигнуты с восходящим, поскольку некоторые пептиды имеют ту же последовательность в различных вариантах гистонов. Вторая проблема, связанная с эффективностью ионизации, может быть решена с использованием библиотеки синтетических пептидов 31. Такой подход обеспечивает более точную оценку относительного содержания гистонов PTMs. Тем не менее, в большинстве экспериментов, желаемый результат относительные изменения данных модификаций между проанализированных условий. В этом случае, такая коррекция не нужно, из-за того, что все образцы имеют одинаковые BIAs.
В заключение, этот протокол позволяет для анализа гистонов PTMs, которые могут быть завершены в течение 3 дней с использованием НЖК, соединенный с тандемной MS. Сравнения с другими , чем MS методов, то есть, используя стратегии на основе антител , как было сказано во введении, не подходят, так как они не могут достичь даже почти такой уровень пропускной способности . Кроме того, методы антител на основе не позволяют за открытие новых модификаций, но они основаны исключительно на подтверждении и количественной оценки предсказанных знаки. Таким образом, мы полагаем, что снизу вверх протеомики на гистонов пептидов будет набирать популярность в лабораториях протеомики благодаря интуитивных преимуществ в знании регулирования гистонов марок, которые являются главными действующими лицами в экспрессии генов настройки и, таким образом, влияют на регулирование протеома. Кроме того, протокол, описанный включает в себя последние достижения в области подготовки проб и программное обеспечение для анализа данных, которые делают анализ гистонов более тривиальным также для LABORAтори, которые никогда не испытывали характеристику этого типа hypermodified пептидов.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана финансирование из NIH грантов (DP2OD007447, R01GM110174 и R01AI118891).
Материалы
| Name | Company | Catalog Number | Comments |
| Trypsin 0.25% EDTA | Invitrogen | 25200056 | For harvesting cells |
| PBS | Invitrogen | 14200075 | |
| Tris | Roche | 77-86-1 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Sodium Chloride | Sigma | S9888 | |
| Magnesium Chloride hexahydrate | Sigma | M9272 | |
| Calcium Chloride, anhydrous | Sigma | C1016 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| DTT | Invitrogen | 15508-013 | |
| AEBSF | EMD Millipore Corp | 101500 | |
| Microcystin | Sigma | M4194 | |
| Sodium Butyrate | Sigma | B5887 | |
| Halt Protease and Phosphatase Inhibitor Cocktail, EDTA-free (100x) | Fisher Scientific | 78445 | |
| NP- 40 Alternative | CALBIOCHEM | 492016 | |
| Sulfuric Acid, ACS grade | Fisher Chemical | 7664-93-9 | |
| Trichloroacetic acid | Sigma | T6399 | |
| Acetone | Sigma | 179124 | |
| HCl | Fisher Chemical | A144-500 | |
| Bradford reagent | Biorad | 500-0006 | |
| 30% acrylamide/bis 29:1 — 500 ml | Biorad | 1610156 | |
| Coomassie | Fisher Scientific | 20278 | |
| C18 Column (5 µm) 2.1 mm x 250 mm | Grace | 218TP52 | |
| C18 Column (5 µm) 4.6 mm x 250 mm | Grace | 218TP54 | |
| HPLC grade acetonitrile | Fisher Chemical | A955-4 | |
| HPLC grade water | Fisher Scientific | W6 4 | |
| TFA | Fisher Scientific | A11650 | |
| Ammonium Bicarbonate | Sigma | A6141 | |
| ammonium hydroxide | Sigma | 338818 | |
| propionic anhydride | Sigma | 240311 | |
| Sequencing grade modified trypsin | Promega | PRV5113 | For digesting histones for MS |
| Acetic Acid | Sigma | 49199 | |
| C18 extraction disk | Empore | 2215 | |
| Formic Acid | Sigma | F0507 |
Ссылки
- Waddington, C. H. Canalization of development and the inheritance of acquired characters. Nature. 150, 563-565 (1942).
- Sharma, S., Kelly, T. K., Jones, P. A. Epigenetics in cancer. Carcinogenesis. 31 (1), 27-36 (2010).
- Reik, W., Dean, W., Walter, J. Epigenetic reprogramming in mammalian development. Science. 293 (5532), 1089-1093 (2001).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128 (4), 693-705 (2007).
- Tessarz, P., Kouzarides, T. Histone core modifications regulating nucleosome structure and dynamics. Nat Rev Mol Cell Bio. 15 (11), 703-708 (2014).
- Fischle, W., Wang, Y. M., Allis, C. D. Histone and chromatin cross-talk. Curr Opin Cell Biol. 15 (2), 172-183 (2003).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Simboeck, E., et al. A Phosphorylation Switch Regulates the Transcriptional Activation of Cell Cycle Regulator p21 by Histone Deacetylase Inhibitors. J Biol Chem. 285 (52), 41062-41073 (2010).
- Hirota, T., Lipp, J. J., Toh, B. H., Peters, J. M. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature. 438 (7071), 1176-1180 (2005).
- Xhemalce, B., Kouzarides, T. A chromodomain switch mediated by histone H3 Lys 4 acetylation regulates heterochromatin assembly. Genes Dev. 24 (7), 647-652 (2010).
- Vermeulen, M., et al. Quantitative interaction proteomics and genome-wide profiling of epigenetic histone marks and their readers. Cell. 142 (6), 967-980 (2010).
- van Attikum, H., Gasser, S. M. Crosstalk between histone modifications during the DNA damage response. Trends Cell Biol. 19 (5), 207-217 (2009).
- Fernandez-Capetillo, O., et al. H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis. Dev Cell. 4 (4), 497-508 (2003).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. Embo J. 28 (17), 2511-2531 (2009).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Sidoli, S., Cheng, L., Jensen, O. N. Proteomics in chromatin biology and epigenetics: Elucidation of post-translational modifications of histone proteins by mass spectrometry. J Proteomics. 75 (12), 3419-3433 (2012).
- Plazas-Mayorca, M. D., et al. One-Pot Shotgun Quantitative Mass Spectrometry Characterization of Histones. J Proteome Res. 8 (11), 5367-5374 (2009).
- Sidoli, S., et al. Drawbacks in the use of unconventional hydrophobic anhydrides for histone derivatization in bottom-up proteomics PTM analysis. Proteomics. 15 (9), 1459-1469 (2015).
- Lin, S., Garcia, B. A. Examining histone posttranslational modification patterns by high-resolution mass spectrometry. Methods Enzymol. 512, 3-28 (2012).
- Sidoli, S., et al. SWATH Analysis for Characterization and Quantification of Histone Post-translational Modifications. Mol Cell Proteomics. , (2015).
- Krautkramer, K. A., Reiter, L., Denu, J. M., Dowell, J. A. Quantification of SAHA-Dependent Changes in Histone Modifications Using Data-Independent Acquisition Mass Spectrometry. J Proteome Res. , (2015).
- Yuan, Z. F., et al. EpiProfile Quantifies Histone Peptides With Modifications by Extracting Retention Time and Intensity in High-resolution Mass Spectra. Mol Cell Proteomics. 14 (6), 1696-1707 (2015).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Yuan, Z. F., Lin, S., Molden, R. C., Garcia, B. A. Evaluation of proteomic search engines for the analysis of histone modifications. J Proteome Res. 13 (10), 4470-4478 (2014).
- Tan, Y., Xue, Y., Song, C., Grunstein, M. Acetylated histone H3K56 interacts with Oct4 to promote mouse embryonic stem cell pluripotency. Proc Natl Acad Sci U S A. 110 (28), 11493-11498 (2013).
- Vonholt, C., et al. Isolation and Characterization of Histones. Methods Enzymol. 170, 431-523 (1989).
- Zhang, K. L., et al. Identification of acetylation and methylation sites of histone H3 from chicken erythrocytes by high-accuracy matrix-assisted laser desorption ionization-time-of-flight, matrix-assisted laser desorption ionization-postsource decay, and nanoelectrospray ionization tandem mass spectrometry. Anal. Biochem. 306 (2), 259-269 (2002).
- Jufvas, A., Stralfors, P., Vener, A. V. Histone Variants and Their Post-Translational Modifications in Primary Human Fat Cells. Plos One. 6 (1), e15960(2011).
- Bonaldi, T., Imhof, A., Regula, J. T. A combination of different mass spectroscopic techniques for the analysis of dynamic changes of histone modifications. Proteomics. 4 (5), 1382-1396 (2004).
- Zhao, X. L., et al. Comparative Proteomic Analysis of Histone Post-translational Modifications upon Ischemia/Reperfusion-Induced Retinal Injury. J Proteome Res. 13 (4), 2175-2186 (2014).
- Lin, S., et al. Stable-isotope-labeled histone peptide library for histone post-translational modification and variant quantification by mass spectrometry. Mol Cell Proteomics. 13 (9), 2450-2466 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены