Method Article
히스톤 추출에서 데이터 분석에 : 상향식 질량 분석 사용 히스톤 번역 후 변형 분석을위한 완벽한 워크 플로우
요약
이 프로토콜은 질량 분석기 (MS)를 사용하여 히스톤 번역 후 변형을 특성화하기위한 완벽하게 통합 된 워크 플로우를 설명합니다. 워크 플로는 나노 흐름 액체 크로마토 그래피 및 데이터 분석을위한 지침을 사용하여 세포 배양 또는 조직, 히스톤 유도체 및 소화, MS 분석에서 히스톤 정화를 포함한다. 삼일 -이 프로토콜은 2 내에 완성을 위해 설계되었습니다.
초록
뉴 클레오 히스톤 단백질의 옥타 감싸 DNA의 147 염기쌍 이루어지는 염색질의 최소 구성 단위이다. 히스톤 기능은 핵 단백질의 무수한에 의해 광범위한 번역 후 변형에 의해 매개된다. 그들은 유전자 조절, DNA 수리 및 염색체 응축에 관여 크로 마틴 구조 및 모집 효소를 조절 이러한 수정은 핵 무결성을 위해 중요하다. 과학계의 큰 부분은 히스톤 PTM 풍부의 특성을 항체 기반 기술을 채택하더라도 에피토프가 근처의 수정에 의해 차단 될 수 있습니다로, 이러한 접근 방식은, 낮은 처리량과 hypermodified 단백질에 대한 편견이다. 이 프로토콜은 히스톤 변형의 정확한 정량 나노 액체 크로마토 그래피 (NLC)와 질량 분석기 (MS)를 사용하는 방법을 설명한다. 이 방법은 히스톤 PTMS의 큰 다양성과 여러 히스톤의 상대적 풍요의 특성을 설계의 내 변종화롯불은 분석한다. 길이 20 AA -이 프로토콜에서, 히스톤 5의 펩티드를 생성하기 위해 트립신 소화 하였다 프로피온산 무수물로 유도된다. 소화 후, 히스톤 펩티드의 새롭게 노출 된 N 말단은 NLC-MS 크로마토 그래피 동안 유지를 향상시키기 위해 유도된다. 이 방법은 크기의 네 주문에 걸친 히스톤 PTMS의 상대적 정량이 가능합니다.
서문
후성 유전학은 기본 DNA 서열 1을 변경 이외의 다른 메커니즘에 의해 발생하는 유전자 발현의 유전 적 변화의 연구로 정의된다. 유기체 극적인 표현형은 DNA의 내용이 변경되지 않는 경우에도 변경 겪는으로 성적인 규제는 개발하는 동안 중요합니다. 다른 메커니즘 (2)을 통해 유전자 발현에 영향을 미치는 각각의 히스톤 번역 후 변형 (PTMS), 히스톤 변형, 비 - 코딩의 RNA, DNA 메틸화와 DNA 결합 요소를 포함하여 적절한 후성 유지에 필요한 몇 가지 중요한 구성 요소가있다. 예를 들면, DNA 메틸화 상태가 유전자 번역 3, 히스톤 변형 및 히스톤 PTMS 더 동적이며 4 가지 다양한 염색질 영향을 억압 할 수 매우 안정 변형이다.
이들이 가장 노출가요 영역만큼 히스톤 PTMS 대부분의 N 말단 꼬리에서 지역화단백질. 그러나, 뉴 클레오 핵심은 크게 평균 단백질 5에 비해 수정됩니다. 히스톤 마크가 광범위하게 지난 10 년을 특징으로되어 있지만, 알려진 히스톤 마크와 그 기능 사이에 많은 링크는 여전히 불분명하다. 이것은 대부분의 히스톤 PTMS이 전사 -6,7- 같은 특정 프로세스를 변경하기 위해 다른 PTMS ( "크로스 토크")와 협력하여 기능을 오히려 혼자서 작동하지만하지 않는다는 사실에 주로 기인한다. 예를 들어, 유전자 P21의 조합 마크 H3S10K14ac 두 PTMS 8 하나만 발생하지 않을의 전사를 활성화시킨다. 단백질 HP1 콤팩트는 H3K9me2 / 여기서 Me3을 인식하고 근처의 뉴 클레오에 수정을 확산하여 염색질. 인접 S10 9 인산화 때, HP1은 H3K9me2 / 3 바인딩 할 수 없습니다. H3K4의 아세틸 화는, 분열의 pombe 10 H3K9me2 / 여기서 Me3에 단백질 spChp1의 결합을 억제한다. 또한, 히스톤 라이신 Demethylase PHF8 세 PTMS H3K4me3, K9ac 및 K14ac 11 존재하는 가장 높은 뉴 클레오 결합 효율을 가지고있다. 이러한 예는 히스톤 PTM 변화의 글로벌 개요를 달성하기보다는 하나의 수정에 초점을 맞추고의 중요성을 강조 표시합니다.
서열의 존재는 또한 변형 히스톤 이소 타입은 일반적으로 고도의 유사한 서열을 가지고, 히스톤 분석의 복잡성을 증가 시키지만, 종종 염색질의 서로 다른 역할이있다. 예를 들어, H2A.x보다 쉽게 정규 H2A 12에 비해 DNA 손상시 인산화 된 C 말단 서열을 보유하고, 수컷 마우스 감수 13 성 염색체의 불 활성화에 요구되고; 유사하게, CENP-A는 동원체 (14)에 정식 히스톤 H3를 대체합니다. 서로 다른 기능에도 불구하고, 이러한 변이체는 식별하고 개별적으로 계량하는 것이 어려워, 각 정규 히스톤과의 아미노산 서열의 많은 부분을 공유한다.
예컨대 웨스턴 블 롯팅과 같은 항체 - 기반 기술은 광범위 히스톤을 특성화하기 위해 채택되었다. 그러나, 항체 기반의 접근법은 다음과 같은 이유로 제한된다 : (I)가 유일한 변형의 존재를 확인할 수 알려지지 PTMS를 식별 할 수있다; (ⅱ)들은 의한 결합력에 영향을 미칠 수있는 공존 마크의 존재로 바이어스된다; (ⅲ) 그들은 단지 거의 항체는 목적 (IV)가 매우 유사한 히스톤 변형 또는 유사한 PTMS (예를 들어, 디 - 및 리신 잔기의 trimethylation) 사이에 교차 반응에 사용할 수있는 바와 같이, 조합 마크를 식별 할 수 없습니다. Egelhofer 등. 상업적인 항체의 25 % 이상이 도트 블롯 또는 웨스턴 블롯에 의해 특이성 테스트를 실패, 특정 항체들 사이에서 20 % 이상 염색질 면역 침전 실험 15에서 실패 것이 기재. 질량 분석 (MS)는 현재 신규 및 / 또는 조합 PTMS을 연구하는 가장 적합한 분석 도구입니다그리고 광범위 (16 평가) 히스톤 단백질에 대해 구현되었다. 이것은 고감도 MS 질량 정확도 및 대규모 분석을 수행 할 수있는 가능성에 주로 기인한다.
(- 20 AA 5) 상향식 전략은 그대로 단백질 효소 짧은 펩티드로 분해되는 것을 특징으로 히스톤 특성 및 PTMS 대한 가장 일반적으로 사용되는 MS 기반 프로테오믹스 전략이다. 이 소화 LC 분리 및 MS 검출 모두를 용이하게한다. 600의 범위에서 대중 - 2000 다 일반적으로 더 쉽게 이온화 큰 질량보다 높은 질량 정확도와 해상도로 식별됩니다. MS / MS 단편화는 짧은 펩티드는 일반적으로 충돌 유도 해리 (CID)에 적합하다, 개선된다. 그들은 높은 염기성 아미노산 잔기, 즉, 라이신과 아르기닌이 풍부한된다 그러나, 히스톤은 상향식 MS에 대한 도전을 제시한다. 따라서, 트립신 소화도 SM 펩티드의 생성에 이르게모든 LC 보유하고 PTMS의 명확한 파악합니다. 이 문제를 회피하기 위해, 우리의 프로토콜은 라이신과 펩티드 N- 말단 화학 유도체 (17)를 포함한다. 프로피온산 무수물의 사용은 다른 시약 (18)에 비해 효율적인 화학 유도체하는 것이 좋습니다. 트립신만을 아르기닌 잔기의 C 말단에서 단백질 분해를 수행 할 수 있도록 이러한 유도체 블록 변성 및 모노 리신 잔기의 ɛ 아미노기를. 아민 유도체의 용액으로 양성자 교환 할 수없고, 따라서 펩티드는 일반적으로 단지 이중 또는 삼중 MS 및 MS / MS 검출을 용이하게 충전된다. 또한, N 말단 펩티드 유도체는 소수성 때문에 역상 크로마토 보존 증가시킨다. 여기서 우리는 히스톤 정화 및 상향식 (bottom-up) 프로테오믹스 (그림 1)를 통해 PTM 분석을 준비 할 워크 플로를 설명합니다. 이 전략은 하나의 히스톤 마크와 조합 마크 (F)의 정량화를 달성아미노산 서열에서 비교적 가까운 또는 히스톤 PTMS.
프로토콜
문화의 세포 1. 수집
- 세포 현탁액에서 재배 된 경우, 5 분 300 RCF에서 원심 분리하여 세포를 수집합니다. 부착, 흡인과 폐기 세포 매체의 경우. 칼슘과 마그네슘 2 +없이 PBS에 부착 된 세포를 씻어 (PBS 향후이라 함). 셀 (시간이 상이한 세포주 다름) 분리 될 때까지 37 ° C에서 판의 표면을 커버하기에 충분한 양으로 - (+ 0.5 %가 세포주에 따라 0.025 %), 트립신 또는 트립신 EDTA 하나의 세포를 인큐베이션.
- 5 분 300 RCF에서 원심 분리하여 세포를 수집합니다. PBS에 세포를 두 번 이상 세척하고 원심 분리하여 수집합니다.
- 1.8 ml의 튜브 15 ML 원뿔 튜브에 표시된 눈금에서 약 포장 셀 볼륨을 예상하고있다.
참고 : 문화의 세포는 액체 질소 스냅인 동결이 단계에서에서 -80 ° C 무기한 저장할 수 있습니다.
본래 세포에서 핵 2. 분리
- 얼음에 해동 세포.
- 해동 핵 분리 완충액 (NIB, 표 1).
- 매 100 ㎕의 포장 셀 볼륨 약 5 ml의 NIB 버퍼 (표 1)을 준비합니다. 1 M DTT의 1 μL, 200 mM의 AEBSF의 2.5 μL, 2.5 μM 마이크로 시스틴 5 M 나트륨 부티레이트의 2 μL의 2 μl를 다음과 같이 매 1 ml의 NIB 버퍼를 들어, 프로테아제 억제제와 안정제를 추가합니다. 억제제 NIB는이 시점에서 NIB이라고한다.
참고 : 히스톤 인산화가 공부하는 경우, EDTA 무료 프로테아제 및 포스 파타 아제 억제제 칵테일을 포함한다. - NIB 버퍼의 제 5 부피 이렇게 제조를 제거하고, 0.2 %의 최종 농도로 대체 NP-40 (표 1)을 추가한다. 나머지 4 다섯째 볼륨은 세척을 위해 사용된다.
- NP-40 대체 비율없이 NIB 1:10 세포 펠렛의 세척 세포 펠렛 (v / v)로. 5 분 동안 700 RCF에서 원심 분리하여 상층 액을 제거합니다.
- 를 Lyse CEL얼음을 놓고 0.2 % NP-40 대안 NIB 1:10 세포 펠렛을 추가하여 L 펠렛 (V / V).
- 조직 샘플에서 추출하는 경우, 박격포와 유 봉 또는 다운스 균질를 사용하여 균질화. 배양 된 세포는 부드러운 파이 펫팅으로 균일화 할 수있다.
- 10 분 - 5 얼음에 균질 세포를 품어. 세포 용균과 핵을 발표 할 예정이다.
- 10 분에서 4 °의 C - 5 천 RCF에서 원심 분리기. 상층 액은 주로 세포질 구성 요소를 포함하는 동안 펠렛은 주로 핵 셀 포함되어 있습니다. 원하는 경우 세포질 부분을 저장합니다.
- 부드럽게 NP-40 대체하지 않고 1시 10분 (v / v)의 NIB에서 그것을 재현 탁하여 핵 펠렛을 씻으십시오.
참고 :이 세척 단계 전에 핵에서 히스톤 추출에 세제의 흔적을 제거하기 위해서만이다. - 4 ° C에서 5 분 동안 1,000 RCF에서 원심 분리기와 뜨는을 제거합니다.
- 단계를 반복 2.10-2.11 적어도 두 배는 완전히 NP-40 대체를 제거합니다. NP-40을 대체 제거 명백 A는세척 단계가 더 이상 거품을 형성하는 동안 부드러운 피펫 S는.
- 조직에서 히스톤 추출 :
- 얼음처럼 차가운 NIB 신선한 또는 해동 냉동 조직을 씻어.
- 젖은 조직을 유지하기 위해 충분한, NIB와 얼음에 배치 된 페트리 접시에 조직을 전송합니다.
- 면도날과 작은 조각 (<1mm)으로 주사위 핵 분리를위한 표면 접촉을 증가시킵니다.
- 미리 냉장 균질화에 다진 조직을 전송하고로 pipetting 아래로 NIB에 씻는다.
- 5 분 동안 300 RCF에서 원심 분리하여 버퍼를 제거합니다.
- 세포에서 세포에 NIB 포함 된 NP-40 대체를 추가 : 1:10 비율을 버퍼 (v / v)의 5로 균질화 - 10 스트로크.
- 세포 용해를 확인하고 필요에 따라 균질화를 반복합니다. 세포가 용해되어있는 좋은 지표 펠렛 부피의 감소이다. 펠렛은 핵을 포함해야합니다.
- 5 분 700 RCF에서 원심 분리기와 펠렛을 저장합니다. 2 시간 -이 펠릿 1을 추출 할 수 있습니다1시 10분에서의 (v / v)의 NIB는 NP-40 대체를 함유; 이 단계에서, 히스톤은 염색질의 의견 추출 및 펠렛 상당히 수축 된했다.
- 세제의 흔적을 제거하는 NP40 대안없이 NIB 3 ㎖ - 2 두 번 씻으십시오.
주 : 중간 정지 점 : 샘플 NIB + 5 % 글리세롤의 최소 부피에 재현 탁하고 -80 ℃에서 저장 될 수있다.
핵에서 히스톤 3. 추출 및 정제
주 : 히스톤 단단히 DNA의 인산 골격과 상호 작용할 수 있도록 이들 염기성 아미노산 잔기 매우 풍부하다. 히스톤은 핵에서 가장 기본적인 단백질 중입니다, 따라서 그 강한 산에 침전 비 히스톤 단백질, 최소한의 오염과 얼음처럼 차가운 황산 (0.2 MH 2 SO 4)에서 추출 할 수 있도록. (33 % 최종 농도) 고농도 TCA는 황산에서 히스톤 침전하는데 사용될 수있다산. TCA는 4 ° C에서 갈색 병에서 100 %로 저장됩니다.
- 를 Resuspend 세포의 핵은 1 : 5 (V / V)는 부드러운 피펫 0.2 MH 2 SO 4 (표 1)을 냉각.
- 4 ℃에서 4 시간 - 일정한 회전 또는 부드러운가 2 진탕 샘플을 품어. 통상적으로, 이상 500 μl의 세포 펠릿 시료를 들면, 2 시간 추출 히스톤를 추출하기에 충분하다; 이상 배양은 다른 기본 단백질의 추출 될 수 있습니다. 작은 핵 펠렛 (<200 μL)을, 4 시간 추출은 더 나은 수율을 제공한다.
- 5 분 동안 4 ° C에서 3400 RCF에서 원심 분리기.
- 새로운 튜브에 뜨는을 전송합니다.
- 어떤 불용성 물질을 제거하는 3.4 - 반복 3.3 단계.
- 히스톤을 침전 1의 비율로 수집 된 상청액 (지금 함유 히스톤)에 냉장 100 % TCA (표 1)를 추가 : 3 (v / v)로 33 %의 최종 TCA 농도를 얻기 위해서이다. 튜브를 몇 t을 반전 믹스IME를.
참고 : 샘플은 히스톤의 존재를 나타내는, TCA를 첨가에 흐린 켜집니다. - 적어도 1 시간 동안 얼음 혼합물을 품어. 작은 시작 펠릿 크기에, 하룻밤 침전하는 것이 좋습니다.
- 5 분 동안 3,400 RCF에서 원심 분리기. 히스톤의 코트 튜브의 측면과 또한 바닥에 입금. 흰색 불용성 펠렛은 주로 비 히스톤 단백질 등의 생체 분자가 들어있는 튜브의 맨 아래에 형성한다. 조심스럽게 측면 또는 펠렛을 긁어없이, 흡인에 의해 뜨는을 제거합니다.
- 측면 및 저면에 코팅 침전 단백질을 덮도록 유리 파스퇴르 피펫을 사용하여 빙냉 아세톤 + 0.1 % HCl (표 1)과 함께 튜브를 헹군다.
- 조심스럽게 측면 또는 펠렛을 긁어없이, 2 분, 흡인 상등액을위한 3,400 RCF에서 원심 분리기.
- 100 %에게 얼음처럼 차가운 아세톤을 사용하여 3.10 - 반복 3.9 단계.
- 공기 흐름 또는 VACU 건조 펠릿음, 아니면 그냥 오픈 튜브를 남겨 원심 분리기. 아세톤은 빨리 증발한다.
- 완전히 흰색 층을 용해하는 것이 가능 최소 볼륨에서 DDH 2 O (증류수)와 히스톤을 용해. 히스톤은 물에 쉽게 용해된다. 1.5 ml의 microcentrifuge 관에서 펠렛의 경우, 100 ㎕의 DDH 2 O는 일반적으로 충분히 히스톤를 수집하는 것입니다.
- 2 분 동안 3,400 RCF에서 원심 분리기 새로운 튜브에 뜨는을 전송합니다.
단백질 농도와 순도 4. 평가
- 단백질 농도를 측정하기 위해, BCA, 브래드 포드 (Bradford) 단백질 분석 또는 아미노산 분석 (AAA)를 사용한다. 히스톤 방향족 아미노산 잔기에서 가난으로, 280 nm에서 흡광도를 채택 기술을 사용하지 마십시오.
- 15 % 아크릴 아마이드 젤 쿠마 염색 (옵션)와 SDS-PAGE 분석에 의해 추출 된 히스톤의 순도를 확인합니다.
- 고순도 단일 히스톤 변형이 요구되는 경우의 HPLC-UV 분별 계속히스톤 변형 (5 절). 그렇지 않은 경우, 상향식 (bottom-up) 히스톤 PTM 분석 (6 절)에 대한 준비를 샘플링 직접 건너 뜁니다.
반전 상 HPLC에 의한 히스톤 변형 5. 분리 (선택 사항)
주 : 고순도 히스톤 변형은 UV 검출기에 결합 역상 HPLC를 사용하여 조질 히스톤 혼합물을 분별하여 수득 할 수있다. 이 정제 히스톤 높은 감도와 순도를 요구하는 연구에 유용하다. 분석이 충분히 민감하고 철저한이기 때문에, 표준 히스톤 PTM 특성화를 위해,이 단계는 생략 할 수있다. 그대로 히스톤의 분별 적 변형 적어도 100 필요 - 출발 물질을 300 μg의.
- 약 100 μg의 히스톤의 0.2 ml / 분의 유속으로 2.1 mm × 250 mm 컬럼을 사용; 출발 히스톤의 농도에 따라서 HPLC에 적절한 C 18 5 μm의 칼럼을 연결 약 300 μg의 히스톤과 함께 4.6 × 250 밀리미터 열을 사용/ 분 0.8 ㎖가 유량. 다음과 같이 버퍼 A와 B는 전용 유리를 사용하여 준비 :
- 완충액 A를 준비 : 5 % HPLC 등급 아세토 니트릴, 0.1 % TFA를 HPLC 등급 물에.
- HPLC 등급 물에 95 % HPLC 등급 아세토 니트릴, 0.1 % TFA : 버퍼 B를 준비합니다.
- 자외선 검출기에 열을 연결하고 210 흡광도 설정 - 220 nm의.
- 0.1 % TFA의 최종 농도를 달성하기 위해 100 % TFA로 물에 용해 히스톤 샘플 산성화.
- 대략 세 컬럼 부피에 해당 권장 유량, 적어도 15 분 동안 100 % 완충액 A로 칼럼을 평형화. 자외선 검출기의 제로 흡광도 수준을 설정하려면이 신호를 사용합니다.
- 수동 또는 자동 샘플 수집에 분수를 수집하기 위해 적절한 크기의 튜브를 준비합니다.
- 약 1 μg의 / μL 이상 농도에서 샘플을 주입한다. 큰 볼륨에 용해 샘플은 열 뒤의 평형을 변경할 수도 있습니다낮은 유지 링로드 및 리드.
- 다음과 같이 프로그램, 그라데이션을 실행 : 0 ~ 30 % B로 1 분에서 90 분으로 30 % ~ 60 B, 1 분에 60 ~ 90 % B를.
- 자동 분획 수집기를 사용하여 1 분 간격으로 (도 2에 도시 된 예 크로마토) 분획을 수집한다. 전체 볼륨을 포함하는 적절한 크기의 튜브에 분수를 수집합니다.
- 진공 농축기에서 분별 샘플을 건조시킵니다.
주 : 중간 정지 점 : 말린 히스톤 분획 짧은 기간 동안 실온에서 저장 될 수있다 - 장기 기간 (1/2 일) 또는 -80 ° C에 냉동한다.
상향식 분석을 위해 프로피온산 무수물을 사용하여 히스톤 6. 화학 유도체 화
- 50 mM의 NH 4 HCO 3의 40 μL에서 히스톤 샘플을 녹이고, pH가 8.0 (권장 금액 : 50-100 μg의). 샘플 순수한 DDH 2 O에 있다면, 50 mM의, pH가 8을 구성하는 NH 4 HCO 3 농축 추가합니다.0.
- 샘플 손실없이 pH를 지표 스트립을 사용하여 pH를 확인하기 위해 샘플에 P10 피펫 팁 젖은. NH 4 OH 포름산 8.0로 pH를 조정하기 위해 사용될 수있다.
주 : 프로토콜의 다음 부분 (단계 6.3 - 6.7) 프로피온산 무수물, 반응성을 유지하기 위해서, 최대 서너 샘플 일괄 수행한다. - 프로피온산 무수물을 사용하는 후속 단계에 대한 흄 후드를 사용합니다. 비가 1에 아세토 니트릴 무수 프로피온산을 혼합하여 신선한 propionylation 시약 준비 : 3 (V / V). 1 맛볼 수 propionylation 시약을 추가 : 4 (v / v)로. 40 μL의 히스톤를 들어, 10 ㎕의 propionylation 시약을 추가합니다.
참고 :이 단계에서 흰색 파편을 관찰 할 수있다. 그러나, 이는 주로 염 및 프로피온산을 포함하고, 따라서 특정 작업이 수행 될 필요가 없다. - 신속하게 솔루션을 다시 설정 pH가 8.0에 NH 4 OH를 추가합니다. 참고 : 펩티드의 자유 아민과 반응 프로피온산 무수물 소품을 생산pH가 감소 이온 산. 일반적으로, 하나의 비율로 샘플을 NH 4 OH를 첨가 : 5 (v / v)로 다시 설정할 pH가 8.0에 적합한, 예를 들면, 시료 40 μL을 NH 4 OH 8 μL.
- 텍싱에 의해 즉시 섞는다.
- 단계 6.2과 같은 절차로 pH를 확인합니다.
주의 : pH가 10.0보다 크면 높은 pKa를 갖는 다른 아미노산 잔기의 표시가 가능하다. - 실온에서 15 분 동안 샘플을 인큐베이션.
- 엄격하게 propionylation 시약의 배치 당 최대 3보다 4 샘플에 대한 반응을 수행, 6.7 - 반복 6.3 단계를 반복합니다.
- 진공 농축기에서 20 μL - 아래 10 드라이 샘플. 이 NH 4 OH로부터 방출 반응 프로피온산 무수물, 아세토 니트릴, 아세트산 및 암모니아 가스를 증발한다. 샘플이 완전히 건조하는 경우, 유의 한 샘플 손실이 발생하지 않습니다.
주 : 이소프로판올 대신에 아세토 니트릴을 사용할 수있다. 그러나, 아세토 니트릴, 따라서 더 낮은 표면 장력을 갖는다빠른 증발. - DDH 2 O와 재현 탁 또는 희석 샘플을 최종 부피의 40 μl를 달성 할 때까지.
- 반복 6.2 단계 - 6.9. 히스톤 propionylation의 더블 라운드 반응 완료> 95 %를 보장합니다.
- 병에 습기와 접촉 아세트산의 형성을 방지하기 위해 아르곤 가스로 프로피온산 무수물 병을 채운다.
주 : 중간 정지 점 : 샘플 DDH 2 O 또는 건조에 재구성 -80 ° C에서 저장 될 수있다.
트립신 7. 단백질 분해 소화
- 50 mM의 NH 4 HCO 3에 재현 탁의 히스톤 1 μg의 / μL 이상 최적의 농도를 달성했다. 더 희석 된 샘플은 트립신의 효율성을 낮출지도한다.
참고 :이 단계에서 히스톤은 여전히 산성, 다음 NH에게 피펫 팁을 사용하여 샘플링하는 4 HCO 3 소금을 추가하면 pH가 8.0에서해야합니다. - 1:10 비율 (중량 / 중량)에서 히스톤 샘플 트립신을 추가합니다.
- Incuba8 시간 - 6, 37 ° C에서 테.
- -80 ° C에서 동결하여 소화를 중지합니다.
- 진공 농축기에서 20 μL - 10 샘플을 건조시킵니다.
주 : 중간 정지 점 : 샘플을 -80 ℃에서 저장 될 수있다.
N 말단에서 히스톤 펩타이드의 8 Propionylation
참고 :이 섹션은 트립신 다이제스트에서 생성 된 펩티드 N 말단의 유도체에 대해 설명합니다. 프로피 오닐 기 등의, 펩티드의 소수성을 증가시킨다 - 이러한 과정은 짧은 펩티드 (히스톤 H3 (8)의 예는 아미노산 3)의 HPLC 보유를 향상시킨다.
- 100 mM의 NH 4 HCO 3의 30 μL에 재현 탁 샘플.
- 반복 6.1 단계 - 6.9.
참고 : 진공 상태에서 시료의 건조가이 단계에서 시간이 오래 걸리는 것은 정상입니다. - 재현 탁 또는 50 샘플을 희석 - 100 μL의 DDH 2 O이 + 0.1 % TFA 중 0.5 % 아세트산. 참고 : 아세트산이 TFA의 facilitat로, 오랫동안 창고에 권장됩니다장기적 메티오닌 산화 말이지. TFA는 더 나은 크로마토 그래피 유지를 도와으로 무대 팁 (섹션 9), 같은 날 수행하는 경우 반면에, TFA 권장합니다.
주 : 중간 정지 점 : 샘플을 -80 ℃에서 저장 될 수있다.
스테이지 - 팁 9. 샘플 탈염
주의 :이 단계에서, 샘플에서 염은 본있다. 그들은 펩타이드에서 신호를 억제하는 동안 전기 분무 이온화 때문에 염은 HPLC-MS 분석을 방해. 염은 비 - 부가 된 펩티드에 대한 신호 세기를 감소 펩티드에 부가 물 이온을 형성 할 수있다. 내전 펩티드 상이한 질량을 가지고있는 바와 같이, 펩티드는 올바르게 식별하거나 정량화되지 않는다.
- P1000 피펫 팁을 사용하여 고상 추출 디스크 C 18 물질의 디스크 펀치. 융합 실리카 모세관을 사용하여 P1000 팁 밖으로 미니 디스크를 밀어 및 P100 / 200 피펫 팁의 하단에 미니 디스크를 입금. 는 D 있는지 확인ISK 확실 팁 (도 3)의 하단에 끼여있다.
참고 : P1000 팁은 C (18) 디스크를 펀치 오히려 작은 구멍이있다. 또한 큰 직경의 구멍을 위해 팁 마지막 cm를 절단하는 것이 적절하다. - 같은 P100의 /의 P200 팁에 두 개의 C (18) 펀치를 사용하여 탈염 샘플의 μg의 25 경우.
- 1.5 ml의 2 ML의의 microcentrifuge 튜브에 장소에 무대 팁을 유지하기 위해 원심 분리기 어댑터를 사용하십시오. - (400 RCF 300)의 회전 속도가 느린를 사용하여 용매는 일반적으로 분 안에 수지를 통과.
- 은 C (18) 재료를 활성화 및 잠재적 오염을 제거하기 위해 100 %의 아세토 니트릴의 50 μL와 회전하여 수지를 세척.
- 저속 원심 분리하여 0.1 % TFA의 80 μl를 세척하여 디스크를 평형.
- pH가 4.0 또는 아세트산과 하단에 샘플을 산성화. 샘플 손실을 최소화하기 위해 산도 스트립과 pH를 확인합니다. 저속 원심 분리하여 디스크에로드 샘플.
- 빨래저속 원심 분리하여 0.1 % TFA의 80 μl의 - (70)을 세척하여 샘플.
- 느린 원심 분리에 의해 70 μl의 75 % 아세토 니트릴 0.5 % 아세트산을 세척하여 샘플을 용리시킨다. 1.5 ML 튜브에서 샘플을 수집합니다.
- 진공 농축기에서 건조 샘플.
주 : 중간 정지 점 : 샘플을 -80 ℃에서 저장 될 수있다.
히스톤 펩타이드 10. 분석
참고 : 기존의 펩타이드 분석에서 수행 같이 NLC-MS 플랫폼은 설정해야합니다. (200)의 사용 - 그들은 감도와 안정성 사이에 훌륭한 타협과 마찬가지로 300 NL 흐름 열 (75 μm의 ID 분석 컬럼, C (18) 입자)을 권장합니다. 이동국 취득 방법은 검사 타겟 (19) 또는 데이터 독립적 수집 (DIA) 20, 21, 대표 결과,도 4에 기재된 양으로 데이터 종속 수집 (DDA)의 조합 일 수있다.
- HPLC 버퍼를 준비 - A : 0.1 % 포름산에서HPLC 등급 물; B : HPLC 등급 아세토 니트릴 0.1 % 포름산.
- 0 내지 30 %의 버퍼 B를 30 분에서 30에서 다음 5 분 동안 100 % B까지 8 분 등용 매 100 % B에서 다음과 같이 HPLC 방법을 프로그램. 10 분 0 % B에서 1 분, 100 0 %의 B의 구배 및 등용 매 유동 다음 HPLC 샘플이 로딩 전에 자동 열 평형 프로그래밍되지 않는다면, 다음과 같다. 300 NL / 분 - 250 분석의 유량을 설정한다.
- 수행하기 위해 MS 획득 방법을 프로그램 중 하나를 표적 검사 19 DIA (20, 21) (그림 4)와 함께 DDA. 보다 정확한 정량이 가능 크로마토 그래피 피크에서 충분한 데이터 포인트를하기 위해, MS의 듀티 사이클은 하나의 전체 MS는 모든 ~ 2 초를 스캔 할 수 있는지 확인합니다. 참고 : 18 C 크로마토 평균 기준 피크 폭은 상기 기울기에 대해 30 초이다.
- HPLC (C) 상에 약 1 μg의 샘플을로드olumn.
- 프로그램으로 HPLC-MS / MS 방법을 실행합니다.
참고 : 프로토콜에서 우리가 개발 한 개별 프로테오믹스 연구실이 방법에 적합합니다 모든 최적의 설정으로, 열, MS 기기 또는 MS 매개 변수 세부 사항의 세부 사항을 사용하지 않는 것이 좋습니다. 히스톤 펩타이드는 기존의 펩타이드로 분리 이후 프로테오믹스 실험실, 자신의 최적화 설정을 사용해야합니다.
11. 데이터 분석
- 피크 지역 통합을 수행하는 소프트웨어로 MS 원시 파일을 가져옵니다. 참고 : EpiProfile (22) 추천, 그것은 히스톤 펩티드에 최적화 된 바와 같이, 용출 크로마토 그래피 체류 시간에 대한 지식을 사용하여 공지 된 히스톤 펩티드 피크 안정적인 영역 추출을 수행한다. 대안 적으로, 스카이 23은 다른 목적에 적합한 소프트웨어이다.
- 그 변형 된 형태 모두에 해당 펩티드의 총 면적의 영역을 분할하여 소정의 펩티드의 상대적인 풍부함을 계산한다. 참고 : 검색 analy의 경우동생 마스코트가 수정 히스톤 펩타이드의 스펙트럼을 확인하는 것이 좋습니다. 이 도구의 성능은 최근 24 설명되었다. 프로테오믹스에 대한 다른 모든 데이터베이스 검색 엔진도 사용할 수 있지만, 우리의 테스트에 그들은 낮은 성능을 제공했다.
결과
예를 들어, 우리는 200 ㎕의 세포 펠렛 개시와 레티노 산 (RA) 자극없이 인간 배아 줄기 세포 (hESCs는)로부터 추출 된 히스톤을 분석 하였다. 세포 배양에서 RA의 존재는 ESC 차별화로 연결됩니다. 히스톤 펩티드의 다중 LC-MS 주사를 수행하기에 충분한 것보다 더 히스톤 100㎍을 추출하고, - 세포 펠렛 약 50부터. 유도체 소화 및 탈염 한 후, 시료에 연결된 마이크로 유체 칩 고성능 액체 나노 크로마토 그래피 시스템에 연속 모드에서 75 μm의 X 15cm C 18 컬럼 (입자 직경이 3 μm, 기공 크기 300 Å) 상에 로딩 하였다 하이브리드 선형 트랩 사중 극자 - orbitrap 질량 분석기. MS 획득은 DIA를 사용하여 수행 하였다. 병행하여, 샘플은 또한 하이브리드 이온 트랩 질량 분광계 orbitrap에 결합 된 나노 - 플로우 UHPLC DDA를 이용한 방법으로 분석 하였다 (데이터는 보이지 않음). 에서각주기는 하나의 전체 MS orbitrap 검출 1,400 m / Z, 6. 그런 다음 데이터에 의존 획득 모드는 동적으로 적용 하였다 (10)의 60,000 AGC (m / z 200)과의 해상도에 290의 스캔 범위 하였다 30 초의 배제. MS / MS 스캔이 가장 강한 것과 부모 이온에 추적 관찰 하였다. 하나의 전하 상태에 이온 MS / MS에서 제외 하였다. 2m / Z의 분리 창을 사용 하였다. 이온은 35 %의 충돌 에너지와 충돌 유도 분해 (CID)를 사용하여 단편화 하였다. 이온 트랩 검출 (10) (4)의 AGC 정상 스캔 범위 모드와 정상 스캔 속도로 사용되었다.
원시 MS 데이터, 즉 23 EpiProfile (22)의 스카이 라인, 전구체 및 조각 이온 크로마토 그램의 추출을위한 소프트웨어를 채택 분석 하였다. 이 때문에 격려의 이전 지식 지능형 피크 면적 추출을 통합으로 EpiProfile는 히스톤 펩티드에 최적화 된조류 체류 시간. 한편, 스카이 라인 DIA 분석에 최적화되어, 따라서 표시되는 DIA 수치 (도 4, 5A)이 소프트웨어의 스크린 샷이다. 추출 된 이온 크로마토 그램에서 곡선 아래 면적을 취득하며, 이는 각각의 펩티드의 풍부함을 추정하는데 사용된다. 크로마토 그래피 피크의 면적은 [M + H] +에 대한 계산 된 [M + 2H] 2+ 및 [M + 3H] 같은 펩티드 3+ 이온 심지어 대부분의 [M + 2H] 비록 2+ 널리 퍼진 형태였다. 이 펩티드의 주어진 수정 된 형태의 원시 풍요 로움을 제공합니다. PTMS의 상대적인 풍부함을 달성하기 위해, 히스톤 펩타이드의 모든 다른 변형 된 형태의 합계가 100 %로 간주하고, 특정 펩티드의 면적은 그것의 변형 된 형태 모두에서 히스톤 펩티드에 대한 전체 면적으로 나누어 .
히스톤 펩타이드는 버지니아에 존재동중 형태의 riety (그림 5). 등압 펩티드, 예 K18ac 및 K23ac 만 독특한 단편 이온이 등압 종 (도 5a 및도 5b)의 비율을 결정하는데 사용되는 MS / MS 수준에서 정량화 할 수있다. 이 비율은 두 종류의 크로마토 그래피 피크의 영역을 분할하는 데 사용된다. DDA를 사용하는 경우 이러한 펩티드는 표준 DDA 실험에서 발생할 것이다, 그들의 전체 용출 통해 조각화 선정 할 필요가 있기 때문에,이 등압 형태, 표적 질량의리스트에 포함되었다. 등압 종의 상대적인 풍부함의 차별은 단편 이온의 용출 프로파일을 모니터링함으로써 수행된다. 한편, 취득 DIA 형식은 포함 목록을 요구하지 않는다. 그러나, 획득 방법이 유형은 알 변형 펩타이드를 발견하지 못할 수도 따라서 기존 데이터베이스 검색과 호환되지 않으며,.
라이신 아세틸 (+ 42.011 다)는 높은 해상도 MS 수집 (> 30,000)를 사용하여 거의 등압 trimethylation (+ 42.047 다) 구별 하였다. 또한, 아세틸 나중에 각각의 트라이 메틸화 것보다 아세틸 펩타이드의 용출로 이어지는 trimethylation보다 더 소수성이다. 동일한 펩타이드의 개질 된 형태로 인해 라이신 propionylated된다는 사실에도 나중에 용출. 요약하면, 하나의 수정 사이트와의 펩티드를위한 소수성의 순서는 디이고 트라이 메틸화 <아세틸 <수정되지 않은 (propionylated)
분화 (도 6a 및 6b)에 대한 자극이 때 hESCs는 아세틸 화 펩티드의 명확한 감소가 나타났다. 이전의 결과는 차별화들 (25)에 비해는 ESC에 더 높은 아세틸를보고 이것은 놀라운 일이 아니었다능성 염색질의 일반적으로 허용 성격을 반영. 히스톤 H3에 초점을 맞춤으로써, 35 가지 변형 된 형태 (그림 6C) 정량화 하였다. 그러나이 방법으로 조사 할 수있는 모든 히스톤 proteoforms 200 개 이상의 모든 히스톤 변형 및 낮은 풍부한 변형 (데이터 미도시)을 포함한다. 또한, 분석은 (± 표준 편차를 나타냄) 오차 막대의 작은 크기에 의해 입증되는 바와 같이, 재현성이 기술 복제 사이 얻을 수있는 것을 나타냈다. 함께이 섹션에서는 NLC-MS 데이터를 사용하여 히스톤 변형 된 펩타이드의 상대적인 풍요를 추출하는 방법에 대해 설명합니다.
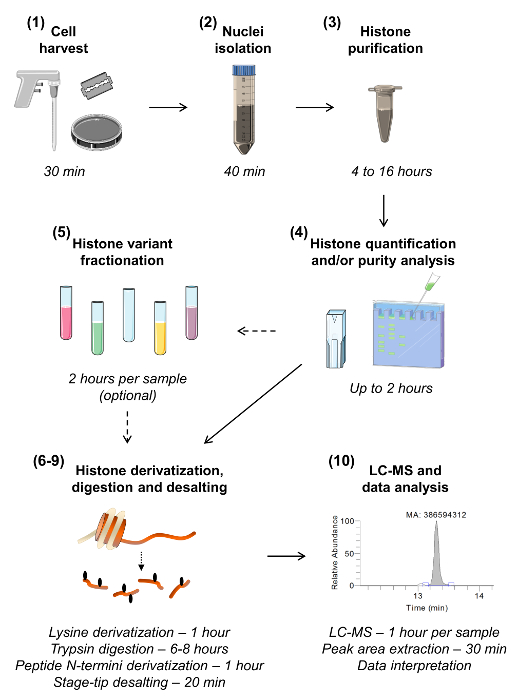
그림 1. 상향식 MS / MS 분석 히스톤 흐름은 히스톤 분석 10 단계는 각 단계에 필요한 시간의 추정을 포함하여 도시된다. 섹션 번호는 원고 본 같이 괄호로 주어진다. 특정 변형의 고감도 분석에 대한 필요가없는 다양한 히스톤 변형 분리 샘플 분획을 설명하는 제 5 항은 생략 될 수있다. 이 도면의 확대를 보려면 여기를 클릭하세요.
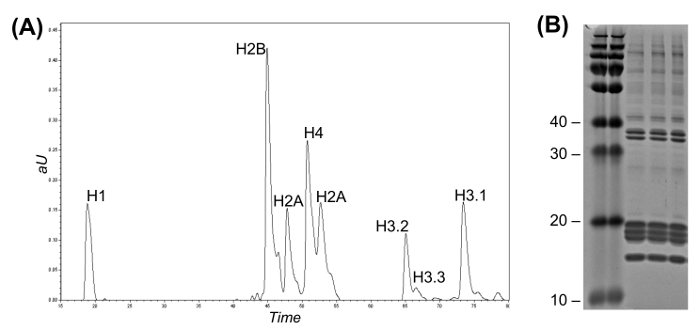
그림 2 : 히스톤 변형 분별와 쿠마 젤에 대한 역상 고 유량 LC (A) 그대로 히스톤 분리를 나타내는 LC-UV 크로마토 그램.. 히스톤 H3 변이체는 용출 시간에있어서 서로 구별 될 수있다. 분획을 자동 분획 수집기를 이용하여 수동으로 또는 수집 될 수있다. 히스톤 정제 세 복제의 (B) 쿠마 겔.= "https://www.jove.com/files/ftp_upload/54112/54112fig2large.jpg"대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :. P1000 피펫 팁으로 플러그 스테이지 - 팁의 제작은 고상 추출 디스크 (제 2 패널)에서 C (18) 재료로 만들어진 디스크를 펀치. 이 모세 혈관의 종류를 사용하여 작은 P100 / 200 피펫 팁으로 압출 될 수 있도록 미니 디스크는 팁 (중간 패널)에 부착된다. 이 예에서는 700 ㎛의 외경 용융 실리카 튜브를 사용했다. 미니 디스크은 (는) 더 (마지막 패널) 갈 수있을 때까지 P100 / 200 피펫 팁의 바닥에 밀어해야합니다. 그것은 다수의 복제를 위해 충분한 샘플 물질을 유지하기에 충분한 용량을 갖고, 상기 스테이지 팁 히스톤 탈염을위한 준비이다. SA의 20 μg의 - 특히, 하나의 미니 디스크 (15)에 대한 충분하다mple. 더 많은 샘플이 필요한 경우, 여러 디스크가 서로에 포장 될 수있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
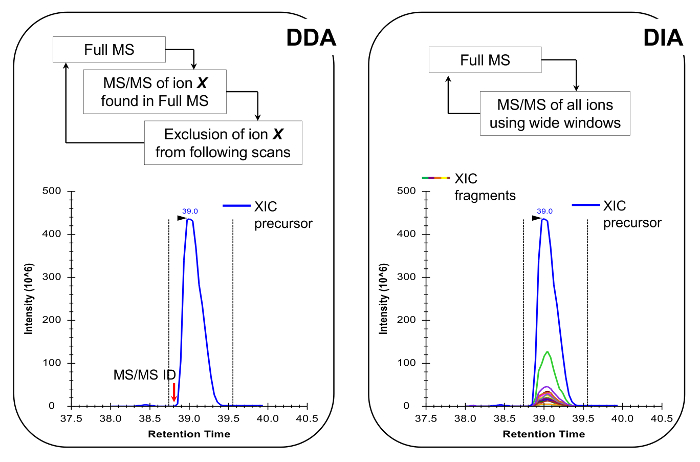
그림 4 :. DDA를 사용하는 경우 DDA 및 DIA 방법의 개략도는 MS 스캔 사이클은 그 강도와 충전 상태에 따라 MS / MS 분열에 대한 전구체 이온의 순차적 인 선택에 의해 특징입니다. 전구체 이온 단편화되면 MS 덜 풍부한 신호로 "파기"할 수 있도록, 동일한 펩타이드의 반복적 인 선택을 피하기 위해 제외리스트에 놓인다. 이번 인수 방법은 검색 모드에 대한 프로테오믹스에서 선택의 기술이다. 정량 확인 된 MS의 옆에 소정의 이온의 전체 주사 신호를 통합함으로써 달성된다 /MS 스펙트럼. DIA, 전체 m / z 범위는 매 스캔주기에서 조각난된다. 이러한 접근법은 검색 모드 덜 적합하지만, 모든 이온 전구체 및 제품의 크로마토 그래피 프로필을 생성한다. 이 자신감 정량 및 동중 형태의 차별로 연결. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
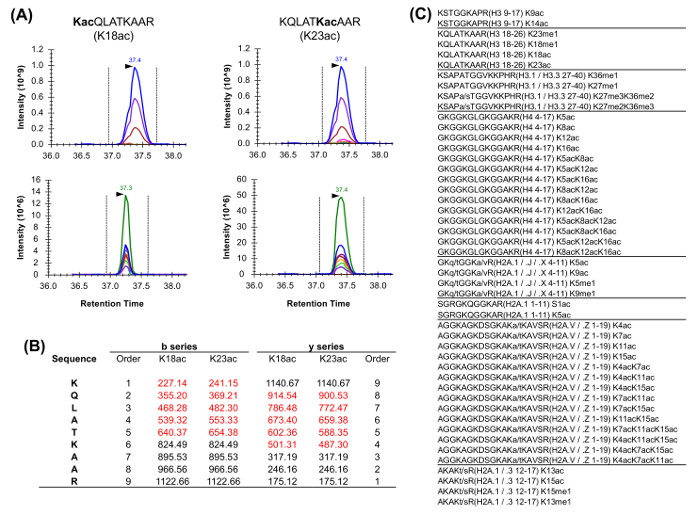
그림 5 : 동중 펩타이드의 정량 히스톤 분석에서 일반적으로 풍부한 두 동중 펩타이드 (A) 예.. 추출 된 이온 크로마토 그램 그들의 전구체 질량 (위) 상대적인 동위 원소 (XIC)은 동일하다. 그러나, 생성물 이온 XIC (아래) 두 등압 형태의 차별을 허용한다. 특히, 만 독특한 조각 이온은 우리를해야한다에드는. 두 종의 상대 풍부 추정 (빨간색으로 강조 표시) 두 설명 펩티드의 고유 조각 이온의 (B) 대표. 적어도 하나의 동중 상당을 가진 호모 사피엔스의 일반적 분석 펩타이드 (C) 목록입니다. 순서 나열된 히스톤 펩타이드가 표시됩니다 사이. 변형 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
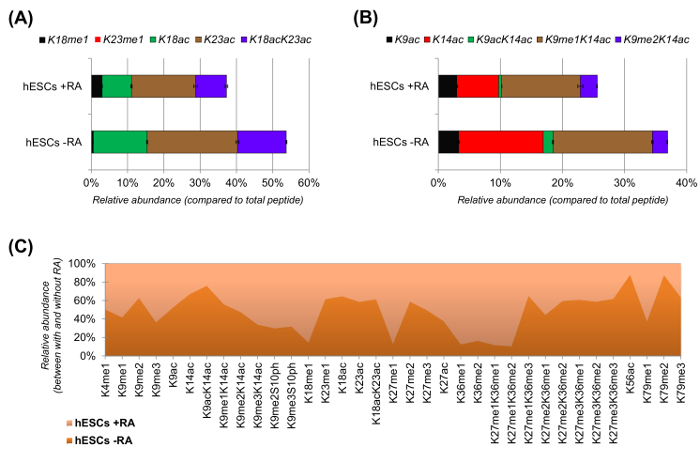
그림 6 :와 레티노 산 처리하지 않고 인간 배아 줄기 세포의 대표 결과 (A) 히스톤 H3 펩타이드 KQLATKAAR의 상대 정량 - 그 수정 proteoforms의 모두 (AA 18 26).. 상대 풍부한 100 %합니다 (REL 모든 proteoforms을 이용하여 추정 하였다. 수정되지 않은 펩타이드의 극상 비율) 도시 히스톤 H3 펩타이드 KSTGGKAPR (AA (9) (B) 상대 정량화되지 않습니다 -. 17) (C)와 레티노 산으로 세포 치료없이 정식 히스톤 H3에 대한 검출 된 펩티드의 상대 풍부. 그림은 주어진 수정 (> 50 %)보다 풍부 두 치료하는냅니다. 전반적으로, 우리는 히스톤 H3의 아세틸 화는 세포 분화의 유도에 따라 라이신 잔기의 대부분에서 감소한다는 것을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 해결책 # | 구성 | ||||||
| 1 | 핵 분리 완충액 (NIB) 스톡은 다음과 같이 제조하고 -20 ℃에서 100 mL의 분취 량으로 동결 저장된다; 해동15 mM 트리스, 60 밀리미터의 KCl, 15 mM의 NaCl을, 5 밀리미터의 MgCl 2, 1 mM의 염화칼슘 2, 250 MM의 자당 : NIB는 몇 주 동안 4 ° C에 저장할 수 있습니다. 버퍼의 pH를 HCl로 7.5로 조정한다. | ||||||
| 이 | 프로테아제 억제제 (버퍼에 새로운 추가 사용 전에) DDH이 1 M 디티 오 트레이 톨 (DTT) O (1000 배); DDH 2 O (400X) 200 mM의 AEBSF | ||||||
| 삼 | 포스파타제 억제제 (버퍼에 새로운 추가 사용 전에) : 2.5 μM 마이크로 시스틴 100 % 에탄올 (500X) | ||||||
| 4 | HDAC 억제제 (사용 전에 버퍼에 새로운 추가) 5 M 소듐 뷰티 레이트, pH가 7.0 (500X)에 수산화 나트륨을 사용하여 5 M 부티르산의 적정에 의해 | ||||||
| (5) | NP-40 대체 : DDH 2 O 10 %의 v / V | ||||||
| 6 | DDH 2 O 0.2 MH 2 SO 4 | ||||||
| (7) | 트리클로로 아세트산 (TCA) : w 100 % / DDH 2 O에서 V | ||||||
| 8 | 아세톤 + 0.1 % 염산 (HCL) : 0.1 % v / V를 염산 아세톤 | ||||||
표 1. 솔루션.
토론
여기에 설명 된 프로토콜은 비용, 시간 및 성능을 고려하여 최적화된다. 다른 제제는 가능하지만, 특히 MS 분석을 결합하는 경우에는 한계가있다. 예를 들어, 높은 소금 추출 프로토콜 히스톤 26 대신 TCA 침전 ((3))를 정제하기 위해 사용될 수있다. 이 강산성을 사용하지 않기 때문에 높은 염 프로토콜은 본질적 온화하다. 이 산해리 PTMS 보존 및 TCA 침전으로 추출 히스톤의 수율을 증가 여러 염색질 결합 단백질을 공동 침전. 그러나, 높은 소금 추출 HPLC-MS / MS에 대해 너무 농축시켜 염을 함유하는 샘플을 이끈다. 트립신 배양 시간 및 효소 / 기판 (27)의 비율 감소 또는 소화 효소로는 argc 28-30를 사용하여, 예를 들어 - 다른 제제에서, 히스톤 소화는 propionylation (8 섹션 6)없이 수행 될 수있다. 그러나, 프로피온산 무수물 유도체 내가 같이 추천t 더 나은 액체 크로마토 그래피 동안 유지됩니다 소수성 펩타이드의 생성으로 이어집니다.
화학 유도체를 들어, 유기산 무수물의 다양한 평가되었으며, 그 장점은 포괄적 18에 대해 논의했다. 그럼에도 불구하고, 프로피온산 무수물 효율성을 최소화 측 제품 및 개선 펩타이드 소수성 사이의 최고의 타협을 입증했다. 잠재적으로, 프로피온산 무수물은 동위 원소 표지 된 형태로 구입할 수 있습니다; 이는 다수의 시료를 혼합하고 무거운 라벨에 부여 상이한 질량에 기초하여 MS의 레벨을 판별의 가능성 다중 분석을 허용한다. 그러나 이러한 분석은 LC-MS 크로마토 그램의 증가 된 복잡성을 초래하고 각 단일 조건 주입 될 수있는 샘플의 양을 감소시킨다.
이와 관련하여, 프로토콜의 몇몇 중요한 측면이 강조되어야한다. 다음은 CH 표기부정적인 결과가 얻어진 경우에는 절차를 수행하는 오류를 발견 ecklist. 우선 핵 침전 후의 펠릿을 조심스럽게 대체 NP-40 (혼합 중에 기포의 부족 띄는) 세제 완전히 제거 될 때까지 (2.10)없이 NIB로 세척한다. 그렇지 않을 경우 산과 히스톤 추출을 손상 것이다. 둘째, TCA와 히스톤 침전 (섹션 3.9) 아세톤 펠렛의 세척 후 중요하다. propionylation 및 소화 (6.1 절)을 직접 수행하는 경우 농축 된 산의 존재는 다음과 같은 단계를 끼칠 것입니다. (섹션 5를) 수행되는 경우 히스톤 분류에없는 문제가 될 것입니다. (- 6.7 섹션 6.3) 셋째, 상기 propionylation 반응이 신속하게 수행하는 것이 필수적이다. 4 연속 샘플 -이를 위해 3 개 이상의 동일한 propionylation 믹스 (프로피온산 무수물 + 아세토 니트릴)를 사용하지 마십시오. 또한, pH는 트립신 분해 (7)의 가장 중요한 측면이다. 그렇지 않은 경우8.0 (7.5-8.5) 주위에 소화 효과가있을 것입니다. 샘플이 단계에서 프로피온산이 풍부 할 것 같은이 발생할 수 있습니다. NH 4 OH 필요까지 추가 할 수 있습니다. 또한, 프로테오믹스 워크 플로우에 익숙한 연구자는 트립신의 소화를 종료 샘플을 산성화 정상 느낄 것이다. 그 다음 반응, 즉, 펩타이드 N 말단 (8.1 절)의 propionylation을 위태롭게하므로 이것은 수행 할 수 없습니다. 마지막으로, 같은 문제에서는, 수정되지 않은 펩타이드가 실제로 변성되지 않는 데이터 분석을 위해 기억하는 것이 중요하다; 모두 무료 리신 잔기 및 N- 말단은 propionylation (56.026 다)에 의해 점유 될 것이다. 이와 같이, 단백질 서열에 고유하게 대응하는 중량의 추출, 이온 크로마토 그래피를 수행하는 단계없이 결과를 가져올 것이다.
방법의 제한은 실제 abun 달성의 편향으로 인해 짧은 펩티드 서열에 조합 PTMS 검출 불능에 주로 관련 있으며다른 변형 된 형태의 펩티드는 상이한 효율로 이온화 할 수 있다는 사실로 인해 변형 댄스. 첫 번째 문제는 중간 또는 다운 (16 평가) 하향식 접근법이 기술을 조합함으로써 해결할 수있다. 하더라도 기술적으로 더 어려운, 이러한 유형의 분석은 수정 공존 주파수를 연구하는데 적합하다. 또한, 일부 펩타이드 다른 히스톤 변형에서 동일한 서열을 갖기 때문에 항상 상향식으로 달성 될 수 없다 히스톤 변형, 더 잘 구별 할 수있다. 이온화 효율과 관련된 두 번째 문제는, 합성 펩티드 (31)의 라이브러리를 사용하여 해결 될 수있다. 이 접근법은 히스톤 PTMS의 상대적인 풍부함의보다 정확한 추정을 보장한다. 그러나, 대부분의 실험에서, 원하는 결과는 분석 조건 사이의 주어진 변형의 상대적 변화이다. 이 경우, 이러한 보정으로 인해 모든 샘플은 동일한 BIA를 가지고 있다는 사실에 필요하지 않다에스.
결론적으로,이 프로토콜은 탠덤 MS에 결합 NLC를 사용하는 일에 완료 할 수 있습니다 히스톤 PTMS의 분석이 가능합니다. MS가 아닌 다른 기술과의 비교 예들이 처리량에도 거의이 수준을 달성 할 수 도입부에서 논의 된 바와 같이 항체 기반 전략을 사용하여, 적합하지 않다. 또한, 항체 기반 기술은 새로운 변형의 발견을 허용하지 않지만, 이들은 단독으로 확인 및 정량 예측 부호에 기초한다. 우리는 따라서 튜닝 유전자 발현의 주인공이다 히스톤 마크의 규정을 알고에 의한 직관적 인 장점 프로테오믹스 실험실에서 인기를 얻을 따라서 프로테옴의 조절에 영향을 미칠 것입니다 히스톤 펩티드에 그 상향식 (bottom-up)의 단백질 체학을 추측. 또, 프로토콜이 기재된 LABORA에도 히스톤 분석 더 단순하게 데이터 분석을위한 시료 준비 및 소프트웨어의 최근 개선 포함hypermodified 펩티드의이 유형의 특성을 경험 한 적이 토리.
공개
저자는 더 경쟁 재정적 이해 관계가 없음을 선언합니다.
감사의 말
이 작품은 NIH 보조금 (DP2OD007447, R01GM110174 및 R01AI118891)에서 자금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Trypsin 0.25% EDTA | Invitrogen | 25200056 | For harvesting cells |
| PBS | Invitrogen | 14200075 | |
| Tris | Roche | 77-86-1 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Sodium Chloride | Sigma | S9888 | |
| Magnesium Chloride hexahydrate | Sigma | M9272 | |
| Calcium Chloride, anhydrous | Sigma | C1016 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| DTT | Invitrogen | 15508-013 | |
| AEBSF | EMD Millipore Corp | 101500 | |
| Microcystin | Sigma | M4194 | |
| Sodium Butyrate | Sigma | B5887 | |
| Halt Protease and Phosphatase Inhibitor Cocktail, EDTA-free (100x) | Fisher Scientific | 78445 | |
| NP- 40 Alternative | CALBIOCHEM | 492016 | |
| Sulfuric Acid, ACS grade | Fisher Chemical | 7664-93-9 | |
| Trichloroacetic acid | Sigma | T6399 | |
| Acetone | Sigma | 179124 | |
| HCl | Fisher Chemical | A144-500 | |
| Bradford reagent | Biorad | 500-0006 | |
| 30% acrylamide/bis 29:1 — 500 ml | Biorad | 1610156 | |
| Coomassie | Fisher Scientific | 20278 | |
| C18 Column (5 µm) 2.1 mm x 250 mm | Grace | 218TP52 | |
| C18 Column (5 µm) 4.6 mm x 250 mm | Grace | 218TP54 | |
| HPLC grade acetonitrile | Fisher Chemical | A955-4 | |
| HPLC grade water | Fisher Scientific | W6 4 | |
| TFA | Fisher Scientific | A11650 | |
| Ammonium Bicarbonate | Sigma | A6141 | |
| ammonium hydroxide | Sigma | 338818 | |
| propionic anhydride | Sigma | 240311 | |
| Sequencing grade modified trypsin | Promega | PRV5113 | For digesting histones for MS |
| Acetic Acid | Sigma | 49199 | |
| C18 extraction disk | Empore | 2215 | |
| Formic Acid | Sigma | F0507 |
참고문헌
- Waddington, C. H. Canalization of development and the inheritance of acquired characters. Nature. 150, 563-565 (1942).
- Sharma, S., Kelly, T. K., Jones, P. A. Epigenetics in cancer. Carcinogenesis. 31 (1), 27-36 (2010).
- Reik, W., Dean, W., Walter, J. Epigenetic reprogramming in mammalian development. Science. 293 (5532), 1089-1093 (2001).
- Kouzarides, T. Chromatin modifications and their function. Cell. 128 (4), 693-705 (2007).
- Tessarz, P., Kouzarides, T. Histone core modifications regulating nucleosome structure and dynamics. Nat Rev Mol Cell Bio. 15 (11), 703-708 (2014).
- Fischle, W., Wang, Y. M., Allis, C. D. Histone and chromatin cross-talk. Curr Opin Cell Biol. 15 (2), 172-183 (2003).
- Lee, J. S., Smith, E., Shilatifard, A. The language of histone crosstalk. Cell. 142 (5), 682-685 (2010).
- Simboeck, E., et al. A Phosphorylation Switch Regulates the Transcriptional Activation of Cell Cycle Regulator p21 by Histone Deacetylase Inhibitors. J Biol Chem. 285 (52), 41062-41073 (2010).
- Hirota, T., Lipp, J. J., Toh, B. H., Peters, J. M. Histone H3 serine 10 phosphorylation by Aurora B causes HP1 dissociation from heterochromatin. Nature. 438 (7071), 1176-1180 (2005).
- Xhemalce, B., Kouzarides, T. A chromodomain switch mediated by histone H3 Lys 4 acetylation regulates heterochromatin assembly. Genes Dev. 24 (7), 647-652 (2010).
- Vermeulen, M., et al. Quantitative interaction proteomics and genome-wide profiling of epigenetic histone marks and their readers. Cell. 142 (6), 967-980 (2010).
- van Attikum, H., Gasser, S. M. Crosstalk between histone modifications during the DNA damage response. Trends Cell Biol. 19 (5), 207-217 (2009).
- Fernandez-Capetillo, O., et al. H2AX is required for chromatin remodeling and inactivation of sex chromosomes in male mouse meiosis. Dev Cell. 4 (4), 497-508 (2003).
- Santaguida, S., Musacchio, A. The life and miracles of kinetochores. Embo J. 28 (17), 2511-2531 (2009).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nat Struct Mol Biol. 18 (1), 91-93 (2011).
- Sidoli, S., Cheng, L., Jensen, O. N. Proteomics in chromatin biology and epigenetics: Elucidation of post-translational modifications of histone proteins by mass spectrometry. J Proteomics. 75 (12), 3419-3433 (2012).
- Plazas-Mayorca, M. D., et al. One-Pot Shotgun Quantitative Mass Spectrometry Characterization of Histones. J Proteome Res. 8 (11), 5367-5374 (2009).
- Sidoli, S., et al. Drawbacks in the use of unconventional hydrophobic anhydrides for histone derivatization in bottom-up proteomics PTM analysis. Proteomics. 15 (9), 1459-1469 (2015).
- Lin, S., Garcia, B. A. Examining histone posttranslational modification patterns by high-resolution mass spectrometry. Methods Enzymol. 512, 3-28 (2012).
- Sidoli, S., et al. SWATH Analysis for Characterization and Quantification of Histone Post-translational Modifications. Mol Cell Proteomics. , (2015).
- Krautkramer, K. A., Reiter, L., Denu, J. M., Dowell, J. A. Quantification of SAHA-Dependent Changes in Histone Modifications Using Data-Independent Acquisition Mass Spectrometry. J Proteome Res. , (2015).
- Yuan, Z. F., et al. EpiProfile Quantifies Histone Peptides With Modifications by Extracting Retention Time and Intensity in High-resolution Mass Spectra. Mol Cell Proteomics. 14 (6), 1696-1707 (2015).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Yuan, Z. F., Lin, S., Molden, R. C., Garcia, B. A. Evaluation of proteomic search engines for the analysis of histone modifications. J Proteome Res. 13 (10), 4470-4478 (2014).
- Tan, Y., Xue, Y., Song, C., Grunstein, M. Acetylated histone H3K56 interacts with Oct4 to promote mouse embryonic stem cell pluripotency. Proc Natl Acad Sci U S A. 110 (28), 11493-11498 (2013).
- Vonholt, C., et al. Isolation and Characterization of Histones. Methods Enzymol. 170, 431-523 (1989).
- Zhang, K. L., et al. Identification of acetylation and methylation sites of histone H3 from chicken erythrocytes by high-accuracy matrix-assisted laser desorption ionization-time-of-flight, matrix-assisted laser desorption ionization-postsource decay, and nanoelectrospray ionization tandem mass spectrometry. Anal. Biochem. 306 (2), 259-269 (2002).
- Jufvas, A., Stralfors, P., Vener, A. V. Histone Variants and Their Post-Translational Modifications in Primary Human Fat Cells. Plos One. 6 (1), e15960 (2011).
- Bonaldi, T., Imhof, A., Regula, J. T. A combination of different mass spectroscopic techniques for the analysis of dynamic changes of histone modifications. Proteomics. 4 (5), 1382-1396 (2004).
- Zhao, X. L., et al. Comparative Proteomic Analysis of Histone Post-translational Modifications upon Ischemia/Reperfusion-Induced Retinal Injury. J Proteome Res. 13 (4), 2175-2186 (2014).
- Lin, S., et al. Stable-isotope-labeled histone peptide library for histone post-translational modification and variant quantification by mass spectrometry. Mol Cell Proteomics. 13 (9), 2450-2466 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유