A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלת סטנטים כליליים בגודל אנושי לתוך אב העורקים בטן עכברוש באמצעות גישה טרנס-ירך
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את ההשתלה של סטנטים כליליים אנושיים לתוך אב העורקים הבטן של חולדות עם apoE-/- רקע באמצעות גישה טרנס-ירך. בהשוואה למודלים אחרים של בעלי חיים, מודלים מוריניים נושאים את היתרונות של תפוקה גבוהה, רבייה, קלות טיפול ודיור, וזמינות רחבה של סמנים מולקולריים.
Abstract
התערבות כלילית מלעורית (PCI), בשילוב עם פריסת סטנט כלילי, מייצג את תקן הזהב בטיפול התערבותי במחלת לב כלילית. רסטנוזיס In-stent (ISR) נקבע על ידי התפשטות מופרזת של רקמה ניאוינטימיאלית בתוך הסטנט ומגביל את ההצלחה ארוכת הטווח של סטנטים. מגוון מודלים של בעלי חיים שימשו כדי להבהיר תהליכים פתופיזיולוגיים שבבסיס restenosis in-stent (ISR), עם כלילית חזירים מודלים עורק איליאק ארנב להיות הנפוץ ביותר. מודלים מוריניים מספקים את היתרונות של תפוקה גבוהה, קלות טיפול ודיור, רבייה וזמינות רחבה של סמנים מולקולריים. מודל העכבר apolipoprotein E לקוי (apoE-/- ) נעשה שימוש נרחב כדי ללמוד מחלות לב וכלי דם. עם זאת, סטנטים חייבים להיות ממוזערים להיות מושתלים בעכברים, מעורבים שינויים חשובים של התכונות המכניות שלהם (פוטנציאל) ביולוגי. השימוש apoE-/- חולדות יכול להתגבר על חסרונות אלה כמו apoE-/- חולדות לאפשר הערכה של סטנטים הכליליים בגודל אנושי בעת ובעונה אחת מתן פנוטיפ אתרוגני. זה הופך אותם מודל מעולה ואמין לחקור ISR לאחר השתלת סטנט. כאן, אנו מתארים, בפירוט, את ההשתלה של סטנטים כליליים אנושיים זמינים מסחרית לתוך אב העורקים הבטן של חולדות עם apoE-/- רקע באמצעות גישה טרנס-ירך.
Introduction
התערבות כלילית מלעורית (PCI), בשילוב עם פריסת סטנט כלילי, מייצג את תקן הזהב בטיפול התערבותי של מחלת לב כלילית1. ההצלחה ארוכת הטווח של סטנטים, עם זאת, יכול להיות מוגבל על ידי התרחשות של restenosis in-stent (ISR) הנקבע על ידי התפשטות מופרזת של רקמה ניאוינטימיאלית בתוך הסטנט2,3. ISR עשוי לדרוש התערבות מחדש עם מעקף עורקים כליליים או PCI מחדש. מגוון מודלים של בעלי חיים הוצעו לחקר ISR, כל אחד מהם כולל יתרונות וחסרונות. החסרונות העיקריים של המודלים הנפוצים ביותר של עורקים כליליים חזיריים וארנב, אם כי פיתוח נגעים דומים במידה ניכרת לבני אדם לאחר השתלת סטנט 4,5, הם בעליחייםגדולים ועלויות דיור אשר מעלה קשיים לוגיסטיים במיוחד במחקרים ארוכי טווח, כמו גם מגבלות בטיפול וציוד. יתר על כן, הזמינות של נוגדנים לחלבונים תאיים של חזירים וארנבות מוגבלת. מצד שני, מודלים מורין לספק את היתרונות העיקריים של תפוקה גבוהה ושחזור, כמו גם קלות הטיפול, דיור, ולכן עלות תועלת. יתר על כן, מספר גבוה יותר של נוגדנים זמינים. עם זאת, בעוד אפוליפופרוטאין E-לקוי (apoE-/-) עכברים שימשו באופן נרחב לחקר טרשת עורקים6,7,8, הם אינם מתאימים לחקר ISR כמו סטנטים צריך להיות ממוזער להיות מושתל לעכברים, פוטנציאל לשנות את המאפיינים המכניים של סטנטים. יתר על כן, קיר העורקים של העכברים מודד בין 50 מיקרומטר בעכברים צעירים ו 85 מיקרומטר בעכברים ישנים9, סטנטים יש לפרוס באמצעות רמות לחץ נמוך כמו 2 כספומט, אשר עלול להוביל לתסבוכת של סטנט10. חולדות, לעומת זאת, מאפשרות השתלה של סטנטים כליליים אנושיים זמינים מסחרית, ומדגימים מסלול ריפוי כלי דם דומה לבעלי חיים גדולים יותר לאחר השתלת סטנטים באבי העורקים, שדווח לראשונה על ידי Langeveld et al.11. טכניקה זו דרשה במקור גישה טרנס-בטן, אשר דרשה התכווצות פיזית של אב העורקים כדי להשיג הפרעה זמנית של זרימת הדם. כדי למנוע את הפגיעה בכלי הקשורים ותגובות דלקתיות, הטכניקה שוכללה מאוחר יותר על ידי כניסתה של גישה טרנס איליאק, אשר בנוסף הביא שיעור הישרדות גבוה יותר של בעליהחיים 12.
מכיוון שחולדות מסוג פראי אינן מפתחות נגעים טרשת עורקים13, חולדות apoE-/- נוצרו באמצעות טכניקות גרעין כגון מפעיל שעתוק-כמו אפקט Nuclease (TALEN)14, מקובצים באופן קבוע בין-מרחבי חזרות פלינדרומיות קצרות (CRISPR/Cas9)15, ואצבע אבץ (ZF)16. חולדות ApoE-/- היו זמינות מסחרית מאז 2011. מתן רקע atherogenic, apoE-/- חולדות לאפשר הערכה מציאותית יותר של סטנטים כלילית בגודל אנושי, במיוחד לגבי ISR.
בזאת, אנו מתארים את השיטה דרך נתיב הגישה הטרנס-פמוראלי ושימוש בסטנט קובלט-כרום-כרום-יתד זמין מסחרית (DES), עם זאת, ניתן ליישם אותה גם לחקר סוגי סטנטים אחרים, כגון סטנטים ממתכת חשופה (BMS) או סטנטים מתכלים.
Protocol
הניסויים בוצעו בהתאם לחוק רווחת בעלי החיים הגרמני (TSchG) ולהוראה 2010/63/EU הנוגעת להגנה על בעלי חיים המשמשים למטרות מדעיות. האישור הרשמי למחקר זה ניתן על ידי הוועדה הממשלתית לטיפול ושימוש בבעלי חיים (פרוטוקול מס': AZ 87-51.04.2010.A065; לנדסמט פיור נטור, אומוולט וורברוצ'רשוץ נורדרהיין-ווסטפאלן, רקלינגהאוזן, גרמניה). פרוטוקול המחקר תואם את המדריך לטיפול ושימוש בבעלי חיים במעבדה. טיפול בכאב לאחר הניתוח מבוסס על המלצות האגודה הגרמנית למדעי בעלי חיים במעבדה (GV-SOLAS) כמו גם טיפול בכאב וטרינרי יוזמה.
1. טכניקות בסיסיות ונהלים נפוצים
- השתמש בחולדות אפו הומוזיגיות-/- ספראג-דוולי. לזהות את הגנוטיפ של כל בעל חיים באמצעות שיטות סטנדרטיות17.
- שמור על בעלי החיים בתנאים זהים (21 °C ± 2 °C (70 °F), 60% ± 5% לחות, ו 12 שעות אור / מחזור כהה) ולהבטיח גישה חופשית למים ומזון.
- בצע את כל ההליכים בתנאים נקיים אך לא סטריליים.
- לאחר החולדה מורדמת, לבצע את כל ההליכים תחת מיקרוסקופ כירורגי בהגדלה של 16x.
- השתמש ספוגיות כותנה עבור עצירת דימום דחיסה. ספוגיות גזה (5 ס"מ x 5 ס"מ) ספוגות בתמיסת צלצול מניקה מועילות לשמירה על לחות המפשעה.
- פעל בהתאם לתקנות סילוק פסולת כדי להיפטר מחומרים משומשים.
2. הכנות לפני הניתוח
- הכינו את התרופות הווטרינריות לפני תחילת הניתוח. שמור את כל הפתרונות בטמפרטורת החדר, אלא אם צוין אחרת.
- שלושים דקות לפני ההליך, לנהל 0.03-0.05 מ"ג /ק"ג buprenorphine תת עורית.
- הרדמה את החולדה עם הזרקה תוך-אישית של 100 מ"ג /ק"ג משקל גוף (BW) (S)-קטמין ו 8 מ"ג / קילוגרם BW xylazine.
- להעריך את משקל החולדה באמצעות סולם שקילה.
- מניחים את החולדה על כרית חימום ולתקן את הגפיים העליונות והתחתונות באמצעות סרט רפואי. מקם את החולדה עם האיבר האחורי השמאלי שלה המורחבת במלואה ככל האפשר בקו אחד עם עמוד השדרה שלה כדי ליצור קו ישר בין עורק הירך לבין העורקים. זה יקל על קידום הסטנט רכוב בלון דרך bifurcation העורקים.
- לשמור על הרדמה עם שאיפה של 1.5 vol% isoflurane ב 97.5% חמצן בקצב זרימה של 2 L / min.
הערה: אפשר לחולדה לנשום באופן ספונטני, ללא צנרור. - יש למרוח משחת עיניים כדי למנוע נזק לעיניים במהלך חוסר הכרה.
- לגלח את הפרווה מאזור המפשעה והבטן התחתונה של החולדה לעקר את העור המתאים עם פתרון povidone-יוד.
- לפני תחילת הניתוח, לאמת עומק נאות של הרדמה על ידי צביטת קצה הזנב ואת הרקמה הבין-ממדית.
3. ניתוח
- בצע חתך בינוני של ~ 0.5 \u20121 ס"מ במפשעה השמאלית כדי לפתוח את העור ואת fascia הבסיסית.
- לנתח בבוטות ולבדוק במעמקים עד עורק הירך השמאלי פועם ניתן לזהות.
- באמצעות מלקחיים עדינים מאוד, להכין את עורק הירך על ידי הסרת בעדינות את רקמת החיבור שמסביב. היזהרו לא לפגוע בעצב הירך ולא בווריד הירך, שהוא מתווך לעורק.
- מכינים כ 1 ס"מ של עורק הירך. בזהירות לשים את קצה המלקחיים מתחת לכלי כדי להרים אותו בעדינות.
- חתיכות חוט של תפר משי 4-0 מתחת לחלקים דיסטליים ופרוקסימליים של העורק ויוצרים קלע. מהדקים את הקצוות של כל אחד משני המתלים בין ענפי מלחציים כירורגיים. השתמש מלחציים כירורגיים כדי לשלוט בעורק. בעדינות למתוח ולהרים את המתלים על מנת להפריע באופן זמני את זרימת הדם.
הערה: לעבוד מהר כדי למנוע חוסם עורקים ממושך אשר עלול להוביל לנזק לרקמות. - באמצעות מספריים מיקרו חדים, לבצע arteriotomy באמצע עורק הירך.
- הצג חוט מדריך דרך העורקים. כאשר מגיעים קלע חוט קרוב, לשחרר את המתח של החוט על ידי הזזת מהדק כירורגי ולקדם את חוט המדריך עוד יותר לכיוון אבי העורקים הבטן.
הערה: חותכים את חוט המדריך באמצעות חותך תיל כדי להקל על הטיפול. - מניחים את הקצה הפרוקסימלי של חוט המדריך בין הסרעפת לעורקי הכליה.
הערה: קידום חוט המדריך רחוק מדי נושא את הסיכון לפגיעה בצי העורקים או הלב. אנו ממליצים לפתוח את הבטן כדי להבטיח מיקום הולם של חוט המדריך ואת הסטנט לפחות עבור בעלי החיים הראשונים. - הציגו סטנט כלילי מכווצים ורכוב על בלון בגודל 2.25 מ"מ x 8 מ"מ (מקסימום 2.5 מ"מ x 8 מ"מ) מעל חוט ההנחיה לעורק הירך וקידמו אותו לאבטת הבטן.
- מניחים את הסטנט ממש מעל bifurcation אב העורקים אבל מתחת לעורקי הכליה. לפרוס את הסטנט על ידי ניפוח קטטר בלון ל 12 atm עבור 15 s באמצעות מערכת מזרק אינפלציה.
- לנפח את קטטר הבלון ולשמור על לחץ שלילי על פי המלצות היצרן עבור סטנט בשימוש.
- לאט לאט למשוך את הקטטר מנופח תוך השארת סטנט במקום.
- רגע לפני הוצאת הקטטר, ליצור מתח על לולאת החוט מעל החתך עם מהדק כירורגי כדי להפריע לזרימת הדם שוב. לאחר מכן להסיר את קטטר בלון ישירות ligate כלי proximally.
- לקשור את לולאות חוט דיסלמי כדי ligate עורק הירך ולאשר hemostasis נאותה של העורקים. עורקים נלווים יבטיחו זלוף נוסף לאיבר.
- סגור את השריר overlying את העורק, כמו גם את חתך העור באמצעות 10-0 תפרים שאינם ניתנים לריבוע.
4. טיפול בבעלי חיים לאחר השתלת סטנט
- מיד לאחר הניתוח, לאפשר לחולדה להתאושש במשך 60 דקות בכלוב מיוחד של יחידת טיפול נמרץ עם אוויר מחומם (30\u201235 °C (60 °F) ואספקת חמצן.
- צפו בבעלי החיים בזהירות עד להחלמתם המלאה. לאחר מכן, להעביר את החולדות לכלוב רגיל. ספק גישה לליביטום של מודעות למים ולמזון.
- ניהול משכך כאבים לאחר הניתוח כל 6-12 שעות עם 0.03-0.05 מ"ג /ק"ג buprenorphine (s.c., ב 500μl NaCl) בסך הכל 72 שעות תחת הערכה קלינית.
- יש את האוכל מעורבב עם clopidogrel (15 מ"ג / קילוגרם) כדי למנוע פקקת של סטנט מושתל.
- כדי לשפר את התנאים hypercholesterolemic היווצרות פלאק, להתחיל האכלה דיאטה מערבית ב 6\u20128 שבועות לאחר הלידה ולהמשיך עד המתת חסד. אם תרצה, קבוצה של בעלי חיים שניזונו מאוכל עכברושים רגיל יכולה לשמש כשליטה.
5. איסוף ועיבוד רקמות
- לפני תחילת הסבר הרקמה בנקודת הזמן המיועדת, המתת חסד את החיה בהתאם להנחיות IACUC. לקצור את העורקים סטנטים לניתוח היסטולוגי בסוף תקופת התצפית.
- פתח את הבטן על ידי חתך קו האמצע ולהסיר את קטע סטנט של העורקים, כמו גם חלקים סמוכים שאינם סטנט של העורקים, מדידה 0.5 ס"מ כל אחד.
- מניחים את הרקמה לתוך פתרון של 4% פורמלין אגירה עבור 24 שעות עבור קיבעון.
- להטמיע את רקמת העורקים הסטנט בפלסטיק ולבצע כתמים היסטולוגיים ואימונוהיסטוכימיים על פי פרוטוקולים סטנדרטיים18,19.
6. ניתוח היסטומורפומטרי
- בצע ניתוח היסטומורפומטרי של חלקים רציפים של החלק הפרוקסימלי, האמצעי והדיסטלי של אב העורקים הסטנט באמצעות מיקרוסקופ המקושר למחשב עם תוכנת ניתוח תמונה מתאימה.
- עקוב אחר קווי המתאר של הלאמינה האלסטית החיצונית (EEL, בין אדוונטיטיה למדיה), למינה אלסטית פנימית (IEL, בין מדיה לניאוינטימה), ולומן עם לוח ציור גרפי. מערכים אלה, חשב אזור EEL, אזור IEL ואזור לומן עם התוכנה.
- חשב את אחוז השטח החתך ב- restenosis (ISR):
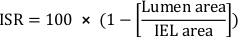
- חשב את האזור הניאו-אינימילי הכולל (Ai):
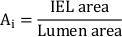
- למדוד את העובי הניאו-ינטימיאלי (NIT) מעל כל יתד סטנט כמרחק בין יתד לומן. למדוד את NIT בין תמוכות stent כמו המרחק בין IEL לומן.
הערה: לחלופין, חשב NIT כ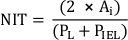
איפה PL ו PIEL הם לומן ומתחם לאמינה אלסטי פנימי, בהתאמה20. - בצע ניתוחים נוספים בהתאם לדרישות המחקר.
תוצאות
פרוטוקול זה מתאר השתלת סטנטים באבי העורקים בבטן של חולדות באמצעות נתיב גישה חוצה ירך (איור 1). הנקודה המרכזית הראשונה במודל זה של בעלי חיים היא שהוא מאפשר פריסה של סטנטים כליליים בגודל אנושי. סטנט כלילי מסחרי רכוב על בלון יכול להיות ממוקם לתוך אדי הבטן של חולדות. לכן, בנוסף, א...
Discussion
פרוטוקול זה מתאר את ההשתלה של סטנטים כליליים בגודל אנושי לתוךאבי העורקים הבטן של חולדות apoE-/- . כמה נקודות טכניות כדאי להדגיש. ראשית, יש להימנע מאי התאמה בין גודל הסטנט לגודל העורקים. הצבת סטנט קטן מדי עלולה להוביל לתקלה סטנט, ואילו השתלת סטנט גדול מדי עבור העורקים עלולה לגרום לתסבוכת ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לגברת אנג'לה פרוינד על הסיוע הטכני שלא יסולא בפז בהפקת הטבעה ומגלשות. כמו כן, ברצוננו להודות למר תדיאוש סטופינסקי במכון למדעי בעלי חיים במעבדה על עזרתו התובנה בעבודתו הווטרינרית.
Materials
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
References
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved