È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Impianto di stent coronari di dimensioni umane nell'aorta addominale del ratto utilizzando un accesso trans-femorale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive l'impianto di stent coronari umani nell'aorta addominale dei ratti con uno sfondo apoE-/- utilizzando un accesso trans-femorale. Rispetto ad altri modelli animali, i modelli murini portano i vantaggi di alta produttività, riproducibilità, facilità di movimentazione e alloggiamento e un'ampia disponibilità di marcatori molecolari.
Abstract
L'intervento coronarica percutaneo (PCI), combinato con l'impiego di uno stent coronarica, rappresenta il gold standard nel trattamento interventico della malattia coronarica. La restenosi in-stent (ISR) è determinata da un'eccessiva proliferazione del tessuto neointimico all'interno dello stent e limita il successo a lungo termine degli stent. Una varietà di modelli animali sono stati utilizzati per chiarire i processi fisiopatologici alla base della restenosi in-stent (ISR), con i modelli coronarica suina e l'arteria iliaca del coniglio che sono i più frequentemente utilizzati. I modelli murini offrono i vantaggi di un'elevata produttività, facilità di movimentazione e alloggiamento, riproducibilità e un'ampia disponibilità di marcatori molecolari. Il modello di topo carente di apolipoproteina E (apoE-/- ) è stato ampiamente utilizzato per studiare le malattie cardiovascolari. Tuttavia, gli stent devono essere miniaturizzati per essere impiantati nei topi, comportando importanti cambiamenti delle loro proprietà meccaniche e (potenzialmente) biologiche. L'uso di ratti apoE-/- può superare queste carenze in quanto i ratti apoE-/- consentono la valutazione degli stent coronari delle dimensioni dell'uomo e allo stesso tempo forniscono un fenotipo aterogenico. Questo li rende un modello eccellente e affidabile per indagare ISR dopo l'impianto stent. Qui descriviamo, in dettaglio, l'impianto di stent coronari umani disponibili in commercio nell'aorta addominale dei ratti con uno sfondo apoE-/- utilizzando un accesso trans-femorale.
Introduzione
L'intervento coronarica percutaneo (PCI), combinato con l'impiego di uno stent coronarica, rappresenta il gold standard nel trattamento interventico della malattia coronarica1. Il successo a lungo termine degli stent, tuttavia, può essere limitato dal verificarsi di restenosi in-stent (ISR) determinata da un'eccessiva proliferazione del tessuto neointimico all'interno dello stent2,3. L'ISR può richiedere un nuovo intervento con bypass coronarica o re-PCI. Per lo studio dell'ISR sono stati suggeriti diversi modelli animali, ognuno dei quali presenta vantaggi e carenze. I principali inconvenienti dei modelli di arteria iliaca suina più comunemente usati e del coniglio iliaca, sebbene sviluppino lesioni marcatamente simili all'uomo dopo l'impianto di stent4,5, sono grandi costi animali e abitativi che sollevano difficoltà logistiche soprattutto negli studi a lungo termine, nonché limitazioni nella manipolazione e nelle attrezzature. Inoltre, la disponibilità di anticorpi contro le proteine cellulari di suini e conigli è limitata. D'altra parte, i modelli murini offrono i principali vantaggi di elevata produttività e riproducibilità, nonché facilità di movimentazione, alloggiamento e quindi economicità. Inoltre, è disponibile un numero maggiore di anticorpi. Tuttavia, mentre i topi apolipoproteina E-carenti (apoE-/-) sono stati ampiamente utilizzati per lo studio dell'aterosclerosi6,7,8, non sono adatti allo studio dell'ISR poiché gli stent devono essere miniaturizzati per essere impiantati nei topi, potenzialmente cambiando le proprietà meccaniche degli stent. Inoltre, la parete aortica dei topi misura tra 50 μm nei giovani topi e 85 μm nei vecchitopi 9e gli stent devono essere utilizzati utilizzando livelli di pressione fino a 2 atm, che potrebbero portare alla malapposizione dello stent10. I ratti, tuttavia, consentono l'impianto di stent coronari umani disponibili in commercio e dimostrano un corso di guarigione vascolare simile agli animali più grandi dopo l'impianto di stent aortico, riportato per la prima volta da Langeveld etal. Questa tecnica originariamente richiedeva un accesso trans-addominale, che richiedeva una costrizione fisica dell'aorta per ottenere un'interruzione temporanea del flusso sanguigno. Per evitare la lesione del vaso potenzialmente associata e le reazioni infiammatorie, la tecnica è stata successivamente perfezionata con l'introduzione di un accesso trans-iliaca, che ha inoltre portato a un più alto tasso di sopravvivenza degli animali12.
Poiché i ratti di tipo selvatico non sviluppano lesioni aterosclerotiche13, i ratti apoE-/- sono stati generati utilizzando tecniche di nucleasi come transcription activator-like Effector Nuclease (TALEN)14, Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR/Cas9)15e Zinc Finger (ZF)16. I ratti ApoE-/- sono disponibili in commercio dal 2011. Fornendo uno sfondo aterogenico, i ratti apoE-/- consentono una valutazione più realistica degli stent coronari a misura d'uomo, in particolare per quanto riguarda l'ISR.
Nel presente documento, descriviamo il metodo attraverso la via di accesso transfemorale e utilizzando uno stent di eluizione del farmaco cobalto-cromo (DES) a punto sottile disponibile in commercio, tuttavia, può anche essere applicato per lo studio di altri tipi di stent, come stt bare metal (BMS) o stent biodegradabili.
Protocollo
Gli esperimenti sono stati eseguiti in conformità con la legge tedesca sul benessere degli animali (TSchG) e la direttiva 2010/63/UE relativa alla protezione degli animali utilizzati a fini scientifici. L'approvazione ufficiale di questo studio è stata concessa dal Governmental Animal Care and Use Committee (Protocollo n.: AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Germania). Il protocollo di studio è conforme alla Guida alla cura e all'uso degli animali da laboratorio. Il trattamento postoperatorio del dolore si basa sulle raccomandazioni della Società tedesca per le scienze animali di laboratorio (GV-SOLAS) e dell'Iniziativa veterinaria per la terapia del dolore.
1. Tecniche di base e procedure comuni
- Utilizzare ratti omozigoti apoE-/- Sprague-Dawley. Identificare il genotipo di ciascun animale utilizzando metodi standard17.
- Mantenere gli animali in condizioni identiche (21 °C ± 2 °C, 60% ± 5% di umidità e un ciclo chiaro / scuro di 12 ore) e garantire il libero accesso all'acqua e al cibo.
- Eseguire tutte le procedure in condizioni pulite ma nonsterili.
- Una volta che il topo è anestetizzato, eseguire tutte le procedure al microscopio chirurgico con un ingrandimento di 16x.
- Utilizzare tamponi di cotone per l'emostasi di compressione. I tamponi di garza (5 cm x 5 cm) imbevuti di soluzione ringer allattata sono utili per mantenere l'inguine umido.
- Seguire le normative sullo smaltimento dei rifiuti per smaltire i materiali usati.
2. Preparativi prima dell'intervento chirurgico
- Preparare i farmaci veterinari prima di iniziare l'operazione. Conservare tutte le soluzioni a temperatura ambiente, salvo diversa indicazione.
- Trenta minuti prima della procedura, somministrare 0,03-0,05 mg/kg di buprenorfina per via sottocutanea.
- Anestetizzare il ratto con un'iniezione intraperitoneale di 100 mg/kg di peso corporeo (BW) (S)-chetamina e 8 mg/kg di xilazina BW.
- Valutare il peso del topo utilizzando una bilancia.
- Posizionare il topo su una pastiglia riscaldante e fissare gli arti superiore e inferiore utilizzando del nastro medico. Posizionare il topo con l'arto posteriore sinistro completamente esteso e il più in linea possibile con la colonna vertebrale in modo da creare una linea retta tra arteria femorale e aorta. Ciò faciliterà l'avanzamento dello stent montato su palloncino attraverso la biforcazione aortica.
- Mantenere l'anestesia con inalazione di isoflurane 1,5 vol% nel 97,5% di ossigeno ad una portata di 2 L/min.
NOTA: Lasciare respirare spontaneamente il topo, senza intubazione. - Applicare un unguento per gli occhi per prevenire danni agli occhi durante l'incoscienza.
- Radere la pelliccia dall'inguine e dall'area inferiore dell'addome del ratto e sterilizzare la pelle corrispondente con una soluzione di povidone-iodio.
- Prima di iniziare l'intervento chirurgico, verificare un'adeguata profondità dell'anestesia pizzicando la punta della coda e il tessuto interdidigitale.
3. Chirurgia
- Effettuare un'incisione mediale di ~ 0,5 \u20121 cm nell'inguine sinistro per aprire la pelle e la fascia sottostante.
- Sezionare e sondare senza mezzi termini nelle profondità fino a quando non è possibile identificare l'arteria femorale sinistra pulsante.
- Usando forcep molto fini, preparare l'arteria femorale rimuovendo delicatamente il tessuto connettivo circostante. Fai attenzione a danneggiare né il nervo femorale né la vena femorale, che è mediale per l'arteria.
- Preparare circa 1 cm dell'arteria femorale. Mettere con cura la punta delle forcep sotto il vaso per sollevarla delicatamente.
- Filettare pezzi di sutura di seta 4-0 sotto le parti distale e prossimale dell'arteria e formare io. Bloccare le estremità di ciascuna delle due irse del filo tra i rami di un morsetto chirurgico. Utilizzare i morsetti chirurgici per controllare l'arteria. Allungare delicatamente e sollevare le indovamenti per interrompere temporaneamente il flusso sanguigno.
NOTA: Lavorare velocemente per evitare un laccio emostatico prolungato che può causare danni ai tessuti. - Usando micro forbici affilate, eseguire un'arteriotomia nel mezzo dell'arteria femorale.
- Introdurre un filo guida attraverso l'arteriotomia. Quando si raggiunge l'io del filo prossimale, rilasciare la tensione del filo spostando il morsetto chirurgico e far avanzare ulteriormente il filo guida verso l'aorta addominale.
NOTA: Tagliare il filo guida utilizzando una fresa a filo per facilitare la movimentazione. - Posizionare l'estremità prossimale del filo guida tra il diaframma e le arterie renali.
NOTA: L'avanzamento troppo lontano del filo guida comporta il rischio di lesioni aortiche o cardiache. Si consiglia di aprire l'addome per garantire un adeguato posizionamento del filo guida e dello stent almeno per i primi diversi animali. - Introdurre uno stent coronare crimpato e montato su palloncino che misura 2,25 mm x 8 mm (max. 2,5 mm x 8 mm) sul filo guida nell'arteria femorale e avanzare verso l'aorta addominale.
- Posizionare lo stent appena sopra la biforcazione aortica ma sotto le arterie renali. Distribuire lo stent gonfiando il catetere a palloncino a 12 atm per 15 s utilizzando un sistema di siringhe di gonfiaggio.
- Sgonfiare il catetere a palloncino e mantenere una pressione negativa secondo le raccomandazioni del produttore per lo stent in uso.
- Ritirare lentamente il catetere sgonfio lasciando lo stent in posizione.
- Poco prima di esettare il catetere, creare tensione sul ciclo del filo sopra l'incisione con il morsetto chirurgico per interrompere nuovamente il flusso sanguigno. Quindi rimuovere il catetere a palloncino e ligare direttamente il vaso prossimamente.
- Legare i cicli prossimali e distale del filo per legare l'arteria femorale e confermare un'adeguata emostasi dell'arteriotomia. Le arterie collaterali garantiranno un'ulteriore perfusione all'arto.
- Chiudi il muscolo sovrascrivere l'arteria e l'incisione cutanea usando 10-0 suture non riassorbibili.
4. Cura degli animali dopo l'impianto di stent
- Subito dopo l'operazione, lasciare recuperare il ratto per 60 minuti in una speciale gabbia per unità di terapia intensiva con aria riscaldata (30\u201235 °C) e un apporto di ossigeno.
- Guarda attentamente gli animali fino a completo recupero. Successivamente, spostare i ratti in una gabbia normale. Fornire accesso ad libitum all'acqua e al cibo.
- Somministrare analgesia postoperatoria ogni 6-12 ore con 0,03-0,05 mg/kg di buprenorfina (s.c., in NaCl da 500μl) per un totale di 72 ore in fase di valutazione clinica.
- Far miscelare il cibo con clopidogrel (15 mg/kg) per evitare la trombosi dello stent impiantato.
- Per migliorare le condizioni ipercolesterolemiche e la formazione della placca, iniziare l'alimentazione della dieta occidentale a 6\u20128 settimane dopo la nascita e continuare fino all'eutanasia. Se lo si desidera, una coorte di animali alimentati con normale chow di ratto può servire da controllo.
5. Raccolta e lavorazione dei tessuti
- Prima di iniziare l'espianto del tessuto nel punto di tempo designato, eutanasiare l'animale secondo le linee guida della IACUC. Raccogliere l'aorta stenta per l'analisi istologica alla fine del periodo di osservazione.
- Aprire l'addome con un'incisione della linea mediana e rimuovere il segmento stentato dell'aorta e le parti adiacenti non stente dell'aorta, misurando 0,5 cm ciascuna.
- Mettere il tessuto in una soluzione di formalina tamponata al 4% per 24 ore per la fissazione.
- Incorporare il tessuto arterioso stentato nella plastica ed eseguire colorazioni istologiche e immunoistochimiche secondo i protocolli standard18,19.
6. Analisi istomorfometrica
- Eseguire l'analisi istomorfometrica delle sezioni sequenziali della parte prossimale, centrale e distale dell'aorta stentata per mezzo di un microscopio collegato a un computer con un software di analisi delle immagini appropriato.
- Traccia i contorni della lamina elastica esterna (EEL, tra adventitia e media), lamina elastica interna (IEL, tra media e neointima) e lume con una tavoletta grafica da disegno. Da questi valori, calcolare l'area EEL, l'area IEL e l'area lume con il software.
- Calcolare la percentuale di restenosi intersezionale in-stent (ISR):
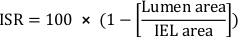
- Calcolare l'area neointimica totale (Ai):
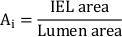
- Misurare lo spessore neointimico (NIT) su ogni puntone stent come distanza tra puntone e lume. Misurare le NTI tra i montanti stent come distanza tra IEL e lume.
NOTA: In alternativa, calcolare le NTI come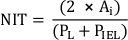
dove PL e PIEL sono il perimetro di lume e lamina elastica interna, rispettivamente20. - Eseguire analisi aggiuntive in base alle esigenze dello studio.
Risultati
Questo protocollo descrive l'impianto di stent nell'aorta addominale dei ratti utilizzando una via di accesso trans-femorale (Figura 1). Il primo punto centrale di questo modello animale è che consente il dispiegamento di stent coronari a misura d'uomo. Uno stent coronare crimpato e montato su palloncino disponibile in commercio può essere posizionato nell'aorta addominale dei ratti. Così, inoltre, può essere applicato lo stesso principio di distribuzione dello stent come negli esseri um...
Discussione
Questo protocollo descrive l'impianto di stent coronari a misura d'uomo nell'aorta addominale dei ratti apoE-/- . Vale la pena sottolineare diversi punti tecnici. In primo luogo, si dovrebbe evitare una mancata corrispondenza tra la dimensione dello stent e la dimensione dell'aorta. Posizionare uno stent troppo piccolo può portare a malapposition stent, mentre l'impianto di uno stent troppo grande per l'aorta può causare sovraccarico, strappo e lesioni del vaso. Pertanto, si consiglia di utilizzare stent tra...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo la signora Angela Freund per la sua preziosa assistenza tecnica nella produzione di incorporamenti e diapositive. Ringraziamo anche Tadeusz Stopinski presso l'Institute for Laboratory Animal Science & Experimental Surgery per il suo perspicoso aiuto nel lavoro veterinario.
Materiali
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Riferimenti
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon