Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Implantation von menschengroßen koronaren Stents in Ratte Abdominal Aorta mit einem transfemoralen Zugang
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Implantation menschlicher koronarer Stents in die Bauchaorta von Ratten mit einemApoE-/- Hintergrund unter Verwendung eines transfemoralen Zugangs. Im Vergleich zu anderen Tiermodellen bieten murine Modelle die Vorteile eines hohen Durchsatzes, der Reproduzierbarkeit, der einfachen Handhabung und des Gehäuses sowie einer breiten Verfügbarkeit molekularer Marker.
Zusammenfassung
Perkutane koronare Intervention (PCI), kombiniert mit dem Einsatz eines koronaren Stents, stellt den Goldstandard in der interventionellen Behandlung von koronaren Herzerkrankungen dar. In-stent Restenose (ISR) wird durch eine übermäßige Proliferation von Neointimgewebe innerhalb des Stents bestimmt und begrenzt den langfristigen Erfolg von Stents. Eine Vielzahl von Tiermodellen wurden verwendet, um pathophysiologische Prozesse zu klären, die der In-Stent-Restenose (ISR) zugrunde liegen, wobei die Schweinekoronare und die Kaninchen-Iliasarterienmodelle am häufigsten verwendet werden. Murine-Modelle bieten die Vorteile eines hohen Durchsatzes, einfacher Handhabung und Gehäuse, Reproduzierbarkeit und einer breiten Verfügbarkeit molekularer Marker. Das Apolipoprotein E-Mangel (ApoE-/- ) Mausmodell wurde häufig verwendet, um Herz-Kreislauf-Erkrankungen zu studieren. Stents müssen jedoch miniaturisiert werden, um mäusen implantiert zu werden, was wichtige Veränderungen ihrer mechanischen und (potenziell) biologischen Eigenschaften mit sich bringen muss. Die Verwendung von ApoE-/- Ratten können diese Unzulänglichkeiten als ApoE überwinden-/- Ratten ermöglichen die Bewertung von koronaren Stents in menschlicher Größe und liefern gleichzeitig einen atherogen Phänotyp. Dies macht sie zu einem ausgezeichneten und zuverlässigen Modell, um ISR nach der Stent-Implantation zu untersuchen. Hier beschreiben wir detailliert die Implantation kommerziell erhältlicher menschlicher Koronarstents in die Bauchaorta von Ratten mit einemapoE-/- Hintergrund unter Verwendung eines transfemoralen Zugangs.
Einleitung
Perkutane koronare Intervention (PCI), kombiniert mit dem Einsatz eines koronaren Stents, stellt den Goldstandard in der interventionellen Behandlung der koronaren Herzkrankheit1dar. Der langfristige Erfolg von Stents kann jedoch durch das Auftreten von In-Stent-Restenose (ISR) begrenzt werden, die durch eine übermäßige Proliferation von Neointimgewebe im Stent bestimmt wird2,3. ISR kann eine erneute Intervention entweder mit koronaren Arterienbypass oder re-PCI erfordern. Für die Untersuchung von ISR wurden verschiedene Tiermodelle vorgeschlagen, von denen jedes Vorteile und Mängel aufweist. Die Hauptnachteile der am häufigsten verwendeten Schweinekoronar- und Kaninchen-Iliac-Arterienmodelle, obwohl sie lästig sind, sind nach der Stent-Implantation4,5, große Tier- und Wohnkosten, die vor allem in Langzeitstudien logistische Schwierigkeiten mit sich bringen, sowie Einschränkungen bei der Handhabung und Ausrüstung. Darüber hinaus ist die Verfügbarkeit von Antikörpern gegen zelluläre Proteine von Schweinen und Kaninchen begrenzt. Auf der anderen Seite bieten murine Modelle die großen Vorteile eines hohen Durchsatzes und der Reproduzierbarkeit sowie der einfachen Handhabung, des Gehäuses und damit der Wirtschaftlichkeit. Darüber hinaus ist eine höhere Anzahl von Antikörpern verfügbar. Obwohl Apolipoprotein E-deficient (apoE-/-) Mäuse weit verbreitet für die Untersuchung von Arteriosklerose6,7,8verwendet wurden, sind sie für die Untersuchung von ISR ungeeignet, da Stents miniaturisiert werden müssen, um in Mäuse implantiert zu werden, was die mechanischen Eigenschaften der Stents verändern könnte. Darüber hinaus misst die Aortenwand von Mäusen bei jungen Mäusen zwischen 50 und bei alten Mäusen9, und Stents müssen mit Druckpegeln von bis zu 2 atm eingesetzt werden, was zu einer Fehlstellung des Stents10führen kann. Ratten erlauben jedoch die Implantation kommerziell erhältlicher menschlicher koronare Stents und zeigen einen vaskulären Heilungsverlauf ähnlich wie größere Tiere nach aortenstents Implantation, zuerst berichtet von Langeveld et al.11. Diese Technik erforderte ursprünglich einen transabdominalen Zugang, der eine physische Verengung der Aorta erforderte, um eine vorübergehende Unterbrechung des Blutflusses zu erreichen. Um die potenziell damit verbundenen Gefäßverletzungen und Entzündungsreaktionen zu vermeiden, wurde die Technik später durch die Einführung eines transiliac Zugangs verfeinert, was zusätzlich zu einer höheren Überlebensrate der Tiereführte 12.
Da Wildtypratten keine atherosklerotischen Läsionen entwickeln13, wurden ApoE-/- Ratten mit Nuklease-Techniken wie Transkription Activator-Like Effector Nuclease (TALEN)14, Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR/Cas9)15und Zinkfinger (ZF)16erzeugt. ApoE-/- Ratten sind seit 2011 im Handel erhältlich. ApoE-/- Ratten mit einem atherogen Hintergrund ermöglichen eine realistischere Bewertung von koronaren Stents in menschlicher Größe, insbesondere in Bezug auf ISR.
Dabei beschreiben wir die Methode über den transfemoralen Zugangsweg und unter Verwendung eines handelsüblichen Dünnstrut-Kobalt-Chrom-Eluing-Stents (DES), kann aber auch für die Untersuchung anderer Stenttypen wie Bare Metal Stents (BMS) oder biologisch abbaubarer Stents eingesetzt werden.
Protokoll
Die Versuche wurden in Übereinstimmung mit dem Deutschen Tierschutzgesetz (TSchG) und der Richtlinie 2010/63/EU zum Schutz von Tieren durchgeführt, die zu wissenschaftlichen Zwecken verwendet werden. Die offizielle Genehmigung für diese Studie wurde vom Staatlichen Ausschuss für Tierpflege und Nutzung erteilt (Protokoll-Nr.: AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen). Das Studienprotokoll entsprach dem Leitfaden für die Pflege und Verwendung von Labortieren. Die postoperative Schmerzbehandlung basiert auf den Empfehlungen der Deutschen Gesellschaft für Labortierkunde (GV-SOLAS) sowie der Initiative Tierärztliche Schmerztherapie.
1. Grundtechniken und gemeinsame Verfahren
- Verwenden Sie homozygote ApoE-/- Sprague-Dawley Ratten. Identifizieren Sie den Genotyp jedes Tieres mit Standardmethoden17.
- Halten Sie die Tiere unter identischen Bedingungen (21 °C ± 2 °C, 60% ± 5% Luftfeuchtigkeit und einem 12 h Licht/Dunkel-Zyklus) und sorgen Sie für freien Zugang zu Wasser und Nahrung.
- Führen Sie alle Verfahren unter sauberen, aber nicht sterilen Bedingungen durch.
- Sobald die Ratte anästhesiert ist, führen Sie alle Eingriffe unter einem chirurgischen Mikroskop bei einer Vergrößerung von 16x durch.
- Verwenden Sie Wattestäbchen für Kompressionshämostase. Gaze Tupfer (5 cm x 5 cm) mit laktierter Ringer-Lösung getränkt sind hilfreich, um die Leistenfeuchte zu halten.
- Befolgen Sie die Abfallentsorgungsvorschriften, um gebrauchte Materialien zu entsorgen.
2. Präparate vor der Operation
- Bereiten Sie die Tierarzneimittel vor Beginn der Operation vor. Halten Sie alle Lösungen bei Raumtemperatur, sofern nicht anders angegeben.
- Dreißig Minuten vor dem Eingriff 0,03-0,05 mg/kg Buprenorphin subkutan verabreichen.
- Anästhesisieren Sie die Ratte mit einer intraperitonealen Injektion von 100 mg/kg Körpergewicht (BW) (S)-Ketamin und 8 mg/kg BW Xylazin.
- Bewerten Sie das Gewicht der Ratte anhand einer Waage.
- Legen Sie die Ratte auf ein Heizkissen und fixieren Sie die oberen und unteren Gliedmaßen mit medizinischem Klebeband. Positionieren Sie die Ratte mit ihrer linken Hintergliedmaße vollständig ausgestreckt und so viel wie möglich im Einklang mit ihrer Wirbelsäule, um eine gerade Linie zwischen Femoralarterie und Aorta zu schaffen. Dies erleichtert das Vorrücken des Ballon-Stents durch die Aortenbifurkation.
- Halten Sie die Anästhesie mit der Inhalation von 1,5 Vol% Isofluran in 97,5% Sauerstoff bei einer Durchflussrate von 2 L/min aufrecht.
HINWEIS: Lassen Sie die Ratte spontan atmen, ohne Intubation. - Tragen Sie Augensalbe auf, um Augenschäden während der Bewusstlosigkeit zu verhindern.
- Rasieren Sie das Fell aus der Leisten- und Unterbauchbereich der Ratte und sterilisieren Sie die entsprechende Haut mit einer Povidon-Jod-Lösung.
- Vor Beginn der Operation eine ausreichende Tiefe der Anästhesie überprüfen, indem Sie die Schwanzspitze und das interdigitale Gewebe kneifen.
3. Chirurgie
- Machen Sie einen medialen Schnitt von 0,5,21 cm in der linken Leiste, um die Haut und die darunter liegende Faszie zu öffnen.
- Bluntly sect und sonde in den Tiefen, bis die pulsierende linke Oberschenkelarterie identifiziert werden kann.
- Mit sehr feinen Zangen bereiten Sie die Femoralarterie vor, indem Sie das umgebende Bindegewebe vorsichtig entfernen. Achten Sie darauf, weder den Oberschenkelnerv noch die Femoralvene zu schädigen, die der Arterie medial ist.
- Bereiten Sie etwa 1 cm der Oberschenkelarterie vor. Legen Sie vorsichtig die Spitze der Zange unter das Gefäß, um es sanft zu heben.
- Fadenstücke von 4-0 Seidennaht unter den distalen und proximalen Teilen der Arterie und bilden Schlingen. Klemmen Sie die Enden jeder der beiden Gewindeschlingen zwischen den Zweigen einer chirurgischen Klemme. Verwenden Sie die chirurgischen Klemmen, um die Arterie zu steuern. Dehnen und heben Sie die Hebegurte sanft an, um den Blutfluss vorübergehend zu unterbrechen.
HINWEIS: Arbeiten Sie schnell, um ein längeres Tourniquet zu vermeiden, das zu Gewebeschäden führen kann. - Führen Sie mit scharfen Mikroscheren eine Arteriotomie in der Mitte der Oberschenkelarterie durch.
- Führen Sie einen Führungsdraht durch die Arteriotomie ein. Wenn Sie den proximalen Fadenschlingen erreichen, lösen Sie die Spannung des Gewindes, indem Sie die chirurgische Klemme bewegen und den Führungsdraht weiter in Richtung der Bauchaorta voranbringen.
HINWEIS: Schneiden Sie den Führungsdraht mit einem Drahtschneider, um die Handhabung zu erleichtern. - Legen Sie das proximale Ende des Führungsdrahtes zwischen dem Zwerchfell und den Nierenarterien.
HINWEIS: Das Vorrücken des Führungsdrahtes zu weit trägt das Risiko von Aorten- oder Herzverletzungen. Wir empfehlen, den Bauch zu öffnen, um eine angemessene Positionierung des Führungsdrahtes und des Stents zumindest für die ersten tiere zu gewährleisten. - Führen Sie einen gekräusten und ballonmontierten koronaren Stent von 2,25 mm x 8 mm (max. 2,5 mm x 8 mm) über den Führungsdraht in die Oberschenkelarterie ein und bringen Sie ihn zur Bauchaorta vor.
- Platzieren Sie den Stent knapp über der Aortenverzweigung, aber unter den Nierenarterien. Stellen Sie den Stent ein, indem Sie den Ballonkatheter mit einem Inflationsspritzensystem auf 12 atm für 15 s aufblasen.
- Entleeren Sie den Ballonkatheter und halten Sie den Unterdruck gemäß den Empfehlungen des Herstellers für den stent im Einsatz.
- Ziehen Sie den deflationierten Katheter langsam ab, während Sie den Stent an Ort und Stelle lassen.
- Kurz vor dem Herausnehmen des Katheters, erzeugen Spannung auf der Fadenschleife über dem Schnitt mit der chirurgischen Klemme, um den Blutfluss wieder zu unterbrechen. Dann den Ballonkatheter entfernen und das Gefäß direkt proximal aufstellen.
- Binden Sie die proximalen und die distalen Fadenschleifen, um die Oberschenkelarterie zu ligan und eine angemessene Hämostase der Arteriotomie zu bestätigen. Kollateralarterien sorgen für eine weitere Durchblutung der Gliedmaße.
- Schließen Sie den Muskel über der Arterie, sowie den Hautschnitt mit 10-0 nicht resorbierbaren Nähten.
4. Tierpflege nach Stent-Implantation
- Unmittelbar nach der Operation die Ratte 60 min in einem speziellen Intensivstation-Käfig mit erwärmter Luft (30-u201235 °C) und sauerstoffhaltiger Versorgung erholen.
- Beobachten Sie die Tiere sorgfältig, bis sie vollständig geborgen sind. Danach bewegen Sie die Ratten in einen normalen Käfig. Bieten Sie ad libitum Zugang zu Wasser und Lebensmitteln.
- Verabreichen Sie postoperative Analgesie alle 6-12 Stunden mit 0,03-0,05 mg/kg Buprenorphin (s.c., in 500 l NaCl) für insgesamt 72 Stunden unter klinischer Bewertung.
- Lassen Sie das Futter mit Clopidogrel (15 mg/kg) gemischt, um eine Thrombose des implantierten Stents zu vermeiden.
- Um hypercholesterolemische Bedingungen und Plaquebildung zu verbessern, beginnen Sie die westliche Diätfütterung bei 6-u20128 Wochen nach der Geburt und setzen Sie bis zur Euthanasie fort. Auf Wunsch kann eine Kohorte von Tieren, die mit normalem Ratten-Chow gefüttert werden, als Kontrolle dienen.
5. Gewebesammlung und -verarbeitung
- Bevor Sie mit der Gewebeexplantation zum angegebenen Zeitpunkt beginnen, müssen Sie das Tier gemäß den IACUC-Richtlinien einschläfern. Ernte die gestete Aorta für histologische Analyse am Ende des Beobachtungszeitraums.
- Öffnen Sie den Bauch durch einen Mittellinienschnitt und entfernen Sie das gestäten Segment der Aorta sowie die angrenzenden nicht-stented Teile der Aorta, die jeweils 0,5 cm messen.
- Legen Sie das Gewebe in eine Lösung von 4% gepuffertem Formalin für 24 h zur Fixierung.
- Einbetten des gestents arteriellen Gewebes in Kunststoff und führen Histologische und immunhistochemische Färbung nach Standardprotokollen18,19durch.
6. Histomorphometrische Analyse
- Führen Sie die histomorphometrische Analyse sequenzieller Abschnitte des proximalen, mittleren und distalen Teils der stented aorta mittels eines Mikroskops durch, das mit einer geeigneten Bildanalysesoftware mit einem Computer verbunden ist.
- Verfolgen Sie die Konturen der äußeren elastischen Lamina (EEL, zwischen Adventitie und Medien), der inneren elastischen Lamina (IEL, zwischen Medien und Neointima) und lumen mit einer grafischen Zeichentablette. Berechnen Sie aus diesen Werten Die EEL-Fläche, die IEL-Fläche und die Lumenfläche mit der Software.
- Berechnen Sie die prozentuale Querschnittsfläche in-stent restenosis (ISR):
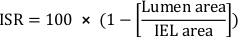
- Berechnen Sie die gesamte Neotimtonfläche (Ai):
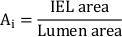
- Messen Sie die Neotimindicke (NIT) über jeder Stentstrebe als Abstand zwischen Federbeine und Lumen. Messen Sie das NIT zwischen den Stentstreben als Abstand zwischen IEL und Lumen.
ANMERKUNG: Alternativ können Sie NIT als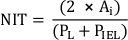
wobei PL und PIEL das Lumen und der interne elastische Laminaumfang sind, bzw.20. - Führen Sie zusätzliche Analysen entsprechend den Anforderungen der Studie durch.
Ergebnisse
Dieses Protokoll beschreibt die Stentimplantation in der Bauchaorta von Ratten mit einem transfemoralen Zugangsweg (Abbildung 1). Der erste zentrale Punkt dieses Tiermodells ist, dass es den Einsatz von koronaren Stents in menschlicher Größe ermöglicht. Ein kommerziell erhältlicher crimpter und ballonmontierter koronaren Stent kann in die Bauchaorta von Ratten gelegt werden. So kann darüber hinaus das gleiche Prinzip der Stent-Einsatz wie beim Menschen angewendet werden. Ein weiterer Vo...
Diskussion
Dieses Protokoll beschreibt die Implantation von koronaren Stents in menschliche Größe in die Bauchaorta von ApoE-/- Ratten. Mehrere technische Punkte sind hervorzuheben. Zunächst sollte eine Diskrepanz zwischen der Stentgröße und der Größe der Aorta vermieden werden. Das Platzieren eines zu kleinen Stents kann zu Stent-Malapposition führen, während die Implantation eines Stents, der zu groß für die Aorta ist, zu Überdehnung, Reißen und Verletzungen des Gefäßes führen kann. Daher empfehlen wir ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Frau Angela Freund für ihre unschätzbare technische Unterstützung bei der Einbettung und Folienproduktion. Wir danken auch Herrn Tadeusz Stopinski vom Institut für Labortierkunde & Experimentalchirurgie für seine aufschlussreiche Hilfe bei der tierärztlichen Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Referenzen
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten