Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Implantation d’endoprothèses coronaires de taille humaine dans l’aorte abdominale du rat à l’aide d’un accès transfémoral
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit l’implantation des stents coronaires humains dans l’aorte abdominale des rats avec un fond d’apoE-/- utilisant un accès transport-fémoral. Par rapport à d’autres modèles animaux, les modèles murins ont les avantages d’un débit élevé, d’une reproductibilité, d’une facilité de manipulation et de logement et d’une large disponibilité de marqueurs moléculaires.
Résumé
L’intervention coronaire percutanée (PCI), combinée avec le déploiement d’un stent coronaire, représente l’étalon-or dans le traitement d’interventional de la maladie de l’artère coronaire. Le restenosis de Dans-stent (ISR) est déterminé par une prolifération excessive de tissu néointimal dans l’endoprothèse et limite le succès à long terme des stents. Une série de modèles animaux ont été utilisés pour élucider les processus pathophysiologiques sous-jacents à la resténose in-stent (ISR), les modèles coronaires porcins et les modèles d’artère iliaque de lapin étant les plus fréquemment utilisés. Les modèles murins offrent les avantages d’un débit élevé, d’une facilité de manipulation et de logement, d’une reproductibilité et d’une large disponibilité de marqueurs moléculaires. Le modèle murin déficient en apolipoprotéine E (apoE-/- ) a été largement utilisé pour étudier les maladies cardiovasculaires. Cependant, les endoprothèses doivent être miniaturisées pour être implantées chez la souris, ce qui implique des changements importants de leurs propriétés mécaniques et (potentiellement) biologiques. L’utilisation de l’apoE-/- rats peut surmonter ces défauts car apoE-/- rats permettent l’évaluation des stents coronaires à taille humaine tout en fournissant en même temps un phénotype atherogenic. Cela en fait un modèle excellent et fiable pour étudier l’ISR après l’implantation d’une endoprothèse. Ici, nous décrivons, en détail, l’implantation des stents coronaires humains disponibles dans le commerce dans l’aorte abdominale des rats avec un apoE-/- fond utilisant un accès transport-fémoral.
Introduction
L’intervention coronarienne percutanée (ICP), combinée au déploiement d’un stent coronaire, représente l’étalon-or dans le traitement interventionnel de la maladie coronarienne1. Le succès à long terme des endoprothèses, cependant, peut être limité par l’apparition d’une resténose in-endoprothèse (ISR) qui est déterminée par une prolifération excessive de tissu néointimal dans l’endoprothèse2,3. ISR peut exiger une ré-intervention avec le pontage de l’artère coronaire ou re-PCI. Une variété de modèles animaux ont été suggérés pour l’étude de l’ISR, chacun d’eux présentant des avantages et des lacunes. Les principaux inconvénients des modèles d’artère iliaque porcins et lapin les plus couramment utilisés, bien que développant des lésions nettement similaires à celles des humains après l’implantation de stent4,5,sont les coûts élevés des animaux et du logement, ce qui soulève des difficultés logistiques, en particulier dans les études à long terme, ainsi que des limitations dans la manipulation et l’équipement. En outre, la disponibilité des anticorps contre les protéines cellulaires des porcs et des lapins est limitée. D’autre part, les modèles murins offrent les principaux avantages d’un débit et d’une reproductibilité élevés, ainsi que d’une facilité de manipulation, de logement et donc d’une rentabilité. En outre, un plus grand nombre d’anticorps sont disponibles. Cependant, alors que les souris déficientes en E de l’apolipoprotéine (apoE-/-) ont été largement utilisées pour l’étude de l’athérosclérose6,7,8,elles ne conviennent pas à l’étude de l’ISR car les endoprothèses doivent être miniaturisées pour être implantées chez la souris, ce qui pourrait modifier les propriétés mécaniques des endoprothèses. De plus, la paroi aortique des souris mesure entre 50 μm chez les jeunes souris et 85 μm chez les souris âgées9,et les endoprothèses doivent être déployées en utilisant des niveaux de pression aussi bas que 2 atm, ce qui pourrait entraîner une malapposition de l’endoprothèse10. Les rats, cependant, permettent l’implantation d’endoprothèses coronaires humaines disponibles dans le commerce, et démontrent un cours de guérison vasculaire semblable à celui des animaux plus gros après implantation d’endoprothèses aortiques, rapportée pour la première fois par Langeveld et al.11. Cette technique a à l’origine eu besoin d’un accès trans-abdominal, qui a rendu nécessaire une constriction physique de l’aorte pour réaliser une interruption provisoire de flux sanguin. Pour éviter les lésions potentiellement associées aux vaisseaux et les réactions inflammatoires, la technique a ensuite été affinée par l’introduction d’un accès trans-iliaque, ce qui a en outre entraîné un taux de survie plus élevé des animaux12.
Parce que les rats de type sauvage ne développent pas de lésions athérosclérotiques13,apoE-/- rats ont été générés en utilisant des techniques de nucléase telles que Transcription Activator-Like Effector Nuclease (TALEN)14, Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR/Cas9)15, et Zinc Finger (ZF)16. ApoE-/- rats sont disponibles dans le commerce depuis 2011. Fournissant un fond atherogenic, apoE-/- rats permettent une évaluation plus réaliste des stents coronaires de taille humaine, particulièrement en ce qui concerne l’ISR.
Ci-dessus, nous décrivons la méthode par l’intermédiaire de la voie d’accès transfémorale et utilisant un stent de drogue-élution de cobalt-chrome de mince-jambe disponible dans le commerce (DES), cependant, il peut également être appliqué pour l’étude d’autres types d’endoprothèse, tels que les stents de métal nu (BMS) ou les stents biodégradables.
Protocole
Les expériences ont été réalisées conformément à la loi allemande sur le bien-être animal (TSchG) et à la directive 2010/63/UE relative à la protection des animaux utilisés à des fins scientifiques. L’approbation officielle de cette étude a été accordée par le Comité gouvernemental pour la protection et l’utilisation des animaux (Protocole n° : AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Allemagne). Le protocole de l’étude était conforme au Guide pour le soin et l’utilisation des animaux de laboratoire. Le traitement de la douleur postopératoire est basé sur les recommandations de la Société allemande pour la science des animaux de laboratoire (GV-SOLAS) ainsi que sur l’Initiative de thérapie de la douleur vétérinaire.
1. Techniques de base et procédures communes
- Utilisez des rats apoE homozygotes-/- Sprague-Dawley. Identifier le génotype de chaque animal à l’aide des méthodes standard17.
- Maintenir les animaux dans des conditions identiques (21 °C ± 2 °C, 60 % ± 5 % d’humidité et un cycle lumière/obscurité de 12 h) et assurer le libre accès à l’eau et à la nourriture.
- Effectuez toutes les procédures dans des conditions propres mais non astiles.
- Une fois que le rat est anesthésié, effectuez toutes les procédures sous un microscope chirurgical à un grossissement de 16x.
- Utilisez des cotons-tiges pour l’hémostase par compression. Les écouvillons de gaze (5 cm x 5 cm) imbibés d’une solution de sonnerie lactée sont utiles pour garder l’aine humide.
- Suivez les règlements sur l’élimination des déchets pour éliminer les matériaux usagés.
2. Préparations avant la chirurgie
- Préparez les médicaments vétérinaires avant de commencer l’opération. Conserver toutes les solutions à température ambiante, sauf indication contraire.
- Trente minutes avant la procédure, administrer 0,03-0,05 mg/kg de buprénorphine par voie sous-cutanée.
- Anesthésier le rat par injection intrapéritonéale de 100 mg/kg de poids corporel (S)-kétamine et de 8 mg/kg de xylazine.
- Évaluer le poids du rat à l’aide d’une balance.
- Placez le rat sur un coussin chauffant et fixez les membres supérieurs et inférieurs à l’aide de ruban médical. Positionnez le rat avec son membre postérieur gauche entièrement étendu et autant que possible en ligne avec sa colonne vertébrale afin de créer une ligne droite entre l’artère fémorale et l’aorte. Cela facilitera l’avancement de l’endoprothèse montée sur ballon à travers la bifurcation aortique.
- Maintenir l’anesthésie avec inhalation de 1,5 vol% d’isoflurane dans 97,5% d’oxygène à un débit de 2 L/min.
REMARQUE: Laisser le rat respirer spontanément, sans intubation. - Appliquez une pommade oculaire pour prévenir les lésions oculaires pendant l’inconscience.
- Rasez la fourrure de l’aine et du bas-ventre du rat et stérilisez la peau correspondante avec une solution de povidone-iode.
- Avant de commencer la chirurgie, vérifiez la profondeur adéquate de l’anesthésie en pinçant le bout de la queue et le tissu interdigital.
3. Chirurgie
- Faites une incision médiale de ~0,5\u20121 cm dans l’aine gauche pour ouvrir la peau et le fascia sous-jacent.
- Disséquer et sonder émoussés dans les profondeurs jusqu’à ce que l’artère fémorale gauche pulsée puisse être identifiée.
- À l’aide d’une pince très fine, préparez l’artère fémorale en enlevant doucement le tissu conjonctif environnant. Veillez à ne nuire ni au nerf fémoral ni à la veine fémorale, qui est médiale à l’artère.
- Préparez environ 1 cm de l’artère fémorale. Placez soigneusement la pointe de la pince sous le navire pour la soulever doucement.
- Enfilez des morceaux de suture de soie 4-0 sous les parties distales et proximales de l’artère et formez des élinges. Serrez les extrémités de chacune des deux élings de fil entre les branches d’une pince chirurgicale. Utilisez les pinces chirurgicales pour contrôler l’artère. Étirez et soulevez doucement les élings afin d’interrompre temporairement le flux sanguin.
REMARQUE: Travaillez rapidement pour éviter un garrot prolongé qui peut entraîner des lésions tissulaires. - À l’aide de micro-ciseaux pointus, effectuez une artériotomie au milieu de l’artère fémorale.
- Introduisez un fil guide à travers l’artériotomie. Lorsque vous atteignez l’élingue proximale, relâchez la tension du fil en déplaçant la pince chirurgicale et avancez le fil de guidage plus loin vers l’aorte abdominale.
REMARQUE: Coupez le fil de guidage à l’aide d’un coupe-fil pour faciliter la manipulation. - Placez l’extrémité proximale du fil de guidage entre le diaphragme et les artères rénales.
REMARQUE: Avancer le fil de guidage trop loin porte le risque de blessure aortique ou cardiaque. Nous recommandons d’ouvrir l’abdomen pour assurer un positionnement adéquat du fil de guidage et de l’endoprothèse au moins pour les premiers animaux. - Introduisez une endoprothèse coronaire sertie et montée sur ballon mesurant 2,25 mm x 8 mm (max. 2,5 mm x 8 mm) au-dessus du fil de guidage dans l’artère fémorale et avancez-la jusqu’à l’aorte abdominale.
- Placez l’endoprothèse juste au-dessus de la bifurcation aortique, mais en dessous des artères rénales. Déployez l’endoprothèse en gonflant le cathéter à ballonnet à 12 atm pendant 15 s à l’aide d’un système de seringue de gonflage.
- Dégonfler le cathéter à ballonnet et maintenir une pression négative conformément aux recommandations du fabricant pour l’endoprothèse utilisée.
- Retirez lentement le cathéter dégonflé tout en laissant l’endoprothèse en place.
- Juste avant de sortir le cathéter, créez une tension sur la boucle de fil au-dessus de l’incision avec la pince chirurgicale pour interrompre à nouveau le flux sanguin. Retirez ensuite le cathéter à ballonnet et léguez directement le vaisseau proximalement.
- Attachez les boucles proximales et distales de fil pour ligate l’artère fémorale et confirmer à hémostase proportionnée de l’artériotomie. Les artères collatérales assureront une perfusion supplémentaire au membre.
- Fermez le muscle qui surlère l’artère, ainsi que l’incision de la peau en utilisant 10-0 sutures non résorbables.
4. Soins aux animaux après l’implantation de l’endoprothèse
- Immédiatement après l’opération, laisser le rat récupérer pendant 60 min dans une cage spéciale de l’unité de soins intensifs avec de l’air réchauffé (30\u201235 °C) et un apport d’oxygène.
- Surveillez attentivement les animaux jusqu’à ce qu’ils soient complètement récupérés. Ensuite, déplacez les rats dans une cage normale. Fournir un accès ad libitum à l’eau et à la nourriture.
- Administrer une analgésie postopératoire toutes les 6 à 12 heures avec 0,03 à 0,05 mg/kg de buprénorphine (s.c., dans 500 μl de NaCl) pour un total de 72 heures en évaluation clinique.
- Faire mélanger l’aliment avec du clopidogrel (15 mg/kg) pour éviter la thrombose de l’endoprothèse implantée.
- Pour améliorer les conditions hypercholestérolémiques et la formation de plaque, commencez l’alimentation occidentale à 6\u20128 semaines après la naissance et continuez jusqu’à l’euthanasie. Si vous le souhaitez, une cohorte d’animaux nourris avec un rat chow normal peut servir de contrôle.
5. Collecte et traitement des tissus
- Avant de commencer l’explantation tissulaire au moment désigné, euthanasier l’animal conformément aux directives de l’IACUC. Récolter l’aorte stentée pour l’analyse histologique à la fin de la période d’observation.
- Ouvrez l’abdomen par une incision médiane et retirez le segment endoprothèse de l’aorte ainsi que les parties adjacentes non endoprothées de l’aorte, mesurant 0,5 cm chacune.
- Placer le tissu dans une solution de formol tamponné à 4% pendant 24 h pour la fixation.
- Incorporer le tissu artériel endoprothèse dans du plastique et effectuer des colorations histologiques et immunohistochimiques selon les protocoles standards18,19.
6. Analyse histomorphométrique
- Effectuer une analyse histomorphométrique des sections séquentielles de la partie proximale, moyenne et distale de l’aorte stentée au moyen d’un microscope lié à un ordinateur avec un logiciel d’analyse d’image approprié.
- Tracez les contours de la lame élastique externe (EEL, entre adventitia et media), la lame élastique interne (IEL, entre media et neointima), et lumen avec une tablette de dessin graphique. À partir de ces valeurs, calculez la zone EEL, la zone IEL et la zone lumen avec le logiciel.
- Calculer le pourcentage de la surface transversale de la resténose in-stent (ISR) :
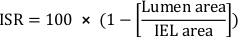
- Calculer la surface néointimale totale (Ai):
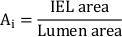
- Mesurez l’épaisseur néointimale (NIT) sur chaque jambe de force d’endoprothèse comme la distance entre la jambe de force et la lumière. Mesurer le NIT entre les jambes de force de l’endoprothèse comme la distance entre l’IEL et la lumière.
Remarque : Vous pouvez également calculer NIT comme suit :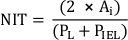
où PL et PIEL sont le périmètre de la lumière et de la lame élastique interne, respectivement20. - Effectuer des analyses supplémentaires selon les exigences de l’étude.
Résultats
Ce protocole décrit l’implantation d’endoprothèses dans l’aorte abdominale de rats à l’aide d’une voie d’accès transfémorale(figure 1). Le premier point central de ce modèle animal est qu’il permet le déploiement d’endoprothèses coronaires à taille humaine. Un stent coronaire serti et ballon-monté disponible dans le commerce peut être placé dans l’aorte abdominale des rats. Ainsi, en outre, le même principe de déploiement d’endoprothèses que chez l’homme ...
Discussion
Ce protocole décrit l’implantation des stents coronaires à taille humaine dans l’aorte abdominale de l’apoE-/- rats. Plusieurs points techniques méritent d’être soulignés. Tout d’abord, un décalage entre la taille de l’endoprothèse et la taille de l’aorte doit être évité. Placer un stent trop petit peut mener à la malapposition stent, tandis que l’implantation d’un stent qui est trop grand pour l’aorte peut causer le surstretch, la déchirure, et la blessure du navire. Par consé...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Mme Angela Freund pour son aide technique inestimable dans la production d’intégration et de diapositives. Nous tenons également à remercier M. Tadeusz Stopinski de l’Institute for Laboratory Animal Science &Experimental Surgery pour son aide perspicace dans le travail vétérinaire.
matériels
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Références
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon