Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Trans-Femoral Erişim Kullanılarak İnsan Büyüklüğünde Koroner Stentlerin Rat Abdominal Aort'a yerleştirilmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, insan koroner stentlerin trans-femoral erişim kullanılarak apoE-/- arka plan ile sıçanların karın aortuna implantesini açıklar. Diğer hayvan modelleriyle karşılaştırıldığında, murine modelleri yüksek verim, tekrarlanabilirlik, kullanım ve muhafaza kolaylığı ve moleküler belirteçlerin geniş bir kullanılabilirliği avantajlarını taşır.
Özet
Perkütan koroner girişim (PCI), koroner stent dağıtımı ile birlikte koroner arter hastalığının girişimsel tedavisinde altın standardı temsil eder. Stent içi restenoz (ISR), stent içindeki neointimal dokunun aşırı çoğalması ile belirlenir ve stentlerin uzun süreli başarısını sınırlar. Steno-in-stent restenozunun (ISR) altında yatan patofizyolojik süreçlerin aydınlatılması için çeşitli hayvan modelleri kullanılmıştır, porsin koroner ve tavşan iliak arter modelleri en sık kullanılanlardır. Murine modelleri, yüksek verim, kullanım ve gövde kolaylığı, tekrarlanabilirlik ve moleküler belirteçlerin geniş bir kullanılabilirliği avantajları sağlar. Apolipoprotein E eksikliği (apoE-/- ) fare modeli kardiyovasküler hastalıkları incelemek için yaygın olarak kullanılmıştır. Bununla birlikte, stentlerin farelere yerleştirilmek için minyatürleştirilmesi gerekir, mekanik ve (potansiyel olarak) biyolojik özelliklerinin önemli değişikliklerini içeren. ApoE-/- sıçanların kullanımı, apoE-/- sıçanlar insan büyüklüğünde koroner stentlerin değerlendirilmesine izin verirken aynı zamanda aterojenik bir fenotip sağlarken bu eksikliklerin üstesinden gelebilir. Bu, stent implantasyonundan sonra ISR'yi araştırmak için mükemmel ve güvenilir bir model haline getirir. Burada, ticari olarak mevcut insan koroner stentlerinin trans-femoral erişim kullanarak apoE-/- arka plan ile sıçanların karın aortuna implante edilmesi ayrıntılı olarak açıklanmaktadır.
Giriş
Perkütan koroner girişim (PCI), koroner stent dağıtımı ile birlikte koroner arter hastalığının girişimsel tedavisinde altın standardı temsil eder1. Bununla birlikte, stentlerin uzun vadeli başarısı, stent içinde neointimal dokunun aşırı çoğalması ile belirlenen stent istirenozunun (ISR) ortaya çıkması ile sınırlanabilir2,3. ISR koroner arter bypass veya yeniden PCI ile yeniden müdahale gerektirebilir. ISR'nin çalışması için her biri avantaj ve eksiklik içeren çeşitli hayvan modelleri önerilmiştir. En sık kullanılan porcine koroner ve tavşan iliak arter modellerinin en büyük dezavantajları, stent implantasyonu4,5'ten sonra insanlara belirgin bir şekilde benzeyen lezyonlar geliştirmek deolsa,özellikle uzun vadeli çalışmalarda lojistik zorlukların yanı sıra elleçleme ve ekipman sınırlamalarını gündeme getiren büyük hayvan ve barınma maliyetleridir. Ayrıca, domuz ve tavşanların hücresel proteinlerine karşı antikorların mevcudiyeti sınırlıdır. Öte yandan, murine modelleri yüksek verim ve tekrarlanabilirliğin yanı sıra kullanım kolaylığı, konut ve dolayısıyla maliyet etkinliğinin önemli avantajlarını sağlar. Ayrıca, daha fazla sayıda antikor mevcuttur. Bununla birlikte, apolipoprotein E-eksik (apoE-/-) fareler ateroskleroz6,7,8çalışması için yaygın olarak kullanılmış olsa da, stentlerin farelere implante edilmesi için minyatürleştirilmesi ve stentlerin mekanik özelliklerinin potansiyel olarak değiştirilmesi gerektiği için ISR çalışması için uygun değildir. Ayrıca, farelerin aort duvarı genç farelerde 50 μm ile yaşlı farelerde 85 μm arasında ölçülmektedir9ve stentler 2 atm kadar düşük basınç seviyeleri kullanılarak dağıtılmalıdır, bu da stenin malapposition10'ayol açabilir. Bununla birlikte, sıçanlar, ticari olarak mevcut insan koroner stentlerin implantasyonuna izin verir ve ilk olarak Langeveld ve ark.11tarafından bildirilen aort stent implantasyonundan sonra daha büyük hayvanlara benzer bir damar iyileşme kursu gösterir. Bu teknik başlangıçta, kan akışının geçici olarak kesintiye uğraması için aortu fiziksel olarak daraltmayı gerektiren bir trans-abdominal erişim gerektiriyordu. Potansiyel olarak ilişkili damar yaralanmasını ve enflamatuar reaksiyonları önlemek için, teknik daha sonra hayvanların daha yüksek bir hayatta kalma oranına neden olan bir trans-iliak erişimin tanıtılmasıyla rafine edildi12.
Wildtype sıçanlar aterosklerotik lezyonlar geliştirmediği için13, apoE-/- sıçanlar Transkripsiyon Aktivatör Benzeri Efektör Nükleaz (TALEN)14, Kümelenmiş Düzenli Aralıklı Kısa Palindropik Tekrarlar (CRISPR/ Cas9)15ve Çinko Parmak (ZF)16gibi nükleaz teknikleri kullanılarak üretilmiştir. ApoE-/- sıçanlar 2011 yılından beri ticari olarak mevcuttur. Aterojenik bir arka plan sağlayan apoE-/- sıçanlar, özellikle ISR ile ilgili olarak insan büyüklüğündeki koroner stentlerin daha gerçekçi bir şekilde değerlendirilmesini sağlar.
Burada, yöntemi transfemoral erişim yolu üzerinden ve piyasada bulunan ince payanda kobalt-krom ilaç eluting stent (DES) kullanarak açıklıyoruz, ancak çıplak metal stentler (BMS) veya biyolojik olarak parçalanabilir stentler gibi diğer stent türlerinin çalışması için de uygulanabilir.
Protokol
Deneyler, bilimsel amaçlarla kullanılan hayvanların korunmasıyla ilgili Alman hayvan refahı yasası (TSchG) ve Direktifi 2010/63/AB uyarınca gerçek gerçekleştirildi. Bu çalışma için resmi onay Hükümet Hayvan Bakım ve Kullanım Komitesi tarafından verilmiştir (Protokol No.: AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Almanya). Çalışma protokolü Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirildi. Ameliyat sonrası ağrı tedavisi, Alman Laboratuvar Hayvanları Bilimi Derneği'nin (GV-SOLAS) önerilerine ve Girişim Veteriner Ağrı Terapisi'ne dayanmaktadır.
1. Temel teknikler ve ortak prosedürler
- Homozigöz apoE-/- Sprague-Dawley sıçanları kullanın. Standart yöntemler kullanarak her hayvanın genotipini tanımlayın17.
- Hayvanları aynı koşullarda (21 °C ± 2 °C, %60 ± %5 nem ve 12 saat açık/karanlık döngü) tutun ve suya ve yiyeceğe ücretsiz erişim sağlayın.
- Tüm prosedürleri temiz ama nonsteril koşullar altında gerçekleştirin.
- Sıçan uyuşturuldıktan sonra, tüm prosedürleri 16x büyütmede cerrahi bir mikroskop altında gerçekleştirin.
- Sıkıştırma hemostazı için pamuklu çubuk kullanın. Laktlı Ringer çözeltisi ile ıslatılmış gazlı bez sürüntüleri (5 cm x 5 cm) kasık nemli tutmak için faydalıdır.
- Kullanılmış malzemeleri bertaraf etmek için atık bertaraf yönetmeliklerine uyun.
2. Ameliyat öncesi hazırlıklar
- Operasyona başlamadan önce veteriner ilaçlarını hazırlayın. Aksi belirtilmedikçe tüm çözümleri oda sıcaklığında tutun.
- İşlemden otuz dakika önce, 0.03-0.05 mg/kg buprenorfin deri altından uygulayın.
- Sıçanı 100 mg/kg vücut ağırlığı (BW) (S)-ketamin ve 8 mg/kg BW ksilazin intraperitoneal enjeksiyon ile uyuşturun.
- Bir tartım terazisi kullanarak sıçanın ağırlığını değerlendirin.
- Sıçanı bir ısıtma yastığına yerleştirin ve tıbbi bant kullanarak üst ve alt uzuvları sabitleyin. Sıçanı sol arka uzvu tamamen uzatılmış ve omurgasıyla mümkün olduğunca uyumlu olarak konumlandırın, böylece femoral arter ve aort arasında düz bir çizgi oluşturun. Bu, balona monte stentlerin aort çatallanması yoluyla ilerletilmesini kolaylaştıracaktır.
- 2 L/dk akış hızında %97,5 oksijende %1,5 vol izofluran soluma ile anesteziyi koruyun.
NOT: Sıçanın entübasyon yapmadan kendiliğinden nefes almasına izin verin. - Bilinçsizlik sırasında göz hasarlarını önlemek için göz merhemi uygulayın.
- Kürkü sıçanın kasık ve alt karın bölgesinden tıraş edin ve ilgili cildi bir povidone-iyot çözeltisi ile sterilize edin.
- Ameliyata başlamadan önce kuyruk ucunu ve interdigital dokuyu sıkıştırarak yeterli anestezi derinliğini doğrulayın.
3. Cerrahi
- Cildi ve alttaki fasyayı açmak için sol kasıkta ~0,5\u20121 cm medial kesi yapın.
- Titreşen sol uyluk atardamarı tespit edilene kadar derinlikleri künt bir şekilde parçalara ayrılın ve araştırın.
- Çok ince tokmalar kullanarak, çevredeki bağ dokusunu nazikçe çıkararak femoral arteri hazırlayın. Ne femoral sinire ne de artere medial olan femoral damara zarar vermeye dikkat edin.
- Femoral arterin yaklaşık 1 cm'sini hazırlayın. Yavaşça kaldırmak için kabın altına asma ucunu dikkatlice koyun.
- Atardamarın distal ve proksimal kısımlarının altında 4-0 ipek dikiş iplik parçaları ve sapanlar oluşturur. İki iplik sapanının her birinin uçlarını cerrahi kelepçenin dalları arasında sıkıştırın. Atardamarı kontrol etmek için cerrahi kelepçeleri kullanın. Kan akışını geçici olarak kesmek için sapanları hafifçe uzatın ve kaldırın.
NOT: Doku hasarına yol açabilecek uzun süreli bir turnikeden kaçınmak için hızlı çalışın. - Keskin mikro makas kullanarak, femoral arterin ortasında bir arteriotomi gerçekleştirin.
- Arteriotomi yoluyla bir kılavuz tel tanıtın. Proksimal iplik sapanlarına ulaşırken, cerrahi kelepçeyi hareket ettirerek ipliğin gerginliğini serbest bırakın ve kılavuz teli karın aortine doğru daha da ilerletin.
NOT: Elleçlemeyi kolaylaştırmak için kılavuz teli bir tel kesici kullanarak kesin. - Kılavuz telin proksimal ucunu diyafram ve renal arterler arasına yerleştirin.
NOT: Kılavuz telin çok ileriye doğru ilerleten aort veya kardiyak yaralanma riski taşır. Kılavuz telin ve stenin en azından ilk birkaç hayvan için yeterli konumlandırılmasını sağlamak için karnın açılmasını öneririz. - Kılavuz tel üzerinden uyluk atardamarına 2,25 mm x 8 mm (maks. 2,5 mm x 8 mm) ölçülerinde kıvrkıt ve balona monte koroner stent takın ve karın aortuna ilerletin.
- Stetiği aort çatallanmasının hemen üstüne ancak renal arterlerin altına yerleştirin. Balon kateterini şişirerek steni 15 sn için 12 atm'ye şişirerek bir şişirme şırınna sistemi kullanarak dağıtın.
- Balon kateterini söndür ve üreticinin kullanımdaki stent için önerilerine göre negatif basıncı koruyun.
- Sönmüş kateteri yavaşça çekin ve steni yerinde bırakın.
- Kateteri çıkarmadan hemen önce, kan akışını tekrar kesmek için cerrahi kelepçe ile kesiğin üzerindeki iplik halkasında gerginlik yaratın. Daha sonra balon kateterini çıkarın ve damarı proksimally olarak doğrudan lige edin.
- Femoral arteri lige etmek ve arteriotomi yeterli hemostazı doğrulamak için proksimal ve distal iplik döngülerini bağlayın. Kollateral arterler uzuvlara daha fazla perfüzyon sağlayacaktır.
- 10-0 resorbable olmayan dikiş kullanarak arterin üzerindeki kası ve cilt kesisini kapatın.
4. Stent implantasyonundan sonra hayvan bakımı
- Ameliyattan hemen sonra, farenin ısınan hava (30\u201235 °C) ve oksijen kaynağı olan özel bir yoğun bakım ünitesi kafesinde 60 dakika boyunca iyileşmesine izin verin.
- Tamamen iyileşene kadar hayvanları dikkatlice izleyin. Daha sonra, sıçanları normal bir kafese taşıyın. Suya ve yiyeneğe reklam libitum erişimi sağlayın.
- Klinik değerlendirme altında toplam 72 saat boyunca 0.03-0.05 mg/kg buprenorfin (s.c., in 500μl NaCl) ile her 6-12 saatte bir postoperatif analjezi uygulamak.
- İmplant edilen stensin trombozdan kaçınmak için yiyecekleri klopidogrel (15 mg/kg) ile karıştırın.
- Hiperkolestemik koşulları ve plak oluşumunu geliştirmek için doğumdan 6\u20128 hafta sonra batı diyet beslenmesine başlayın ve ötanaziye kadar devam edin. İstenirse, normal sıçan yemeğiyle beslenen bir hayvan grubu kontrol görevi görebilirsiniz.
5. Doku toplama ve işleme
- Doku eksplantasyonuna belirlenen zaman noktasında başlamadan önce, hayvanı IACUC yönergelerine göre ötenazi edin. Gözlem süresinin sonunda histolojik analiz için stented aort hasat edin.
- Karnı orta çizgi kesiğiyle açın ve aortun eğimli segmentini ve aortun bitişik olmayan kısımlarını her biri 0,5 cm ölçülerinde çıkarın.
- Dokuyu sabitleme için 24 saat boyunca% 4 tamponlanmış formalin çözeltisine yerleştirin.
- Stented arteriyel dokuyu plastiğe gömün ve standart protokollere göre histolojik ve immünohistokimyasal lekeleme gerçekleştirin18,19.
6. Histomorfometrik analiz
- Uygun bir görüntü analiz yazılımına sahip bir bilgisayara bağlı mikroskop vasıtasıyla, stental aortun proksimal, orta ve distal kısmının sıralı bölümlerinin histoporfometrik analizini yapın.
- Dış elastik lamina (EEL, adventitia ve medya arasında), iç elastik lamina (IEL, medya ve neointima arasında) ve lümen konturlarını bir grafik çizim tableti ile takip edin. Bu değerlerden, yazılımla birlikte EEL alanını, IEL alanını ve lümen alanını hesaplayın.
- Stent restenozunda (ISR) kesitsel alan yüzdesini hesaplayın:
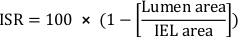
- Toplam neointimal alanı hesaplayın (Ai):
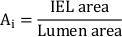
- Her stent payandası üzerindeki neointimal kalınlığı (NIT) payanda ve lümen arasındaki mesafe olarak ölçün. Nit'i stent payandaları arasında IEL ve lümen arasındaki mesafe olarak ölçün.
NOT: Alternatif olarak, NIT'yi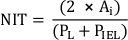
burada PL ve PIEL sırasıyla lümen ve iç elastik lamina çevresidir20. - Çalışmanın gerekliliklerine göre ek analizler yapmak.
Sonuçlar
Bu protokol, trans-femoral erişim yolu kullanan sıçanların karın aortunda stent implantasyonunu açıklar (Şekil 1). Bu hayvan modelinin ilk merkezi noktası, insan büyüklüğünde koroner stentlerin yerleştirilmesine izin veriyor olmasıdır. Piyasada bulunan kıvraklı ve balona monte koroner stent, sıçanların karın aortuna yerlenebilir. Böylece, ek olarak, insanlarda olduğu gibi aynı stent dağıtım prensibi uygulanabilir. Sıçan kullanımının bir başka avantajı, tic...
Tartışmalar
Bu protokol, insan büyüklüğündeki koroner stentlerin apoE-/- sıçanların karın aortuna implantesini açıklar. Birkaç teknik nokta vurgu etmeye değer. İlk olarak, stent boyutu ile aortun büyüklüğü arasında bir uyumsuzluk önlenmelidir. Çok küçük bir stent yerleştirmek stent malappozasyonuna yol açabilirken, aort için çok büyük bir stent takılması damarın aşırı uzamasına, yırtılmasına ve yaralanmasına neden olabilir. Bu nedenle, çapı 2,0 ila 2,5 mm arasında stent kullanm...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bayan Angela Freund'a gömme ve slayt üretimindeki paha biçilmez teknik yardımı için teşekkür ederiz. Ayrıca Laboratuvar Hayvan Bilimi ve Deneysel Cerrahi Enstitüsü'ndeki Bay Tadeusz Stopinski'ye veterinerlik çalışmalarına yaptığı anlayışlı yardımlar için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Referanslar
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır