Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Имплантация коронарных стентов размером с человека в крысиную брюшную аорту с использованием транс-беморального доступа
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает имплантацию коронарных стентов человека в брюшную аорту крыс с апоЭ-/- фоном с использованием трансфеморального доступа. По сравнению с другими моделями животных, модели мурина имеют преимущества высокой пропускной способности, воспроизводимости, простоты обработки и жилья, а также широкой доступности молекулярных маркеров.
Аннотация
Перкутанное коронарное вмешательство (PCI), в сочетании с развертыванием коронарного стента, представляет собой золотой стандарт в интервенционной лечении ишемической болезни сердца. Внутри стент-рестиноз (ISR) определяется чрезмерным распространением неоинтимальной ткани в стенте и ограничивает долгосрочный успех стентов. Различные модели животных были использованы для выяснения патофизиологических процессов, лежащих в основе стент рестиденоза (ISR), с свиной коронарной и кролика подвздошной артерии модели наиболее часто используются. Модели Murine обеспечивают преимущества высокой пропускной способности, простоты обработки и жилья, воспроизводимости и широкой доступности молекулярных маркеров. Модель аполипопротеина E deficient (apoE-/ ) была широко использована для изучения сердечно-сосудистых заболеваний. Тем не менее, стенты должны быть миниатюризированы, чтобы быть имплантированы в мышей, с участием важных изменений их механических и (потенциально) биологических свойств. Использование апоЭ-/- крысы могут преодолеть эти недостатки вкачестве апофея -/- крысы позволяют для оценки человеческого размера коронарных стентов и в то же время обеспечивая атерогенный фенотип. Это делает их отличной и надежной моделью для исследования ISR после имплантации стента. Здесь мы подробно описываем имплантацию коммерчески доступных коронарных стентов человека в брюшную аорту крыс сапоЭ -/- фоном с использованием трансфеморального доступа.
Введение
Перкутанное коронарное вмешательство (PCI), в сочетании с развертыванием коронарного стента, представляет собой золотой стандарт в интервенционной терапии ишемической болезнисердца 1. Долгосрочный успех стентов, однако, может быть ограничен возникновением стент-ретеноза (ISR), который определяется чрезмерным распространением неоинтимальной ткани в стенте2,3. ISR может потребовать повторного вмешательства либо при шунтировании коронарной артерии, либо при повторном PCI. Для изучения ИСР были предложены различные модели животных, каждая из которых имеет преимущества и недостатки. Основными недостатками наиболее часто используемых моделей свиной коронарной и кроликовой подвихов, хотя и развивающихся поражений заметно похож на людей после стентимплантации 4,5 , являютсябольшиерасходы на животных и жилья, который воспитывает логистические трудности, особенно в долгосрочных исследованиях, а также ограничения в обработке и оборудования. Кроме того, ограничена доступность антител к клеточным белкам свиней и кроликов. С другой стороны, модели murine обеспечивают основные преимущества высокой пропускной способности и воспроизводимости, а также простоту обработки, жилья и, следовательно, рентабельность. Кроме того, доступно большее количество антител. Однако, в то время как аполипопротеин E-дефицит (apoE-/ )мышей были широко использованыдля изучения атеросклероза 6,7,8, они непригодны для изучения ISR как стенты должны быть миниатюризированы, чтобы быть имплантированы в мышей, потенциально изменяя стенты механических свойств. Кроме того, аорта стенка мышей меры между 50 мкм у молодых мышей и 85 мкм устарых мышей 9, и стенты должны быть развернуты с использованием уровня давления, как низко как 2 атм, что может привести к недомоганию стента10. Крысы, однако, позволяют имплантировать коммерчески доступные коронарные стенты человека, и продемонстрировать сосудистый курс заживления похож на крупных животных после имплантации стента аорты, впервые сообщил Langeveld et al.11. Этот метод первоначально требовал трансбрюшного доступа, что требовало физического сужения аорты для достижения временного прерывания кровотока. Чтобы избежать потенциально связанных травм сосудов и воспалительных реакций, метод был позже усовершенствован введением транс-илиак доступа, что дополнительно привело к более высокой выживаемостиживотных 12.
Потому что дикие крысы не развиваются атеросклеротическиепоражения 13, apoE- крысы были созданы с использованием нуклеазных методов, таких как транскрипция Активатор-как эффектор Nuclease (TALEN)14, Кластерные регулярно interspaced Короткие Palindromic Повторы (CRISPR/Cas9)15, и цинк палец(NOF) 16. ApoE-/- Крысы были коммерчески доступны с 2011 года. Предоставление атерогенного фона,апоЭ -/- крысы позволяют более реалистично оценки человека размера коронарных стентов, особенно в отношении ISR.
В этом случае мы описываем метод через трансфеморальный маршрут доступа и используя коммерчески доступные тонко стойки кобальта-хрома наркотиков-eluting стент (DES), однако, он также может быть применен для изучения других типов стента, таких как голые металлические стенты (BMS) или биоразлагаемых стентов.
протокол
Эксперименты проводились в соответствии с немецким законом о защите животных (TSchG) и Директивой 2010/63/EU, касающейся защиты животных, используемых в научных целях. Официальное разрешение на это исследование было предоставлено Правительственным комитетом по уходу за животными и использованию (Протокол No: АК 87-51.04.2010.A065; Ландесамт Фюр Натур, Умвелт и Вербраучершутц Нордрейн-Вестфален, Реклингхаузен, Германия). Протокол исследования соответствовал Руководству по уходу и использованию лабораторных животных. Послеоперационное лечение боли основано на рекомендациях Немецкого общества лабораторных наук о животных (GV-SOLAS), а также инициативной ветеринарной обезболивающей терапии.
1. Основные методы и общие процедуры
- Используйте гомозиготныеапоЭ -/- Крысы Спраг-Доули. Определите генотип каждого животного с помощью стандартныхметодов 17.
- Держите животных в одинаковых условиях (21 градус по Цельсию ± 2 градуса по Цельсию, 60% ± 5% влажности и 12 ч света / темного цикла) и обеспечить свободный доступ к воде и пище.
- Проведение всех процедур в чистых, но нестерильные условиях.
- После того, как крыса анестезируется, выполнять все процедуры под хирургическим микроскопом при увеличении в 16 раз.
- Используйте ватные тампоны для сжатия гемостаз. Марлевые тампоны (5 см х 5 см), пропитанные лактатым раствором Ringer, полезны для увлажнения паха.
- Следуйте правилам удаления отходов для удаления использованных материалов.
2. Подготовка перед операцией
- Подготовка ветеринарных препаратов перед началом операции. Храните все растворы при комнатной температуре, если не указано иное.
- За тридцать минут до процедуры вводят 0,03-0,05 мг/кг бупренорфина подкожно.
- Обезболизовать крысу с внутриперитонеальной инъекцией 100 мг/кг массы тела (BW) (S)-кетамин и 8 мг/кг BW ксилазина.
- Оцените вес крысы с помощью весовой шкалы.
- Поместите крысу на грелку и зафиксйте верхние и нижние конечности с помощью медицинской ленты. Позиция крысы с левой задней конечности полностью расширена и столько в соответствии с позвоночником, как это возможно, с тем чтобы создать прямую линию между бедренной артерии и аорты. Это облегчит продвижение установленного на воздушном шаре стента через бифуркацию аорты.
- Поддержание анестезии при вдыхании 1,5 воль% изофлюрана в 97,5% кислорода при скорости потока 2 л/мин.
ПРИМЕЧАНИЕ: Разрешить крысе дышать спонтанно, без инутубации. - Нанесите мазь глаза, чтобы предотвратить повреждение глаз во время бессознательного.
- Брить мех из паха и нижней части живота области крысы и стерилизовать соответствующую кожу с раствором povidone-йода.
- Перед началом операции проясните достаточную глубину анестезии, ущипнув кончик хвоста и междигитальную ткань.
3. Хирургия
- Сделайте медиальный разрез в размере 0,5-20121 см в левом паху, чтобы открыть кожу и лежащую в основе фасцию.
- Грубо вскрыть и зондировать в глубинах до пульсирующей левой бедренной артерии могут быть определены.
- Используя очень тонкие типсы, подготовьте бедренную артерию, аккуратно удалив окружающие соединительные ткани. Будьте осторожны, чтобы нанести вред ни бедренной нерва, ни бедренной вены, которая является медиальной артерии.
- Приготовьте около 1 см бедренной артерии. Аккуратно положите кончик типса под сосуд, чтобы аккуратно поднять его.
- Кусочки нити 4-0 шелковых швов под дистальной и проксимальной частями артерии и образуют строп. Зажим концы каждой из двух ниток строп между ветвями хирургического зажима. Используйте хирургические зажимы для контроля артерии. Аккуратно растянуть и поднять строп, с тем чтобы временно прервать кровоток.
ПРИМЕЧАНИЕ: Работа быстро, чтобы избежать длительного турникет, который может привести к повреждению тканей. - Используя острые микро ножницы, выполните артериотомию в середине бедренной артерии.
- Ввести направляющий провод через артериотомию. При достижении проксимальной нити слинг, освободить напряжение нити, перемещая хирургический зажим и заранее направляющий провод дальше к брюшной аорты.
ПРИМЕЧАНИЕ: Вырезать направляющий провод с помощью резака для облегчения обработки. - Поместите проксимальный конец направляющей проволоки между диафрагмой и почечной артерией.
ПРИМЕЧАНИЕ: Продвижение направляющий провод слишком далеко несет риск аорты или сердечной травмы. Мы рекомендуем открыть брюшную полость, чтобы обеспечить адекватное позиционирование направляющий провод и стент по крайней мере для первых нескольких животных. - Введи обжимной и шар-установленный коронарный стент размером 2,25 мм х 8 мм (максимум 2,5 мм х 8 мм) над направляющий провод в бедренную артерию и перейти его к брюшной аорте.
- Поместите стент чуть выше бифуркации аорты, но ниже почечных артерий. Развернуть стент, надувая воздушный шар катетер до 12 3 на 15 с с помощью системы инфляционных шприцев.
- Сдуть воздушный шар катетер и поддерживать негативное давление в соответствии с рекомендациями производителя для стента в использовании.
- Медленно свястите спущенный катетер, оставив стент на месте.
- Перед тем, как вынул катетер, создайте напряжение на нити петли над разрезом с хирургическим зажимом, чтобы прервать кровоток снова. Затем удалите воздушный шар катетер и непосредственно ligate сосуд проксимально.
- Свяжите проксимальные и дистальные петли нити, чтобы лигат бедренной артерии и подтвердить адекватный гемостаз артериотомии. Сопутствующие артерии обеспечат дальнейшее перфузии конечности.
- Закройте мышцы, переогрев артерию, а также разрез кожи с помощью 10-0 нерезорбируемых швов.
4. Уход за животными после имплантации стента
- Сразу после операции дайте крысе восстановиться в течение 60 минут в клетке специального отделения интенсивной терапии с прогретым воздухом (30-u201235 C) и запасом кислорода.
- Внимательно следите за животными до полного выздоровления. После этого перемести крыс в обычную клетку. Обеспечить доступ к воде и продовольствию.
- Администрирование послеоперационной анальгезии каждые 6-12 часов с 0,03-0,05 мг/кг бупренорфина (с.c., в 500 л NaCl) в общей сложности 72 часов в соответствии с клинической оценкой.
- Испокойную пищу смешать с клопидогрелом (15 мг/кг), чтобы избежать тромбоза имплантированного стента.
- Для улучшения гиперхолестеринемических состояний и образования бляшек, начните западное питание питанием в течение 6-20128 недель после рождения и продолжайте до эвтаназии. При желании когорта животных, которых кормят нормальной крысиной чау, может служить контролем.
5. Сбор и обработка тканей
- Перед началом эксплантации тканей в назначенное время, усыпить животное в соответствии с руководящими принципами МАКУК. Урожай стентированную аорту для гистологического анализа в конце периода наблюдений.
- Откройте брюшную полость путем разреза средней линии и удалите стентированный сегмент аорты, а также прилегающие неупомяненные части аорты размером 0,5 см каждая.
- Поместите ткань в раствор 4% буферного формалина на 24 ч для фиксации.
- Встраивание стентированной артериальной ткани в пластик и выполнить гистологическое и иммуногистохимическоеокрашивание в соответствии со стандартными протоколами 18,19.
6. Гистоморфометрический анализ
- Выполните гистоморфометрический анализ последовательных секций проксимальной, средней и дистальной части стентированной аорты с помощью микроскопа, связанного с компьютером с соответствующим программным обеспечением для анализа изображений.
- Отслеживай контуры внешней эластичной ламины (EEL, между адвентитией и мультимедиа), внутренней эластичной ламины (IEL, между мультимедиа и неоинтимой) и люмена с графическим рисунком планшета. Из этих значений вычислите область EEL, область IEL и область люмена с программным обеспечением.
- Рассчитайте процент поперечной области стент-ререноза (ISR):
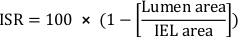
- Рассчитайте общую неоинтиматальную область(A i):
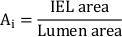
- Измерьте неоинтималенную толщину (NIT) над каждой стентной стойки как расстояние между стойкой и люменом. Измерьте NIT между стентными стойкими как расстояние между IEL и люменом.
ПРИМЕЧАНИЕ: В качестве альтернативы вычислите NIT как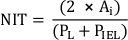
где PL и PIEL являются люменом и внутренним эластичным периметром ламины,соответственно 20. - Выполняем дополнительные анализы в соответствии с требованиями исследования.
Результаты
Этот протокол описывает имплантацию стента в брюшной аорте крыс с помощью транс-беморального маршрута доступа(рисунок 1). Первая центральная точка этой модели животных заключается в том, что она позволяет развертывание коронарных стентов размером с человека. Коммерчес...
Обсуждение
Этот протокол описывает имплантацию коронарных стентов размером с человека в брюшную аорту апоЭ-/- крыс. Стоит подчеркнуть ряд технических моментов. Во-первых, следует избегать несоответствия между размером стента и размером аорты. Размещение слишком маленького стента может при?...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить г- жву Ангелу Фрейнд за ее неоценимую техническую помощь в внедрении и производстве слайдов. Мы также хотели бы поблагодарить г-на Тадеуша Стопински из Института лабораторных наук о животных и экспериментальной хирургии за его проницательную помощь в ветеринарной работе.
Материалы
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Ссылки
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены