このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
トランス・大腿部アクセスを用いたヒトサイズの冠動脈ステントのラット腹部大動脈への移植
* これらの著者は同等に貢献しました
要約
このプロトコルは、トランス・フィスモラル・アクセスを用いて、apoE-/- バックグラウンドを有するラットの腹部大動脈へのヒト冠動脈ステントの移植を記述する。他の動物モデルと比較して、マウスモデルは高い効率、再現性、取扱いおよびハウジングの容易さ、および分子マーカーの広い利用可能性の利点を運ぶ。
要約
経皮的冠動脈介入(PCI)は、冠状動脈ステントの展開と相まって、冠動脈疾患の介入治療におけるゴールドスタンダードを表す。インステント・レステノーシス(ISR)は、ステント内の新内皮組織の過剰増殖によって決定され、ステントの長期的な成功を制限する。様々な動物モデルが、ブタ冠動脈およびウサギの腸骨動脈モデルが最も頻繁に使用されている、ステント内修復(ISR)の基礎となる病態生理学的プロセスを解明するために使用されてきた。Ming モデルは、高スループット、取り扱いとハウジングの容易さ、再現性、および分子マーカーの幅広い可用性の利点を提供します。アポリポプロテインE欠損(apoE-/-) マウスモデルは、心血管疾患の研究に広く使用されています。しかし、ステントは、機械的および(潜在的に)生物学的特性の重要な変化を伴うマウスに移植されるように小型化する必要があります。apoE-/- ラットの使用は、アポエ-/- ラットとしてこれらの欠点を克服できると同時に、アテロゲン性表現型を提供しながら、ヒトサイズの冠状動脈ステントの評価を可能にする。これにより、ステント注入後のISRを調査するための優れた信頼性の高いモデルになります。ここでは、例えば、市販のヒト冠状動脈ステントをapoE-/- バックグラウンドを有するラットの腹部大動脈へのトランスポンテーションを、トランス・フェモラル・アクセスを用いて詳細に説明する。
概要
経皮的冠動脈介入(PCI)は、冠状動脈ステントの展開と相まって、冠動脈疾患1の介入治療におけるゴールドスタンダードを表す。しかし、ステントの長期的な成功は、ステント内の新内組織の過剰増殖によって決定されるステント内レステノーシス(ISR)の発生によって制限され得る2,3。ISRは、冠状動脈バイパスまたは再PCIのいずれかで再介入を必要とするかもしれない。ISRの研究には様々な動物モデルが提案されており、それぞれが長所と短絡を特徴とする。最も一般的に使用されるブタ冠動脈およびウサギの腸動脈モデルの主な欠点は、ステント移植後のヒトと著しく類似した病変を発症する4、5であり、特に長期的な研究における物流上の困難、ならびに取り扱いや機器の制限を引き起こす大きな動物および住宅コストである。さらに、豚やウサギの細胞タンパク質に対する抗体の入手は限られています。一方、マウスモデルは、高スループットと再現性の大きな利点だけでなく、取り扱い、ハウジング、したがってコスト効率の容易さを提供します。さらに、より多くの抗体が利用可能である。しかし、アポリポタンパク質E欠損(apoE-/--)マウスはアテローム性動脈硬化症6、7、8の研究に広く使用されてきたが、ステントをマウスに移植するために小型化しなければならないため、ISRの研究には不向きであり、ステントの機械的特性を変化させる可能性がある。さらに、マウスの大動脈壁は、若いマウスでは50μm、古いマウスでは85μmの間で測定され、ステントは2気圧の低い圧力レベルを使用して展開する必要があり、ステント10のマラッピングにつながる可能性がある。しかしながら、ラットは、市販のヒト冠状ステントの移植を可能にし、大動脈ステント移植後に大きな動物と同様の血管治癒過程を示す、最初にLangeveldららによって報告された。この技術はもともと、血流の一時的な中断を達成するために大動脈の物理的な収縮を必要とする経腹的なアクセスを必要としました。潜在的に関連する血管損傷および炎症反応を避けるために、この技術は後にトランス腸骨アクセスの導入によって洗練され、さらに動物12の生存率が高くなる。
野生型ラットはアテローム硬化性病変13を発症しないため、アポエ-/-ラットは、転写活性化因子様エフェクターヌクレアーゼ(TALEN)14などのヌクレアーゼ技術を用いて生成されており、クラスター化された定期的に間隔をあけた短いパリンドローム反復(CRISPR/Cas9)15、およびジンクフィンガー(ZF)16。ApoE-/-ラットは2011年から市販されている。アテローム原性の背景を提供するapoE-/-ラットは、特にISRに関して、ヒトサイズの冠状動脈ステントのより現実的な評価を可能にする。
ここで、我々は、経大的なアクセス経路を介して、市販の薄いストラットコバルトクロム薬物溶出ステント(DES)を用いた方法を記述するが、ベアメタルステント(BMS)または生分解性ステントのような他のステントタイプの研究にも適用することができる。
プロトコル
実験は、科学的目的のために使用される動物の保護に関するドイツの動物福祉法(TSchG)および指令2010/63/EUに従って行われました。この研究の公式承認は、政府動物のケアと使用委員会によって付与されました (プロトコル No.: AZ 87-51.04.2010.A065;ランデサムト・フュル・ナートゥール、ウムヴェルト・ウント・ヴェルブラウヒャーシュッツ・ノルドハイン=ヴェストファーレン、レックリングハウゼン、ドイツ)。研究プロトコルは、実験動物のケアと使用のためのガイドに準拠しています。術後疼痛治療は、ドイツ実験動物科学会(GV-SOLAS)とイニシアチブ獣医痛み治療の勧告に基づいています。
1. 基本的なテクニックと一般的な手順
- ホモ接合アポエを使用してください -/- スプレイグ・ドーリーラット。標準的な方法17を使用して、各動物の遺伝子型を特定する。
- 同じ条件(21°C±2°C、湿度5%±60%、明暗サイクル12時間)で動物を保管し、水と食べ物への自由なアクセスを確保してください。
- 清潔で無菌状態ですべての手順を実行します。
- ラットを麻酔したら、16倍の倍率で手術顕微鏡ですべての処置を行う。
- 圧縮止止めには綿棒を使用してください。授乳中のリンゲル溶液を浸したガーゼ綿棒(5cm x 5cm)は、鼠径部を湿潤に保つのに役立ちます。
- 廃棄物処理規則に従って、使用済み資材を処分する。
2. 手術前の準備
- 手術を開始する前に、動物用医薬品を準備してください。特に明記されていない限り、すべての溶液を室温に保ちます。
- 処置の30分前に 、0.03-0.05 mg/kgブプレノルフィンを皮下に投与する。
- ラットを腹腔内注射で麻酔薬を100mg/kg体重(BW)(S)ケタミンおよび8mg/kg BWキシラジンで麻酔します。
- 計量スケールを使用してラットの体重を評価します。
- ラットを加熱パッドに置き、医療テープを使用して上肢と下肢を固定します。大腿動脈と大動脈の間に直線を作るように、左後肢を完全に伸ばし、背骨に沿ってラットを配置する。これは大動脈分岐を通して気球取付けられたステントを進めるのを容易にする。
- 2 L/minの流量で97.5%酸素中1.5体積%イオブルランの吸入で麻酔を維持する。
注:ラットは挿管せずに自発的に呼吸することができます。 - 意識不明の間に目の損傷を防ぐために眼軟膏を適用します。
- ラットの鼠径部と下腹部の部分から毛皮を剃り、ポビドネ-ヨウ素溶液で対応する皮膚を殺菌する。
- 手術を開始する前に、尾端とデジタル間組織をつまんで麻酔の適切な深さを確認してください。
3. 手術
- 皮膚と下層筋膜を開くために、左鼠径部に〜0.5\u20121 cmの内側切開を行います。
- 脈動した左大腿動脈が同定されるまで、深部で鈍く解剖し、プローブする。
- 非常に細かい鉗子を使用して、周囲の結合組織を穏やかに除去することによって大腿動脈を準備する。大腿神経にも大腿静脈も、動脈の内側に害を与えないように注意してください。
- 大腿動脈の約1cmを準備します。慎重に容器の下に鉗子の先端を置き、そっと持ち上げます。
- 動脈の遠位部および近位部分の下の4-0シルク縫合糸の糸片および形態スリング。外科用クランプの枝の間の2つの糸のスリングの両端をクランプします。動脈を制御するために外科用クランプを使用してください。血流を一時的に中断するために、スリングを軽く伸ばして持ち上げます。
注:組織の損傷につながる可能性があり、長時間の止血帯を避けるために速く働きます。 - 鋭利なマイクロハサミを使用して、大腿動脈の真ん中で動脈切開術を行う。
- 動脈切開術を通してガイドワイヤーを導入します。近位糸スリングに達したら、外科用クランプを動かして糸の張力を解放し、ガイドワイヤーを腹部大動脈に向かってさらに進める。
注: 取り扱いが容易な場合は、ワイヤカッターを使用してガイドワイヤをカットします。 - ダイヤフラムと腎動脈の間にガイドワイヤーの近位端を置きます。
注:ガイドワイヤーを進みすぎると、大動脈や心臓の損傷のリスクがあります。少なくとも最初の数匹の動物のためにガイドワイヤーとステントの適切な位置を確保するために腹部を開くことをお勧めします。 - ガイドワイヤーを介して2.25mm x 8mm(最大2.5mm x 8 mm)の圧着とバルーンマウントされた冠状動脈ステントを大腿動脈に導入し、腹部大動脈に進めます。
- ステントを大動脈分岐のすぐ上に置き、腎動脈の下に置きます。インフレシリンジシステムを使用して、バルーンカテーテルを15sの12気圧に膨らませてステントを展開します。
- バルーンカテーテルを収縮させ、使用中のステントに対するメーカーの推奨に従って負圧を維持します。
- ステントを所定の位置に残したまま、膨張したカテーテルをゆっくりと引き出します。
- カテーテルを取り出す直前に、切開部の上の糸ループに緊張を作り出し、外科的クランプで血流を中断します。次にバルーンカテーテルを取り外し、容器を直接近位にリゲートします。
- 近位と遠位の糸を結んで大腿動脈を装い、動脈管内の十分な止血を確認する。副次動脈は、四肢へのさらなる灌流を保証する。
- 10-0非蘇性縫合糸を使用して、動脈の上の筋肉を閉じるだけでなく、皮膚切開。
4. ステント移植後の動物のケア
- 操作の直後に、ラットが温め空気(30\u201235 °C)と酸素供給を備えた特別な集中治療室のケージで60分間回復することを許可する。
- 完全に回復するまで、動物を注意深く見てください。その後、ラットを通常のケージに移動します。水と食べ物へのアドリビタムアクセスを提供します。
- 術後鎮痛を6-12時間ごとに0.03-0.05mg/kgブプレノルフィン.c(500μl NaCl)で6時間ごとに、臨床評価の下で合計72時間投与する。
- 植え付けられたステントの血栓症を避けるためにクロピドグレル(15mg/kg)と混合食品を持っています。
- 高コレステロール血症状態とプラーク形成を高めるために、生後6\u20128週に西洋の食事餌を開始し、安楽死まで続ける。必要であれば、正常なラットチャウを与えられた動物のコホートがコントロールとして機能することができる。
5. 組織の収集と処理
- 指定された時点で組織の排泄を開始する前に、IACUCガイドラインに従って動物を安楽死させる。観察期間の終わりに組織学的分析のためにステント大オルタを収穫する。
- 正中線の切開で腹部を開き、大間のステントセグメントと大間の隣接する非ステント部分を取り除き、それぞれ0.5cmを測定します。
- 組織を4%緩衝ホルマリンの溶液に入れ、24時間固定します。
- ステント動脈組織をプラスチックに埋め込み、標準プロトコル18、19に従って組織学的および免疫組織化学的染色を行う。
6. ヒストモルフォメトリック解析
- 適切な画像解析ソフトウェアを用いてコンピュータにリンクされた顕微鏡を用いて、ステント付大関係の近位、中間部、および遠位部分のヒストモルフォメトリクス解析を行う。
- 外部弾性薄層(EEL、アドベンチシアとメディアの間)、内部弾性薄層(IEL、メディアとネオインティマの間)、およびグラフィック描画タブレットを備えたルーメンの輪郭をトレースします。これらの値から、ソフトウェアで EEL 面積、IEL 領域、およびルーメン領域を計算します。
- ステント・レステノーシス (ISR) の断面積率を計算します。
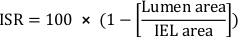
- 合計のネオインティマル領域を計算します (Ai):
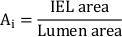
- 支柱と内腔の間の距離として、各ステントストラット上のネオインティマル厚さ(NIT)を測定します。ステント支柱間の NIT を IEL とルーメンの間の距離として測定します。
注: または、NIT を次のように計算します。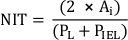
ここで、PL および PIEL はルーメンと内部弾性層周長、それぞれ20です。 - スタディの要件に従って、追加の解析を実行します。
結果
このプロトコルは、トランス大腿部アクセス経路を用いたラットの腹部大動脈におけるステント移植について説明する(図1)。この動物モデルの最初の中心点は、人間サイズの冠状動脈ステントの展開を可能にすることです。市販の圧着およびバルーン付着冠状動脈ステントは、ラットの腹部大動脈に配置することができる。したがって、加えて、ステント展開の原理は?...
ディスカッション
このプロトコルは、ヒトサイズの冠状動脈ステントをapoE-/- ラットの腹部大動脈に移植する方法を説明する。いくつかの技術的な点は強調する価値があります。まず、ステントサイズと大オータのサイズの不一致を避けるべきです。ステントを小さすぎると、ステントのマラプ位置につながる可能性がありますが、大間に大きすぎるステントの埋め込みは、血管の過度の伸縮、引裂、...
開示事項
著者らは開示するものは何もない。
謝辞
埋め込みとスライド制作に関する貴重な技術支援をしてくれたアンジェラ・フロイント夫人に感謝します。また、動物実験外科研究所のタデウシュ・ストインスキー氏の獣医の仕事に対する洞察力に満ちた支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
参考文献
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved