É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Implantação de stents coronários de tamanho humano na aorta abdominal de rato usando um acesso trans-femoral
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a implantação de stents coronários humanos na aorta abdominal de ratos com um apoE-/- fundo usando um acesso trans-femoral. Em comparação com outros modelos animais, os modelos murinos carregam as vantagens da alta produtividade, reprodutibilidade, facilidade de manuseio e habitação, e uma ampla disponibilidade de marcadores moleculares.
Resumo
A intervenção coronária percutânea (ICI), combinada com a implantação de um stent coronário, representa o padrão-ouro no tratamento intervencionista da doença arterial coronariana. A restenose in-stent (ISR) é determinada por uma proliferação excessiva do tecido neointimal dentro do stent e limita o sucesso a longo prazo dos stents. Uma variedade de modelos animais têm sido usados para elucidar processos fisiopatológicos subjacentes à restenose de stent (ISR), sendo o coronário suíno e os modelos de artéria ilíaca de coelho sendo os mais utilizados. Os modelos murinos oferecem as vantagens de alta produtividade, facilidade de manuseio e habitação, reprodutibilidade e ampla disponibilidade de marcadores moleculares. O modelo de camundongos deficientes apolipoprotein E (apoE-/- ) tem sido amplamente utilizado para estudar doenças cardiovasculares. No entanto, os stents devem ser miniaturizados para serem implantados em camundongos, envolvendo mudanças importantes de suas propriedades mecânicas e (potencialmente) biológicas. O uso de apoE-/- ratos podem superar essas deficiências como apoE-/- ratos permitem a avaliação de stents coronários de tamanho humano e, ao mesmo tempo, fornecendo um fenótipo aterogênico. Isso faz deles um modelo excelente e confiável para investigar isr após a implantação do stent. Aqui, descrevemos, em detalhes, a implantação de stents coronários humanos comercialmente disponíveis na aorta abdominal de ratos com um apoE-/- fundo usando um acesso trans-femoral.
Introdução
A intervenção coronária percutânea (ICI), combinada com a implantação de um stent coronário, representa o padrão-ouro no tratamento intervencionista da doença arterial coronariana1. O sucesso a longo prazo dos stents, no entanto, pode ser limitado pela ocorrência de restenose in-stent (ISR) que é determinada por uma proliferação excessiva de tecido neointimal dentro do stent2,3. O ISR pode exigir uma nova intervenção com bypass da artéria coronária ou re-PCI. Uma variedade de modelos animais foram sugeridos para o estudo do ISR, cada um deles apresentando vantagens e deficiências. As principais desvantagens dos modelos de artérias ilíacas suínos mais utilizados e coelhinhos, embora desenvolvendo lesões marcadamente semelhantes aos humanos após a implantação do stent4,5, são grandes custos de animais e habitação que trazem dificuldades logísticas especialmente em estudos de longo prazo, bem como limitações no manuseio e equipamentos. Além disso, a disponibilidade de anticorpos para proteínas celulares de suínos e coelhos é limitada. Por outro lado, os modelos murine proporcionam as principais vantagens do alto rendimento e reprodutibilidade, bem como a facilidade de manuseio, moradia e, portanto, custo-efetividade. Além disso, um maior número de anticorpos estão disponíveis. No entanto, enquanto os camundongos deficientes e-deficientes de apolipoproteína (apoE-/-) camundongos têm sido amplamente utilizados para o estudo da aterosclerose6,7,8, eles são inadequados para o estudo do ISR, pois os stents devem ser miniaturizados para serem implantados em camundongos, potencialmente mudando as propriedades mecânicas dos stents. Além disso, a parede aórtica de camundongos mede entre 50 μm em camundongos jovens e 85 μm em camundongos antigos9, e os stents devem ser implantados usando níveis de pressão tão baixos quanto 2 atm, o que pode levar à malapposição do stent10. Os ratos, no entanto, permitem a implantação de stents coronários humanos disponíveis comercialmente, e demonstram um curso de cura vascular semelhante a animais maiores após a implantação do stent aórtico, relatado pela primeira vez por Langeveld et al.11. Esta técnica originalmente exigia um acesso trans-abdominal, o que exigia uma constrição física da aorta para conseguir uma interrupção temporária do fluxo sanguíneo. Para evitar a lesão potencialmente associada do vaso e reações inflamatórias, a técnica foi posteriormente refinada pela introdução de um acesso transilílico, o que resultou, além disso, em uma maior taxa de sobrevivência dos animais12.
Como ratos de tipo selvagem não desenvolvem lesões ateroscleróticas13, apoE-/- ratos foram gerados usando técnicas de nuclease como Transcription Activator-Like Effector Nuclease (TALEN)14, Clustered Regularmente Interspaced Short Palindromic Repeats (CRISPR/Cas9)15, e Zinc Finger (ZF)16. ApoE-/- ratos estão disponíveis comercialmente desde 2011. Fornecendo um fundo atherogênico, os ratos apoEpermitem uma avaliação mais realista dos stents coronários do tamanho humano, especialmente no que diz respeito ao ISR.
Aqui, descrevemos o método através da rota de acesso transfemoral e usando um stent de eluição de drogas de cobalto-cromo (DES) comercialmente disponível, no entanto, também pode ser aplicado para o estudo de outros tipos de stent, como stents metálicos nus (BMS) ou stents biodegradáveis.
Protocolo
Os experimentos foram realizados de acordo com a Lei Alemã de Bem-Estar Animal (TSchG) e a Diretiva 2010/63/UE relativas à proteção de animais utilizados para fins científicos. A aprovação oficial deste estudo foi concedida pelo Comitê Governamental de Cuidados e Uso de Animais (Protocolo nº: AZ 87-51.04.2010.A065; Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, Recklinghausen, Alemanha). O protocolo de estudo cumpriu o Guia de Cuidado e Uso de Animais de Laboratório. O tratamento da dor pós-operatória baseia-se nas recomendações da Sociedade Alemã de Ciência Animal Laboratorial (GV-SOLAS), bem como da Terapia Veterinária da Dor.
1. Técnicas básicas e procedimentos comuns
- Use ratos homozigososapoE -/- Ratos Sprague-Dawley. Identificar o genótipo de cada animal usando os métodos padrão17.
- Mantenha os animais em condições idênticas (21 °C ± 2 °C, 60% ± 5% de umidade e um ciclo claro/escuro de 12 horas) e garanta o livre acesso à água e aos alimentos.
- Realizar todos os procedimentos em condições limpas, mas não estésteres.
- Uma vez que o rato é anestesiado, realize todos os procedimentos sob um microscópio cirúrgico em uma ampliação de 16x.
- Use cotonetes de algodão para hemostasia de compressão. Os cotonetes de gaze (5 cm x 5 cm) encharcados com solução de Ringer lactado são úteis para manter a virilha úmida.
- Siga as normas de descarte de resíduos para descartar materiais usados.
2. Preparações antes da cirurgia
- Prepare as drogas veterinárias antes de começar a operação. Mantenha todas as soluções em temperatura ambiente, a menos que seja indicado de outra forma.
- Trinta minutos antes do procedimento, administre 0,03-0,05 mg/kg buprenorfina subcutânea.
- Anestesiar o rato com uma injeção intraperitoneal de 100 mg/kg de peso corporal (BW) (S)-cetamina e 8 mg/kg de xilazina BW.
- Avalie o peso do rato usando uma balança de pesagem.
- Coloque o rato em uma almofada de aquecimento e fixe os membros superiores e inferiores usando fita médica. Posicione o rato com seu membro traseiro esquerdo totalmente estendido e o máximo possível de linha com sua coluna vertebral, de modo a criar uma linha reta entre artéria femoral e aorta. Isso facilitará o avanço do stent montado em balão através da bifurcação aórtica.
- Manter anestesia com inalação de 1,5 vol% de isoflurane em 97,5% de oxigênio a uma vazão de 2 L/min.
NOTA: Deixe o rato respirar espontaneamente, sem entubação. - Aplique pomada ocular para evitar danos oculares durante a inconsciência.
- Raspe a pele da virilha e da área inferior do abdômen do rato e esterilize a pele correspondente com uma solução povidone-iodo.
- Antes de iniciar a cirurgia, verifique a profundidade adequada da anestesia beliscando a ponta da cauda e o tecido interdigital.
3. Cirurgia
- Faça uma incisão medial de ~0,5\u20121 cm na virilha esquerda para abrir a pele e a fáscia subjacente.
- Dissecar e sondar sem rodeios nas profundezas até que a artéria femoral esquerda pulsante possa ser identificada.
- Usando fórceps muito finos, prepare a artéria femoral removendo suavemente o tecido conjuntivo circundante. Tenha cuidado para danificar nem o nervo femoral nem a veia femoral, que é medial para a artéria.
- Prepare cerca de 1 cm da artéria femoral. Coloque cuidadosamente a ponta dos fórceps sob o vaso para levantá-la suavemente.
- Roscas de sutura de seda 4-0 sob as partes distal e proximal da artéria e formam slings. Aperte as extremidades de cada um dos dois estilado entre os ramos de um grampo cirúrgico. Use os grampos cirúrgicos para controlar a artéria. Estique suavemente e levante os estilados para interromper temporariamente o fluxo sanguíneo.
NOTA: Trabalhe rápido para evitar um torniquete prolongado que possa levar a danos teciduais. - Usando micro tesoura afiada, realize uma arteriotomia no meio da artéria femoral.
- Introduza um fio guia através da arteriotomia. Ao atingir o sling do fio proximal, solte a tensão da rosca movendo o grampo cirúrgico e avance o fio-guia mais para a aorta abdominal.
NOTA: Corte o fio guia usando um cortador de arame para facilitar o manuseio. - Coloque a extremidade proximal do fio guia entre o diafragma e as artérias renais.
NOTA: O avanço do fio-guia é muito longe, traz o risco de lesão aórtica ou cardíaca. Recomendamos abrir o abdômen para garantir o posicionamento adequado do fio guia e do stent pelo menos para os primeiros vários animais. - Introduza um stent coronário crimped e montado em balão medindo 2,25 mm x 8 mm (máx. 2,5 mm x 8 mm) sobre o fio guia na artéria femoral e avance-o para a aorta abdominal.
- Coloque o stent logo acima da bifurcação aórtica, mas abaixo das artérias renais. Implante o stent inflando o cateter de balão para 12 atm por 15 s usando um sistema de seringa inflacionária.
- Esvazie o cateter de balão e mantenha pressão negativa de acordo com as recomendações do fabricante para o stent em uso.
- Retire lentamente o cateter deflacionado enquanto deixa o stent no lugar.
- Pouco antes de retirar o cateter, crie tensão na alça da rosca acima da incisão com o grampo cirúrgico para interromper novamente o fluxo sanguíneo. Em seguida, remova o cateter do balão e liga diretamente o vaso proximally.
- Amarre os laços proximais e os fios distais para ligar a artéria femoral e confirmar hemostasia adequada da arteriotomia. As artérias colaterais garantirão mais perfusão ao membro.
- Feche o músculo sobrepondo a artéria, bem como a incisão da pele usando suturas não resorbáveis de 10-0.
4. Cuidados com animais após implantação de stent
- Imediatamente após a operação, permita que o rato se recupere por 60 minutos em uma gaiola de unidade de terapia intensiva especial com ar aquecido (30\u201235 °C) e um suprimento de oxigênio.
- Observe os animais cuidadosamente até que esteja totalmente recuperado. Depois, mova os ratos para uma gaiola normal. Fornecer acesso a ad libitum à água e à comida.
- Administrar a analgesia pós-operatória a cada 6-12 horas com 0,03-0,05 mg/kg buprenorfina (s.c., em 500μl NaCl) para um total de 72 horas sob avaliação clínica.
- Tenha o alimento misturado com clopidogrel (15 mg/kg) para evitar trombose do stent implantado.
- Para melhorar as condições hipercolesterolômicas e a formação de placas, inicie a alimentação dietética ocidental em 6\u20128 semanas após o nascimento e continue até a eutanásia. Se desejar, uma coorte de animais alimentados com comida normal de ratos pode servir de controle.
5. Coleta e processamento de tecidos
- Antes de iniciar a explantação do tecido no ponto de tempo designado, eutanize o animal de acordo com as diretrizes da IACUC. Colher a aorta stented para análise histológica no final do período de observação.
- Abra o abdômen por uma incisão midline e remova o segmento stent da aorta, bem como partes não-stentadas adjacentes da aorta, medindo 0,5 cm cada.
- Coloque o tecido em uma solução de formalina tamponada de 4% por 24 horas para fixação.
- Incorporar o tecido arterial stent em plástico e realizar coloração histológica e imunohistoquímica de acordo com os protocolos padrão18,19.
6. Análise histomorfométrica
- Realize a análise histomorfométrica de seções sequenciais da parte proximal, média e distal da aorta stented por meio de um microscópio ligado a um computador com um software de análise de imagem apropriado.
- Traçar os contornos da lâmina elástica externa (EEL, entre adventitia e mídia), lamina elástica interna (IEL, entre mídia e neointima), e lúmen com um tablet gráfico de desenho. A partir desses valores, calcule a área de EEL, área de IEL e área de lúmen com o software.
- Calcular a porcentagem de reenose de área transversal no stent (ISR):
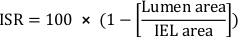
- Calcular a área neointimal total (Ai):
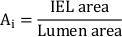
- Meça a espessura neointimal (NIT) sobre cada suporte de stent como a distância entre strut e lúmen. Meça o NIT entre os suportes de stent como a distância entre IEL e lúmen.
NOTA: Alternativamente, calcule o NIT como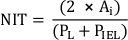
onde PL e PIEL são o lúmen e perímetro interno elástico de lamina,respectivamente 20. - Realizar análises adicionais de acordo com os requisitos do estudo.
Resultados
Este protocolo descreve a implantação de stent na aorta abdominal de ratos utilizando uma rota de acesso trans-femoral(Figura 1). O primeiro ponto central deste modelo animal é que ele permite a implantação de stents coronários de tamanho humano. Um stent coronário comercialmente disponível e montado em balão pode ser colocado na aorta abdominal de ratos. Assim, além disso, o mesmo princípio de implantação de stent como em humanos pode ser aplicado. Outra vantagem do uso de rato...
Discussão
Este protocolo descreve a implantação de stents coronários de tamanho humano na aorta abdominal de apoE-/- ratos. Vários pontos técnicos merecem ser enfatizados. Primeiro, deve ser evitada uma incompatibilidade entre o tamanho do stent e o tamanho da aorta. Colocar um stent muito pequeno pode levar à malapa do stent, enquanto a implantação de um stent muito grande para a aorta pode causar excesso de alongamento, rasgos e ferimentos do vaso. Por isso, recomendamos o uso de stents entre 2,0 e 2,5 mm de d...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer à Sra. Angela Freund por sua inestimável assistência técnica com a incorporação e produção de slides. Também gostaríamos de agradecer ao Sr. Tadeusz Stopinski no Instituto de Ciência Animal & Cirurgia Experimental do Instituto de Ciência Animal & Experimental por sua ajuda perspicaz com o trabalho veterinário.
Materiais
| Name | Company | Catalog Number | Comments |
| Diet | |||
| SNIFF High Fat diet + Clopidogrel (15 mg/kg) | SNIFF Spezialdiäten GmbH, Soest | custom prepared | Western Diet |
| Drugs and Anesthetics | |||
| Buprenorphine | Essex Pharma | 997.00.00 | |
| ISOFLO (Isoflurane Vapor) vaporiser | Eickemeyer | 4802885 | |
| Isoflurane | Forene Abbott | B 506 | |
| Isotonic (0.9%) NaCl solution | DeltaSelect GmbH | PZN 00765145 | |
| Ringer's lactate solution | Baxter Deutschland GmbH | 3775380 | |
| (S)-ketamine | CEVA Germany | ||
| Xylazine | Medistar Germany | ||
| Consumable supplies | |||
| 10 mL syringes | BD Plastipak | 4606108V | |
| 2 mL syringes | BD Plastipak | 4606027V | |
| 6-0 prolene suture | ETHICON | N-2719K | |
| 4-0 silk suture | Seraflex | IC 158000 | |
| Bepanthen Eye and Nose Ointment | Bayer Vital GmbH | 6029009.00.00 | |
| Cotton Gauze swabs | Fuhrmann GmbH | 32014 | |
| Durapore silk tape | 3M | 1538-1 | |
| Poly-Alcohol Skin Desinfection Solution | Antiseptica GmbH | 72PAH200 | |
| Sterican needle 18 G | B. Braun | 304622 | |
| Sterican needle 27 3/4 G | B.Braun | 4657705 | |
| Tissue Paper | commercially available | ||
| Surgical instruments | |||
| Graefe forceps curved x1 | Fine Science Tools Inc. | 11151-10 | |
| Graefe forceps straight | Fine Science Tools Inc. | 11050-10 | |
| Needle holder Mathieu | Fine Science Tools Inc. | 12010-14 | |
| Scissors | Fine Science Tools Inc. | 14074-11 | |
| Semken forceps | Fine Science Tools Inc. | 11008-13 | |
| Small surgical scissors curved | Fine Science Tools Inc. | 14029-10 | |
| Small surgical scissors straight | Fine Science Tools Inc. | 14028-10 | |
| Standard pattern forceps | Fine Science Tools Inc. | 11000-12 | |
| Vannas spring scissors | Fine Science Tools Inc. | 15000-08 | |
| Equipment | |||
| Dissecting microscope | Leica MZ9 | ||
| Temperature controlled heating pad | Sygonix | 26857617 | |
| Equipment for stent implantation | |||
| Drug-eluting stent Xience 2,25mm x 8mm | Abbott Vascular USA | 1009544-18 | |
| Guide wire Fielder XT PTCA guide wire: 0.014" x 300cm | ASAHI INTECC CO., LTD Japan | AGP140302 | |
| Inflation syringe system | Abbott 20/30 Priority Pack | 1000186 | |
| Tissue processing and analysis | |||
| 30% H2O2 | Roth | 9681 | Histology |
| Ethanol | Roth | K928.1 | Histology |
| Giemsas Azur-Eosin-Methylenblau | Merck | 109204 | Histology |
| Graphic Drawing Tablet | WACOM Europe GmbH | CTL-6100WLK-S | |
| Roti Histofix, Formaldehyd 4% buffered | Roth | P087 | Histology |
| Technovit 9100 | Morphisto | 12225.K1000 | Histology |
Referências
- Patel, M. R., et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for Thoracic Surgery, American Heart Association, American Society of Echocardiography, American Society of Nuclear Cardiology, Society for Cardiovasular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society of Thoracic Surgeons. Journal of the American College of Cardiology. 69 (17), 2212-2241 (2017).
- Virmani, R., Farb, A. Pathology of in-stent restenosis. Current Opinion in Lipidology. 10 (6), 499-506 (1999).
- Buccheri, D., Piraino, D., Andolina, G., Cortese, B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. Journal of Thoracic Disease. 8 (10), 1150-1162 (2016).
- Perkins, L. E. Preclinical models of restenosis and their application in the evaluation of drug-eluting stent systems. Veterinary Pathology. 47 (1), 58-76 (2010).
- Kim, W. H., et al. Histopathologic analysis of in-stent neointimal regression in a porcine coronary model. Coronary Artery Disease. 11 (3), 273-277 (2000).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Breslow, J. L. Transgenic mouse models of lipoprotein metabolism and atherosclerosis. Proceedings of the National Academy of Sciences of the United States of America. 90 (18), 8314-8318 (1993).
- Knowles, J. W., Maeda, N. Genetic modifiers of atherosclerosis in mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (11), 2336-2345 (2000).
- Wheeler, J. B., Mukherjee, R., Stroud, R. E., Jones, J. A., Ikonomidis, J. S. Relation of murine thoracic aortic structural and cellular changes with aging to passive and active mechanical properties. Journal of the American Heart Association. 4 (3), 001744 (2015).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Langeveld, B., et al. Rat abdominal aorta stenting: a new and reliable small animal model for in-stent restenosis. Journal of Vascular Research. 41 (5), 377-386 (2004).
- Oyamada, S., et al. Trans-iliac rat aorta stenting: a novel high throughput preclinical stent model for restenosis and thrombosis. Journal of Surgical Research. 166 (1), 9 (2011).
- Touchard, A. G., Schwartz, R. S. Preclinical restenosis models: challenges and successes. Toxicologic Pathology. 34 (1), 11-18 (2006).
- Wei, S., et al. Apolipoprotein E-deficient rats develop atherosclerotic plaques in partially ligated carotid arteries. Atherosclerosis. 243 (2), 589-592 (2015).
- Zhao, Y., et al. Hyperlipidemia induces typical atherosclerosis development in Ldlr and Apoe deficient rats. Atherosclerosis. 271, 26-35 (2018).
- Ekuni, D., et al. Occlusal disharmony accelerates the initiation of atherosclerosis in apoE knockout rats. Lipids in Health and Disease. 13 (144), 13 (2014).
- Bhattacharya, D., Van Meir, E. G. A simple genotyping method to detect small CRISPR-Cas9 induced indels by agarose gel electrophoresis. Scientific Reports. 9 (1), 39950 (2019).
- Malik, N., et al. Intravascular stents: a new technique for tissue processing for histology, immunohistochemistry, and transmission electron microscopy. Heart. 80 (5), 509-516 (1998).
- Kumar, A. H., McCauley, S. D., Hynes, B. G., O'Dea, J., Caplice, N. M. Improved protocol for processing stented porcine coronary arteries for immunostaining. Journal of Molecular Histology. 42 (2), 187-193 (2011).
- Jiang, Z., et al. A novel vein graft model: adaptation to differential flow environments. American Journal of Physiology - Heart and Circulatory Physiology. 286 (1), 18 (2004).
- Cornelissen, A., et al. Apolipoprotein E deficient rats generated via zinc-finger nucleases exhibit pronounced in-stent restenosis. Scientific Reports. 9 (1), 54541 (2019).
- Ritskes-Hoitinga, M. G. T., Jensen, T. L., Mikkelsen, L. F. . The Laboratory Mouse (Second Edition). , 567-599 (2012).
- Rune, I., et al. Long-term Western diet fed apolipoprotein E-deficient rats exhibit only modest early atherosclerotic characteristics. Scientific Reports. 8 (1), 23835 (2018).
- Daemen, J., et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 369 (9562), 667-678 (2007).
- Cornelissen, A., Vogt, F. J. The effects of stenting on coronary endothelium from a molecular biological view: Time for improvement. Journal of Cellular and Molecular Medicine. 23 (1), 39-46 (2019).
- Mori, H., et al. Pathological mechanisms of left main stent failure. International Journal of Cardiology. 263, 9-16 (2018).
- Wolinsky, H., Glagov, S. Comparison of abdominal and thoracic aortic medial structure in mammals. Deviation of man from the usual pattern. Circulation Research. 25 (6), 677-686 (1969).
- Lowe, H. C., James, B., Khachigian, L. M. A novel model of in-stent restenosis: rat aortic stenting. Heart. 91 (3), 393-395 (2005).
- Unthank, J. L., Nixon, J. C., Lash, J. M. Early adaptations in collateral and microvascular resistances after ligation of the rat femoral artery. Journal of Applied Physiology. 79 (1), 73-82 (1985).
- Nevzati, E., et al. Biodegradable Magnesium Stent Treatment of Saccular Aneurysms in a Rat Model - Introduction of the Surgical Technique. Journal of Visualized Experiments. (128), e56359 (2017).
- Aquarius, R., Smits, D., Gounis, M. J., Leenders, W. P. J., de Vries, J. Flow diverter implantation in a rat model of sidewall aneurysm: a feasibility study. Journal of NeuroInterventional Surgery. 10 (1), 88-92 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados