A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול מקיף בעל יעילות גבוהה לבידוד, תרבית, קיטוב ואפיון גליקוליטי של מקרופאגים שמקורם במח העצם
In This Article
Summary
פרוטוקול זה מספק שיטות מפורטות ומקיפות לבידוד, תרבית, קיטוב ומדידה של המצב המטבולי הגליקוליטי של מקרופאגים חיים שמקורם במח עצם (BMDMs). מאמר זה מספק הוראות שלב אחר שלב עם איורים חזותיים מציאותיים לזרימת עבודה והערכה גליקוליטית של BMDM בזמן אמת.
Abstract
מקרופאגים הם בין התאים החשובים ביותר המציגים אנטיגן. תת-קבוצות רבות של מקרופאגים זוהו עם חתימות מטבוליות ייחודיות. מקרופאגים מסווגים בדרך כלל כתת-סוגים דמויי M1 (דלקתיים) ודמויי M2 (אנטי דלקתיים). מקרופאגים דמויי M1 הם מקרופאגים פרו-דלקתיים המופעלים על ידי LPS ו/או ציטוקינים פרו-דלקתיים כגון INF-γ, IL-12 ו-IL-2. מקרופאגים מקוטבים דמויי M1 מעורבים במחלות שונות על ידי תיווך ההגנה של המארח למגוון חיידקים ווירוסים. זה חשוב מאוד לחקור מקרופאגים דמויי M1 המושרים על ידי LPS ומצבם המטבולי במחלות דלקתיות. מקרופאגים דמויי M2 נחשבים למקרופאגים אנטי דלקתיים, המופעלים על ידי ציטוקינים וממריצים אנטי דלקתיים. במצב פרו-דלקתי, מקרופאגים מראים גליקוליזה מוגברת בתפקוד הגליקוליטי. התפקוד הגליקוליטי נחקר באופן פעיל בהקשר של גליקוליזה, יכולת גליקוליטית, רזרבה גליקוליטית, גליקוליזה מפצה או החמצה לא גליקוליטית באמצעות מנתחי שטף חוץ-תאי (XF).
מאמר זה מדגים כיצד להעריך את המצבים הגליקוליטיים בזמן אמת באמצעות שלבים קלים לביצוע כאשר המקרופאגים שמקורם במח העצם (BMDM) נושמים, צורכים ומייצרים אנרגיה. באמצעות מעכבים ומפעילים ספציפיים של גליקוליזה בפרוטוקול זה, אנו מראים כיצד להשיג תצוגה מערכתית ומלאה של תהליכים מטבוליים גליקוליטיים בתאים ולספק תוצאות מדויקות ומציאותיות יותר. כדי להיות מסוגלים למדוד פנוטיפים גליקוליטיים מרובים, אנו מספקים שיטת נורמליזציה קלה, רגישה ומבוססת DNA להערכת קיטוב של BMDM. תרבית, הפעלה/קיטוב וזיהוי הפנוטיפ והמצב המטבולי של BMDM הן טכניקות חיוניות שיכולות לעזור לחקור סוגים רבים ושונים של מחלות.
במאמר זה, קיטבנו את המקרופאגים הנאיביים M0 למקרופאגים דמויי M1 ו-M2 עם LPS ו-IL4, בהתאמה, ומדדנו מערך מקיף של פרמטרים גליקוליטיים ב-BMDM בזמן אמת ולאורך זמן, באמצעות ניתוח שטף חוץ-תאי ומפעילים ומעכבים גליקוליטיים.
Introduction
מקרופאגים הם אחד התאים הקריטיים ביותר של מערכת החיסון המולדת דמוי M1. הם מעורבים בניקוי מחלות זיהומיות, פגוציטוזיס, הצגת אנטיגן וויסות דלקת2. יתר על כן, מקרופאגים נדרשים לווסת תאים חיסוניים אחרים באמצעות ציטוקינים שונים שהם משחררים3. יש ספקטרום גדול בפנוטיפים של מקרופאגים4. בהתאם לאותות שאליהם נחשפים המקרופאגים, הם מקוטבים לעבר מצבים דלקתיים ומטבוליים שונים5. מקרופאגים מבטאים שינויים מטבוליים במחלות שונות, תלוי באיזו רקמה שוכנים המקרופאגים6. למקרופאגים מקוטבים יש את היכולת לתכנת מחדש או להחליף את חילוף החומרים הגליקוליטי, חילוף החומרים של השומנים, חילוף החומרים של חומצות האמינו והזרחון החמצוני המיטוכונדריאלי (OXPHOS)7,8. מקרופאגים דמויי M1 המופעלים באופן קלאסי ומקרופאגים דמויי M2 המופעלים לחלופין הם שני הפנוטיפים הנחקרים ביותר של מקרופאגים3. מקרופאגים שקטים שאינם מופעלים מכונים מקרופאגים M0. קיטוב של מקרופאגים M0 לעבר פנוטיפ דמוי M1 יכול להיגרם על ידי גירוי של BMDMs נאיביים עם ליפופוליסכריד חיידקי (LPS)9. ניתן להפעיל את מסלול האיתות PI3K-AKT-mTOR-HIF1a במקרופאגים בנוכחות ציטוקינים דלקתיים, אינטרפרון-גמא (IFN γ) או גורם נמק גידול (TNF)10. מקרופאגים דמויי M1 הגדילו את רמות חילוף החומרים של גליקוליזה, ירידה ברמות הזרחון החמצוני (OXPHOS), ומייצרים ציטוקינים דלקתיים המעורבים במחלות זיהומיות ודלקתיות8. מצד שני, קיטוב כלפי הפנוטיפ דמוי M2 יכול להיגרם על ידי אינטרלוקין (IL)-4, דרך מסלולי JAK-STAT, PPAR ו-AMPK, או על ידי נתיבי (IL)-13 ו-TGFβ11,12.
בניגוד למקרופאגים דמויי M1, מקרופאגים דמויי M2 הפחיתו את הגליקוליזה והגדילו את OXPHOS ומעורבים בפעילויות אנטי-טפיליות ותיקון רקמות 8,13. BMDMs הם מערכת בשימוש נרחב לחקר מקרופאגים שמקורם בתאי גזע של מח עצם. גליקוליזה ו-OXPHOS הם שני מסלולי ייצור האנרגיה המובילים בתאים14. בהתבסס על המיקרו-סביבה שלהם, BMDM יכולים לבחור להשתמש בכל אחד מהמסלולים הללו; במקרים מסוימים, עבור מאחד לשני, או השתמש בשני המסלולים14. במחקר זה, התמקדנו במטבוליזם של גליקוליזה במקרופאגים פרו-דלקתיים פעילים. כאשר הגלוקוז בציטופלזמה מומר לפירובט ולאחר מכן לקטט, התאים מייצרים פרוטונים בתווך הגורמים לעלייה בקצב ההחמצה בתווך המוקף של תאים דמויי M15. מנתח שטף חוץ-תאי שימש למדידת קצב ההחמצה של המדיה התאית. התוצאות מדווחות כקצב החמצה חוץ-תאית (ECAR) או כקצב פליטת פרוטונים.
שיטה אופטימלית, מהירה וקלה לגישה לרמות גליקוליזה במקרופאגים מקוטבים חיונית לקביעת הפנוטיפ הגליקוליטי, שינויים במטבוליטים וההשפעות של מעכבים/מפעילים ותרופות על המקרופאגים המקוטבים. השיטה המתוארת בכתב יד זה עברה אופטימיזציה כדי לתת מידע על גורמי גליקוליזה ספציפיים (גליקוליזה, קיבולת גליקוליטית, רזרבה גליקוליטית והחמצה לא גליקוליטית), כמו גם תכנות מחדש מטבולי של מטבוליזם גליקוליטי. המעכב (2DG) ששימש במחקר זה מכוון במפורש למסלול הגליקוליזה.
פרוטוקול אופטימלי זה שונה ושופר על סמך השילוב של פרוטוקול16 שפורסם, ניתוח שטף חוץ-תאי של מבחנים גליקוליטיים של מדריכי המשתמש של היצרן, ותקשורת ישירה עם מדעני המו"פ של היצרן.
Protocol
עכברים הוקרבו באופן אנושי על פי הנחיות הערכה והסמכה של טיפול בחיות מעבדה (AAALAC) והאגודה האמריקאית למדעי חיות מעבדה (AALAS) ותוך שימוש בפרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת טקסס A&M (IACUC).
1. קצירת מח עצם של עכברים ותרבית BMDM
- עכבר מקריב (6-10 שבועות בגיל C57Bl/6 עכברים היו בפרוטוקול זה) והניח אותו על צד הגחון שלו, חתך את העור ושכבת הצפק וקילף בעדינות את הרגליים.
הערה: השתמש בחשיפה לגז CO2 כדי להמית את העכבר. - הפרד את שתי הרגליים האחוריות מהמותן כלפי מטה, היזהר לא לחתוך את העצם.
- הנח את כל הרגל בצינור חרוטי ריק של 50 מ"ל (כשהרגליים פונות כלפי מעלה כדי שתהיה אחיזה קלה לשליפה מאוחר יותר) על קרח והמשך בקצירת שתי הרגליים מהעכבר.
2. חשיפה לעצם הירך
הערה: בצע את השלבים הבאים בארון בטיחות ביולוגית.
- קצרו את עצם הירך על ידי ניתוק השוקה מכל רגל והסירו כמה שיותר רקמות המקיפות את עצם הירך בעזרת מספריים ונייר מעבדה.
- מניחים את עצם הירך שנקטפה ו"מנוקה" בצלחת בגודל 10 ס"מ המכילה פיסת נייר מעבדה רוויה במדיום תרבית רקמות (TC) או PBS. הניחו אותם על קרח.
- המשיכו לקצור את עצם הירך ולהסיר רקמות מכל עצם הירך לפני שתמשיכו לשלב ההדחה (איור 1A).
3. שטיפה של מח העצם
- כדי לשטוף מח עצם הירך, השתמש במזרק של 3 מ"ל מלא במדיום TC או PBS עם מחט 23G. מלאו את המזרק לפני חשיפת המח.
- השתמש במספריים כדי לחשוף את המח על ידי חיתוך קצה עצם הירך בשתי האפיפיזות.
- הכנס את קצה המחט לעצם הירך ושטוף בעדינות את המח החוצה לכלי בגודל 10 ס"מ.
- העבירו את המחט לכל אורך עצם הירך, ושטפו עד שצבע העצם הופך ללבן. בדרך כלל, ניתן לשטוף את רוב מח העצם עם 2-3 מ"ל של מדיה.
- שטפו את כל עצם הירך ומח העצם הבריכה בצלחת. השתמש במחט כדי לפרק גושים גלויים. מסננים מח לתוך צינור חרוטי של 50 מ"ל (איור 1A).
4. ליזיס RBC
- סובב מח ב -190 x גרם למשך 10 דקות. שאפו את הסופרנטנט.
- השעו מחדש את הגלולה ב-4 מ"ל של מאגר ליזה ACK בעזרת פיפטה. אפשר למאגר הליזה של RBC לעבוד במשך 5 דקות בטמפרטורת החדר.
- הוסף 4 מ"ל של TC בינוני RPMI-C 10% (RPMI 1640 -GlutaMAX) בתוספת 2-מרקפטואתנול, גנטמיצין, סטרפטומיצין ו-10% FCS לתרחיף המח וסובב ב-1300 x גרם למשך 10 דקות.
- מסננים שוב כדי להסיר פסולת RBC ולהשעות מחדש בנפח קטן של RPMI-C 10% לספירה.
- ספרו תאים עם מונה תאים (איור 1B). מונה Vi-Cell שימש לקביעת הספירה והכדאיות של תאים בתרחיף.
5. ציפוי ותרבות
- הוסף 10 מ"ל של RPMI-C 10% + 10 ננוגרם/מ"ל M-CSF (גורם מגרה של מושבת מקרופאגים, מווסת חיוני של התפשטות, התמיינות והישרדות) ללוחות של 10 ס"מ לפי הצורך.
- הוסף נפח מתאים של תאים שנספרו כך שכל צלחת בגודל 10 ס"מ תכיל 1 x 106 תאים. הכניסו את הצלחות לאינקובטור של 37 מעלות צלזיוס (מוגדר כיום 0).
- ביום השלישי, הוסיפו בעדינות 5 מ"ל של RPMI-C טרי 10% + 10 ננוגרם/מ"ל M-CSF לכל צלחת.
הערה: ביום השביעי, BMDM צריכים להיות מוכנים לבדיקה (איור 1C).
6. קציר מצלחות
- השתמש במיקרוסקופ אור כדי לאשר שרוב התאים נדבקו לצלחות.
- שאפו בעדינות מדיה. לאחר מכן מוסיפים 3 מ"ל PBS ומערבבים בעדינות את הצלחת. שאפו היטב את זה כדי להסיר את כל התאים שנותרו שאינם נדבקים.
- הוסף לצלחת 7-10 מ"ל PBS קר, השתמש בפיפטה P1000 כדי לשטוף את תחתית הצלחות, וקצור את כל התאים הנותרים לצינור איסוף.
הערה: שמור את הצינורות על קרח מכיוון שהמקרופאגים נדבקים היטב וייצמדו לחלק הפנימי של הצינור. אם התאים יישארו קרים, הם יהיו פחות צמודים. - צנטריפוגה, ספירה ותאי צלחת עבור ניסויים (איור 1D). באמצעות ציטומטריית זרימה, התאים המתקבלים צריכים להיות חיוביים ב->95% עבור CD11b ו-F4/80. (קיטוב המקרופאגים נקבע על ידי צביעה עם סמנים דמויי M1 של CD38, TNF-a ו-MCP-1 וסמן דמוי M2 של CD206.
הערה: בצע את שלבים 6.1-6.3 בארון הבטיחות הביולוגית ובצע את שלב 6.4 על הספסל. שמור על טכניקות אספטיות לאורך כל ההליך.
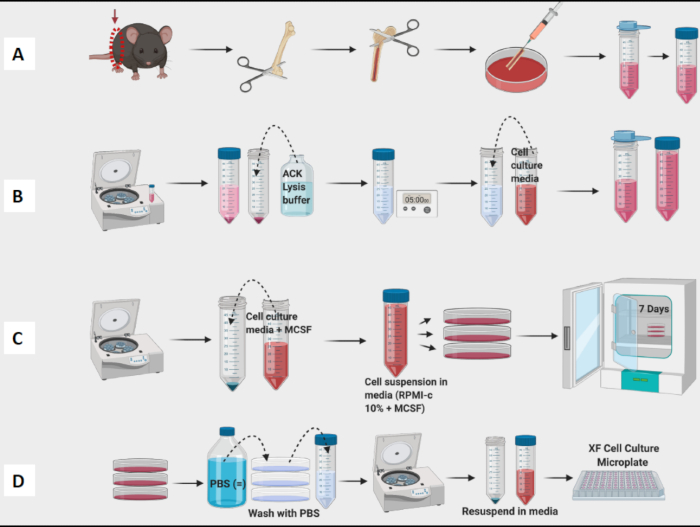
איור 1: זרימת עבודה גרפית של תרבית מח עצם של עכבר של מקרופאגים שמקורם ב-BM. (A) קציר רגליים, חשיפה לעצם הירך ושטיפה של מח העצם; (ב) RBC Lysis; (ג) ציפוי ותרבות; (D) קציר תאים מהצלחות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
7. יום לפני בדיקת מנתח השטף המטבולי: זריעה וקיטוב של התאים לבדיקה הגליקוליטית
- לחמם את מנתח השטף המטבולי ל-37 מעלות צלזיוס על ידי הפעלת המכשיר.
- לחות מחסנית על ידי הוספת 200 מיקרוליטר של תמיסת קליברנט ודגירה של המחסנית באינקובטור שאינו CO2 למשך הלילה (איור 2A). הלחות של חממה שאינה CO2 אינה חשובה ללחות המחסניות.
- שעה לפני הניסוי טובלים את הצלחת כמה פעמים למעלה ולמטה, מה שיעזור להסיר בועות אוויר.
- תכנן את מפת הלוחות בתוכנה בברירת המחדל של בדיקת מאמץ גליקוליזה-הזרקה חריפה, על ידי ביצוע הוראות הבדיקה.
- לחץ על סמל התוכנה ולאחר מכן לחץ על בדיקת הזרקה אקוטית של גליקוליזה. בסמל הגדרת הקבוצה, צור שמות קבוצות.
- ישנם חמישה מחזורי מדידה באורך של 18 דקות וארבע זריקות. שנה את ההזרקה של יציאה A לגלוקוז, יציאה B לאוליגומיצין, יציאה C לרוטנון ואנטימיצין A (Rot/AA), ויציאה D ל-2DG.
- השעו מחדש את התאים ב-RPMI-C 10% בינוני וזרע 50k תאים לבאר למעט ארבעת קצוות הצלחת (A1, A12, H1 ו-H12; הוסף מדיה בלבד, ללא תאים) במיקרו-צלחת מנתח שטף מטבולי לנפח סופי של 100 מיקרוליטר. בדרך כלל נדרש מינימום של 40 אלף תאים כדי לבצע בדיקה זו.
- אפשר לתאים לשבת בטמפרטורת החדר למשך 45 דקות כדי למנוע את אפקט הקצה של התאים. אפקט הקצה הוא כאשר המדיום סביב היקף הצלחת מתאדה חלקית, מה שגורם לשינויים בנפח ובריכוז ומפחית את כדאיות התא.
- הוסף 10 ננוגרם/מ"ל LPS כדי לקטב את המקרופאגים הנאיביים לכיוון תאים דמויי M1 והוסף 20 ננוגרם/מ"ל של IL-4 כדי לקטב אותם לכיוון תאים דמויי M2. השתמש לפחות ב-3 עד 6 בארות לכל מצב (איור 2B).
- בדוק את התאים מתחת למיקרוסקופ והנח את הצלחת באינקובטור בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך 24 שעות.
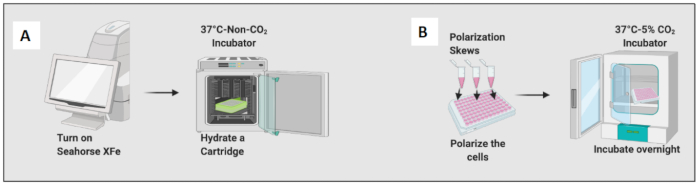
איור 2: הדגמה גרפית של זריעה וקיטוב של התאים. (א) הגדרת מנתח שטף חוץ-תאי והידרציה של מחסנית; (B) קיטוב של התאים ודגירה למשך הלילה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
8. יום הבדיקה: הכנה בינונית ומורכבת XF
- משלים 100 מ"ל של מדיום בדיקה XF RPMI (pH 7.4) עם 2 מ"מ גלוטמין.
- עקר את המדיה באמצעות מערכת מסנן ואקום של 0.2 מיקרומטר.
- הנח את אמצעי הבדיקה באמבט מים של 37 מעלות צלזיוס למשך 20 דקות.
- הסר את התאים המצופים מהחממה של 37 מעלות צלזיוס, 5% CO2 . שטפו את התאים באמצעי בדיקה פעמיים והחליפו את המדיה הקודמת באמצעי בדיקה לנפח הסופי של 180 מיקרוליטר.
- השתמש במיקרוסקופ כדי לוודא שלכל הבארות יש תאים קונפלואנטים ולסמן בארות שיש בהן שריטות כלשהן מפיפטינג. אם יש שריטות, הסר את הצלחת לפני הניתוח.
- מקם את הצלחת המכילה תאים בחממה שאינה CO2 למשך 45 דקות (איור 3A).
- שימוש בתרכובות ובאמצעי הבדיקה לייצור תמיסות מלאי של גלוקוז (100 מ"מ), אוליגומיצין (100 מיקרומטר), ריקבון/AA (50 מיקרומטר) ו-2DG (500 מ"מ) (טבלה 1).
- הכינו תערובת הזרקה פי 10 של כל תרכובת באמצעות מדיית בדיקה (טבלה 2).
| מלאי הזרקה (מסופק בערכות) | הוסף מדיית בדיקה מלאה (מ"ל) | ריכוז מלאי סופי (μM) |
| גלוקוז | 3 | 100 ק"מ |
| אוליגומיצין | 0.72 | 100 |
| 2-DG | 3 | 100 אלף |
טבלה 1. מניות הזרקה
| יציאות על המחסנית | פתרונות מלאי | הוספת נפח מלאי | הוספת מדיית בדיקה | ריכוז סופי של זריקות (פי 10) | הוספת אמצעי אחסון זה ליציאה ייעודית (μL) | ריכוז סופי לאחר הזרקה בכל באר |
| A | גלוקוז (100 מ"מ) | 3000 מיקרוליטר + 0 מיקרוליטר | 100 מ"מ | 20 | 10 מ"מ | |
| B | אוליגומיצין (100 מיקרומטר) | 300 מיקרוליטר + 2700 מיקרוליטר | 10 מיקרומטר | 22 | 1.0 מיקרומטר | |
| C | רוטנון/אנטימיצין A (50 מיקרומטר) | 300 מיקרוליטר + 2700 מיקרוליטר | 5 מיקרומטר | 25 | 0.5 מיקרומטר | |
| D | 2-DG (500 מ"מ) | 300 מיקרוליטר + 0 מיקרוליטר | 500 מ"מ | 28 | 50 מ"מ | |
טבלה 2. ריכוזי הזרקה סופיים
9. יום הבדיקה: ביצוע הבדיקה הגליקוליטית החריפה על מקרופאגים מקוטבים
- פתח את התבנית השמורה של בדיקת מתח גליקוליזה (הזרקה חריפה) מהתוכנה. בדיקת ברירת המחדל של מאמץ גליקו אקוטי כוללת 3 דקות של ערבוב ומדידה לפני כל זריקה.
- בדוק את התבנית ואת פרטי הבדיקה, וכשמוכן, לחץ על הפעל ופעל לפי ההוראות של בדיקת ברירת המחדל. עם זאת, ניתן להתאים אישית את כל הפרמטרים.
- הסר את מחסנית החיישן מהחממה שאינה CO2 , הסר את המכסה והכנס את המכשיר באופן שבאר A1 של לוחית המחסנית תיפול לפינה השמאלית העליונה של לוח ההכנסה של המכונה. בדרך כלל, הכיול לוקח בין 20 ל-45 דקות.
- לאחר סיום הכיול, המכשיר יוציא את הצלחת המכילה את תמיסת הקליברנט ויחזיק את מחסנית החיישן. הסר את הקליברנט המכיל את הצלחת.
- הסר את לוחית התא מהחממה שאינה CO2 , הסר את מכסה הצלחת והכנס אותה למכונה. לחץ על הפעל (איור 3B).
- בסיום הבדיקה, המכונה תוציא את לוחית התא ואת מחסנית החיישן.
- הסר את המדיה מהצלחת והקפיא אותה בטמפרטורה של -20 מעלות צלזיוס להמשך נורמליזציה.
- השתמש בערכת הבדיקה המסחרית של התפשטות תאים (למשל, CyQUANT) לנורמליזציה של התאים.
- הוסף 1 מ"ל של תרכובת B או מאגר ליזה ל-19 מ"ל של מים מזוקקים ללא נוקלאז.
- הוסף 100 מיקרוליטר של תמיסת עבודה תרכובת A או GR לפתרון הנ"ל.
- וודאו שהתאים בצלחת מופשרים ולאחר מכן הוסיפו 200 מיקרוליטר מהתמיסה לכל באר.
- יש לדגור למשך 5 דקות בטמפרטורת החדר (RT).
- מדוד את הקרינה באורכי גל של עירור של 480 ננומטר ופליטה של 520 ננומטר באמצעות קורא צלחות.
- נרמל את התאים בלוח הנורמליזציה של התוכנה.
- לנרמל תאים בהתבסס על ספירת תאים נאיבית של מקרופאגים (איור 3C). קחו בחשבון את הממוצע של המקרופאגים הנאיביים כ-1 (על ידי חלוקת מספר התאים של כל באר במספר התאים הממוצע של מקרופאגים נאיביים) והחילו אותם על כל המקרופאגים.
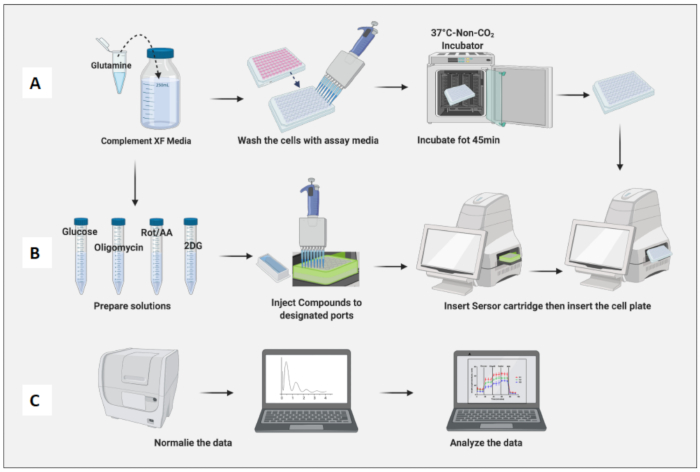
איור 3: יום הבדיקה: הכנה בינונית ומורכבת והפעלת הבדיקה. (A) הכנת תאים לבדיקה; (ב) תרכובות הכנה, כיול והפעלת הבדיקה; (ג) נורמליזציה וניתוח נתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות
גליקוליזה וזרחון חמצוני מיטוכונדריאלי הם שני מסלולי ייצור ה-ATP העיקריים בתאים (איור 4A). לתאים מסוימים יש את היכולת לעבור בין שני המסלולים הללו כדי לעמוד בדרישות האנרגיה שלהם. ההמרה של גלוקוז לפירובט בציטופלזמה נקראת גליקוליזה. לפירובט י...
Discussion
כפי שהוזכר קודם לכן, מכונת מנתח השטף החוץ-תאי יכולה לספק מידע בזמן אמת על שני מסלולים עיקריים לייצור אנרגיה של התאים על ידי מדידת OCR (קצב צריכת חמצן), אינדיקטור לפעילות OXPHOS המיטוכונדריאלית ו-ECAR (קצב החמצה חוץ-תאית) המהווה אינדיקטור לגליקוליזה. מקרופאגים יכולים להשתמש בשני ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לגב' ג'ואנה רושה על הסיוע בעריכה. העבודה נתמכה באופן חלקי על ידי המכונים הלאומיים לבריאות (NIH) R01DK118334 (לד"ר סון ואלאניז) ו-(NIH) R01A11064Z (לד"ר ג'ייארמאן ואלאניז).
Materials
| Name | Company | Catalog Number | Comments |
| 23G needles | VWR | BD305145 | |
| 2-mercaptoethanol | Life Technologies | 21985023 | |
| 50ml Conical Tube | VWR | 21008-951 | |
| ACK lysis buffer | Thermo Fisher Scientific | A1049201 | It can be lab-made |
| Agilent Seahorse XF glycolysis stress test kit | Agilent Technologies | 103020-100 | |
| Agilent Seahorse XF Glycolysis Stress Test Kit User Guide | Agilent Technologies | 103020-400 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Agilent Seahorse XF Glycolytic Rate Assay Kit User Guide | Agilent Technologies | 103344-100 | |
| Alexa Fluor 488 anti-mouse CD206 (MMR) Antibody | BioLegend | 141710 | |
| anti-mouse CD11b eFluor450 100ug | eBioscience | 48-0112-82 | |
| BD 3ML - SYRINGE | VWR | BD309657 | Other syringes are acceptable too |
| Cell counter-Vi-CELL- XR Complete System | BECKMAN COULTER Life Sciences | 731050 | Cells can be manually counted too |
| Cell Strainer-70µm | VWR | 10199-656 | |
| CyQUANT Cell Proliferation Assay Kit | Thermo Fisher Scientific | C7026 | |
| F4/80 monoclonal antibody (BM8) pe-Cyanine7 | eBioscience | 25-4801-82 | |
| Fetal Bovine Serum | Life Technologies | 16000-044 | |
| Flow cytometer: BD LSFRFortessa X-20 | BD | 656385 | |
| Kim Wipes | VWR | 82003-822 | |
| LPS-SM ultrapure (tlrl-smpls) 5 mg | Invivogen | tlrl-smlps | |
| MCSF | Peprotech | 315-02 | |
| Murine IL-4 | Peprotech | 214-14 | |
| PE Rat Anti-Mouse CD38 | BD Biosciences | 553764 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Petri Dish 100mm x 15 mm | Fisher Scientific | F80875712 | |
| RPMI, Glutamax, HEPES | Invitrogen | 72400-120 | |
| Seahorse Calibrant Solution | Agilent Technologies | 103059-000 | |
| Seahorse XF 200mM Glutamine Solution | Agilent Technologies | 103579-100 | |
| Seahorse XF Glycolytic Rate Assay Kit | Agilent Technologies | 103344-100 | |
| Seahorse XFe96 FluxPaks | Agilent Technologies | 102416-100 | |
| XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| XF RPMI Medium, pH 7.4 without phenol Red | Agilent Technologies | 103336-100 |
References
- Rosowski, E. E. Determining macrophage versus neutrophil contributions to innate immunity using larval zebrafish. Disease Models & Mechanisms. 13 (1), (2020).
- Martinez-Pomares, L., Gordon, S. . The Autoimmune Diseases. , 191-212 (2020).
- Orecchioni, M., Ghosheh, Y., Pramod, A. B., Ley, K. Macrophage polarization: different gene signatures in M1 (LPS+) vs. classically and M2- (LPS–) vs. alternatively activated macrophages. Frontiers in immunology. 10, 1084 (2019).
- Barrett, T. J. Macrophages in atherosclerosis regression. Arteriosclerosis, Thrombosis, and Vascular Biology. 40 (1), 20-33 (2020).
- Ni, Y., et al. Adipose tissue macrophage phenotypes and characteristics: the key to insulin resistance in obesity and metabolic disorders. Obesity. 28 (2), 225-234 (2020).
- Chu, C., et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. Journal of Biomedical Materials Research Part A. 108 (1), 127-135 (2020).
- Batista-Gonzalez, A., Vidal, R., Criollo, A., Carreño, L. J. New insights on the role of lipid metabolism in the metabolic reprogramming of macrophages. Frontiers in Immunology. 10, 2993 (2020).
- Kang, S., Kumanogoh, A. The spectrum of macrophage activation by immunometabolism. International Immunology. , (2020).
- Shi, Y., et al. M1 But Not M0 Extracellular Vesicles Induce Polarization of RAW264. 7 Macrophages Via the TLR4-NFκB Pathway In Vitro. Inflammation. , 1-9 (2020).
- Zhang, L., Li, S. Lactic acid promotes macrophage polarization through MCT-HIF1α signaling in gastric cancer. Experimental Cell Research. 388 (2), 111846 (2020).
- Geng, T., et al. CD137 signaling induces macrophage M2 polarization in atherosclerosis through STAT6/PPARδ pathway. Cellular Signalling. , 109628 (2020).
- Liu, Q., et al. Combined blockade of TGf-β1 and GM-CSF improves chemotherapeutic effects for pancreatic cancer by modulating tumor microenvironment. Cancer Immunology & Immunotherapy. , 1-16 (2020).
- Rigoni, T. S., et al. RANK Ligand Helps Immunity to Leishmania major by Skewing M2 Into M1 Macrophages. Frontiers in Immunology. 11, 886 (2020).
- Viola, A., Munari, F., Sánchez-Rodríguez, R., Scolaro, T., Castegna, A. The metabolic signature of macrophage responses. Frontiers in Immunology. 10, (2019).
- Ivashkiv, L. B. The hypoxia–lactate axis tempers inflammation. Nature Reviews Immunology. 20 (2), 85-86 (2020).
- Van den Bossche, J., Baardman, J., de Winther, M. P. Metabolic characterization of polarized M1 and M2 bone marrow-derived macrophages using real-time extracellular flux analysis. Journal of Visualized Experiments. (105), e53424 (2015).
- Van den Bossche, J., et al. Mitochondrial dysfunction prevents repolarization of inflammatory macrophages. Cell reports. 17 (3), 684-696 (2016).
- Liu, P. S., Ho, P. C. . Metabolic Signaling. , 173-186 (2019).
- Wang, F., et al. Glycolytic stimulation is not a requirement for M2 macrophage differentiation. Cell metabolism. 28 (3), 463-475 (2018).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. . Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology. , (2018).
- Mookerjee, S. A., Brand, M. D. Measurement and analysis of extracellular acid production to determine glycolytic rate. Journal of Visualized Experiments. (106), e53464 (2015).
- Mookerjee, S. A., Goncalves, R. L., Gerencser, A. A., Nicholls, D. G., Brand, M. D. The contributions of respiration and glycolysis to extracellular acid production. Biochimica Et Biophysica Acta-Bioenergetics. 1847 (2), 171-181 (2015).
- Yang, S., et al. Macrophage polarization in atherosclerosis. Clinica Chimica Acta. 501, 142-146 (2020).
- Hörhold, F., et al. Reprogramming of macrophages employing gene regulatory and metabolic network models. PLoS Computational Biology. 16 (2), e1007657 (2020).
- Han, X., Ma, W., Zhu, Y., Sun, X., Liu, N. Advanced glycation end products enhance macrophage polarization to the M1 phenotype via the HIF-1α/PDK4 pathway. Molecular and Cellular Endocrinology. , 110878 (2020).
- Müller, E., et al. Toll-like receptor ligands and interferon-γ synergize for induction of antitumor M1 macrophages. Frontiers in Immunology. 8, 1383 (2017).
- Soto-Heredero, G., Gómez de las Heras, M. M., Gabandé-Rodríguez, E., Oller, J., Mittelbrunn, M. Glycolysis–a key player in the inflammatory response. The FEBS Journal. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved